修回日期: 2017-02-15
接受日期: 2017-02-27
在线出版日期: 2017-04-08
探讨组蛋白去乙酰化酶3(histone deacetylase 3, HDAC3)在肝细胞癌(hepatocellular carcinoma, HCC)组织中的表达及其临床意义.
采用免疫组织化学法检测60例HCC组织及癌旁组织石蜡切片中HDAC3的表达, 分析其与HCC临床病理特征及与患者预后的关系.
HCC组织中HDAC3的表达水平明显高于其相应癌旁组织(P<0.05). HDAC3在HCC中的表达水平与HCC患者的性别、年龄、乙型肝炎病毒感染、TNM分期、病理分级、AFP水平、是否合并肝硬化、肿瘤数目、肿瘤大小和肿瘤结节的单发多发数目等无关(P>0.05), 与肿瘤复发有相关性(P<0.05). HDAC3的表达与p-STAT3的表达呈正相关(r2 = 0.622, P<0.001). HDAC3高表达组患者的术后生存时间明显低于低表达组患者(P<0.05), 提示HDAC3高表达可能与HCC患者的预后有关.
HDAC3表达升高可能与HCC的发生、发展密切相关.
核心提要: 肝癌组织中HDAC3表达水平上调, 并与肝癌的复发有关; HDAC3的表达与p-STAT3的表达存在相关性; 肝癌的复发是决定其预后的重要因素. 因此, HDAC3高表达可作为肝癌的预后指标, 且HDAC3可能通过上调p-STAT3的表达水平促进肝癌的复发, 但是其具体机制仍有待进一步深入研究.
引文著录: 朱柯亭, 武振汝, 卢徐锋, 纪洪杰, 周永杰, 曹潇月, 朱永杰, 步宏, 石毓君. 肝细胞肝癌中HDAC3的表达及临床意义. 世界华人消化杂志 2017; 25(10): 922-928
Revised: February 15, 2017
Accepted: February 27, 2017
Published online: April 8, 2017
To detect the expression of histone deacetylase 3 (HDAC3) in hepatocellular carcinoma (HCC) and analyze its clinicopathological significance.
Immunohistochemistry was performed in 60 pairs of HCC tissues and tumor-adjacent normal tissues. The relationship of HDAC3 expression with clinical and pathological features and overall survival was analyzed statistically.
HDAC3 expression was significantly up-regulated in the HCC specimens compared to corresponding normal tissues (P < 0.05). The expression of HDAC3 in HCC had no significant correlation with gender, age, history of hepatitis B virus infection, TNM stage, pathological classification, α-fetoprotein level, liver cirrhosis, tumor size, or tumor number (P > 0.05). There was a positive correlation between HDAC3 and p-STAT3 expression in HCC tissues (r2 = 0.622, P < 0.001). However, HDAC3 expression had a significant correlation with tumor recurrence (P < 0.05). The overall survival of postoperative HCC patients in the HDAC3 positive group was obviously poorer than that of patients in the HDAC3 negative group (P < 0.05), suggesting that high HDAC3 expression is associated with a poor prognosis in HCC patients.
The up-regulated expression of HDAC3 may be closely related with the occurrence and development of HCC.
- Citation: Zhu KT, Wu ZR, Lu XF, Ji HJ, Zhou YJ, Cao XY, Zhu YJ, Bu H, Shi YJ. Clinical significance of expression of histone deacetylase 3 in hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2017; 25(10): 922-928
- URL: https://www.wjgnet.com/1009-3079/full/v25/i10/922.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v25.i10.922
肝细胞癌(hepatocellular carcinoma, HCC)已经成为影响人类生存的最重要疾病之一. 世界卫生组织的调查报告显示肝癌在恶性肿瘤中的发病率位居第5, 致死率位居第3, 每年新增患者数超过70万, 有近100万人死于肝癌[1,2]. 我国肝癌发患者数约占全世界肝癌发患者数的43.7%, 死亡人数占45%, 高居恶性消化系肿瘤之首[3,4]. HCC主要风险因素包括乙型肝炎病毒(hepatitis B virus, HBV)或丙型肝炎病毒感染、酒精性肝硬化以及非酒精性脂肪性肝炎等[5,6]. 肝癌易转移及复发, 预后极差, 给临床诊断与治疗带来了极大的挑战. 因此, 研究肝癌的发病及复发机制在肝癌的治疗中具有重要的临床价值及意义. 组蛋白去乙酰化酶3(histone deacetylase 3, HDAC3)是高度保守的HDACI类家族成员之一, 在真核生物中普遍表达, 其功能的调节需要通过蛋白与蛋白之间的相互作用而实现[7-9]. 在小鼠肝脏中特异性敲除HDAC3破坏肝细胞糖脂代谢平衡并引起严重的肝脏脂变[10-12]. 研究[13]显示, HBV引起的肝癌接受肝切除手术后, HDAC3阳性表达的患者预后更差. 虽然HDAC3在HBV引起的肝癌中的表达情况已有初步的研究, 但是HDAC3与HCC所有类型的患者临床病理因素和预后之间的关系, 未见详细深入的研究. 本研究中, 我们采用免疫组织化学染色的方法, 检测HDAC3在HCC癌及对应癌旁肝组织中的表达情况, 并探讨其临床意义.
60例HCC及相应的癌旁组织石蜡标本来自2006-2012年四川大学华西医院手术切除组织, 临床和病理诊断均为HCC. 选取的癌旁组织距癌灶距离≥3 cm, 术后病理检查未发现癌细胞. 所有患者均行手术治疗, 术前均未进行放、化疗等辅助治疗, 且有完整的临床资料. 肿瘤分化程度依据Edmondson-Steiner分级标准来确定, 肿瘤分期按美国肿瘤研究联合委员会2010发布的第7版分期系统的标准确定. 具体的临床病理参数如表1. 本研究由四川大学华西医院伦理委员会审核批准, 并且所有标本均征得患者及家属知情同意.
| 参数 | n = 60 | HDAC3表达 | p-STAT3表达 | ||||
| 阴性(n = 41) | 阳性(n = 19) | P值 | 低(≤50%, n = 28) | 高(>50%, n = 32) | P值 | ||
| 年龄(岁) | 0.802 | 0.835 | |||||
| ≤50 | 27 | 18 | 9 | 13 | 14 | ||
| >50 | 33 | 23 | 10 | 15 | 18 | ||
| 性别 | 0.172 | 0.355 | |||||
| 男 | 50 | 36 | 14 | 22 | 28 | ||
| 女 | 10 | 5 | 5 | 6 | 4 | ||
| AFP(ng/mL) | 0.704 | 0.267 | |||||
| ≤20 | 17 | 11 | 6 | 6 | 11 | ||
| >20 | 43 | 30 | 13 | 22 | 21 | ||
| 是否肝硬化 | 0.231 | 0.187 | |||||
| 是 | 52 | 37 | 15 | 26 | 26 | ||
| 否 | 8 | 4 | 4 | 2 | 6 | ||
| HBsAg | 0.907 | 0.885 | |||||
| 有 | 51 | 35 | 16 | 24 | 27 | ||
| 无 | 9 | 6 | 3 | 4 | 5 | ||
| 肿瘤直径(cm) | 0.165 | 0.038 | |||||
| ≤5 | 30 | 23 | 7 | 18 | 12 | ||
| >5 | 30 | 18 | 12 | 10 | 20 | ||
| 肿瘤数目 | 0.535 | 0.817 | |||||
| 单个 | 50 | 35 | 15 | 23 | 27 | ||
| 多发 | 10 | 6 | 4 | 5 | 5 | ||
| TNM分期 | 0.682 | 0.887 | |||||
| Ⅰ-Ⅱ | 37 | 26 | 11 | 17 | 20 | ||
| Ⅲ-Ⅳ | 23 | 15 | 8 | 11 | 12 | ||
| 病理分级 | 0.839 | 0.914 | |||||
| Ⅰ | 0 | 0 | 0 | 0 | 0 | ||
| Ⅱ | 39 | 27 | 14 | 18 | 21 | ||
| Ⅲ | 21 | 14 | 5 | 10 | 11 | ||
| 是否复发 | 0.011 | 0.005 | |||||
| 是 | 42 | 31 | 11 | 13 | 26 | ||
| 否 | 18 | 10 | 8 | 15 | 6 | ||
1.2.1 免疫组织化学染色的主要试剂与方法: 60例HCC及相应的癌旁组织石蜡标本, 4 μm连续切片, 经二甲苯脱蜡, 梯度酒精水化, 置于pH 9.0的EDTA抗原修复液中微波修复8 min×2, 于3%过氧化氢溶液中孵育15 min封闭内源性过氧化物酶, TBST洗涤后滴加羊血清室温封闭30 min, 甩干后加HDAC3抗体(购自Novus, 工作浓度1:100)或者p-STAT3抗体(购自CST, 工作浓度1:200)4 ℃孵育过夜; 第2天于室温下复温30 min, TBST洗涤后加Envision二抗工作液(购自Dako), 室温孵育60 min, TBST洗涤后在显微镜下进行DAB显色. 苏木精复染、1%的盐酸酒精分化、流水冲洗返蓝、梯度酒精脱水、二甲苯透明、中性树胶封片. 5例正常人肝组织作为正常对照, 取自肝内胆管结石手术切除患者, 用PBS缓冲液代替一抗作阴性对照.
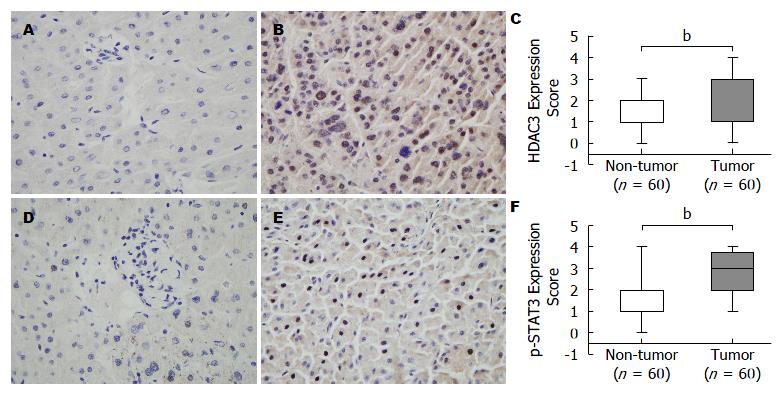
1.2.2 判断标准: HDAC3阳性主要定位于细胞核上, 少量在细胞质表达, 以出现棕黄着色作为阳性反应. HDAC3按染色强弱程度分值: 阴性染色为1分, 弱染色为2分, 中等强度染色为3分, 强染色为4分. p-STAT3按阳性细胞所占的百分比记分: 核阳性≤5%为0分, 6%-25%为1分, 26%-50%为2分, 51%-75%为3分, >75%为4分. 统计学处理时, HDAC3弱阳性和阴性合并归为HDAC3低表达组, HDAC3强阳性和阳性合计为HDAC3高表达组; p-STAT3核阳性≤50%定义为p-STAT3低表达组, p-STAT3核阳性>50%定义为p-STAT3高表达组.
统计学处理 用SPSS17.0统计软件进行统计分析. 对HCC中HDAC3的表达与肝癌患者相应的临床病理学特征之间的关系采用χ2检验. HDAC3和p-STAT3在肝癌组织中表达的相关性采用Pearson相关分析验证. 生存分析采用Kaplan-Meier法估计, 应用Log-rank检验进行单因素分析, 多因素分析采用Cox比例风险模型进行. 以P<0.05为差异具有统计学意义.
HDAC3在HCC癌组织中的表达明显高于癌旁肝脏组织免疫组织化学结果显示, HDAC3蛋白阳性主要定位于细胞核上, 少量定位于细胞胞浆, 染色呈棕黄色(图1B, C), 而在癌旁肝脏组织中HDAC3蛋白呈低表达或无表达(图1A, C). p-STAT3阳性主要定位于细胞核上, 染色呈棕黄色, 在HCC癌组织中的表达明显高于癌旁肝脏组织(图1D-F). 按免疫组织化学染色半定量评分结果, 将HCC患者分为HDAC3低表达组和HDAC3高表达组. 在60例HCC标本中, 有19例HCC的HDAC3表达呈现阳性, 41例HCC的HDAC3表达呈现阴性; 而p-STAT3高表达的HCC有32例, p-STAT3低表达的HCC有28例(图1C, F, 表1).
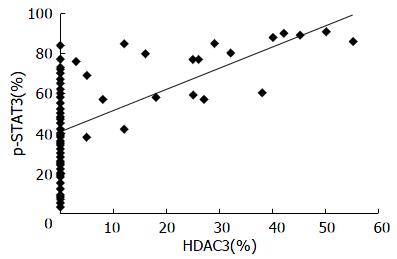
HDAC3的表达水平与患者的性别、年龄、血清AFP水平、是否伴有肝硬化状态、血清HBsAg阳性与否、TNM分级、病理分级、肿瘤大小和肿瘤数目(P>0.05)无关(表2); 但与肿瘤复发(P<0.001)、p-STAT3的表达水平(P<0.01)均显著相关(表2). 经Pearson相关系数法分析表明, HDAC3与p-STAT3在60例HCC组织中的表达呈正相关(r2 = 0.622, P<0.001, 图2).
| 参数 | Overall survival HR | 95%CI | P值 |
| 年龄(>50岁 vs ≤50岁) | 0.854 | 0.416-1.750 | 0.666 |
| 性别(男 vs 女) | 1.636 | 0.569-4.700 | 0.361 |
| AFP(≤20 ng/mL vs >20 ng/mL) | 0.511 | 0.223-1.173 | 0.113 |
| 肝硬化(是 vs 否) | 1.822 | 0.653-5.087 | 0.252 |
| HBsAg(否 vs 是) | 0.532 | 0.173-1.640 | 0.272 |
| 肿瘤直径(>5 cm vs ≤5 cm) | 1.805 | 0.807-4.036 | 0.150 |
| 肿瘤数目(单个 vs 多发) | 0.452 | 0.164-1.246 | 0.125 |
| TNM分期(Ⅰ-Ⅱ期 vs Ⅲ-Ⅳ) | 0.954 | 0.438-2.077 | 0.905 |
| 病理分级(Ⅰ-Ⅱ vs Ⅲ) | 0.887 | 0.400-1.968 | 0.768 |
| 是否复发(是 vs 否) | 6.812 | 2.354-19.712 | 0.000 |
| p-STAT3表达(高 vs 低) | 2.895 | 1.281-6.545 | 0.011 |
| HDAC3表达(阳性 vs 阴性) | 4.720 | 1.878-11.861 | 0.001 |
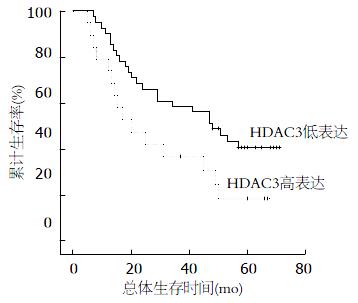
对60例HCC患者进行Kaplan-Meier生存曲线分析, 结果显示, HDAC3低表达组HCC患者的累积生存率和无瘤生存率明显高于HDAC3高表达组HCC患者(P<0.05, 图3). 多因素生存分析显示, HDAC3的表达可作为HCC预后的独立指标(P<0.01, 表3).
| 参数 | Overall survival HR | 95%CI | P值 |
| 是否复发(是 vs 否) | 4.930 | 1.962-12.388 | 0.001 |
| HDAC3表达(阳性 vs 阴性) | 2.988 | 1.397-6.390 | 0.005 |
| p-STAT3表达(高 vs 低) | 3.801 | 1.771-8.155 | 0.001 |
近些年来, 研究发现HDAC3在肝脏的发育、脂代谢和增殖起举足轻重的作用, 并与HCC的发生密切相关, 因而备受关注. 有报道[8]称HDAC3的mRNA的表达水平在13%的人肝癌样本中降低, 在32.6%(14/43)HBV引起的肝癌样本中显示免疫组织化学核阳性[13]. 同时, HDAC3 DNA拷贝数在一些肝癌样本中也是显著升高的[14,15]. 和之前的研究报道一致, 我们也发现了HDAC3在31.67%(19/60)的肝癌样本中显著升高.
最近的研究发现HDAC3对细胞周期进程的调控起着重要的作用. HDAC3通过与AKAP95和HA95相互结合作用于细胞的有丝分裂, HDAC3缺失在S期引起DNA损伤[16-18]. HDAC3可调控神经干细胞G2/M期的CDK1水平[19], 同时HDAC3也是维持染色体结构及基因组稳定性所必需的[20,21]. 此外, HDAC3缺失会引起Hep3B细胞的p21WAF1/cip1表达水平的升高造成G1阻滞[22]. HDAC3能够调控多潜能因子的表达从而促进肝癌干细胞的自我更新[23,24]. HDAC抑制剂panobinostat能够显著降低Huh7、Hep3B和HepG2等肝癌细胞的增殖, 同时明显减缓裸鼠皮下肿瘤的生长[14].
本研究用免疫组织化学法检测60例HCC癌及相应癌旁组织中HDAC3的表达, 我们的研究结果显示, HDAC3主要在HCC癌组织中显著高表达, 而在相应的癌旁组织中表达相对较低或缺失. 上述结果提示了HDAC3的高表达可能与HCC的发生发展有关. 高表达的HDAC3显著促进肿瘤的复发从而降低患者的生存率.
磷酸化的STAT3(p-STAT3)对肝损伤后的肝细胞增殖的启动和促进期重要的作用. Kupffer分泌的IL-6促进STAT3磷酸化, 从而启动肝细胞增殖相关的早期反应基因的表达[25-27]. p-STAT3高表达的肝癌患者的预后也很差[28,29]. 而且STAT3又是HDAC3直接结合的蛋白之一[8,30]. 因此, 我们检测了增殖指标p-STAT3在HCC中的表达情况. 本研究证实HDAC3和p-STAT3的表达在HCC组织中呈正相关, 提示HDAC3可能是通过p-STAT3参与HCC细胞的异常增殖, 其机制可能是HDAC3能够促进p-STAT3的水平, 从而促进肝癌细胞的增殖, 并促进细胞周期的进程. 此外, 本研究还分析了HDAC3及p-STAT3的表达与HCC患者的临床病理特征和预后的关系, 发现HDAC3的表达与HCC患者肿瘤复发有关. 生存曲线及Cox多因素分析表明, 高表达HDAC3的HCC患者预后差, HDAC3可以作为临床评估HCC患者预后的独立指标.
总之, 通过本次研究发现, HDAC3在HCC癌组织中的表达比正常以及癌旁肝脏组织明显增高, 可能通过p-STAT3促进HCC细胞的异常增殖. HDAC3在肝癌的发生发展过程中以及预后评估方面扮演着重要角色, 有望成为肝癌治疗的新靶点. 然而, HDAC3在肝癌中如何调控STAT3促进肝细胞增殖的机制, 有待进一步深入研究.
组蛋白去乙酰化酶3(histone deace-tylase 3, HDAC3)在肝脏的代谢平衡和肝癌的形成中发挥着重要的作用, HDAC3具有抑制脂类合成、促进糖异生等作用, HDAC3敲除会对小鼠肝细胞造成严重损伤, 最终自发形成肝细胞癌(hepatocellular carcinoma, HCC).
HCC是一种高死亡率的原发性肝癌, 是全球范围最常见的恶性肿瘤之一. HDAC3对细胞周期的进程转换起至关重要的作用并与HCC的发生密切相关, 然而, HDAC3表达与临床上HCC的预后的关系尚未明确.
HDAC3在人类肿瘤中起到了致癌的作用, 是一种新型致癌因子. HDAC3高表达可能是结肠癌的特征之一, 在结肠癌的侵袭力及淋巴结转移中起一定的作用, 并且能够影响患者的预后.
本研究应用免疫组织化学技术检测HDAC3、p-STAT3蛋白在肝癌和癌旁组织中表达水平, 统计分析HDAC3表达与临床病理特征之间关系及其与p-STAT3表达的相关性.
肝癌组织中HDAC3表达水平上调, 并与肝癌的复发有关; 肝癌的复发是决定其预后的重要因素. 因此, HDAC3高表达可作为肝癌的预后指标. HDAC3的表达与p-STAT3的表达存在相关性, 提示肝癌组织中HDAC3高表达可能通过上调p-STAT3的表达水平促进肝癌的复发.
肝细胞癌(HCC): 是一种高死亡率的原发性肝癌, 是全球范围最常见的恶性肿瘤之一. 癌细胞排列形成实性团块状, 周围富有扩张的血窦. 癌细胞境界不清, 大小较一致, 胞浆丰富. 核单个, 类圆形, 异形性不明显, 核分裂现象少见.
朱争艳, 研究员, 天津市第三中心医院
本文立意较新颖, 试验方法较科学, 统计学方法选用恰当, 结果可靠. 对临床有一定的指导意义.
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 四川省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): 0
D级 (一般): 0
E级 (差): 0
编辑: 闫晋利 电编:胡珊
| 1. | Yang JD, Roberts LR. Hepatocellular carcinoma: A global view. Nat Rev Gastroenterol Hepatol. 2010;7:448-458. [PubMed] [DOI] |
| 2. | Lasagna N, Fantappiè O, Solazzo M, Morbidelli L, Marchetti S, Cipriani G, Ziche M, Mazzanti R. Hepatocyte growth factor and inducible nitric oxide synthase are involved in multidrug resistance-induced angiogenesis in hepatocellular carcinoma cell lines. Cancer Res. 2006;66:2673-2682. [PubMed] [DOI] |
| 3. | El-Serag HB, Rudolph KL. Hepatocellular carcinoma: epidemiology and molecular carcinogenesis. Gastroenterology. 2007;132:2557-2576. [PubMed] [DOI] |
| 5. | European Association For The Study Of The Liver, European Organisation For Research And Treatment Of Cancer. EASL-EORTC clinical practice guidelines: management of hepatocellular carcinoma. J Hepatol. 2012;56:908-943. [PubMed] [DOI] |
| 6. | El-Serag HB. Epidemiology of viral hepatitis and hepatocellular carcinoma. Gastroenterology. 2012;142:1264-1273.e1. [PubMed] [DOI] |
| 7. | Bhaskara S, Chyla BJ, Amann JM, Knutson SK, Cortez D, Sun ZW, Hiebert SW. Deletion of histone deacetylase 3 reveals critical roles in S phase progression and DNA damage control. Mol Cell. 2008;30:61-72. [PubMed] [DOI] |
| 8. | Bhaskara S, Knutson SK, Jiang G, Chandrasekharan MB, Wilson AJ, Zheng S, Yenamandra A, Locke K, Yuan JL, Bonine-Summers AR. Hdac3 is essential for the maintenance of chromatin structure and genome stability. Cancer Cell. 2010;18:436-447. [PubMed] [DOI] |
| 9. | Farooq M, Sulochana KN, Pan X, To J, Sheng D, Gong Z, Ge R. Histone deacetylase 3 (hdac3) is specifically required for liver development in zebrafish. Dev Biol. 2008;317:336-353. [PubMed] [DOI] |
| 10. | Knutson SK, Chyla BJ, Amann JM, Bhaskara S, Huppert SS, Hiebert SW. Liver-specific deletion of histone deacetylase 3 disrupts metabolic transcriptional networks. EMBO J. 2008;27:1017-1028. [PubMed] [DOI] |
| 11. | Feng D, Liu T, Sun Z, Bugge A, Mullican SE, Alenghat T, Liu XS, Lazar MA. A circadian rhythm orchestrated by histone deacetylase 3 controls hepatic lipid metabolism. Science. 2011;331:1315-1319. [PubMed] [DOI] |
| 12. | Sun Z, Miller RA, Patel RT, Chen J, Dhir R, Wang H, Zhang D, Graham MJ, Unterman TG, Shulman GI. Hepatic Hdac3 promotes gluconeogenesis by repressing lipid synthesis and sequestration. Nat Med. 2012;18:934-942. [PubMed] [DOI] |
| 13. | Wu LM, Yang Z, Zhou L, Zhang F, Xie HY, Feng XW, Wu J, Zheng SS. Identification of histone deacetylase 3 as a biomarker for tumor recurrence following liver transplantation in HBV-associated hepatocellular carcinoma. PLoS One. 2010;5:e14460. [PubMed] [DOI] |
| 14. | Lachenmayer A, Toffanin S, Cabellos L, Alsinet C, Hoshida Y, Villanueva A, Minguez B, Tsai HW, Ward SC, Thung S. Combination therapy for hepatocellular carcinoma: additive preclinical efficacy of the HDAC inhibitor panobinostat with sorafenib. J Hepatol. 2012;56:1343-1350. [PubMed] [DOI] |
| 15. | Yang Z, Zhou L, Wu LM, Xie HY, Zhang F, Zheng SS. Combination of polymorphisms within the HDAC1 and HDAC3 gene predict tumor recurrence in hepatocellular carcinoma patients that have undergone transplant therapy. Clin Chem Lab Med. 2010;48:1785-1791. [PubMed] [DOI] |
| 16. | Hirota T, Lipp JJ, Toh BH, Peters JM. Histone H3 serine 10 phosphorylation by Aurora B causes HP1 dissociation from heterochromatin. Nature. 2005;438:1176-1180. [PubMed] [DOI] |
| 17. | Fischle W, Tseng BS, Dormann HL, Ueberheide BM, Garcia BA, Shabanowitz J, Hunt DF, Funabiki H, Allis CD. Regulation of HP1-chromatin binding by histone H3 methylation and phosphorylation. Nature. 2005;438:1116-1122. [PubMed] [DOI] |
| 18. | Li Y, Kao GD, Garcia BA, Shabanowitz J, Hunt DF, Qin J, Phelan C, Lazar MA. A novel histone deacetylase pathway regulates mitosis by modulating Aurora B kinase activity. Genes Dev. 2006;20:2566-2579. [PubMed] [DOI] |
| 19. | Jiang Y, Hsieh J. HDAC3 controls gap 2/mitosis progression in adult neural stem/progenitor cells by regulating CDK1 levels. Proc Natl Acad Sci USA. 2014;111:13541-13546. [PubMed] [DOI] |
| 20. | Ishii S, Kurasawa Y, Wong J, Yu-Lee LY. Histone deacetylase 3 localizes to the mitotic spindle and is required for kinetochore-microtubule attachment. Proc Natl Acad Sci USA. 2008;105:4179-4184. [PubMed] [DOI] |
| 21. | Eot-Houllier G, Fulcrand G, Watanabe Y, Magnaghi-Jaulin L, Jaulin C. Histone deacetylase 3 is required for centromeric H3K4 deacetylation and sister chromatid cohesion. Genes Dev. 2008;22:2639-2644. [PubMed] [DOI] |
| 22. | Zhang HY, Chen P, Bai SJ, Huang CH. The histone deacetylase inhibitor MS-275 induces p21(WAF1/Cip1) expression in human Hep3B hepatoma cells. Drug Development Research. 2007;68:61-70. [DOI] |
| 23. | Liu C, Liu L, Shan J, Shen J, Xu Y, Zhang Q, Yang Z, Wu L, Xia F, Bie P. Histone deacetylase 3 participates in self-renewal of liver cancer stem cells through histone modification. Cancer Lett. 2013;339:60-69. [PubMed] [DOI] |
| 24. | Farooq M, Hozzein WN, Elsayed EA, Taha NA, Wadaan MA. Identification of histone deacetylase 1 protein complexes in liver cancer cells. Asian Pac J Cancer Prev. 2013;14:915-921. [PubMed] [DOI] |
| 25. | Park EJ, Lee JH, Yu GY, He G, Ali SR, Holzer RG, Osterreicher CH, Takahashi H, Karin M. Dietary and genetic obesity promote liver inflammation and tumorigenesis by enhancing IL-6 and TNF expression. Cell. 2010;140:197-208. [PubMed] [DOI] |
| 26. | He G, Karin M. NF-κB and STAT3 - key players in liver inflammation and cancer. Cell Res. 2011;21:159-168. [PubMed] [DOI] |
| 27. | Fausto N, Campbell JS, Riehle KJ. Liver regeneration. J Hepatol. 2012;57:692-694. [PubMed] [DOI] |
| 28. | Wu WY, Li J, Wu ZS, Zhang CL, Meng XL, Lobie PE. Prognostic significance of phosphorylated signal transducer and activator of transcription 3 and suppressor of cytokine signaling 3 expression in hepatocellular carcinoma. Exp Ther Med. 2011;2:647-653. [PubMed] [DOI] |
| 29. | Yang SF, Wang SN, Wu CF, Yeh YT, Chai CY, Chunag SC, Sheen MC, Lee KT. Altered p-STAT3 (tyr705) expression is associated with histological grading and intratumour microvessel density in hepatocellular carcinoma. J Clin Pathol. 2007;60:642-648. [PubMed] [DOI] |
| 30. | Togi S, Kamitani S, Kawakami S, Ikeda O, Muromoto R, Nanbo A, Matsuda T. HDAC3 influences phosphorylation of STAT3 at serine 727 by interacting with PP2A. Biochem Biophys Res Commun. 2009;379:616-620. [PubMed] [DOI] |