修回日期: 2016-02-18
接受日期: 2016-02-22
在线出版日期: 2016-03-28
目的: 循环肿瘤细胞(circulating tumor cell, CTC)是一种重要的体液生物标志, 通过检测CTC的数量及其表型可以动态了解肿瘤进展. 本研究建立一种基于CTC细胞滴片上的RNA原位杂交方法, 分析CTC表型间接了解肿瘤进展.
方法: 采用负性富集技术获得肝细胞肝癌患者外周血CTC等有核细胞的细胞滴片, 并在CTC滴片上尝试建立RNA原位杂交技术. 选择真核生物高度保守的肽基脯氨酰顺反异构酶B(peptidyl-prolyl cis-trans isomerase B, PPIB)基因作为阳性对照, 合成针对PPIB基因高灵敏度的RNA杂交探针, 并在实体肿瘤患者外周血CTC滴片中检测PPIB基因的转录活性.
结果: 用于外周血有核细胞负性富集的多种试剂, 均不影响在CTC滴片上的RNA原位杂交, 最终优化了对传统CTC滴片细胞的固定方式和固定时间, 实现了在负性富集的肝细胞肝癌CTC滴片上的PPIB基因原位RNA杂交, 获得了CTC细胞中PPIB基因转录信息, 建立了实时动态监测实体肿瘤患者外周血CTC中特定基因转录活性的方法.
结论: 缩短采血到固定细胞的时间以减少RNA降解, 通过高灵敏探针的RNA原位杂交可以实现对CTC中特定基因转录水平的实时监测.
核心提示: 本研究结合负性富集外周血循环肿瘤细胞(circulating tumor cell, CTC)和新的高精度RNA原位杂交方法, 优化了富集过程中细胞固定的条件, 避免RNA降解, 成功建立了基于肝细胞肝癌外周血CTC滴片上RNA原位杂交技术.
引文著录: 周典蓉, 李薇, 高佳佳, 鞠强, 赵朋月, 赵晓航. 建立基于循环肿瘤细胞上的RNA原位杂交技术. 世界华人消化杂志 2016; 24(9): 1349-1356
Revised: February 18, 2016
Accepted: February 22, 2016
Published online: March 28, 2016
AIM: To develop a circulating tumor cells (CTCs) based RNA in situ hybridization technique for analyzing CTC phenotype and indirectly detecting tumor progression.
METHODS: We adopted the negative enrichment method to obtain slides of peripheral blood CTC and nucleated cells of hepatocellular carcinoma patients, and then RNA ISH on CTC slides was then developed. The peptidyl-prolyl cis-trans isomerase B (PPIB) gene, which is highly conserved in eukaryotes, was used as a positive control probe, which can detect the PPIB gene transcriptional activity on CTC slides.
RESULTS: The negative enrichment method allowed for successful isolation of peripheral blood CTCs from hepatocellular carcinoma patients. However, on CTC and nucleated cell slides which were fixed by conventional methods, RNA in situ hybridization signal was very weak. We tested the reagents used in negative enrichment, which showed that the reagents had no influence on the cells. Finally, we got the transcriptional information of PPIB on CTC slides after adjusting the conventional fixing method and time, and provided scientific data for real-time dynamic monitoring specific gene expression in peripheral blood CTCs of patients with solid tumors.
CONCLUSION: Shortening the time between blood collection and cell fixation can improve RNA degradation. On more than 10 slides of peripheral nucleated blood cells isolated by negative enrichment, real-time monitoring of CTC specific gene transcription level can be achieved through a high sensitive RNA in situ hybridization technique.
- Citation: Zhou DR, Li W, Gao JJ, Ju Q, Zhao PY, Zhao XH. Development of a circulating tumor cells based RNA in situ hybridization technique. Shijie Huaren Xiaohua Zazhi 2016; 24(9): 1349-1356
- URL: https://www.wjgnet.com/1009-3079/full/v24/i9/1349.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i9.1349
循环肿瘤细胞(circulating tumor cells, CTC)是自肿瘤原发灶或转移性病灶脱落进入外周血液循环系统的肿瘤细胞[1,2]. 绝大多数的肿瘤细胞进入外周血后在短期内死亡, 仅有一小部分具有高度活力、高度转移潜能的肿瘤细胞在循环系统中存活下来, 相互聚集形成微小肿瘤细胞簇, 随血流迁移到达合适的微环境, 发展为转移灶[3]. 研究[4]表明, 通过CTC"窗口", 动态监测CTC的数量和表型改变能了解肿瘤进展、治疗疗效以及预测复发转移. 外周血CTC含量增高与肿瘤侵袭性进展和复发转移相关, CTC也可以在肝细胞肝癌肝移植患者的移植物中形成新的转移灶[2,5,6], CTC是一种循环肿瘤标志, 有可能成为下一个肿瘤分期的标准[7]. 实体肿瘤样本取材困难, 而存在于外周血中的CTC相对取材方便, 可以实时、多次以微侵入性方式获得的"液体活检"(liquid biopsy)样本, 是动态直观了解病情[8-10]和指导个体化肿瘤诊疗的一个不可替代的生物标志物, 也是研究肿瘤复发转移机制的重要切入点.
相较于数目庞大的外周血细胞, 白细胞3.5×106-9.5×106/mL, 红细胞3.8×109-5.8×109/mL, 存在于外周血的CTC是数量极少的稀有细胞, 其分离和富集十分困难, 极大的限制了CTC的基础研究和临床应用. 近年来, 随着多种分离、鉴定稀有CTC实验技术的成功建立, 使得进一步研究CTC成为可能. 一般来说, CTC的检测由两个主要步骤组成: 即富集(分离)和鉴定(识别)[11]. 从外周血富集CTC可以采用捕获肿瘤细胞的"正性富集"和去除红白细胞的"负性富集"两种主要策略[12-14]. CTC的鉴定, 主要采用肿瘤细胞表面特异表达的蛋白标志, 针对肝细胞肝癌(hepatocellular carcinoma, HCC), CTC鉴定主要选择表达上皮细胞角蛋白(cytokeratin, CK)、磷脂酰肌醇蛋白聚糖3(glypican 3, GPC3)、唾液酸糖蛋白受体(asialoglycoprotein receptor, ASGR)的两个亚结构蛋白ASGR1和ASGR2等肿瘤细胞标志, 细胞核染色染料4,6-联眯-2-苯基吲哚(4,6-diamidino-2-phenylindole, DAPI)+以及不表达白细胞共同标志CD45分子的细胞[15,16]. 除了对CTC的计数外, 还可以从转录水平分析富集到CTC细胞的表型, 如细胞凋亡通路分析、干细胞特征分析等, 有助于指导临床实施精准地个体化用药与治疗, 以及有助于对患者进行临床分层[17]. 在CTC中进行RNA的检测对了解肿瘤分子类型, 指导化疗, 肿瘤靶向治疗有着重要意义[18,19]. 因此, 建立一种基于CTC细胞滴片上的RNA原位杂交方法, 以便分析CTC表型, 间接了解肿瘤进展非常必要.
高精度的RNA原位杂交技术在保持细胞形态的同时, 可以高特异高灵敏度地原位检测特定基因的转录活性[20]. 本文选择HCC患者外周血CTC, 整合高灵敏度RNA原位杂交技术, 旨在尝试建立一种基于实体肿瘤外周血CTC滴片上的RNA原位杂交检测方法, 以便通过CTC中特定基因转录活性动态监测肿瘤进展与治疗疗效.
选择2015-02/2015-04就诊于中国医学科学院肿瘤医院的HCC行单纯性手术切除术病例12例. 经所在医院伦理委员会批准, 在知情同意前提下, 分别用枸橼酸钠抗凝管采集肝癌患者的静脉血7.5 mL, 室温保存并于24 h内完成负性富集. 人类结肠癌HCT116细胞株(ATCC CCL-247)购自美国标准生物品收藏中心(American Type Culture Collection, ATCC)(Rockville, MD, USA). 抗人白细胞表面共同抗原(CD45)磁珠、异硫氰酸荧光素标记的抗人细胞角蛋白抗体(Cytokeratin 8/18/19, CK-FITC)、藻红蛋白标记的抗人白细胞共同抗原抗体(CD45)、强磁场磁性细胞分离架MidiMACS Separator/MultiStand购自德国Miltenyi Biotec公司(Bergisch Gladbach, Germany). 肽基脯氨酰顺反异构酶B(peptidyl-prolyl cis-trans isomerase B, PPIB)阳性对照探针、DapB阴性对照探针、显色试剂盒RNAscope® 2.0 HD Detection Kit和杂交炉HybEZ™ Humidifying System购自美国Advanced Cell Diagnostics公司(Advanced Cell Diagnostics Inc, CA, USA). 荧光标记二抗Alexa-488标记山羊抗小鼠IgG和Alexa-594标记的山羊抗兔IgG购自美国Invitrogen公司(Carslbad, CA, USA). 细胞核染料DAPI和牛血清白蛋白(bovine serum albumin, BSA)购自美国Sigma-Aldrich公司(St. Louis, MO, USA). 多聚甲醛(Paraformaldehyde, PFA)购自美国Electron Microscopy Sciences公司(Hatfield, PA, USA).
1.2.1 免疫磁珠负性富集和滴片制备: 7.5 mL外周血转入50 mL离心管, 加缓冲液(137 mmol/L NaCl、2.7 mmol/L KCl、10 mmol/L Na2HPO4、2 mmol/L EDTA、0.5%BSA, pH 7.4)至45 mL, 400 g离心5 min后去上清; 加入红细胞裂解液(155 mmol NH4Cl; 10 mmol KHCO3; 0.1 mmol EDTA)至45 mL, 避光, 室温旋转混匀8 min, 400 g离心5 min后去上清, 重复2次; 1×107白细胞加入20 μL抗人CD45磁珠与细胞沉淀混匀, 4 ℃孵育15 min; 加入1×107白细胞/2 mL缓冲液, 离心后去上清, 加入500 μL缓冲液重悬沉淀, 将细胞悬液加入强磁场环境下的LS柱, 洗脱并收集未与CD45磁珠结合的有核细胞(包括CTC), 控制液滴速度1.5-2.0 mL/min; 载玻片中央用免疫组织化学笔画一直径约2 cm圆圈, 放置干燥; 充分混匀有核细胞上清, 每100 μL细胞悬液滴一张片. 滴片放在超净台中室温放至半干, 加入4%多聚甲醛固定30 min, 1×PBS洗涤3次, 每次3 min, 室温干燥后备用[12,14,16].
1.2.2 免疫荧光染色: 滴片分别加入2%BSA磷酸盐缓冲液(PBS)稀释的抗CK8/18/19-FITC(1:100)、GPC3(1:100)、ASGR1/2(1:100)和CD45-PE(1:500)抗体, 室温孵育1 h. 用洗液(0.2%BSA)洗3次, 去除未结合的抗体. 与GPC3和ASGR1/2抗体孵育的细胞滴片再与Alexa Huor 488标记的荧光二抗(1:500, 2%BSA稀释)室温孵育1 h, 用洗液洗涤3次, 去除未结合的抗体. 上述染色滴片加7 μL DAPI的封固剂封片, 避光4 ℃保存.
1.2.3 HCC CTC鉴定: CTC鉴定标准为: 细胞整体形态完整, 为圆形或椭圆形; 可见细胞核, 即DAPI(+); CK、GPC3和ASGR1/2(+); 白细胞标记CD45(-).
1.2.4 RNA原位杂交: 按说明操作, 主要流程为: pretreat 1处理10 min, pretreat 3孵育40 ℃ 30 min, PBS浸洗1次. 在40 ℃杂交炉内杂交, 探针孵育2 h, 洗液浸洗; 依次加入信号放大探针Amp1-4孵育40 ℃, 30 min, 15 min交替进行. Amp5, 6在室温孵育30 min和15 min. 显色剂A、B等体积混合加入待检样本, 反应10 min, 洗去, 苏木染色2 min, 乙醇梯度脱水, 二甲苯浸泡20 min, 中性树脂封片[21].
统计学处理 采用SPSS19.0软件对数据进行统计学处理, 计量资料以mean±SD表示. 用t检验比较术前和术后CTC数目的差异, P<0.05为差异有统计学意义.
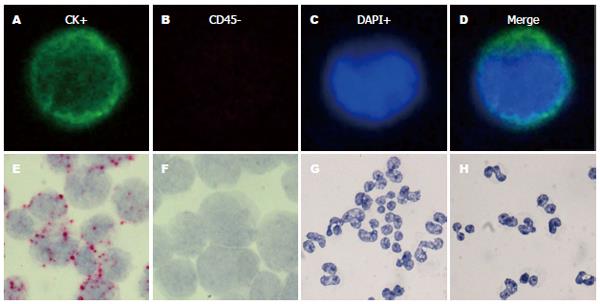
在12例HCC患者外周血中成功富集到了CTC, 上皮细胞标志物CK为阳性(图1A), 白细胞表面标志物CD45为阴性(图1B), DAPI进行核染色阳性(图1C), 证明成功的在HCC患者外周血中富集到了CTC(图1D). 在同一病例的滴片中进行了PPIB的检测, 并用HCT116细胞滴片与PPIB、DapB作为阳性和阴性对照实验. 结果显示, 在阴阳性对照中出现杂交信号的前提下(图1E, F), HCC患者外周血滴片中未能检测到PPIB RNA信号(图1G, H).
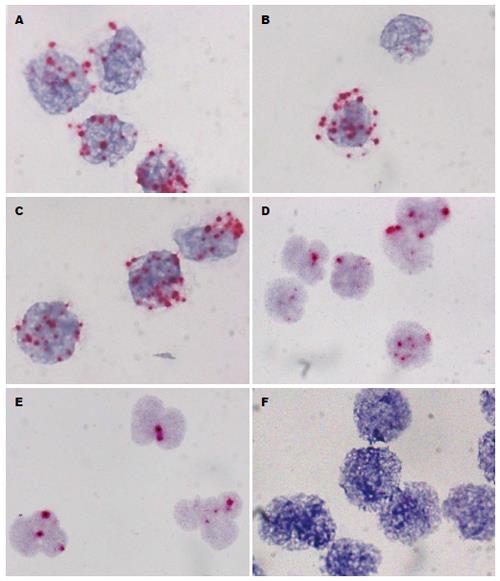
细胞分别经过细胞缓冲液、红细胞裂解液和抗体标记的免疫磁珠与HCT116细胞悬液处理并经过上限时间共孵育后, HCT116细胞滴片上均出现了RNA阳性杂交信号(图2A-C). 经优化样本的外周血有核细胞滴片中检测到了RNA原位杂交的阳性信号(图2D, E), 缩短从采血到细胞富集并固定的处理时间可以减少RNA的降解, 保证外周血有核细胞的RNA质量.
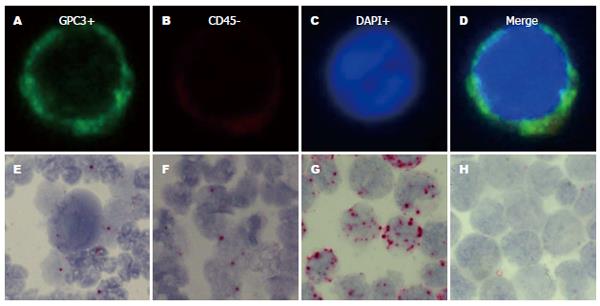
细胞滴片经免疫荧光染色, 荧光显微镜下可见经负性富集的HCC CTC形态规则, 细胞膜和细胞核完整, 细胞核呈圆形或卵圆形, 染色质分布均匀, 核质比增大, 细胞呈现GPC3(+)、CK(+)、ASGR1/2(+)和CD45(-)特征(图3A-D). 同一病例的细胞滴片RNA原位杂交结果表明, 经负性富集的HCC CTC(图3E)和外周血白细胞(图3E, F)中均可检测到PPIB探针的杂交信号. 在HCT116细胞滴片上用PPIB探针杂交阳性(阳性对照)和用DapB探针杂交阴性(阴性对照)表明实验条件工作(图3G, H). 在12例HCC患者术前术后外周血样本中重复了该实验, 肝癌切除术后患者CTC数量明显下降, 在经过负性富集得到的有核细胞中杂交出了RNA的阳性信号.
本研究探索了负性富集CTC方法中影响RNA质量的因素, 通过调整固定步骤建立了在负性富集HCC CTC中原位检测RNA的方法, 为进一步在CTC中检测目的基因转录水平研究奠定了基础.
肿瘤细胞从原发灶和转移灶侵入或脱落到血液中, 少数高活力和侵袭能力的肿瘤细胞聚集成簇, 通过血液循环到达适宜生长的部位形成新的转移灶和复发灶[3], CTC具有连接原发灶和转移灶的桥梁作用, 对通过血行转移的肿瘤有重要的意义. 近年来, CTC的检测逐渐受到人们的关注[9,10], 主要研究集中在评估肿瘤转移复发风险[22]; 肿瘤分类、实时监测肿瘤进展和疗效以及预后[23-25]; 探索肿瘤治疗的靶标和耐药机制[26], 以及研究肿瘤的发展进程等方面.
CTC的检测主要分为富集和鉴定两大部分. 目前, 从外周血中富集CTC的方法主要有捕获肿瘤细胞的"正性富集"和去除红白细胞的"负性富集"两种主要策略. 正性富集一般偶联抗肿瘤细胞表面标志分子抗体的磁珠捕获(如EpCAM免疫磁珠), 由于肿瘤高度异质性, 仅有约30%的HCC细胞表达EpCAM, 因此容易发生漏检. 本研究采用负性富集策略, 即应用抗白细胞表面共同标记CD45抗体结合的纳米磁珠, 从血液中去除大量的白细胞后, 富集剩余有核细胞, 细胞经固定滴片后鉴定CTC, 可以有效避免因敏感度不够带来的漏检. 经特异性较高的抗体(CK, GPC3等)识别并结合形态学分析, 鉴定负性富集的有核细胞可最大程度地减少对目标细胞的干扰, 同时可以保持细胞形态学的完整性[15,16].
作为液体活检, CTC是动态直观了解肿瘤进展不可替代的生物标志物, 有助于基于原发肿瘤特定基因分型的肿瘤靶向治疗[27-30]. 例如, 监测CTC中雌激素受体和HER2编码基因的表达可以辅助分类和指导内分泌治疗和曲妥单抗治疗. 而且, 曲妥单抗的应用可以减少CTC数目和CK19阳性病例化疗耐药性, 从而减少复发, 延长生存[31]. 因此, 了解CTC分子表型是了解肿瘤转移耐药的新视角.
应用CTC辅助肿瘤个体化治疗和实时监测依赖有效的核酸分析技术[12]. 目前, 通过单细胞测序可以分析CTC的表型, 但由于技术复杂和高昂的花费使其很难用于临床检测. 本研究选择一种简单精准的RNA原位杂交新技术, 并尝试用于分析CTC单细胞中特定基因的转录活性. 该技术采用独特的ZZ探针设计和信号放大系统, 具有较高的灵敏度和特异度[32]. 负性富集CTC结合RNA原位杂交检测系统, 可辅助临床动态监测肿瘤进展, 实现对肿瘤更为精准的治疗.
肝细胞肝癌是我国常见恶性肿瘤之一, 易发生血行转移, 预后较差. 外周血循环肿瘤细胞(circulating tumor cell, CTC)的检测对实时监测肝癌进展, 指导治疗有着重要意义.
唐哲, 教授, 主任医师, 郑州大学第一附属医院普外科; 谭宁, 副研究员, 桂林医学院科学实验中心, 广西肝损伤及修复分子医学重点实验室
CTC的检测主要采用基于肿瘤细胞核酸和表面表达蛋白标志的方法, 用于研究肿瘤转移复发机制, 监测治疗疗效及预后评估.
针对CTC正性富集方法很难克服漏检这一缺点, 本研究采用负性富集策略获得外周血稀有肿瘤细胞. 结合高精度RNA杂交技术, 建立在肝细胞肝癌CTC滴片上的RNA原位杂交技术, 可实现对CTC特定基因RNA转录本的分析, 辅助临床更为精准的肿瘤治疗.
本研究建立的基于循环肿瘤细胞上的RNA原位杂交方法, 更适用于临床动态监测肿瘤进展, 了解药物敏感性, 辅助指导化疗和免疫靶向治疗, 为肿瘤精准化治疗提供了新的技术支持.
负性富集: 应用抗白细胞表面共同标记CD45抗体结合的纳米磁珠, 从血液中去除大量的白细胞后, 富集剩余的有核细胞从而获得稀有CTC的方法.
本文将负性富集CTC的方法与RNA原位杂交技术相结合, 创新性较为突出. 优化了富集过程中影响RNA质量的条件并成功建立基于循环肿瘤细胞上的RNA原位杂交方法, 对临床动态监测肿瘤进展, 了解药物敏感性, 辅助指导化疗和免疫靶向治疗有重要意义. 实验设计严谨, 结论可信程度较高.
编辑: 于明茜 电编:都珍珍
| 1. | Hong B, Zu Y. Detecting circulating tumor cells: current challenges and new trends. Theranostics. 2013;3:377-394. [PubMed] [DOI] |
| 2. | Cristofanilli M, Budd GT, Ellis MJ, Stopeck A, Matera J, Miller MC, Reuben JM, Doyle GV, Allard WJ, Terstappen LW. Circulating tumor cells, disease progression, and survival in metastatic breast cancer. N Engl J Med. 2004;351:781-791. [PubMed] [DOI] |
| 3. | Aceto N, Bardia A, Miyamoto DT, Donaldson MC, Wittner BS, Spencer JA, Yu M, Pely A, Engstrom A, Zhu H. Circulating tumor cell clusters are oligoclonal precursors of breast cancer metastasis. Cell. 2014;158:1110-1122. [PubMed] [DOI] |
| 4. | Qiao YY, Lin KX, Zhang Z, Zhang DJ, Shi CH, Xiong M, Qu XH, Zhao XH. Monitoring disease progression and treatment efficacy with circulating tumor cells in esophageal squamous cell carcinoma: A case report. World J Gastroenterol. 2015;21:7921-7928. [PubMed] [DOI] |
| 5. | Cohen SJ, Punt CJ, Iannotti N, Saidman BH, Sabbath KD, Gabrail NY, Picus J, Morse M, Mitchell E, Miller MC. Relationship of circulating tumor cells to tumor response, progression-free survival, and overall survival in patients with metastatic colorectal cancer. J Clin Oncol. 2008;26:3213-3221. [PubMed] [DOI] |
| 6. | de Bono JS, Scher HI, Montgomery RB, Parker C, Miller MC, Tissing H, Doyle GV, Terstappen LW, Pienta KJ, Raghavan D. Circulating tumor cells predict survival benefit from treatment in metastatic castration-resistant prostate cancer. Clin Cancer Res. 2008;14:6302-6309. [PubMed] [DOI] |
| 7. | Plaks V, Koopman CD, Werb Z. Cancer. Circulating tumor cells. Science. 2013;341:1186-1188. [PubMed] [DOI] |
| 8. | Pantel K, Alix-Panabières C. Circulating tumour cells in cancer patients: challenges and perspectives. Trends Mol Med. 2010;16:398-406. [PubMed] [DOI] |
| 9. | Attard G, de Bono JS. Utilizing circulating tumor cells: challenges and pitfalls. Curr Opin Genet Dev. 2011;21:50-58. [PubMed] [DOI] |
| 10. | Zhang Y, Li J, Cao L, Xu W, Yin Z. Circulating tumor cells in hepatocellular carcinoma: detection techniques, clinical implications, and future perspectives. Semin Oncol. 2012;39:449-460. [PubMed] [DOI] |
| 12. | Ren C, He P, Zhang J, Zheng Z, Qiao Y, Zhao X. Malignant characteristics of circulating tumor cells and corresponding primary tumor in a patient with esophageal squamous cell carcinoma before and after surgery. Cancer Biol Ther. 2011;11:633-638. [PubMed] [DOI] |
| 13. | Ren C, Han C, Zhang J, He P, Wang D, Wang B, Zhao P, Zhao X. Detection of apoptotic circulating tumor cells in advanced pancreatic cancer following 5-fluorouracil chemotherapy. Cancer Biol Ther. 2011;12:700-706. [PubMed] |
| 14. | Ren C, Han C, Wang D, Zhao X, Jin G, Shen H. Detection of circulating tumor cells: Clinical relevance of a novel metastatic tumor marker. Exp Ther Med. 2011;2:385-391. [PubMed] |
| 15. | Mu H, Lin KX, Zhao H, Xing S, Li C, Liu F, Lu HZ, Zhang Z, Sun YL, Yan XY. Identification of biomarkers for hepatocellular carcinoma by semiquantitative immunocytochemistry. World J Gastroenterol. 2014;20:5826-5838. [PubMed] [DOI] |
| 17. | Khoja L, Lorigan P, Dive C, Keilholz U, Fusi A. Circulating tumour cells as tumour biomarkers in melanoma: detection methods and clinical relevance. Ann Oncol. 2015;26:33-39. [PubMed] [DOI] |
| 18. | Raimondi C, Gradilone A, Naso G, Vincenzi B, Petracca A, Nicolazzo C, Palazzo A, Saltarelli R, Spremberg F, Cortesi E. Epithelial-mesenchymal transition and stemness features in circulating tumor cells from breast cancer patients. Breast Cancer Res Treat. 2011;130:449-455. [PubMed] [DOI] |
| 19. | Chen WS, Chung MY, Liu JH, Liu JM, Lin JK. Impact of circulating free tumor cells in the peripheral blood of colorectal cancer patients during laparoscopic surgery. World J Surg. 2004;28:552-557. [PubMed] |
| 20. | Payne RE, Wang F, Su N, Krell J, Zebrowski A, Yagüe E, Ma XJ, Luo Y, Coombes RC. Viable circulating tumour cell detection using multiplex RNA in situ hybridisation predicts progression-free survival in metastatic breast cancer patients. Br J Cancer. 2012;106:1790-1797. [PubMed] [DOI] |
| 21. | Finkin S, Yuan D, Stein I, Taniguchi K, Weber A, Unger K, Browning JL, Goossens N, Nakagawa S, Gunasekaran G. Ectopic lymphoid structures function as microniches for tumor progenitor cells in hepatocellular carcinoma. Nat Immunol. 2015;16:1235-1244. [PubMed] [DOI] |
| 22. | Fan ST, Yang ZF, Ho DW, Ng MN, Yu WC, Wong J. Prediction of posthepatectomy recurrence of hepatocellular carcinoma by circulating cancer stem cells: a prospective study. Ann Surg. 2011;254:569-576. [PubMed] [DOI] |
| 23. | Liu S, Li N, Yu X, Xiao X, Cheng K, Hu J, Wang J, Zhang D, Cheng S, Liu S. Expression of intercellular adhesion molecule 1 by hepatocellular carcinoma stem cells and circulating tumor cells. Gastroenterology. 2013;144:1031-1041.e10. [PubMed] [DOI] |
| 24. | Sun YF, Xu Y, Yang XR, Guo W, Zhang X, Qiu SJ, Shi RY, Hu B, Zhou J, Fan J. Circulating stem cell-like epithelial cell adhesion molecule-positive tumor cells indicate poor prognosis of hepatocellular carcinoma after curative resection. Hepatology. 2013;57:1458-1468. [PubMed] [DOI] |
| 25. | Schulze K, Gasch C, Staufer K, Nashan B, Lohse AW, Pantel K, Riethdorf S, Wege H. Presence of EpCAM-positive circulating tumor cells as biomarker for systemic disease strongly correlates to survival in patients with hepatocellular carcinoma. Int J Cancer. 2013;133:2165-2171. [PubMed] [DOI] |
| 26. | Toso C, Mentha G, Majno P. Liver transplantation for hepatocellular carcinoma: five steps to prevent recurrence. Am J Transplant. 2011;11:2031-2035. [PubMed] [DOI] |
| 27. | Paterlini-Brechot P, Benali NL. Circulating tumor cells (CTC) detection: clinical impact and future directions. Cancer Lett. 2007;253:180-204. [PubMed] [DOI] |
| 28. | Fidler IJ. The pathogenesis of cancer metastasis: the 'seed and soil' hypothesis revisited. Nat Rev Cancer. 2003;3:453-458. [PubMed] [DOI] |
| 29. | Alix-Panabieres C, Pantel K. [The circulating tumor cells: liquid biopsy of cancer]. Klin Lab Diagn. 2014;60-64. [PubMed] |
| 30. | Klein CA. Parallel progression of primary tumours and metastases. Nat Rev Cancer. 2009;9:302-312. [PubMed] [DOI] |
| 31. | Georgoulias V, Bozionelou V, Agelaki S, Perraki M, Apostolaki S, Kallergi G, Kalbakis K, Xyrafas A, Mavroudis D. Trastuzumab decreases the incidence of clinical relapses in patients with early breast cancer presenting chemotherapy-resistant CK-19mRNA-positive circulating tumor cells: results of a randomized phase II study. Ann Oncol. 2012;23:1744-1750. [PubMed] [DOI] |
| 32. | Yang D, Wang L, Tian X. Application of circulating tumor cells scope technique on circulating tumor cell research. Mol Cell Ther. 2014;2:8. [PubMed] [DOI] |