修回日期: 2016-02-05
接受日期: 2016-02-22
在线出版日期: 2016-03-28
目的: 通过毛花苷C作用于人肝癌SMMC-7721细胞, 研究其对SMMC-7721细胞增殖的影响, 初步探讨其作用机制.
方法: 使用不同浓度毛花苷C干预SMMC-7721细胞, 通过细胞增殖实验及克隆形成实验, 检测毛花苷C对SMMC-7721细胞增殖的作用; 通过流式细胞仪检测毛花苷C对SMMC-7721细胞周期和凋亡的影响; 采用Western blot技术分析细胞凋亡抑制基因survivin的表达.
结果: 毛花苷C对SMMC-7721细胞增殖有明显的抑制作用, 各加药组与对照组相比差异有统计学意义(P<0.01), 并呈现剂量-效应相关关系; 流式细胞术显示, 毛花苷C将SMMC-7721细胞阻滞于S期, 并诱导其凋亡; Western blot检测结果显示毛花苷C下调SMMC-7721细胞内survivin蛋白的表达.
结论: 毛花苷C明显抑制SMMC-7721细胞增殖, 将细胞阻滞在S期并诱导其凋亡. 该机制可能与下调survivin的蛋白表达有关.
核心提示: 有关毛花苷C在抑制肝癌细胞增殖的作用机制方面鲜见报道. 本研究通过体外实验, 表明毛花苷C明显抑制肝癌SMMC-7721细胞的增殖, 将细胞阻滞于S期并诱导其凋亡, 其作用机制可能与下调survivin蛋白表达相关.
引文著录: 王建超, 余翥, 胡艳梅, 王坦, 曾永联, 谭宁, 徐庆. 毛花苷C促进肝癌SMMC-7721细胞凋亡及抑制survivin的表达. 世界华人消化杂志 2016; 24(9): 1331-1341
Revised: February 5, 2016
Accepted: February 22, 2016
Published online: March 28, 2016
AIM: To investigate the effect of lanatoside C on the proliferation of human hepatocarcinoma SMMC-7721 cells and to explore the underlying mechanism.
METHODS: SMMC-7721 cells were treated with lanatoside C. Then cell proliferation assay and colony formation assay were applied to detect the cell proliferation. The effect of lanatoside C on the cell cycle and apoptosis of SMMC-7721 cells were detected by flow cytometry. Western blot assay was used to detect survivin protein expression.
RESULTS: Compared with control cells, lanatoside C significantly inhibited the proliferation of SMMC-7721 cells (P < 0.01) in a dose-dependent manner. Results of flow cytometry indicated that lanatoside C arrested SMMC-7721 cells at the S phase and induced their apoptosis. Western blot assay showed that lanatoside C down-regulated the expression of survivin protein in SMMC-7721 cells.
CONCLUSION: Lanatoside C could inhibit the proliferation of SMMC-7721 cells obviously, arrest the SMMC-7721 cells at S phase and induce their apoptosis. The mechanism may be associated with the down-regulation of survivin expression.
- Citation: Wang JC, Yu Z, Hu YM, Wang T, Zeng YL, Tan N, Xu Q. Lanatoside C promotes apoptosis and inhibits survivin expression in hepatocarcinoma SMMC-7721 cells. Shijie Huaren Xiaohua Zazhi 2016; 24(9): 1331-1341
- URL: https://www.wjgnet.com/1009-3079/full/v24/i9/1331.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i9.1331
原发性肝癌(以下简称肝癌)是我国常见的恶性肿瘤之一, 我国每年约有38.3万人死于肝癌, 占全球肝癌死亡人数的51%[1]. 据卫生部最新数据统计, 肝癌在各种恶性肿瘤死亡率中顺位已由20世纪70年代的第3位上升至21世纪初的第2位, 仅次于肺癌[2]. 目前, 肝癌最有效的治疗方法仍采用以手术为主的综合治疗[3], 但由于许多患者不能满足手术的治疗标准, 其他治疗方法如药物治疗就显得越来越重要. 因为药物治疗缺乏高度的组织选择性, 往往产生严重的全身性不良反应[4], 所以如何提高药物治疗效果, 减轻不良反应, 就成为药物治疗亟待解决的关键问题[5]. 20世纪60年代末起, 药物学研究者逐渐将强心苷(cardiac glycosides)应用于肿瘤治疗领域, 发现地高辛(Digoxin)、洋地黄毒苷(Digitoxin)及毒毛花苷G(Ouabain)等强心苷类药物能够预防和治疗肿瘤[6,7].
因此, 本实验研究不同浓度毛花苷C对肝癌SMMC-7721细胞增殖、周期和凋亡的影响, 检测其对凋亡抑制基因survivin表达变化情况, 初步探讨其作用机制, 为临床应用提供新的理论依据.
人肝癌SMMC-7721细胞株购自中国科学院上海生科院细胞资源中心; 毛花苷C(上海旭东海普药业有限公司, CAS: #17575-22-3, 将毛花苷C溶于嘧啶试剂, 制成20 mg/mL存储液, 0.22 µm微孔滤器过滤除菌, 避光常温保存); DMEM高糖培养液(GIBCO公司, C11995500BT); 胎牛血清FBS(CORILLE公司, C1015-05); Cell Counting Kit-8试剂(上海同仁化学研究所, CK04); survivin单克隆抗体(SC-10811, 兔源性)、抗β-actin一抗(SC-47778, 鼠源性)及二抗(羊抗兔、羊抗鼠)均购自SANTA CRUZ公司; Annexin V-FITC/PI试剂(东仁化学科技上海有限公司, AD10).
1.2.1 细胞培养: 人肝癌SMMC-7721细胞接种于含10%胎牛血清的经改良的DMEM培养液中(含支原体抗生素), 在37 ℃、50 mL/L CO2培养箱饱和湿度下培养, 用0.25%胰蛋白酶进行消化传代, 选用对数生长期的细胞进行实验.
1.2.2 细胞增殖实验: (1)半抑制浓度(inhibitory concentration 50%, IC50)实验: 以2000个细胞/孔接种于96孔板, 细胞贴壁24 h后, 加入毛花苷C使其终浓度为0.0195、0.0391、0.0781、0.1563、0.3125、0.6250、1.2500、2.5000、5.0000、10.0000 µg/mL, 对照组加等体积嘧啶, 同一浓度设置3个复孔. 连续波长酶标仪(infinite M200 PRO), 读取450 nm波长处吸光度(A)值, 记录加药后48 h数值, 然后计算出毛花苷C干预48 h后的IC50; (2)细胞生长曲线实验(CCK-8法): 采用对数生长期SMMC-7721细胞, 以0.25%胰蛋白酶消化, 含10%FBS的DMEM培养液将细胞吹打为单细胞悬液, 按500个细胞/孔接种于96孔板. 贴壁24 h后, 加入毛花苷C使其终浓度为0.078、0.156、0.312、0.625、1.250、2.500 µg/mL, 对照组加等体积嘧啶, 设置2个终浓度为0.078、2.500 µg/mL, 同一浓度设置3个复孔. 检测前, 弃去培养基, 在每孔加入100 µL CCK-8检测试剂, 轻微震荡10 s. 恒温培养箱孵育2 h后, 置于连续波长酶标仪(infinite M200 PRO), 读取450 nm波长处吸光度(A)值, 分别记录加药后2 h及第2、4、6天数值, 所有结果重复验证3次. 然后计算出毛花苷C干预4 d的细胞抑制率. 细胞抑制率(%) = (嘧啶对照组A450值-毛花苷C组A450值)/嘧啶对照组A450值×100%.
1.2.3 克隆形成实验: 按2000个细胞/孔接种于6孔培养板. 恒温培养箱孵育5 d后, 加入药液使毛花苷C终浓度为0.078、0.156、0.312、0.625、1.250、2.500 µg/mL. 待药物作用3 d后, 弃去上清液, D-PBS溶液(含Mg2+)浸洗3次, 4%多聚甲醛固定15 min, 弃固定液, 结晶紫染液染色15 min, 纯水洗去染液, 空气中自然干燥, 扫描图像. 然后加入10%冰醋酸溶液2 mL/孔, 摇床>30 min, 结晶紫溶解后, 取100 µL/孔加入96孔板中. 使用连续波长酶标仪(infinite M200 PRO), 读取各孔560 nm波长处吸光度值并计算克隆抑制率. 克隆抑制率(%) = (嘧啶对照组A560值-毛花苷C组A560值)/嘧啶对照组A560值×100%.
1.2.4 细胞周期检测: 取SMMC-7721细胞以数量为5×105接种至6 cm培养皿后加入毛花苷C, 使其终浓度为0.078、0.156、0.312、0.625、1.250、2.500 µg/mL. 培养48 h后收集细胞, 采用冰冻无水乙醇固定, -20 ℃保存. 检测前用D-PBS(不含Mg2+)洗去固定液. 每管加入500 µL染液(PI终浓度为50 µg/mL, RNaseA终浓度为100 µg/mL), 37 ℃避光孵育30 min. 染色后以300目筛网过滤, 用流式细胞仪(BD FACS AriaⅢ)检测, 数据采用Multicycle DNA软件进行测定与分析.
1.2.5 细胞凋亡检测: 用10 cm培养皿接种1×106个处于对数生长期的SMMC-7721细胞, 恒温培养箱孵育24 h. 待贴壁后, 加入毛花苷C使其终浓度为0.156、0.625、2.500 µg/mL, 对照组加等体积嘧啶. 待药物作用48 h后, 收集细胞并离心, 弃上清液, D-PBS洗涤1次, 离心, 弃上清液, 1×Annexin V Binding Buffer重悬细胞, 并吹打混匀, 加入15 µL Annexin V/FITC和15 µL PI染色液(20 mg/L), 避光30 min. 采用300目筛网过滤, 使用流式细胞仪(BD FACS AriaⅢ)测定采集数据.
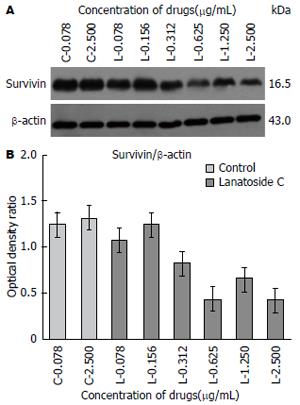
1.2.6 Western blot检测: 收集培养细胞, 采用细胞裂解液提取细胞总蛋白, 蛋白定量试剂盒测定蛋白质浓度, 制备好的蛋白样品置-20 ℃冰箱保存备用. 经聚丙烯酰胺凝胶(13%分离胶+5%浓缩胶)电泳后转移至NC膜上, 5%脱脂奶粉封闭1 h, 一抗4 ℃孵育过夜, TBST洗涤, 二抗37 ℃孵育1 h, TBST洗涤, 与免疫印迹化学发光试剂(ECL)反应, X线片曝光, 显影, 定影. 通过Gel-Pro Analyzer图像分析系统对X线片进行吸光度值计算分析, 以survivin与β-actin吸光度比值作为该因子的相对表达强度.
统计学处理 采用SPSS18.0软件对所有数据进行统计学处理, 以上实验均重复3次. 计量资料以mean±SD表示, 多个样本间的均数比较采用单因素方差分析, 组间多重比较采用Bonferroni-t检验, P<0.05表示差异有统计学意义.
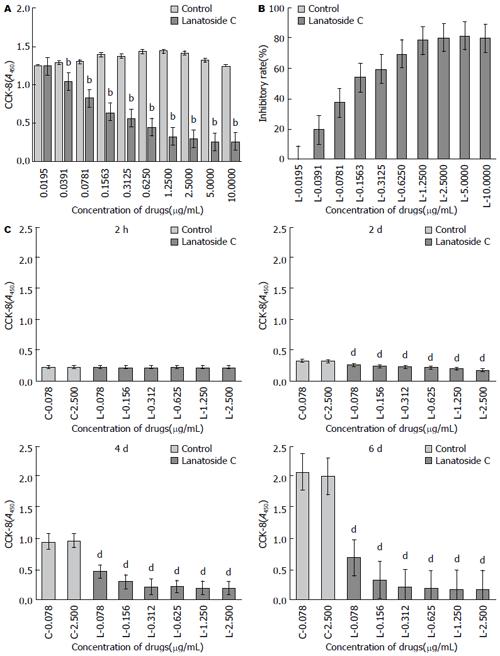
不同浓度嘧啶试剂及毛花苷C作用48 h后, CCK-8法检测记录450 nm波长处吸光度(A)值(图1A). 在一定范围内, 随着毛花苷C浓度的增加, 药物对SMMC-7721细胞的抑制率明显增加, 分别为-0.33%±5.21%、19.18%±3.63%、37.16%±2.17%、53.99%±2.59%、59.14%±2.12%、69.33%±1.31%、77.90%±0.50%、79.94%±0.52%、81.09%±1.54%、79.35%±1.66%, 且有统计学意义(F = 1148.338, P<0.01). 经测算得出毛花苷C作用于SMMC-7721细胞48 h的IC50值为0.227 µg/mL. 毛花苷C作用2 h后各加药组与对照组比较差异无统计学意义(F = 2.016, P>0.05)(图1B). 作用2、4、6 d后, 各加药组与对照组相比差异均有统计学意义(F = 152.794、187.811、857.287, P<0.01)(图1C). 不同浓度毛花苷C作用4 d后, 计算SMMC-7721细胞增殖抑制率分别为53.34%±3.70%、69.32%±2.45%、76.92%±2.05%、79.60%±1.66%、80.98%±1.53%、80.95%±1.50%, 差异有统计学意义(F = 202.490, P<0.01).
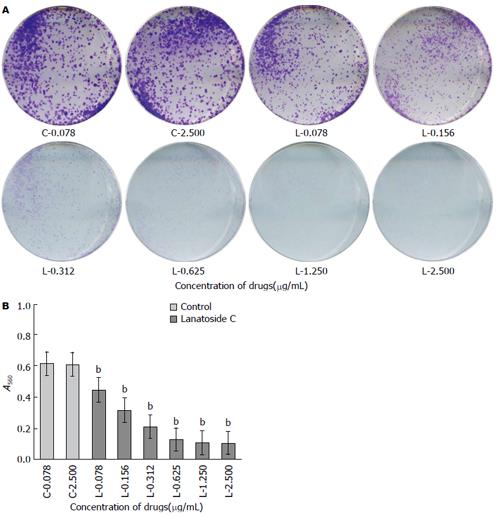
结果显示, 两个浓度(0.078、2.500 µg/mL)嘧啶对照组的克隆计数肉眼观和吸光度值差异无统计学意义(P>0.05). 毛花苷C组相对于嘧啶对照组吸光度值有差异, 且差异有统计学意义(F = 735.838, P<0.01). SMMC-7721细胞克隆抑制率随毛花苷C浓度增加而增高. 不同浓度毛花苷C干预3 d后, 克隆抑制率分别为26.47%±5.66%、47.92%±5.07%、66.09%±2.93%、80.07%±1.49%、82.89%±1.44%、83.31%±1.21%, 差异有统计学意义(F = 1593.616, P<0.01)(图2).
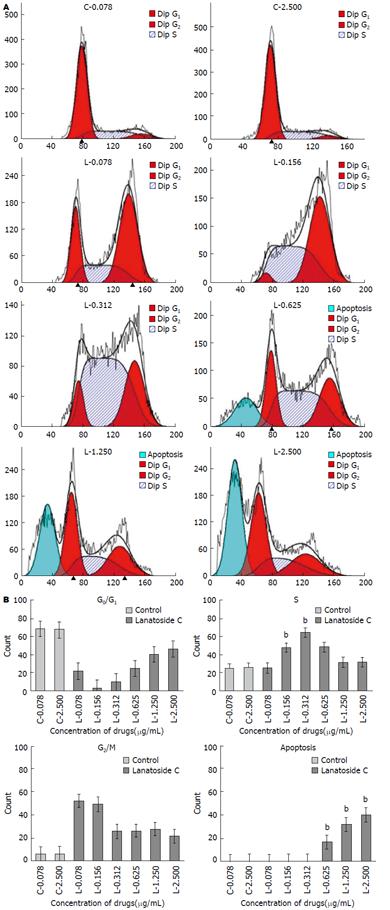
结果显示, 不同浓度毛花苷C干预SMMC-7721细胞48 h后, 其S期细胞群百分比例分别为25.49%±1.43%、47.63%±2.45%、63.93%±1.26%、48.63%±0.45%、32.12%±0.91%、31.75%±4.30%. 0.625、1.250、2.500 µg/mL浓度的细胞凋亡率分别为16.32%±0.62%、31.68%±1.76%、40.29%±1.96%. 与阴性对照组相比, 不同浓度毛花苷C能使S期细胞所占百分比增加, 及0.625、1.250、2.500 µg/mL浓度毛花苷C的细胞凋亡率逐渐增加, 且呈剂量依赖性(F = 897.721, P<0.01)(图3).
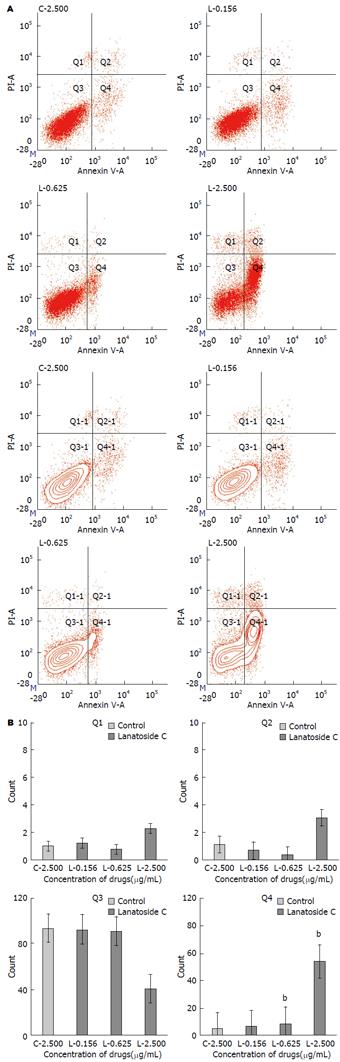
SMMC-7721细胞在不同浓度毛花苷C干预后, 与对照组相比, 细胞凋亡比例明显增加, 且呈剂量-效应相关关系. 2.500 µg/mL嘧啶对照组及0.156、0.625、2.500 µg/mL毛花苷C组凋亡细胞所占比例分别为5.77%±0.98%、7.00%±0.36%、8.77%±0.25%、57.23%±0.93%, 差异有统计学意义(F = 3730.131, P<0.01). 结果显示毛花苷C对SMMC-7721细胞凋亡具有促进作用(图4).
不同浓度毛花苷C干预SMMC-7721细胞48 h后, survivin蛋白表达与β-actin蛋白表达吸光度比值分别为1.07±0.06、1.23±0.07、0.82±0.04、0.43±0.02、0.65±0.03、0.42±0.01; 0.078、2.500 µg/mL浓度嘧啶对照组survivin蛋白表达相对吸光度比值分别为1.23±0.06、1.32±0.01. 结果显示毛花苷C组与嘧啶对照组相比, SMMC-7721细胞的survivin蛋白表达水平在毛花苷C干预后出现明显下调, 差异有统计学意义(F = 644.020, P<0.01)(图5).
研究发现强心苷类药物选择性地抑制肿瘤细胞的增殖, 诱导其凋亡, 但对正常细胞无明显影响[8-10]. 其抗癌作用机制主要包括抑制Na+/K+-ATP酶活性[11]、抑制促纤维生长因子-2和核因子-κB[12]、抑制缺氧诱导因子-1活性[13]、抑制拓扑异构酶的活性[14]、阻断雌激素受体[15]、诱导细胞凋亡[16]、调节细胞周期[17]、细胞毒性[18]等. 在众多抗癌机制中, 抑制Na+/K+-ATP酶活性是其发挥抗癌作用的主要靶点[6]. Badr等[19]研究发现毛花苷C诱导人恶性胶质瘤细胞的凋亡, 是通过激活Caspase介导的细胞凋亡通路, 在肿瘤细胞早期凋亡过程中, 细胞消耗ATP并降低线粒体膜电位, 可能是一个对抗癌细胞凋亡抵抗的重要激活机制. 强心苷类药物一直被视为治疗心力衰竭、心房颤动和阵发性室上性心动过速的常用药物[20,21], 国内外在其对肝癌细胞的生长抑制及诱导细胞凋亡的作用机制方面鲜有报道.
本实验结果证实毛花苷C对SMMC-7721细胞的增殖具有明显的抑制作用, 并呈剂量-效应相关性. 与嘧啶对照组比较, 毛花苷C作用后S期和凋亡细胞增多, G2/M期细胞减少. 说明毛花苷C阻滞细胞周期的抑制作用点在S/G2, 阻滞细胞由S期进入G2/M, S期细胞DNA的合成复制与蛋白质的合成等生理过程受到抑制, 使其停滞在S期, 细胞周期不能正常进行, 从而有效控制SMMC-7721细胞的增殖, 即发生了细胞周期阻滞. 通过流式细胞技术检测SMMC-7721细胞经毛花苷C干预48 h后, 发现随着毛花苷C浓度的增加, 其细胞凋亡率均逐步增高, 提示毛花苷C有明显的诱导肿瘤细胞凋亡的作用. Western blot技术实验结果则证实毛花苷C可显著下调SMMC-7721细胞内survivin的表达, 这可能是毛花苷C抑制肿瘤细胞增殖, 诱导其凋亡, 进而抑制肿瘤细胞生长的作用机制之一.
Survivin基因由耶鲁大学Ambrosini等[22]在1997年首次克隆出, 其位于染色体17q25靠近端粒的位置, 由3个内含子和4个外显子组成, 共编码142个氨基酸, 分子量为16.5 kDa. survivin是凋亡抑制蛋白家族的新成员, 具有肿瘤特异性, 在多种恶性肿瘤细胞中高表达, 而在癌旁和正常组织中低表达或无表达[23-25], 这一特性使其作为肿瘤标志物成了研究抗肿瘤药物的热点. Yang等[24]通过收集63例术后肝癌标本、10例癌旁组织和10例正常肝组织研究发现, survivin在肝癌组织中表达率为77.8%, 而在正常肝组织中survivin阳性表达率为0%. 研究不断证明survivin具有抑制细胞凋亡、调节细胞周期信号转导和血管形成的作用[26,27], 最近证明其可调节肿瘤细胞微环境和免疫逃逸[27,28], 即表现为促进肿瘤效应. Survivin也是迄今所发现的分子量最小和作用最强的凋亡抑制蛋白[26,29]. 目前认为survivin抑制细胞凋亡的作用是肯定的, 但对其抑制细胞凋亡的具体机制尚存在争议[30]. 一般认为, survivin主要是通过直接或间接抑制凋亡终末效应器半胱天冬氨酸蛋白水解酶(Caspase3、Caspase7、Caspase9等)而作用于细胞周期信号转导通路来抑制细胞凋亡[31]. Khan等[32]通过实验证明, survivin的作用机制可能依赖于抑制凋亡终末效应器Caspase2、Caspase3、Caspase7和Caspase9而发挥作用, 并与扰乱正常细胞周期有关. 万彬彬等[33]研究发现纳米氧化锌(ZnO NPs)下调人神经SH-SY5Y细胞survivin的表达, 激活细胞线粒体凋亡通路, 诱导细胞周期阻滞和凋亡产生. 由此可见, survivin既可调节细胞周期又有效阻断多条凋亡途径, 故其凋亡抑制作用在肿瘤治疗中起着关键作用.
总之, 通过本实验研究得出, 毛花苷C在体外对肝癌SMMC-7721细胞增殖具有明显抑制作用, 且诱导其凋亡. 其作用机制可能与毛花苷C阻滞SMMC-7721细胞于S期, 下调细胞survivin的表达有关. 但其具体作用机制需要体内试验和相关临床研究才能进一步证实.
近年来, 肝癌死亡率在我国不断上升, 以手术为主的综合治疗仍是肝癌最有效的治疗方法, 探索特异高效的治疗药物显得尤为重要. 自20世纪60年代药学研究者将毛花苷C等强心苷类药物用于预防和治疗肿瘤方面, 其抗肝癌方面的研究便被越来越多的研究者所热衷.
李成刚, 副教授, 副主任医师, 中国人民解放军总医院肿瘤外二科; 朱继业, 教授, 主任医师, 北京大学人民医院肝胆外科
随着科学研究的进行, 强心苷类的抗癌作用及机制逐步深入, 有关毛花苷C抑制肝癌细胞增殖, 并诱导其凋亡, 其作用机制可能与下调survivin蛋白表达有关还尚无报道.
前期学者研究发现, survivin基因在淋巴瘤、乳腺癌、宫颈癌、肺癌、胃癌、胰腺癌、直肠癌、膀胱癌、前列腺癌等恶性肿瘤组织中高表达, 而在癌旁和正常组织中低表达或无表达. 故下调该基因表达可抑制肿瘤细胞的生长. survivin基因在控制细胞凋亡、调节细胞周期及血管形成中起着关键作用, 但其作用机制尚不清楚. 研究该基因必将给肿瘤患者带来新的希望, 为肿瘤的治疗开辟新的道路.
本研究显示毛花苷C明显抑制肝癌SMMC-7721细胞增殖, 并诱导其凋亡, 为临床应用提供新的理论依据. 研究发现survivin基因表达可能对肝癌发生发展具有指示意义, 为肝癌的基因治疗提供新靶点.
Survivin基因:是凋亡抑制基因家族的新成员, 具有肿瘤特异性, 只表达于肿瘤和胚胎组织, 且与肿瘤细胞的分化增殖及浸润转移密切相关. Survivin基因抑制凋亡的机制尚存争议, 一般认为, 主要通过直接或间接抑制Caspase3、Caspase7以及Caspase9等而作用于细胞周期信号转导通路来抑制细胞凋亡.
本文探讨毛花苷C抑制肝癌SMMC-7721细胞增殖, 诱导其细胞凋亡, 并下调survivin基因表达, 综合评价实验设计合理, 结果详实可信, 具有一定的科学价值和研究意义.
编辑: 于明茜 电编:都珍珍
| 1. | 吕 桂帅, 陈 磊, 王 红阳. 我国肝癌研究的现状与前景. 中国科学: 生命科学. 2015;27:238-248. |
| 2. | Chen JG, Zhang SW. Liver cancer epidemic in China: past, present and future. Semin Cancer Biol. 2011;21:59-69. [PubMed] [DOI] |
| 4. | Lencioni R, Petruzzi P, Crocetti L. Chemoembolization of hepatocellular carcinoma. Semin Intervent Radiol. 2013;30:3-11. [PubMed] [DOI] |
| 5. | Berisavac II, Pavlović AM, Trajković JJ, Šternić NM, Bumbaširević LG. Drug treatment of vertigo in neurological disorders. Neurol India. 2015;63:933-939. [PubMed] [DOI] |
| 6. | Prassas I, Diamandis EP. Novel therapeutic applications of cardiac glycosides. Nat Rev Drug Discov. 2008;7:926-935. [PubMed] [DOI] |
| 7. | Babula P, Masarik M, Adam V, Provaznik I, Kizek R. From Na+/K+-ATPase and cardiac glycosides to cytotoxicity and cancer treatment. Anticancer Agents Med Chem. 2013;13:1069-1087. [PubMed] [DOI] |
| 8. | Newman RA, Yang P, Pawlus AD, Block KI. Cardiac glycosides as novel cancer therapeutic agents. Mol Interv. 2008;8:36-49. [PubMed] [DOI] |
| 9. | Yeh JY, Huang WJ, Kan SF, Wang PS. Inhibitory effects of digitalis on the proliferation of androgen dependent and independent prostate cancer cells. J Urol. 2001;166:1937-1942. [PubMed] [DOI] |
| 10. | McConkey DJ, Lin Y, Nutt LK, Ozel HZ, Newman RA. Cardiac glycosides stimulate Ca2+ increases and apoptosis in androgen-independent, metastatic human prostate adenocarcinoma cells. Cancer Res. 2000;60:3807-3812. [PubMed] |
| 11. | Sapia L, Palomeque J, Mattiazzi A, Petroff MV. Na+/K+-ATPase inhibition by ouabain induces CaMKII-dependent apoptosis in adult rat cardiac myocytes. J Mol Cell Cardiol. 2010;49:459-468. [PubMed] [DOI] |
| 12. | Winnicka K, Bielawski K, Bielawska A. Cardiac glycosides in cancer research and cancer therapy. Acta Pol Pharm. 2006;63:109-115. [PubMed] |
| 13. | Zhang H, Qian DZ, Tan YS, Lee K, Gao P, Ren YR, Rey S, Hammers H, Chang D, Pili R. Digoxin and other cardiac glycosides inhibit HIF-1alpha synthesis and block tumor growth. Proc Natl Acad Sci U S A. 2008;105:19579-19586. [PubMed] [DOI] |
| 14. | Bielawski K, Winnicka K, Bielawska A. Inhibition of DNA topoisomerases I and II, and growth inhibition of breast cancer MCF-7 cells by ouabain, digoxin and proscillaridin A. Biol Pharm Bull. 2006;29:1493-1497. [PubMed] [DOI] |
| 16. | Ihenetu K, Qazzaz HM, Crespo F, Fernandez-Botran R, Valdes R. Digoxin-like immunoreactive factors induce apoptosis in human acute T-cell lymphoblastic leukemia. Clin Chem. 2007;53:1315-1322. [PubMed] [DOI] |
| 17. | Perne A, Muellner MK, Steinrueck M, Craig-Mueller N, Mayerhofer J, Schwarzinger I, Sloane M, Uras IZ, Hoermann G, Nijman SM. Cardiac glycosides induce cell death in human cells by inhibiting general protein synthesis. PLoS One. 2009;4:e8292. [PubMed] [DOI] |
| 18. | Nasu K, Nishida M, Ueda T, Takai N, Bing S, Narahara H, Miyakawa I. Bufalin induces apoptosis and the G0/G1 cell cycle arrest of endometriotic stromal cells: a promising agent for the treatment of endometriosis. Mol Hum Reprod. 2005;11:817-823. [PubMed] [DOI] |
| 19. | Badr CE, Wurdinger T, Nilsson J, Niers JM, Whalen M, Degterev A, Tannous BA. Lanatoside C sensitizes glioblastoma cells to tumor necrosis factor-related apoptosis-inducing ligand and induces an alternative cell death pathway. Neuro Oncol. 2011;13:1213-1224. [PubMed] [DOI] |
| 20. | Schoner W, Scheiner-Bobis G. Endogenous and exogenous cardiac glycosides: their roles in hypertension, salt metabolism, and cell growth. Am J Physiol Cell Physiol. 2007;293:C509-C536. [PubMed] [DOI] |
| 21. | Leite JA, Alves AK, Galvão JG, Teixeira MP, Cavalcante-Silva LH, Scavone C, Morrot A, Rumjanek VM, Rodrigues-Mascarenhas S. Ouabain modulates zymosan-induced peritonitis in mice. Mediators Inflamm. 2015;2015:265798. [PubMed] [DOI] |
| 22. | Ambrosini G, Adida C, Altieri DC. A novel anti-apoptosis gene, survivin, expressed in cancer and lymphoma. Nat Med. 1997;3:917-921. [PubMed] [DOI] |
| 23. | Peroukides S, Bravou V, Alexopoulos A, Varakis J, Kalofonos H, Papadaki H. Survivin overexpression in HCC and liver cirrhosis differentially correlates with p-STAT3 and E-cadherin. Histol Histopathol. 2010;25:299-307. [PubMed] |
| 24. | Yang Y, Zhu J, Gou H, Cao D, Jiang M, Hou M. Clinical significance of Cox-2, Survivin and Bcl-2 expression in hepatocellular carcinoma (HCC). Med Oncol. 2011;28:796-803. [PubMed] [DOI] |
| 25. | Huang J, Lyu H, Wang J, Liu B. MicroRNA regulation and therapeutic targeting of survivin in cancer. Am J Cancer Res. 2015;5:20-31. [PubMed] |
| 26. | Altieri DC. Survivin, cancer networks and pathway-directed drug discovery. Nat Rev Cancer. 2008;8:61-70. [PubMed] [DOI] |
| 27. | Khan S, Ferguson Bennit H, Asuncion Valenzuela MM, Turay D, Diaz Osterman CJ, Moyron RB, Esebanmen GE, Ashok A, Wall NR. Localization and upregulation of survivin in cancer health disparities: a clinical perspective. Biologics. 2015;9:57-67. [PubMed] [DOI] |
| 28. | Khan S, Bennit HF, Wall NR. The emerging role of exosomes in survivin secretion. Histol Histopathol. 2015;30:43-50. [PubMed] |
| 29. | Véquaud E, Desplanques G, Jézéquel P, Juin P, Barillé-Nion S. Survivin contributes to DNA repair by homologous recombination in breast cancer cells. Breast Cancer Res Treat. 2016;155:53-63. [PubMed] [DOI] |
| 31. | Mobahat M, Narendran A, Riabowol K. Survivin as a preferential target for cancer therapy. Int J Mol Sci. 2014;15:2494-2516. [PubMed] [DOI] |
| 32. | Khan S, Aspe JR, Asumen MG, Almaguel F, Odumosu O, Acevedo-Martinez S, De Leon M, Langridge WH, Wall NR. Extracellular, cell-permeable survivin inhibits apoptosis while promoting proliferative and metastatic potential. Br J Cancer. 2009;100:1073-1086. [PubMed] [DOI] |