修回日期: 2016-01-19
接受日期: 2016-01-25
在线出版日期: 2016-03-18
目的: 从microRNAs(miRNAs)调控角度揭示慢性乙型肝炎病毒(hepatitis B virus, HBV)感染的分子机制.
方法: 将符合标准的病例分为慢性HBV感染者组(含慢性乙型肝炎及慢性HBV携带者)与正常组, 借助Agilent Human miRNA 8×60k微阵列芯片检测血浆中miRNAs表达谱, 求得两组间的差异表达miRNAs谱(P<0.05), 借助miRNA生物信息学分析软件预测其靶基因并对靶基因进行GO功能富集分析和Pathway分析.
结果: 两组间的差异表达miRNAs共69条(P<0.05), 28条上调, 41条下调; GO分析及Pathway分析得到其功能主要涉及生物黏附、转录正/负调控、生物合成过程的正/负调控、氮化合物的代谢过程的正/负调控、蛋白质定位、蛋白氨基酸的磷酸化、Notch信号传导途径、细胞凋亡、Wnt信号通路、Hedgehog信号通路、T细胞受体信号通路、MAPK信号通路、转化生长因子β信号通路、B细胞受体信号通路、ErbB信号通路、p53信号通路等.
结论: 慢性HBV感染受特异性miRNAs调控, 其调控涉及多个生命过程和信号通路.
核心提示: 乙型肝炎病毒(hepatitis B virus, HBV)慢性感染患者血浆差异表达microRNAs(miRNAs)共69条, 28条上调, 41条下调; GO分析及Pathway分析发现HBV慢性感染受特异性miRNAs调控, 其调控涉及多个生命过程和信号通路.
引文著录: 张传涛, 刘业方, 黄群, 刘真真, 王德莉, 杨鸿, 辜海英, 胡蓉, 郑政隆, 乔胃娟. 基于microRNAs调控的慢性HBV感染的分子机制. 世界华人消化杂志 2016; 24(8): 1184-1190
Revised: January 19, 2016
Accepted: January 25, 2016
Published online: March 18, 2016
AIM: To reveal the molecular mechanism of chronic HBV infection from the perspective of microRNA (miRNA) regulation.
METHODS: Patients with chronic hepatitis B virus infection (including chronic hepatitis B and chronic HBV carrier) and normal controls were included. Agilent Human miRNA8 × 60k microarray chip was used to profile the expression of miRNAs in plasma, to obtain differentially expressed miRNAs between the groups (P < 0.05). miRNA bioinformatics analysis software was used to predict the target genes, and conduct GO functional enrichment analysis and pathway analysis of target genes.
RESULTS: There were 69 differentially expressed miRNAs between the two groups (P < 0.05), including 28 up-regulated and 41 down-regulated ones. By GO enrichment analysis and pathway analysis, the target genes are mainly involved in bioadhesive, positive/negative regulation of transcription, positive/negative regulation of biosynthesis, positive/negative regulation of metabolism of nitrogen compounds, protein localization, phosphorylation of protein amino acids. Notch signaling pathway, apoptosis, Wnt signal pathway, Hedgehog signaling pathway, T cell receptor signaling pathway, MAPK signaling pathway, TGF-β signaling pathways, B cell receptor signaling pathway, ErbB signaling pathway, and p53signaling pathway.
CONCLUSION: Chronic HBV infection is regulated by specific miRNAs, and the regulation involves a number of life processes and signaling pathways.
- Citation: Zhang CT, Liu YF, Huang Q, Liu ZZ, Wang DL, Yang H, Gu HY, Hu R, Zheng ZL, Qiao WJ. Molecular mechanism of chronic HBV infection based on miroRNA regulation. Shijie Huaren Xiaohua Zazhi 2016; 24(8): 1184-1190
- URL: https://www.wjgnet.com/1009-3079/full/v24/i8/1184.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i8.1184
全球约20亿人曾感染乙型肝炎病毒(hepatitis B virus, HBV), 其中2.4亿人为慢性HBV感染者[1], 每年约有65万人死于HBV感染所致的肝衰竭、肝硬化和肝细胞癌[2]. 我国是HBV感染高流行区, 其中慢性乙型肝炎(chronic hepatitis B, CHB)是我国三大传染性疾病之一[3]. 由HBV感染引起的肝硬化和肝癌比例分别为60%和80%[4]. 目前抗HBV治疗一线药物仍为核苷类似物和干扰素, 这些药物虽然在促进谷丙转氨酶复常、降低血清HBVDNA水平等方面取得较好疗效[5], 但仍难以彻底清除HBV, 且具有较明显不良反应[6,7], 核苷类似物类药物的耐药问题日益严重[8]. MicroRNAs(miRNAs)是一类具有21-25个核苷酸的单链小分子RNAs, 调控了人体近1/3基因功能[9], miRNAs调控HBV复制、细胞外基质生成及抑癌基因的沉默等过程, 从而影响疾病的进展并能在后期对乙型肝炎相关肝硬化、肝衰竭、肝细胞癌等疾病发生发展中发挥重要作用[10-13]. 研究miRNA调控进一步更新HBV感染的新机制, 已经成为研究热点[14-16]. 本研究借助目前Agilent Human miRNA 8×60k微阵列芯片从miRNA调控角度揭示慢性HBV感染分子机制, 这有利于更新HBV致病机制, 也为今后抗HBV新药研发提供了新的研究靶点.
病例均来自成都市传染病医院等临床中心2013-07/2014-02期间门诊, 分为: 慢性HBV感染者组16例、正常组8例. 慢性HBV感染者组男9例, 女7例, 平均年龄30.65岁±5.64岁. 正常组男5例, 女3例, 平均年龄31.37岁±5.87岁. 参照中华医学会肝病学分会和中华医学会感染病分会联合制定《慢性乙型肝炎防治指南》(2005年版)拟定慢性乙型肝炎、慢性HBV携带者诊断标准[17]. 纳入标准: (1)符合慢性HBV感染(慢性乙型肝炎、慢性HBV携带者)诊断标准; (2)就诊前3 mo内未进行过中西医抗病毒及保肝等治疗; (3)20岁≤年龄≤40岁; (4)同意并签署知情同意书者. 同时以上标准者, 才能进入本研究. 微阵列扫描仪(安捷伦P/N G2565BA)、不锈钢杂交室(安捷伦P/N G2534A)、杂交室垫片幻灯片8微阵列(安捷伦P/N G2534A)、miRNA的完整标签和HYB套件(安捷伦P/N 5190-0456)、基因表达的洗涤液套装(安捷伦P/N 5188-5327).
用血常规管(EDTA抗凝)采取符合标准患者肘静脉血10 mL, 立即4 ℃静置30 min, 离心, 提取血浆, RNA抽提, 杂交, 8×60k微阵列芯片技术检测, 芯片洗涤、扫描, 在线SAS系统(http://www.ebioservice.com)行t检验和SAM筛选, 对筛选出来2倍以上表达差异的miRNAs利用miRNA生物信息学分析软件进行靶基因预测, 将筛选的靶基因行GO功能富集基因分类和Pathway分析.
统计学处理 差异miRNAs筛选采用SAS系统进行. 比较采用配对t检验, miRNAs表达组间比较进行方差分析, P<0.05为差异有统计学意义.
慢性乙型肝炎感染者组与正常组两组间的差异表达miRNAs共69条(P<0.05), 28条上调, 41条下调. 2倍以上差异表达的miRNAs 31条, 8条上调, 23条下调. 上调的8条为hsa-miR-122、hsa-miR-26a、hsa-miR-130a、hsa-miR-103、hsa-miR-142-3p、hsa-miR-630、hsa-miR-3195、hsa-miR-4281等. 下调的23条为: hsa-miR-638、hsa-miR-3665、hsa-miR-671-5p、hsa-miR-15a、hsa-miR-92a、hsa-miR-4306、hsa-miR-107、hsa-miR-1246、hsa-miR-19b、hsa-let-7i、hsa-miR-15b、hsa-miR-123、hsa-miR-106b、hsa-miR-16、hsa-miR-451、hsa-miR-25、hsa-miR-486-5p、hsa-miR-1228、hsa-miR-1280、hsa-miR-1281、hsa-miR-1234、hsa-miR-191*、hsa-miR-20a等.
利用miRNA生物信息学分析软件miRDB, miRNA, TarBase等对两组间2倍以上的差异miRNAs进行靶基因预测, 利用DAVID在线软件对所预测的靶基因进行GO功能富集分析. 上调组差异miroRNAs所对应的靶基因共参与66项显著生物功能(表1), 包括生物黏附、细胞黏附、细胞内的信号级联、小GTP酶介导的信号转导调控、转录正调控、RNA代谢过程正调控、生物合成过程的正/负调控、RNA聚合酶Ⅱ启动子转录调控、Ras蛋白信号转导调控、蛋白氨基酸的磷酸化、Wnt受体信号通路、蛋白质定位等.
| 项目 | 类目名 | n | P值 | 富集 | 伪发现率(%) |
| GO:0022610 | 生物黏附 | 502 | 5.95×1015 | 1.24184964 | 1.17×1011 |
| GO:0007155 | 细胞黏附 | 501 | 7.46×1015 | 1.241146373 | 1.46×1011 |
| GO:0007242 | intracellular signaling cascade | 847 | 9.01×1014 | 1.169437693 | 1.76×1010 |
| GO:0051056 | 细胞内的信号级联 | 197 | 1.04×1011 | 1.355654444 | 2.03×108 |
| GO:0045893 | 转录正调控, DNA依赖性 | 345 | 2.01×1011 | 1.254249778 | 3.93×108 |
| GO:0051254 | RNA代谢过程正调控 | 347 | 2.98×1011 | 1.251029974 | 5.82×108 |
| GO:0010557 | 大分子生物合成过程中的积极调控 | 457 | 4.90×1011 | 1.211774386 | 9.59×108 |
| GO:0009891 | 生物合成过程的正调控 | 482 | 8.36×1011 | 1.202667431 | 1.64×107 |
| GO:0006357 | 调控转录由RNA聚合酶II启动子 | 502 | 9.32×1011 | 1.197436861 | 1.82×107 |
| GO:0046578 | Ras蛋白信号转导调控 | 166 | 1.06×1010 | 1.370793732 | 2.08×107 |
| GO:0031328 | 细胞生物合成过程中的积极调控 | 475 | 1.20×1010 | 1.202503516 | 2.35×107 |
| GO:0042127 | 细胞增殖调节 | 539 | 1.36×1010 | 1.187674274 | 2.67×107 |
下调组的差异miroRNAs所对应的靶基因共参与56项显著生物功能(表2), 包括细胞增殖、细胞内的信号级联、生物黏附、细胞黏附、RNA代谢过程正调控、转录正调控、囊泡介导的转运、生物合成过程的正/负调控、氮化合物的代谢过程的正/负调控、酶联受体蛋白信号通路、细胞投影组织、大分子生物合成过程中的积极调控、离子转运、蛋白氨基酸的磷酸化、蛋白质转运、细胞迁移、细胞内受体介导信号途径、嘌呤核苷酸代谢过程等.
| 项目 | 类目名 | n | P值 | 富集 | 伪发现率(%) |
| GO:0042127 | 细胞增殖调节 | 718 | 7.29×1013 | 1.107198032 | 1.44×109 |
| GO:0007242 | 细胞内的信号级联 | 1117 | 2.14×1011 | 1.079292421 | 4.23×108 |
| GO:0022610 | 生物黏附 | 639 | 2.43×1011 | 1.106263118 | 4.80×108 |
| GO:0007155 | 细胞黏附 | 638 | 2.10×1011 | 1.10610978 | 5.34×108 |
| GO:0051254 | RNA代谢过程正调控 | 444 | 3.90×1010 | 1.12024622 | 7.69×107 |
| GO:0045893 | 转录正调控, DNA依赖性 | 440 | 6.23×1010 | 1.119463379 | 1.23×106 |
| GO:0016192 | 囊泡介导的转运 | 526 | 8.56×1010 | 1.108252843 | 1.69×106 |
| GO:0009891 | 生物合成过程的正调控 | 629 | 9.88×1010 | 1.09835172 | 1.95×106 |
| GO:0051173 | 氮化合物的代谢过程的正调控 | 584 | 1.88×109 | 1.100531742 | 3.71×106 |
| GO:0030030 | 细胞投影组织 | 343 | 2.23×109 | 1.131154415 | 4.40×106 |
| GO:0007167 | 酶联受体蛋白信号通路 | 320 | 2.38×109 | 1.135532231 | 4.69×106 |
| GO:0031328 | 细胞生物合成过程中的积极调控 | 619 | 2.64×109 | 1.096669262 | 5.21×106 |
| GO:0010557 | 大分子生物合成过程中的积极调控 | 592 | 3.06×109 | 1.0985493 | 6.03×106 |
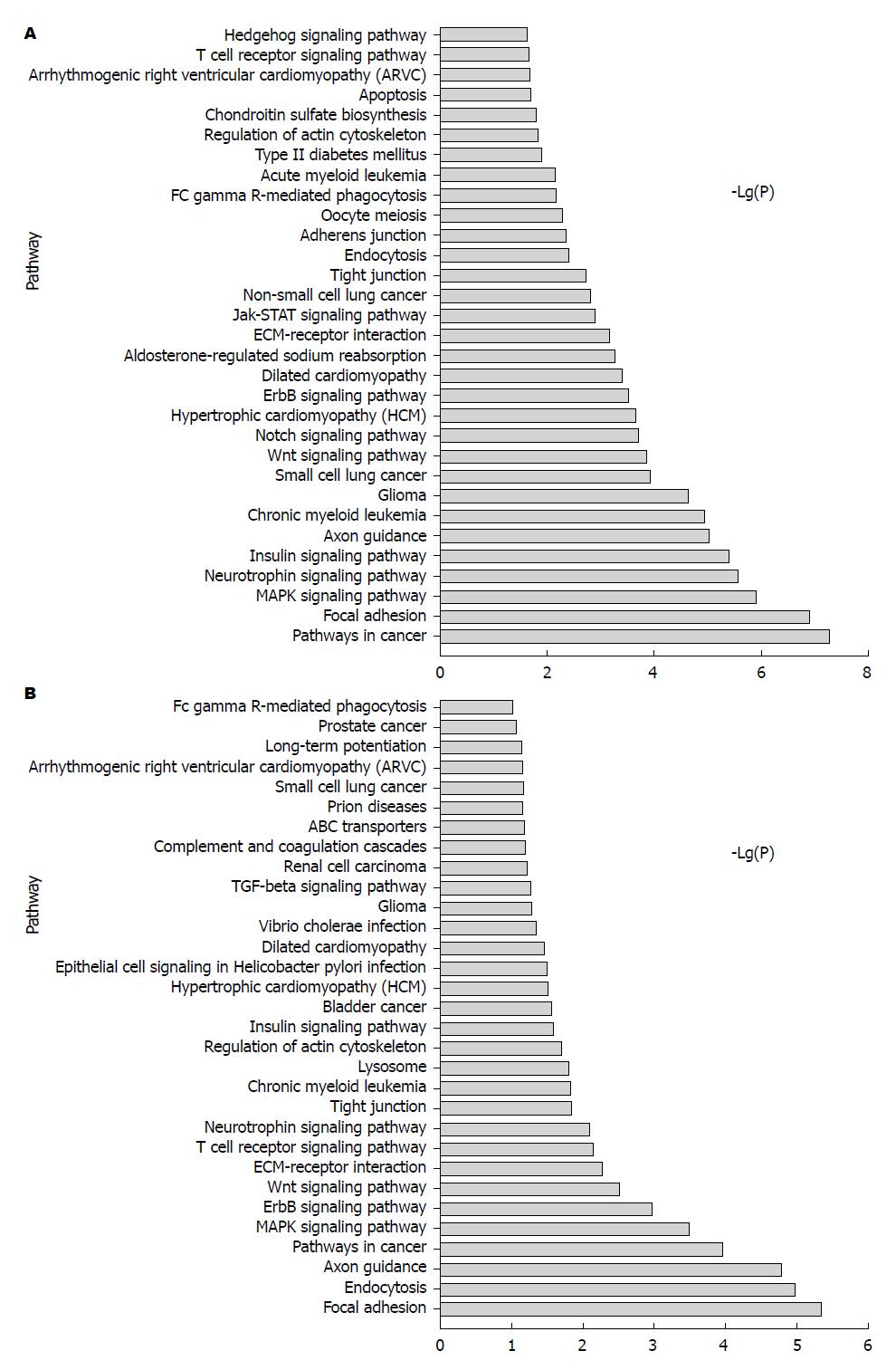
慢性HBV感染组/正常组上调差异miRNAs的靶基因参与的显著性信号通路58条(图1A), 包括Hedgehog信号通路、T细胞受体信号途径、细胞凋亡、硫酸软骨素合成、肌动蛋白骨架调节、Ⅱ型糖尿病、急性髓细胞性白血病、FcγR-介导的吞噬作用、胞吞作用、紧密连接、Jak-STAT信号途径、细胞外基质受体相互作用、醛固酮调节钠重吸收、心脏相关疾病、ErbB信号途径、Notch信号途径、Wnt信号通路、轴突导向、胰岛素信号通路、神经营养因子信号通路、MAPK信号通路、癌症途径、磷脂酰肌醇信号系统、脂肪细胞因子信号通路、钙信号通路、B细胞受体信号通路、p53信号通路等.
下调差异miRNAs的靶基因参与的显著性信号通路31条(图1B), 包括FcγR-介导吞噬作用、癌症途径、长时程增强、心脏相关疾病、朊病毒疾病、ABC转运、补体和凝血级联、转化生长因子β信号通路、霍乱弧菌感染、幽门螺杆菌感染上皮细胞信号转导、胰岛素信号通路、肌动蛋白骨架调节、溶酶体、紧密连接、神经营养因子信号通路、T细胞受体信号途径、细胞外基质受体相互作用、Wnt信号通路、MAPK信号通路、轴突导向、胞吞作用、B细胞受体信号通路、T细胞受体信号通路等.
本研究借助Agilent Human miRNA 8×60k微阵列芯片技术, 从miRNAs角度慢性HBV感染组/正常组差异miRNAs谱, 其中显著性(2倍以上)差异表达31条, 8条上调, 23条下调. 借助生物信息学分析软件DAVID对差异miRNAs预测靶基因进行GO富集分析发现其功能主要涉及生物黏附、氮化合物的代谢过程的正/负调控、生物合成过程的正/负调控、蛋白氨基酸的磷酸化、基因表达的正/负调控、Wnt信号通路、钙离子转运等生命过程. KEGG分析提示主要涉及Wnt信号通路、MAPK信号通路、胰岛素信号通路、Notch信号途径、B细胞受体信号通路、T细胞受体信号通路、p53的信号通路、JAK-STAT信号通路等.
目前认为机体免疫状态异常是HBV感染慢性化最重要机制, 其中B细胞和T细胞功能异常发挥关键作用[18]. miRNA在人体免疫系统的发展中充当重要角色, 如miR-155与T、B细胞的分化以及B细胞抗体类别转换密切相关[19-21]. HBV在与机体相互作用的过程中导致了多种miRNA分子异常表达, 这些差异miRNA可能参与调控HBV感染后机体抗HBV免疫应答过程[22,23]. 慢性HBV感染免疫耐受期及免疫清除期肝组织中miRNA表达谱存在明显差异, 差异的miRNA有可能与机体免疫功能恢复、HBV免疫清除有关[24]. 阻断Notch信号通路可减少CHB患者外周单个核细胞Foxp3 mRNA的表达, Notch信号通路可能是HBV持续感染的一个因素[25].
TH17作为一种新发现的Th, 参与乙型肝炎疾病的病程发展和转归, HBV可能通过PI3K/AKt/mTOR信号通路激活Th17, 进而高表达白介素-17[26], 推测差异miRNAs调控了B/T细胞受体信号通路而影响机体免疫状态与HBV慢性感染有关. 本研究发现差异miRNAs调控了JAK/STAT信号通路, 而有证据证实乙型肝炎病毒e抗原具有抑制干扰素α、λ激活JAK/STAT信号通路的功能[27]. 肝纤维化中MAPK信号通路能够对肝星状细胞活性产生影响[28]. 差异表达的miRNAs可能与HBV慢性感染相关疾病如肝癌等密切相关, 如miR-26a通过在PIK3C2α/AKT/VEGF通路调节血管生成抑制肝癌的进展[29]. hsa-miR-26a-5p被认为可作为诊断乙型肝炎感染后肝癌的潜在生物标志物[30]. 但仍需我们进一步的验证研究.
总之, 本研究初步揭示慢性HBV感染引起的机体出现差异特异表达的miRNAs谱, 并发现一些重要的miRNAs调控了机体的众多生命过程及信号转导通路, 这对今后开展HBV致病机制研究及抗HBV新药研发具有重要的启发意义. 但是本课题未对筛选到的差异miRNAs及其靶基因进行验证, 且样本数量有限, 需借助更先进技术开展大样本量的系统研究.
全球约20亿人曾感染乙型肝炎病毒(hepatitis B virus, HBV), 其中2.4亿人为慢性HBV感染者, 每年约有65万人死于HBV感染所致的肝衰竭、肝硬化和肝细胞癌. 慢性乙型肝炎属于我国重大传染病之一, 对我国人民健康造成严重影响.
何清, 主任医师, 深圳市第三人民医院肝病Ⅱ科; 曲春枫, 教授, 中国医学科学院肿瘤医院肿瘤研究所, 分子肿瘤学国家重点实验室
目前HBV发病机制研究主要局限于免疫角度, 目前抗HBV药物难以彻底清除病毒. 有必要借助新技术、新手段系统研究以更新HBV发病机制, 积极研发安全、有效、简便的抗HBV新药也是该领域亟待解决的问题.
microRNAs(miRNAs)是一类单链小分子RNA, 调控人体近1/3基因功能, miRNA能够调控HBV复制、细胞外基质生成及抑癌基因的沉默等过程.
本研究使用Agilent Human miRNA 8×60k微阵列芯片研究了包含不同状态的HBV慢性感染患者血浆miRNAs差异表达谱, 并对差异miRNAs的靶基因和Pathway进行了初步分析, 获得了一些与HBV感染相关的重要成果.
本文从miRNA调控角度研究慢性HBV感染的机制, 有望更新目前HBV致病机制, 对今后抗HBV新药研发也有重要的价值.
MicroRNA: 是一种大小约21-23个碱基的小分子RNA, 是由具有发夹结构的约70-90个碱基大小的单链RNA前体经过Dicer酶加工后生成, miRNA调节着人类三分之一的基因, 每个miRNA可以有多个靶基因, 而几个miRNA也可以调节同一个基因.
miRNAs调控也是近关注较多的领域, 本文具备一定的学术及技术水平, 对于更新目前HBV发病机制及今后抗HBV新药研发具有较高价值.
编辑: 于明茜 电编: 闫晋利
| 1. | Ott JJ, Stevens GA, Groeger J, Wiersma ST. Global epidemiology of hepatitis B virus infection: new estimates of age-specific HBsAg seroprevalence and endemicity. Vaccine. 2012;30:2212-2219. [PubMed] [DOI] |
| 2. | Lozano R, Naghavi M, Foreman K, Lim S, Shibuya K, Aboyans V, Abraham J, Adair T, Aggarwal R, Ahn SY. Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010: a systematic analysis for the Global Burden of Disease Study 2010. Lancet. 2012;380:2095-2128. [PubMed] |
| 3. | Zou L, Zhang W, Ruan S. Modeling the transmission dynamics and control of hepatitis B virus in China. J Theor Biol. 2010;262:330-338. [PubMed] [DOI] |
| 4. | Wang FS, Fan JG, Zhang Z, Gao B, Wang HY. The global burden of liver disease: the major impact of China. Hepatology. 2014;60:2099-2108. [PubMed] [DOI] |
| 6. | 胡 倩倩, 时 丽丽, 谭 初兵, 张 洁, 潘 晓菲, 徐 为人. 核苷类似物线粒体毒性机制及临床表现. 中国药理学与毒理学杂志. 2013;27:885-886. |
| 9. | Berezikov E, Guryev V, van de Belt J, Wienholds E, Plasterk RH, Cuppen E. Phylogenetic shadowing and computational identification of human microRNA genes. Cell. 2005;120:21-24. [PubMed] |
| 11. | 冯 洪玲, 李 谦. 血清miRNA在乙型肝炎诊断和预后中的研究进展. 胃肠病学和肝病学杂志. 2014;23:1124-1126. |
| 13. | Waidmann O, Bihrer V, Pleli T, Farnik H, Berger A, Zeuzem S, Kronenberger B, Piiper A. Serum microRNA-122 levels in different groups of patients with chronic hepatitis B virus infection. J Viral Hepat. 2012;19:e58-e65. [PubMed] [DOI] |
| 14. | Manikandan J, Aarthi JJ, Kumar SD, Pushparaj PN. Oncomirs: the potential role of non-coding microRNAs in understanding cancer. Bioinformation. 2008;2:330-334. [PubMed] |
| 19. | Thai TH, Calado DP, Casola S, Ansel KM, Xiao C, Xue Y, Murphy A, Frendewey D, Valenzuela D, Kutok JL. Regulation of the germinal center response by microRNA-155. Science. 2007;316:604-608. [PubMed] |
| 20. | Rodriguez A, Vigorito E, Clare S, Warren MV, Couttet P, Soond DR, van Dongen S, Grocock RJ, Das PP, Miska EA. Requirement of bic/microRNA-155 for normal immune function. Science. 2007;316:608-611. [PubMed] |
| 21. | Vigorito E, Perks KL, Abreu-Goodger C, Bunting S, Xiang Z, Kohlhaas S, Das PP, Miska EA, Rodriguez A, Bradley A. microRNA-155 regulates the generation of immunoglobulin class-switched plasma cells. Immunity. 2007;27:847-859. [PubMed] |
| 22. | Xing TJ, Xu HT, Yu WQ, Wang B, Zhang J. MiRNA-548ah, a potential molecule associated with transition from immune tolerance to immune activation of chronic hepatitis B. Int J Mol Sci. 2014;15:14411-14426. [PubMed] |
| 23. | Brunetto MR, Cavallone D, Oliveri F, Moriconi F, Colombatto P, Coco B, Ciccorossi P, Rastelli C, Romagnoli V, Cherubini B. A serum microRNA signature is associated with the immune control of chronic hepatitis B virus infection. PLoS One. 2014;9:e110782. [PubMed] [DOI] |
| 25. | 李 小亮, 裴 金仙, 奚 敏, 汤 正好, 臧 国庆, 余 永胜. 阻断Notch1信号通路对慢性乙型肝炎患者外周血Foxp3 mRNA表达的影响. 胃肠病学和肝病学杂志. 2011;20:67-70. |
| 27. | 余 奕. 乙型肝炎病毒调控炎症因子网络及干扰素信号通路的研究. 武汉: 武汉大学 2012; . |