修回日期: 2016-01-15
接受日期: 2016-01-25
在线出版日期: 2016-03-08
目的: 研究腹腔注射外源性巨噬细胞对细菌性腹膜炎小鼠转归的影响, 探讨巨噬细胞对细菌性腹膜炎小鼠的治疗作用, 并与抗生素的治疗作用进行比较.
方法: 预实验确定了大肠杆菌浓度的半数致死量、激活的U937细胞的最大安全浓度及大肠杆菌敏感的庆大霉素最大安全剂量. 60只小鼠被随机分为: A组PBS液对照组, B组庆大霉素组, C组激活U937细胞组. 观察每组小鼠的体质量变化、一般情况及死亡情况.
结果: 激活U937细胞或庆大霉素注射的小鼠体质量明显大于PBS液的对照组(P<0.05), 一般情况比对照组好(P<0.05), 死亡率明显降低; 此外激活U937细胞组小鼠体质量明显大于庆大霉素组(P<0.05), 一般情况比庆大霉素组好(P<0.05), 注射细菌和激活U937细胞的小鼠无死亡, 而注射细菌和庆大霉素的小鼠死亡率为20.0%(P<0.01).
结论: 腹腔注射外源性巨噬细胞对小鼠细菌性腹膜炎有治疗作用, 可能优于腹腔注射庆大霉素的治疗作用.
核心提示: 巨噬细胞可完整的吞噬细菌并将其消化在细胞内, 避免细菌毒素和炎性因子的释放, 可有效杀灭细菌和减轻炎症反应. 腹腔注射巨噬细胞可有效治疗小鼠细菌性腹膜炎, 其效果可能优于抗生素.
引文著录: 刘娜娜, 欧希龙, 郑中伟, 伍建业. 外源性巨噬细胞对小鼠细菌性腹膜炎的治疗作用. 世界华人消化杂志 2016; 24(7): 1076-1081
Revised: January 15, 2016
Accepted: January 25, 2016
Published online: March 8, 2016
AIM: To determine the therapeutic effects of exogenous macrophages (U937) in mice with bacterial peritonitis.
METHODS: Sixty mice were randomized into three groups. Group A received injections of E. coli suspension and PBS. Group B received injections of E. coli suspension and gentamycin. Group C received injections of E. coli suspension and activated U937 cells. All dosages, included median lethal dose (LD50) of E. coli and maximum safe doses of activated U937 cells and gentamycin, were determined by pre-tests.
RESULTS: The weight and general condition of mice in groups B and C were significantly better than those of group A (P< 0.05). The fatality rate in groups B and C was lower than that of group A. Compared with group C, general condition and weight of mice in group B were better. The fatality rate in group B was 0, while that of group C was 20% (P < 0.01).
CONCLUSION: As a treatment for bacterial peritonitis, exogenous macrophages (U937) are better than gentamycin.
- Citation: Liu NN, Ou XL, Zheng ZW, Wu JY. Therapeutic effects of exogenous macrophages in mice with bacterial peritonitis. Shijie Huaren Xiaohua Zazhi 2016; 24(7): 1076-1081
- URL: https://www.wjgnet.com/1009-3079/full/v24/i7/1076.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i7.1076
细菌性腹膜炎是常见的急性腹膜炎, 常继发于肝硬化腹水、腹腔内脏器穿孔、脏器的损伤破裂、肠壁坏死等, 引起腹膜炎的细菌多为消化系的常驻菌群, 以大肠杆菌最多见, 其次是厌氧菌、链球菌及肺炎双球菌等. 根据患者的抵抗力、感染的严重程度和治疗情况, 可发展为局限性腹膜炎, 也可扩散发展为弥漫性腹膜炎. 弥漫性腹膜炎时由于腹腔内细菌感染、细菌移位、内毒素血症等, 常可导致全身炎症反应综合征, 引起心肺功能受损, 出现感染性休克, 严重者可发生多器官功能障碍综合征而危及生命[1]. 早期抗菌素治疗可提高存活率, 但使用抗菌素后会使细菌大量死亡并释放出毒素, 会造成或加重全身中毒现象, 使死亡危险性增加[2]. 因此需要一种既能清除细菌又不造成全身中毒反应的治疗方法, 来改善患者的预后.
动物实验意外发现, 将大肠杆菌、肺炎双球菌注射入小鼠的静脉中, 并不造成严重感染和死亡, 但同样数量的细菌注射入小鼠腹腔, 则会使小鼠在72 h内死亡. 结合国内外研究发现, 进入血液的细菌主要是被体内巨噬细胞(最重要的是肝脏Kupffer细胞)吞噬并清除[3], 这一过程并不造成严重的中毒反应, 其原因是入侵的细菌可被巨噬细胞完整吞噬并消化在细胞内, 避免了中性粒细胞、细菌内毒素及炎性因子的释放[4]. 而在腹腔起主要作用的是中性粒细胞, 其数量有限, 且在吞噬细菌后会很快死亡, 并释放大量炎性因子而加重全身炎症反应. 故本文通过注射外源性巨噬细胞至细菌性腹膜炎小鼠腹腔, 以期达到治疗细菌性腹膜炎的作用, 并与抗生素进行比较.
实验用CD2健康♂小鼠购自南京市江宁区青龙山动物繁殖场. 选用6-7周龄CD2健康♂小鼠, 体质量20-25 g, 共60只. 细胞株来源于人单核细胞系的U937细胞株由英国利物浦大学王国祯教授实验室赠送. U937细胞呈悬浮生长, 激活后才变成巨噬细胞, 呈贴壁生长, 可分泌炎性因子并获得吞噬能力. 将复苏的U937细胞培养至有足够的细胞数(通过细胞计数板计数, 达到107-108/mL), 室温保存不超过2 h. 大肠杆菌菌株(111121201)由东南大学附属中大医院检验科从腹膜炎患者的腹水中培养得到. 并且3次标本获得同样的细菌, 经过鉴定储存备用. 本实验使用的大肠杆菌菌株为111121201. 实验选用的抗生素是庆大霉素(2 mL/8万单位), 为通过药敏试验测定的对大肠杆菌(菌株为111121201)敏感的抗生素中的一种.
60只小鼠随机分为3组, 每组20只, 实验分组及注射物质如表1. 每组20只小鼠, 实验前用电子天平称量每只小鼠体质量, 按表1中小鼠分组情况及注射物质对每只小鼠进行处理, 于处理后1 wk称量小鼠体质量, 观察小鼠活动、觅食一般情况及小鼠死亡情况, 记录小鼠死亡时间. 如有死亡小鼠, 称量死亡时的小鼠体质量.
| 分组 | 注射途径 | 注射物质 | 注射剂量(μL) | 处理前体质量(g) | 处理后体质量(g) | 处理后与处理前差值 |
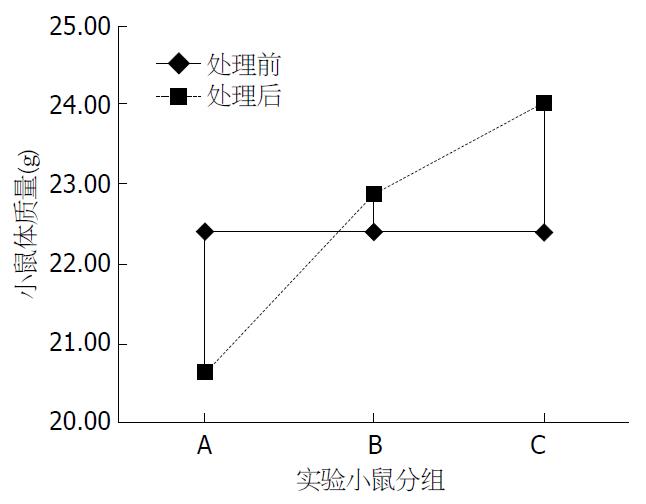
| A组 | 腹腔 | 细菌+PBS液 | 细菌100, PBS液100 | 22.40±0.85 | 20.62±0.73 | -1.78±0.22 |
| B组 | 腹腔 | 细菌+庆大霉素 | 细菌100, 庆大霉素100 | 22.38±0.76 | 22.85±0.83 | 0.47±0.20 |
| C组 | 腹腔 | 细菌+激活U937细胞 | 细菌100, 细胞100 | 22.38±0.75 | 23.98±0.82 | 1.60±0.31 |
实验选用大肠杆菌的浓度为预实验中确定的腹腔注射细菌的最佳剂量2.0×106 CFU/mL, 即腹腔注射可使50.0%小鼠死亡的细菌浓度. 预实验发现当细菌与巨噬细胞比例为1:5, 即巨噬细胞浓度为1.0×107/mL时, 腹腔注射巨噬细胞和细菌不引起小鼠死亡, 为实验所需的对小鼠细菌性腹膜炎有治疗作用的最佳巨噬细胞浓度.
统计学处理 实验中所有数据采用SPSS17.0统计软件进行分析. 实验结果中计量资料以mean±SD表示, 多组均数间比较采用单因素方差分析, 两两组间比较采用q检验. 等级变量资料采用非参数的秩和检验, 多个独立样本比较采用Kruskal-Wallis检验, 两个独立样本比较采用Mann-Whitney检验, 配对资料比较采用Wilcoxom符合秩和检验, P<0.05为差异有统计学意义.
腹腔注射激活U937细胞或庆大霉素对细菌性腹膜炎小鼠体质量的影响如表1. 处理前各组小鼠体质量无显著性差异(P>0.05), 与处理前比较, 细菌和巨噬细胞组及细菌与抗生素组小鼠体质量明显增加(P<0.05), 细菌和PBS液组明显降低(P<0.05), 且处理后细菌和巨噬细胞组重于细菌+庆大霉素、细菌+PBS液组(P<0.05), 细菌+庆大霉素组重于细菌+PBS液组(P<0.05). 处理后各组小鼠体质量增加或减轻的趋势如图1.
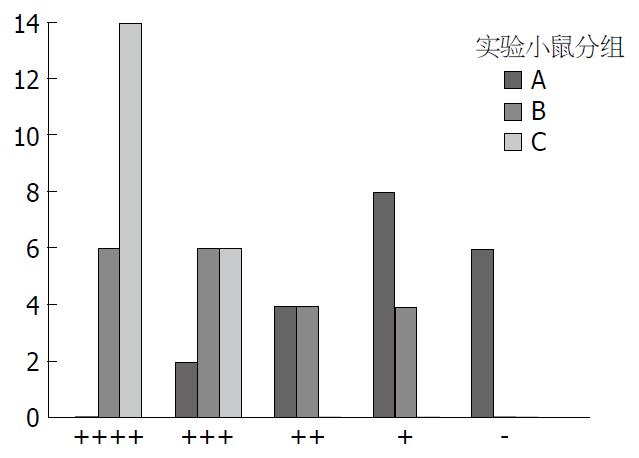
评价小鼠一般情况的观察项目包括小鼠的活动、觅食情况及对受刺激反应: 细菌分别与PBS液、激活U937细胞和庆大霉素不同物质注射时, 处理前和处理后各组小鼠一般情况如表2和图2. 处理前小鼠为一般情况极好的正常无干预小鼠, 各组小鼠比较无显著性差异(P>0.05), 处理后各组小鼠一般情况不完全相同(P<0.05), 经两两比较后A、B、C各组小鼠一般情况均不相同(P<0.05), 且各组与处理前比较亦均不相同(P<0.05), 由图2可见C组一般情况最好, B组次之, A组最差.
| 分组 | 小鼠一般情况 | ||||
| ++++ | +++ | ++ | + | - | |
| A组 | 20 | 0 | 0 | 0 | 0 |
| B组 | 20 | 0 | 0 | 0 | 0 |
| C组 | 20 | 0 | 0 | 0 | 0 |
腹腔注射激活U937细胞或庆大霉素对细菌性腹膜炎小鼠死亡情况的影响如表3. 本实验选用的是腹腔注射可使50.0%小鼠死亡的细菌浓度(2.0×106 CFU/mL)和不引起腹腔入侵细菌小鼠死亡的巨噬细胞浓度(1.0×107/mL). C组小鼠无死亡, B组小鼠死亡率为20.0%, A组为50.0%, 即腹腔注射激活U937细胞或庆大霉素均可降低细菌性腹膜炎小鼠的死亡率, 且注射细菌和激活U937细胞组小鼠死亡率显著低于注射细菌和庆大霉素组(P<0.01).
| 分组 | 小鼠死亡数及具体时间 | 合计 | 死亡率(%) | ||||||
| 24 h | 48 h | 72 h | 4 d | 5 d | 6 d | 7 d | |||
| A组 | 2 | 6 | 2 | 0 | 0 | 0 | 0 | 10 | 50.0 |
| B组 | 2 | 2 | 0 | 0 | 0 | 0 | 0 | 4 | 20.0 |
| C组 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0.0 |
细菌性腹膜炎时出现的症状多是由细胞炎性因子引起的[5], 炎性细胞因子在细菌感染和内毒素血症中起到了重要作用, 参与炎症反应的细胞因子有干扰素、GM-CSF、肿瘤坏死因子(tumor necrosis factor, TNF)、白介素(interleukin, IL)等. 细胞炎性因子是巨噬细胞和其他宿主细胞对细菌或细菌产物发生反应后产生的, 在腹腔渗出液中浓度高[6]. 细菌性腹膜炎最初是一个感染过程, 继而是一个炎症过程, 重症腹膜炎时表现为体内细胞因子TNF-α、IL-1、IL-6、IL-8过度表达[7], 由于大量有害细胞因子的分泌, 器官功能受损, 进一步发展成多器官功能障碍综合征和多器官功能衰竭, 可使病情更为严重, 细胞因子升高的程度与腹膜炎的预后有直接相关性[8].
中性粒细胞处于机体抵御感染的第一线, 在机体抵御各种感染源的过程中起到了重要的作用, 但是同时也参与了各种炎症反应的病理过程. 中性粒细胞释放的花生四烯酸可转变为血栓素和前列腺素, 引起炎症反应, 此外在吞噬细菌时能产生大量细胞毒性效应分子, 在吞噬过程中脱颗粒, 释放一系列溶酶体酶类, 造成血管和周围组织损伤[9]. 单核巨噬细胞系统, 是体内具有强烈吞噬能力的巨噬细胞系统, 其中肝脏的Kupffer细胞占全身全部巨噬细胞的70%, 是机体内最大最主要的清道夫, 对防御肠源和血源性细菌入侵, 清理体内细胞碎片, 甚至血红蛋白的降解产物都起到关键性作用[10]. 巨噬细胞可完整的吞噬细菌, 并将其消化在细胞内, 避免了细菌毒素和炎性因子的释放, 可有效杀灭细菌及减轻炎症反应. 在腹膜炎时, 腹腔中起主要作用的是中性粒细胞, 会在吞噬细菌后很快死亡, 同时释放大量的炎性细胞因子, 加重炎症反应. 而腹腔内的巨噬细胞来自于血中单核细胞, 当有炎症时, 单核细胞和中性粒细胞一样被激活而进入腹腔[11], 但其数量有限, 没有能力清除腹腔内的细菌. 因此我们通过增加腹腔局部的巨噬细胞数量来抵御腹腔入侵的细菌, 减轻全身炎症反应. 向腹腔增加的巨噬细胞可吞噬细菌和中性粒细胞, 并将其降解在细胞内, 减少内毒素、血管活性物质等毒性介质的释放, 在此过程中也分泌炎性因子, 但对全身中毒现象的作用远不如中性粒细胞来得急促[12]. 此外有研究[13]表明, 与中性粒细胞的接触可抑制巨噬细胞产生炎性因子.
实验室培养的巨噬细胞有很多, 最常用的一种细胞是U937细胞株[14]. U937细胞来源于人的单核细胞系, 激活后具有强大的吞噬能力, 常用来研究细胞的吞噬能力[15]. 由于激活后不会再继续增殖, 又是来源于人的细胞, 最终会被小鼠免疫系统清除, 因此本实验选用U937细胞作为外源性巨噬细胞. 实验中, 我们使用腹腔注射可使50%小鼠死亡的大肠杆菌浓度制备小鼠细菌性腹膜炎模型, 向腹腔注射外源性巨噬细胞, 结果显示, 腹腔注射巨噬细胞可明显降低细菌性腹膜炎小鼠的死亡率, 改善小鼠的一般情况, 减轻炎症反应时的消耗, 使腹膜炎小鼠的体质量增加, 并且随着腹腔注射的巨噬细胞浓度的增加, 腹膜炎小鼠的死亡率逐渐下降, 一般情况改善越多, 小鼠体质量增加越多, 当达到一定浓度时(本实验中为1.0×107/mL, 细菌与细胞比例为1:5), 可完全逆转腹膜炎小鼠的死亡, 并极大改善小鼠的觅食、活动等一般情况. 从而说明腹腔注射外源性巨噬细胞, 增加细菌性腹膜炎小鼠腹腔的吞噬能力, 可有效控制细菌感染, 减轻全身炎症反应. 本实验中我们也将腹腔注射巨噬细胞和抗生素对小鼠细菌性腹膜炎的治疗作用进行了比较研究, 结果显示, 腹腔注射抗生素虽可降低腹膜炎小鼠的死亡率, 但不能完全逆转小鼠的死亡, 而腹腔注射外源性巨噬细胞完全可逆转小鼠的死亡. 因此, 腹腔注射巨噬细胞和抗生素对细菌性腹膜炎小鼠均有治疗作用, 而巨噬细胞的治疗作用可能优于抗生素. 临床腹膜炎多采取两种抗菌素联合用药, 本实验只选用了一种对大肠杆菌敏感的抗生素, 尚不能完全肯定巨噬细胞的治疗作用一定强于抗菌素联合用药, 还有待进一步研究.
近年来吞噬作用在机体对抗细菌入侵的作用越来越受到重视[16]. 根据本次实验研究的结果, 使用外源性巨噬细胞, 增加腹腔的吞噬能力, 及时清除入侵的细菌和死亡的粒细胞, 减少炎性因子及毒性效应分子的释放, 将会有效减轻组织损伤和全身炎症反应, 从而降低细菌性腹膜炎小鼠的死亡率. 这将成为细菌性腹膜炎研究的新方向, 为今后开拓治疗细菌性腹膜炎的新疗法提供理论和物质基础. 然而激活的U937细胞也会分泌炎性细胞因子, 其对腹膜炎小鼠的炎症反应和死亡是否会有影响, 以及这些炎性因子种类和功能的确定仍需进一步研究. 此外, 注射到腹腔的外源性巨噬细胞是否会迁移到其他组织器官, 以及在体内的存活时间尚不清楚, 这些问题直接关系到新疗法的可行性. 因此, 尚需对腹腔注射的外源性巨噬细胞在体内迁移、分布及存活时间, 以及其产生的炎性因子及功能等进行详细的研究.
细菌注射入小鼠静脉中不引起严重感染和死亡, 而注入腹腔则会引起死亡, 是因为入血的细菌主要被体内巨噬细胞完整吞噬并清除, 不加重炎症反应, 而腹腔起主要作用的是中性粒细胞, 其在杀灭细菌后很快死亡, 同时释放炎性因子而加重炎症反应. 细菌性腹膜炎的症状多是由炎性因子引起, 早期抗生素治疗可杀灭细菌, 但细菌死亡时会释放大量毒素, 加重全身炎症反应. 因此需要一种既能清除细菌又不加重全身炎症反应的治疗方法.
张进祥, 副教授, 华中科技大学同济医学院附属协和医院
巨噬细胞在机体对抗入侵细菌中的作用越来越重要, 本文主要研究通过外源性巨噬细胞增强腹腔吞噬能力, 有效清除细菌, 减少炎性因子释放, 有效减轻腹膜炎症状及全身炎症反应, 将成为细菌性腹膜炎研究的新方向. 但对于外源性巨噬细胞在体内的存活时间、分布, 是否会迁移至其他组织器官, 以及是否分泌炎性因子及其功能等仍需进一步研究.
Bilzer等研究的Kupffer细胞在机体防御机制中的作用指出Kupffer细胞占全部巨噬细胞的70%, 是机体最大最主要的清道夫, 对防御肠源和血源性细菌入侵、清理体内细胞碎片等, 起到重要的作用. Whyte等研究的通过U937细胞激活变为巨噬细胞, U937细胞来源于人单核细胞器, 激活前为悬浮生长, 激活后贴壁生长, 具有强大的吞噬能力.
本文为细菌性腹膜炎的治疗提供了新的思路, 通过进一步研究外源性巨噬细胞对机体的影响以及产生炎性因子的情况, 在将来有望用于临床治疗中. 对于严重感染, 抗生素治疗无效的腹膜炎患者, 可采用外源性巨噬细胞增加腹腔吞噬能力, 减轻全身炎症反应.
本文主要研究腹腔注射外源性巨噬细胞对细菌性腹膜炎小鼠的治疗作用, 实验设计基本合理, 有一定的新颖性.
编辑: 于明茜 电编: 都珍珍
| 1. | Koulaouzidis A, Bhat S, Saeed AA. Spontaneous bacterial peritonitis. World J Gastroenterol. 2009;15:1042-1049. [PubMed] [DOI] |
| 2. | Holzheimer RG. The significance of endotoxin release in experimental and clinical sepsis in surgical patients--evidence for antibiotic-induced endotoxin release? Infection. 1998;26:77-84. [PubMed] [DOI] |
| 3. | Cousens LP, Wing EJ. Innate defenses in the liver during Listeria infection. Immunol Rev. 2000;174:150-159. [PubMed] [DOI] |
| 4. | Hirakata Y, Tomono K, Tateda K, Matsumoto T, Furuya N, Shimoguchi K, Kaku M, Yamaguchi K. Role of bacterial association with Kupffer cells in occurrence of endogenous systemic bacteremia. Infect Immun. 1991;59:289-294. [PubMed] |
| 5. | Gürlich R, Maruna P, Pesková M, Cermák J, Chachkhiani I, Frasko R. [Cytokines in the diagnosis of peritoneal inflammation]. Rozhl Chir. 2000;79:585-588. [PubMed] |
| 6. | Sotto A, Lefrant JY, Fabbro-Peray P, Muller L, Tafuri J, Navarro F, Prudhomme M, De La Coussaye JE. Evaluation of antimicrobial therapy management of 120 consecutive patients with secondary peritonitis. J Antimicrob Chemother. 2002;50:569-576. [PubMed] [DOI] |
| 7. | Fröhlich D, Eiber RM, Jochum M, Billing A. Perioperative pattern of peritoneal interleukin 8, tumour necrosis factor-alpha, and granulocyte elastase release in human secondary peritonitis. Cytokine. 1997;9:288-292. [PubMed] [DOI] |
| 8. | van Till JW, van Veen SQ, den Broeder V, Bresser P, Lutter R, Out TA, Schultz MJ, Gouma DJ, Boermeester MA. Compartmental apoptosis and neutrophil accumulation in severe peritonitis. J Surg Res. 2010;164:321-328. [PubMed] [DOI] |
| 9. | Smith JA. Neutrophils, host defense, and inflammation: a double-edged sword. J Leukoc Biol. 1994;56:672-686. [PubMed] |
| 10. | Bilzer M, Roggel F, Gerbes AL. Role of Kupffer cells in host defense and liver disease. Liver Int. 2006;26:1175-1186. [PubMed] [DOI] |
| 11. | Topley N, Mackenzie RK, Williams JD. Macrophages and mesothelial cells in bacterial peritonitis. Immunobiology. 1996;195:563-573. [PubMed] [DOI] |
| 12. | Kantari C, Pederzoli-Ribeil M, Witko-Sarsat V. The role of neutrophils and monocytes in innate immunity. Contrib Microbiol. 2008;15:118-146. [PubMed] [DOI] |
| 13. | Holub M, Cheng CW, Mott S, Wintermeyer P, van Rooijen N, Gregory SH. Neutrophils sequestered in the liver suppress the proinflammatory response of Kupffer cells to systemic bacterial infection. J Immunol. 2009;183:3309-3316. [PubMed] [DOI] |
| 14. | Whyte J, Roberts AD, Morley KA, Sharp RJ, Marsh PD. Phagocytosis of mycobacteria by U937 cells: a rapid method for monitoring uptake and separating phagocytosed and free bacteria by magnetic beads. Lett Appl Microbiol. 2000;30:90-94. [PubMed] [DOI] |
| 15. | Kurlander RJ, Gartrell JE. The binding and processing of monoclonal human IgG1 by cells of a human macrophage-like cell line (U937). Blood. 1983;62:652-662. [PubMed] |
| 16. | Djaldetti M, Salman H, Bergman M, Djaldetti R, Bessler H. Phagocytosis--the mighty weapon of the silent warriors. Microsc Res Tech. 2002;57:421-431. [PubMed] [DOI] |