修回日期: 2016-01-09
接受日期: 2016-01-19
在线出版日期: 2016-03-08
目的: 观察威灵仙总皂苷干预实验性非酒精性脂肪性肝炎(non-alcoholic steatohepatitis, NASH)大鼠模型氧化应激的疗效, 为临床应用威灵仙总皂苷防治NASH提供科学依据.
方法: 采用高脂饲料饲养SD大鼠建立实验性NASH大鼠模型, 并给予威灵仙总皂苷灌胃干预, 通过检测空白组、模型组、威灵仙总皂苷组和易善复组下腔静脉血清中总抗氧化能力(total antioxidant capacity, T-AOC)、丙二醛(malondialdehyde, MDA)的含量以及肝组织上清液中谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-Px)、过氧化氢酶(catalase, CAT)、超氧化物歧化酶(superoxide dismutase, SOD)、丙二醛(malondialdehyde, MDA)的含量, 并分别统计分析各组间氧化能力的差异和抗氧化能力的差异, 观察威灵仙总皂苷干预实验性NASH大鼠模型氧化应激的疗效.
结果: 威灵仙总皂苷组NASH大鼠与模型组相比, 血清和肝组织MDA含量均明显降低(均P<0.01), 血清T-AOC和肝组织GSH-Px、CAT、SOD含量均明显升高(均P<0.01); 威灵仙总皂苷组NASH大鼠与易善复组相比, 血清MDA、T-AOC和肝组织MDA、GSH-Px、CAT、SOD含量均相当(均P>0.05).
结论: 威灵仙总皂苷可有效改善NASH大鼠的氧化应激, 疗效与易善复相当.
核心提示: 高脂饮食诱导的非酒精性脂肪性肝炎(non-alcoholic steatohepatitis, NASH )大鼠, 氧化应激参与了其发生及发展过程. 威灵仙总皂苷可减少NASH大鼠血清和肝组织丙二醛的产生, 从而减弱氧化应激的损害, 同时可增加血清总抗氧化能力和肝组织谷胱甘肽过氧化物酶、过氧化氢酶、超氧化物歧化酶的释放, 从而提高机体抗氧化能力, 最终使NASH得到一定程度的缓解.
引文著录: 高璠, 琚坚, 王伟, 闫福媛, 王晓青. 威灵仙总皂苷对实验性非酒精性脂肪性肝炎大鼠氧化应激的干预作用. 世界华人消化杂志 2016; 24(7): 1070-1075
Revised: January 9, 2016
Accepted: January 19, 2016
Published online: March 8, 2016
AIM: To observe the effect of total saponins of Radix clematidis on oxidative stress in a rat model of non-alcoholic steatohepatitis (NASH), in order to provide a scientific basis for the prevention and treatment of NASH with total saponins of Radix clematidis in clinical practice.
METHODS: A rat model of NASH was developed by feeding SD rats a high-fat diet. The rats were divided into a blank group, a model group, a total saponins of Radix clematidis group and a polyene phosphatidylcholine group. After intervention with total saponins of Radix clematidis, the contents of total antioxidant capacity (T-AOC), malondialdehyde (MDA) in the serum from the inferior vena cava and the contents of glutathione peroxidase (GSH-Px), catalase (CAT), superoxide dismutase (SOD) and MDA in the supernatants of liver tissue were detected. The differences in oxidation capacity and antioxidant capacity were compared among all groups.
RESULTS: Compared with the model group, NASH rats treated with total saponins of Radix clematidis had lower contents of MDA in serum and liver tissue (P < 0.01 for both), and higher contents of T-AOC in serum, as well as GSH-Px, CAT, and SOD in liver tissue (P < 0.01 for all). Compared with the polyene phosphatidylcholine group, NASH rats treated with total saponins of Radix clematidis had similar serum MDA and T-AOC levels as well as hepatic levels of MDA, GSH-Px, CAT and SOD (P > 0.05 for all).
CONCLUSION: Total saponins of Radix clematidis improve oxidative stress in rats with experimental NASH, and their therapeutic effect is equivalent to that of polyene phosphatidylcholine.
- Citation: Gao F, Ju J, Wang W, Yan FY, Wang XQ. Effect of total saponins of Radix clematidis on oxidative stress in a rat model of non-alcoholic steatohepatitis. Shijie Huaren Xiaohua Zazhi 2016; 24(7): 1070-1075
- URL: https://www.wjgnet.com/1009-3079/full/v24/i7/1070.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i7.1070
非酒精性脂肪性肝炎(non-alcoholic steatohepatitis, NASH)是指在无过量饮酒史(或酒精摄入量<20 g/d)的前提下, 以肝细胞脂肪变性、气球样变、弥漫性肝小叶轻度炎症和/或肝中央静脉、肝窦周围胶原沉积等为病理特征的慢性肝脏炎性疾病[1]. NASH是单纯性脂肪性肝病发生肝硬化的必经阶段, 单纯NASH在8-13年后约12%-40%进展为NASH相关早期肝纤维化、约15%进展为肝硬化, NASH相关代偿期肝硬化者在10年内约7%发生肝癌、约50%需要肝移植或者死于肝脏相关疾病[2]. 故有效治疗NASH, 将有助于延缓乃至阻断非酒精性脂肪性肝病的进展, 改善患者生活质量. 然而, NASH的发病机制尚未完全明确, 缺乏切实有效的治疗手段, 明确其发病机制、并寻找有效的治疗手段已经成为医学界甚至整个社会关注的问题. 威灵仙总皂苷是毛莨科植物威灵仙的有效成分之一, 近年来从威灵仙中已分离鉴定出60多种皂苷类化合物[3], 文献报道[4]表明, 威灵仙总皂苷具有抗肿瘤及抗炎镇痛的作用. 本文从探索NASH的有效防治药物入手, 结合威灵仙总皂苷的有关基础药理研究成果, 针对NASH发病机制中氧化应激这一重要环节, 与易善复进行对比, 观察探索威灵仙总皂苷干预实验性NASH大鼠模型氧化应激的疗效和价值.
清洁级健康♂SD大鼠50只, 体质量70 g±10 g, 购自昆明医科大学动物实验中心[SCXK(滇)2005-0008], 大鼠饲养于昆明医科大学动物实验中心动物房. 所有大鼠分笼饲养在安静、通风良好、自然昼夜光线、室温22 ℃±2 ℃、相对湿度50%±5%的环境中. 实验期间大鼠自由饮水、进食、活动. 猪油购自昆明市农贸市场; 蛋黄粉、胆固醇、胆酸钠购自上海源叶生物科技有限公司; 威灵仙总皂苷由安徽大学生命科学院采用棉团铁线莲提取、分离和纯化, 测定威灵仙总皂苷纯度为61.5%; 多烯磷脂酰胆碱胶囊(228 mg/粒)购自赛诺菲(北京)制药有限公司; 戊巴比妥钠购自上海西塘生物科技有限公司; 甲醛溶液购自上海远慕生物科技有限公司; 检测试剂盒采用南京建成生物工程研究所产品; 主要仪器设备: LT202精密电子天平200 g/0.01 g、B600B型医用低速离心机、7020全自动生化分析仪、石蜡切片机、光学显微镜、SHH420恒温水浴箱、Mix Ⅱ Type 37600漩涡混匀器、连续波长酶标仪.
1.2.1 建立NASH大鼠模型: 从50只健康清洁级♂SD大鼠中随机抽取14只作为空白组, 剩余的36只作为模型组, 分别予普通饲料和高脂饲料(配方: 82.5%普通饲料+10.0%猪油+2.0%胆固醇+5.0%蛋黄粉+0.5%胆酸钠)喂养16 wk. 然后分别于造模期间的第4周末、第8周末随机抽取空白组与模型组各1只, 第12周末与第16周末随机抽取空白组与模型组各2只, 下腔静脉采血测定谷草转氨酶(aspartate transaminase, AST)、谷丙转氨酶(alanine transaminase, ALT)、总胆固醇(total cholesterol, TC)、三酰甘油(triacylglycerol, TG)水平, 于肝右叶中央部位取适量肝组织, 行HE染色后在光镜下观察肝脏脂肪变、炎症和纤维化的情况, 综合评估实验性NASH大鼠模型是否成功建立[5].
1.2.2 干预方案: 实验性NASH大鼠模型建立成功后, 将剩余的30只原模型组大鼠随机分成: 模型组10只、易善复组10只、威灵仙总皂苷组10只; 剩余的8只原空白组大鼠作为空白组. 分别给予易善复[195.4 mg/(kg•d)]3 mL、威灵仙总皂苷[50 mg/(kg•d)]3 mL、0.9%NaCl注射液3 mL, 灌胃干预8 wk.
1.2.3 大鼠血清采集及指标测定: 剖杀大鼠前禁食禁饮24 h, 3%戊巴比妥钠0.10-0.15 mL/100 g行腹腔麻醉, 然后下腔静脉采血测定血清总抗氧化能力(total antioxidant capacity, T-AOC)、丙二醛(malondialdehyde, MDA)水平, 血清T-AOC测定步骤严格按照大鼠血清分光光度法试剂盒说明书进行操作, 血清MDA测定步骤严格按照大鼠血清硫代巴比妥酸荧光法试剂盒说明书进行操作.
1.2.4 大鼠肝脏采集及指标测定: 于肝右叶中央部取0.2-0.3 g肝脏组织, 捣碎、离心, 取上清液测定MDA含量及谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-Px)、过氧化氢酶(catalase, CAT)、超氧化物歧化酶(superoxide dismutase, SOD)活性, 肝组织MDA测定步骤严格按照大鼠血清硫代巴比妥酸荧光法试剂盒说明书进行操作, GSH-Px与CAT测定步骤严格按照分光光度法试剂盒说明书进行操作, SOD测定步骤严格按照盐酸羟胺法试剂盒说明书进行操作.
统计学处理 采用SPSS17.0软件进行统计分析. 定量资料采用mean±SD表示, 统计方法采用t检验和单因素方差分析. P<0.05表示差异具有统计学意义.
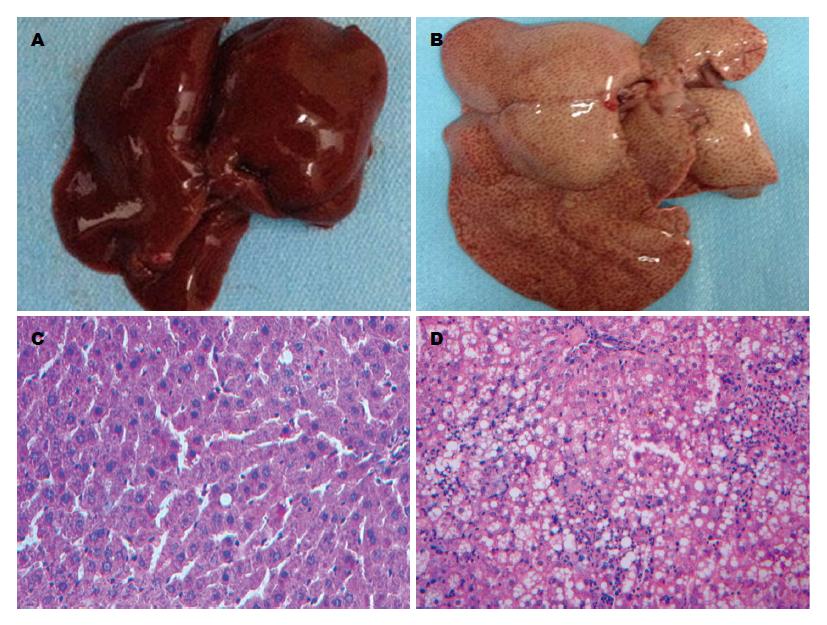
大鼠一般状况观察: 随着造模时间的推进, 模型组大鼠逐渐出现皮毛光泽度变差, 活动量减少, 食欲降低, 饮水量增加, 大便变软、变稀等情况, 而空白组大鼠毛发整齐有光泽, 活动力强, 进食饮水量正常, 大便性状正常等. 大鼠转氨酶和血脂指标变化: 随着造模时间的推进, 模型组的AST、ALT、TC、TG呈逐渐升高趋势, 空白组的AST、ALT、TC、TG未见明显升高. 模型组的AST、ALT、TC和TG都明显高于空白组, 两组的AST、ALT、TC、TG相比较, 差异都有统计学意义(P = 0.000, 0.002, 0.000, 0.023)(表1). 大鼠肝脏观察: 肉眼观察: 模型组肝脏表面光泽度差, 色淡黄, 体积增大, 肝脏边缘稍钝, 切之有油腻感; 空白组肝脏表面光滑、质软, 色粉红, 体积适中, 肝脏边缘锐(图1A, B). 光镜观察: 模型组: 16 wk末表现为: Ⅳ度肝细胞脂肪变, 肝细胞较多气球样变, 部分门管区少量炎细胞浸润及小叶内多数灶状坏死, 炎症分级达2级, 未见肝纤维化. 空白组: 均未见明显肝细胞脂肪变或者气球样变或者炎症坏死或者肝纤维化(图1C, D).
| 检测 | 空白组 | 模型组 | P值 |
| AST(U/L) | 122.50±7.29 | 205.67±26.83 | 0.000 |
| ALT(U/L) | 39.67±6.06 | 63.33±12.12 | 0.002 |
| TC(mmol/L) | 1.52±0.13 | 2.51±0.23 | 0.000 |
| TG(mmol/L) | 0.68±0.09 | 0.84±0.12 | 0.023 |
大鼠一般情况观察: 经灌胃干预后, 易善复组、威灵仙总皂苷组大鼠食欲欠佳、活动量少、皮毛不光整情况较模型组有所改善; 但各组大鼠体质量增加都相对放缓; 空白组大鼠进食饮水量无异常、活动力正常、毛发较为光整. 模型组、易善复组、威灵仙总皂苷组大鼠大便性状仍旧软、稀, 饮水仍较多, 3组间无明显差别且与造模期间无明显区别; 空白组大便性状正常. 各组大鼠血清T-AOC、MDA和肝组织MDA、GSH-Px、CAT、SOD的测定结果: 干预结束后, 空白组血清T-AOC、MDA和肝组织MDA、GSH-Px、CAT、SOD的含量与模型组相比, 差异具有显著统计学意义(P<0.01), 而分别与易善复组、威灵仙总皂苷组相比, 差异不具有统计学意义(均P>0.05); 模型组血清T-AOC、MDA和肝组织MDA、GSH-Px、CAT、SOD的含量分别与易善复组、威灵仙总皂苷组相比, 差异具有显著统计学意义(均P<0.01); 易善复组血清T-AOC、MDA和肝组织MDA、GSH-Px、CAT、SOD的含量与威灵仙总皂苷组相比, 差异不具有统计学意义(P>0.05)(表2).
| 分组 | n | 血清 | 肝组织 | ||||
| T-AOC(U/mL) | MDA(nmol/g组织) | MDA(nmol/g组织) | GSH-Px(U/mg组织) | CAT(U/mg组织) | SOD(U/mg组织) | ||
| 空白组 | 8 | 10.60± 1.94 | 4.90± 1.05 | 10.15± 1.50 | 201.66±30.97 | 26.78± 2.21 | 216.99±23.87 |
| 模型组 | 10 | 7.61± 2.05b | 8.85± 1.76b | 291.18±95.63b | 148.40±18.73b | 16.73± 4.34b | 163.36±16.45b |
| 易善复组 | 10 | 10.44± 2.68c | 6.41± 2.63c | 246.30±52.12c | 201.09±29.89c | 22.20± 3.99c | 210.41±41.15c |
| 威灵仙总皂苷组 | 10 | 10.13± 1.50c | 6.41± 1.59c | 211.31±28.68c | 195.71±28.30c | 21.31± 4.24c | 220.34±39.65c |
NASH是以肝细胞丧失、脂肪变性、气球样变、炎症坏死及纤维化形成为特征的病理状态[6]. 胰岛素抵抗、脂肪酸代谢障碍、线粒体功能障碍、氧化应激以及脂肪细胞因子网络的调节紊乱等是引起肝脂肪变性直至进展至NASH的重要原因, 然而对于这些因素是如何相互作用并引起NASH的分子发病机制尚不完全清楚[7].
威灵仙为临床常用中药, 味辛咸、性温, 具有祛风除湿、通络止痛、消痰散结之功效, 可用于治疗多种疾病, 威灵仙总皂苷是威灵仙的有效成分之一. 威灵仙中所发现的大多数皂苷的苷元均为齐墩果酸, 而齐墩果酸对多种原因引起的急慢性肝损伤有显著保护作用, 并可抑制细胞外基质在受损肝脏中的沉积而减轻肝纤维化程度[8], 表明了齐墩果酸具有较强的保肝、抗肝纤维化、抗肝硬化等药理作用. 齐墩果酸可能通过对抗肝星状细胞收缩, 使缩小的肝窦直径有所恢复, 减少了肝内血流阻力, 从而在增加了肝内微循环血流量的同时, 降低了门脉压力, 从而达到抗肝硬化的目的[9]. 齐墩果酸还可显著降低血糖[10], 而其同分异构体熊果酸还能显著改善胰岛素敏感性, 降低血脂水平, 改善肝脏组织脂肪变性和炎症反应[11].
氧化应激是指机体在遭受各种有害刺激时, 体内高活性分子如活性氧簇(reactive oxygen species, ROS)和活性氮(reactive nitrogen species, RNS)产生过多而超出抗氧化系统的清除能力, 氧化系统和抗氧化系统失衡, 从而导致组织损伤. ROS是氧自由基和非自由基的含氧物的总称. ROS可以攻击生物膜而引发脂质过氧化损伤. NASH时, 功能障碍的线粒体产生大量ROS, 导致肝细胞受损. 体内的抗氧化防御体系主要包括抗氧化酶和非酶性抗氧化剂, 前者如SOD、CAT、GSH-Px和其他血红素蛋白过氧化物酶, 后者如谷胱甘肽(glutathione, GSH)、维生素E、维生素C、β-胡萝卜素、硒、白蛋白、乳铁蛋白、结合珠蛋白等. 人体内各种抗氧化大分子、抗氧化小分子和酶的总水平体现了人体的T-AOC. 在氧化应激状态下, 机体内的ROS等氧化剂和SOD等抗氧化剂失衡, 此时ROS便可攻击生物膜中的多不饱和脂肪酸而引发脂质过氧化损伤, 不但通过链式和链式支链反应放大活性氧的作用, 而且产生一些有害的脂质过氧化终产物, 如MDA等, 这些产物可以弥散至细胞或细胞外的靶标而放大氧化应激损害[12], 严重破坏生物膜、蛋白质、核酸等大分子物质, 导致细胞肿胀、坏死. MDA的含量反映机体脂质过氧化的程度, 也间接反应肝损伤的程度[13-15].
本研究发现大鼠长期高脂饮食致脂质在肝脏沉积, 肝脏摄取脂肪酸过多, 氧化应激、脂质过氧化反应增强, MDA产物增加, 导致肝细胞受损; 过多的MDA耗竭SOD、CAT、GSH-Px等抗氧化因子, 总抗氧化能力下降, 使氧化剂与抗氧化剂之间的动态平衡失调; 由于高脂饮食等病因的持续存在, 氧化应激、脂质过氧化反应进一步增强, MDA对肝细胞损伤加重, 病变呈持续进展, 可见氧化应激、脂质过氧化参与了NASH大鼠的发生及发展过程. 威灵仙总皂苷可减少NASH大鼠血清和肝组织MDA的产生, 从而减弱氧化应激的损害, 同时可增加血清T-AOC和肝组织GSH-Px、CAT、SOD的释放, 从而提高机体抗氧化能力, 最终使NASH得到一定程度的缓解. 威灵仙总皂苷有效改善NASH大鼠氧化应激的疗效与易善复相当, 可为临床应用威灵仙总皂苷防治NASH提供一定的科学依据和价值.
胰岛素抵抗、脂肪酸代谢障碍、线粒体功能障碍、氧化应激以及脂肪细胞因子网络的调节紊乱等是引起肝脂肪变性直至进展至非酒精性脂肪性肝炎(non-alcoholic steatohepatitis, NASH)的重要原因, 然而对于这些因素是如何相互作用并引起NASH的分子发病机制尚不完全清楚.
陈涛, 教授, 三峡大学医学院党委书记办公室
在NASH治疗方面, 益生菌和胰高血糖素样肽-1活性上调剂的作用值得期待, 但药物治疗总的进展不大.
理论上, NASH的药物治疗包括多烯磷脂酰胆碱、维生素E及熊去氧胆酸等, 但在临床上尚无任何一种药物对NASH有明确治疗作用.
威灵仙总皂苷有效改善NASH大鼠氧化应激的疗效与多烯磷脂酰胆碱相当, 可为临床应用威灵仙总皂苷防治NASH提供一定的科学依据和价值.
本文引用多篇权威性的文章, 提供了大量有价值的信息, 对NASH的临床治疗研究有一定的应用价值.
本文对研究NASH具有重要的学术价值和临床指导意义.
编辑: 于明茜 电编: 都珍珍
| 1. | Björnsson E, Angulo P. Non-alcoholic fatty liver disease. Scand J Gastroenterol. 2007;42:1023-1030. [PubMed] [DOI] |
| 2. | de Alwis NM, Day CP. Non-alcoholic fatty liver disease: the mist gradually clears. J Hepatol. 2008;48 Suppl 1:S104-S112. [PubMed] [DOI] |
| 3. | Shi S, Jiang D, Dong C, Tu P. Triterpene saponins from clematis mandshurica. J Nat Prod. 2006;69:1591-1595. [PubMed] |
| 5. | 王 伟. 威灵仙总皂苷干预实验性NASH大鼠内毒素血症的疗效观察. 昆明: 昆明医科大学 2014; . |
| 6. | 叶 江锋, 琚 坚, 王 伟, 赵 钰鑫. 威灵仙多糖对实验性NASH大鼠血清IL-17、TNF-α水平和肝脏病理改变的干预作用. 世界华人消化杂志. 2015;23:4864-4870. [DOI] |
| 7. | 方 文军, 陆 帅, 陈 寒蓓, 苏 青. 非酒精性脂肪性肝病患者的炎症细胞因子水平与氧化应激参数的变化. 同济大学学报(医学版). 2014;35:71-75. |
| 10. | Pérez Gutiérrez RM, Vargas Solis R, Garcia Baez E, Gallardo Navarro Y. Hypoglycemic activity of constituents from Astianthus viminalis in normal and streptozotocin-induced diabetic mice. J Nat Med. 2009;63:393-401. [PubMed] [DOI] |
| 12. | 杨 正强. 丙丁酚对大鼠实验性非酒精性脂肪性肝炎的作用研究. 天津: 天津医科大学 2007; . |
| 13. | Koruk M, Taysi S, Savas MC, Yilmaz O, Akcay F, Karakok M. Oxidative stress and enzymatic antioxidant status in patients with nonalcoholic steatohepatitis. Ann Clin Lab Sci. 2004;34:57-62. [PubMed] |
| 15. | Hassan K, Bhalla V, El Regal ME, A-Kader HH. Nonalcoholic fatty liver disease: a comprehensive review of a growing epidemic. World J Gastroenterol. 2014;20:12082-12101. [PubMed] [DOI] |