修回日期: 2016-01-18
接受日期: 2016-01-25
在线出版日期: 2016-03-08
目的: 研究扁塑藤素对胃癌MGC803和SGC7901细胞增殖及凋亡的影响, 并初步探讨其可能的作用机制.
方法: 体外培养MGC803和SGC7901细胞, 细胞接受0-50 μmol/L药物处理之后, 采用CCK-8实验、Annexin V-FITC/PI双染细胞凋亡检测及细胞周期检测实验研究扁塑藤素对胃癌MGC803细胞增殖及凋亡的影响; 采用罗丹明123测定细胞线粒体跨膜电位变化, 最后采用Western blot检测B淋巴细胞瘤-2(B-cell lymphoma-2, Bcl-2)和Bcl-2相关x蛋白(Bcl-associated x protein, Bax)表达水平. 同时用人胃癌细胞系MGC803进行裸鼠成瘤实验, 观察扁塑藤素对裸鼠成瘤的影响.
结果: 扁塑藤素可以抑制MGC803和SGC7901细胞增殖, 其IC50值分别为8.5 μmol/L和12.6 μmol/L; Annexin V-FITC/PI双染实验显示随着药物浓度的增加, 出现凋亡的细胞明显增加; 细胞周期实验显示扁塑藤素可以诱导MGC803细胞出现G1期阻滞; 细胞经过药物处理后, 细胞线粒体跨膜电位明显下降. Western blot实验显示随着药物浓度的增加, 细胞中Bax蛋白表达水平上升, Bcl-2蛋白表达水平下降, 呈现一定的浓度依赖性. 裸鼠成瘤实验显示, 扁塑藤素可以抑制裸鼠种植瘤的生长.
结论: 扁塑藤素能显著抑制胃癌MGC803和SGC7901细胞增殖并诱导其凋亡, 认为扁塑藤素可能通过增强线粒体通透性来诱导细胞凋亡.
核心提示: 研究发现, 从草药植物雷公藤中分离出的一种生物活性成分扁塑藤素可以显著抑制胃癌细胞的增殖, 并诱导胃癌细胞凋亡, 这种作用的发挥可能是通过增强线粒体通透性来诱导细胞凋亡.
引文著录: 赵钦府, 袁学敏, 夏会, 吴琼, 姜开通. 扁塑藤素对胃癌细胞MGC803及SGC7901增殖和凋亡的影响. 世界华人消化杂志 2016; 24(7): 1064-1069
Revised: January 18, 2016
Accepted: January 25, 2016
Published online: March 8, 2016
AIM: To investigate the effects of pristimerin on the growth and apoptosis of gastric cancer MGC803 and SGC7901 cells, and to preliminarily explore its action mechanism.
METHODS: MGC803 and SGC7901 cells were cultured in vitro. After treatment with pristimerin, CCK-8 assay, Annexin V-FITC/PI staining, and cell cycle analysis were conducted to investigate the effects of pristimerin on the growth and apoptosis of MGC803 and SGC7901 cells, and then the mitochondrial membrane potential and Bax and Bcl-2 protein expression were determined by Rhodamine 123 staining and Western blot, respectively. Human gastric cancer MGC803 cells were transplanted to nude mice to establish an animal model, and the effect of pristimerin on tumor growth in this model was observed.
RESULTS: Pristimerin inhibited MGC803 and SGC7901 cell growth, with the IC50 values of 8.5 and 12.6 μmol/L, respectively. Annexin-V/PI staining showed that pristimerin induced the apoptosis of MGC803 and SGC7901 cells in a dose-dependent manner. The cell cycle analysis revealed that pristimerin could induce a G1-phase arrest. Treatment with pristimerin significantly decreased the mitochondrial membrane potential. Treatment with pristimerin increased the expression of Bax protein and decreased the expression of Bcl-2 in a concentration-dependent manner. Treatment with pristimerin could inhibit tumor growth in the nude mouse model.
CONCLUSION: Pristimerin could inhibit proliferation and induce apoptosis of gastric cancer MGC803 and SGC7901 cells, possibly by inducing the loss of mitochondrial membrane potential.
- Citation: Zhao QF, Yuan XM, Xia H, Wu Q, Jiang KT. Pristimerin inhibits growth and induces apoptosis of gastric cancer MGC803 and SGC7901 cells. Shijie Huaren Xiaohua Zazhi 2016; 24(7): 1064-1069
- URL: https://www.wjgnet.com/1009-3079/full/v24/i7/1064.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i7.1064
扁蒴藤素是从草药植物雷公藤中分离出的一种生物活性成分[1]. 扁蒴藤素具有许多药理活性, 包括抗真菌和抗氧化作用[2-5]. 近期研究人员发现扁蒴藤素具有良好的抗癌作用[6,7]. Gao等[8]发现扁蒴藤素可以通过激活AKT/核因子-κB(nuclear factor-κB, NF-κB)/mTOR信号通路抑制卵巢癌细胞的增殖并诱导其凋亡. Liu等[9]发现扁蒴藤素能通过泛素-蛋白酶体途径诱导前列腺癌细胞凋亡. 因此扁蒴藤素具有成为抗癌药物或先导化合物的潜力.
然而, 扁塑藤素对胃癌细胞增殖及凋亡的影响的研究未见报道. 因此, 本实验研究了扁塑藤素对胃癌MGC803和SGC7901细胞增殖及凋亡的影响, 并初步探讨了其可能的作用机制, 为其临床应用提供了一定的理论基础.
扁塑藤素(纯度>98%)购自中国药品生物制品检定所. CCK-8试剂盒购自碧云天生物科技有限公司. 胎牛血清、青霉素、链霉素和Annexin V-FITC/PI凋亡检测试剂盒购自GIBCO公司. PBS、胰蛋白酶和RIPA裂解液购自Thermo公司. 罗丹明123购自碧云天生物技术公司. DMEM培养基购自Hyclone公司. B淋巴细胞瘤-2(B-cell lymphoma-2, Bcl-2)抗体、Bcl-2相关x蛋白(Bcl-associated x protein, Bax)抗体、GAPDH抗体购自Cell Signaling Technology(Beverly, MA).
1.2.1 细胞培养: 人胃癌MGC803和SGC7901细胞购自中国科学院上海细胞库. 将MGC803和SGC7901细胞细胞置于DMEM培养液(含10%胎牛血清)的培养瓶中, 于37 ℃, 50 mL/L CO2的恒温细胞培养箱中进行培养. 细胞生长至80%左右即可传代, 用0.25%胰蛋白酶消化成单细胞悬液, 进行细胞传代或实验. 细胞平均2-3 d传代一次.
1.2.2 CCK-8实验: 采用DMEM培养液将MGC803和SGC7901细胞密度调整至5×104个/mL, 以100 μL每孔将细胞悬液接种于96孔板中间孔, 边缘孔用无菌PBS填充, 细胞贴壁之后分别向培养液中加入用培养基稀释的0-50 μmol/L的扁塑藤素溶液, 同时设置阴性对照组和空白组, 且每个浓度设置5个复孔. 细胞接受药物处理24 h后每孔加入10 μL的CCK-8溶液, 然后将细胞置于培养箱中继续培养, 4 h后采用酶标仪在450 nm波长处测定各孔的吸光度值, 计算药物对细胞的杀伤作用的IC50.
1.2.3 Annexin V-FITC/PI双染细胞凋亡检测: MGC803细胞和SGC7901细胞接受不同浓度的扁塑藤素(MGC803: 2、5、10 μmol/L; SGC7901: 5、10、20 μmol/L)处理24 h之后, 采用Annexin V-FITC/PI双染细胞凋亡检测试剂盒及流式细胞仪(FACSCalibur, BD公司, San Jose, CA)检测细胞凋亡情况.
1.2.4 细胞周期检测: 采用不同浓度的扁塑藤素(MGC803: 2、5、10 μmol/L; SGC7901: 5、10、20 μmol/L)处理MGC803和SGC7901细胞细胞24 h, 然后将接受扁塑藤素处理之后的细胞用PBS清洗2次, 然后用低渗溶液[0.1% Triton X-100, 1 mmol/L Tris-HCl(pH 8.0), 3.4 mmol/L的柠檬酸钠, 0.1 mmol/L的EDTA和50 μg/mL的碘化丙啶]将细胞悬浮于溶液中, 然后加入50 μg/mL的碘化丙啶. 采用流式细胞仪对DNA含量进行分析, 处于各个细胞周期的细胞数量用Cell ModiFit软件(BD公司)进行统计.
1.2.5 线粒体跨膜电位检测: MGC803和SGC7901细胞接受不同浓度的扁塑藤素(MGC803: 2、5、10 μmol/L; SGC7901: 5、10、20 μmol/L)处理24 h之后, 每组加入罗丹明123至浓度为1 nmol/L, 于37 ℃, 50 mL/L CO2的恒温细胞培养箱中避光孵育20 min, 在多功能酶标仪上, 以507 nm为激发波长、529 nm为发射波长检测各组荧光强度值, 据此反应线粒体膜电位的变化.
1.2.6 Western blot实验: MGC803细胞接受不同浓度的扁塑藤素(2、5、10 μmol/L)处理24 h之后, 700 g离心10 min收集细胞, 然后采用RIPA裂解液于4 ℃裂解15 min重悬细胞. 采用BCA试剂盒对蛋白含量进行测定. 采用Western blot对Bax及Bcl-2蛋白表达进行分析.
1.2.7 裸鼠成瘤实验: 将24只6周龄裸鼠, 于每只裸鼠右侧腋腹壁皮下接种MGC803细胞5×106/100 μL(0.2 mL). 每日观察肿瘤生长情况, 测量肿瘤体积, 肿瘤体积 = (D×d×π)/6(D表示肿瘤的长径, d表示肿瘤的短径). 当肿瘤体积约为80 mm3时, 采用完全随机设计的方法的将裸鼠分为3组, 每组8只. 分别为对照组(含10%胎牛血清的DMEM培养液)、扁塑藤素低剂量组(10 mg/kg)及扁塑藤素高剂量组(50 mg/kg). 各组分别于腹腔注射相应的药物(扁塑藤素以含10%胎牛血清的DMEM培养液为溶剂), 每次注射200 μL, 隔日注射, 连续7次给药. 于给药后的第16天处死裸鼠, 剥离肿瘤, 称取肿瘤质量. 计算抑瘤率: 抑瘤率 = (对照组平均瘤质量-给药组平均瘤质量)/对照组平均瘤质量×100%.
统计学处理 采用SPSS20进行统计学分析, 两两比较采用q检验. 检验水准α = 0.05, P<0.05为差异具有统计学意义.
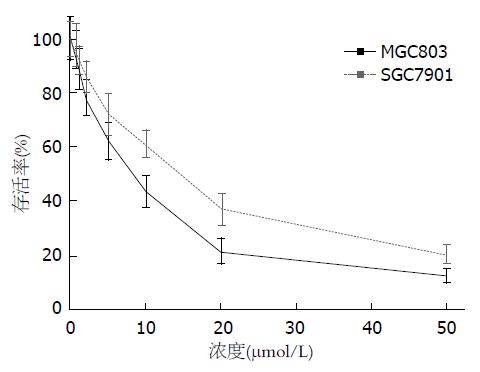
扁塑藤素在体外对胃癌细胞MGC803和SGC7901细胞增殖的抑制作用如图1, 扁塑藤素可以显著抑制MGC803和SGC7901细胞的增殖, 其中IC50值分别为8.5 μmol/L和12.6 μmol/L.
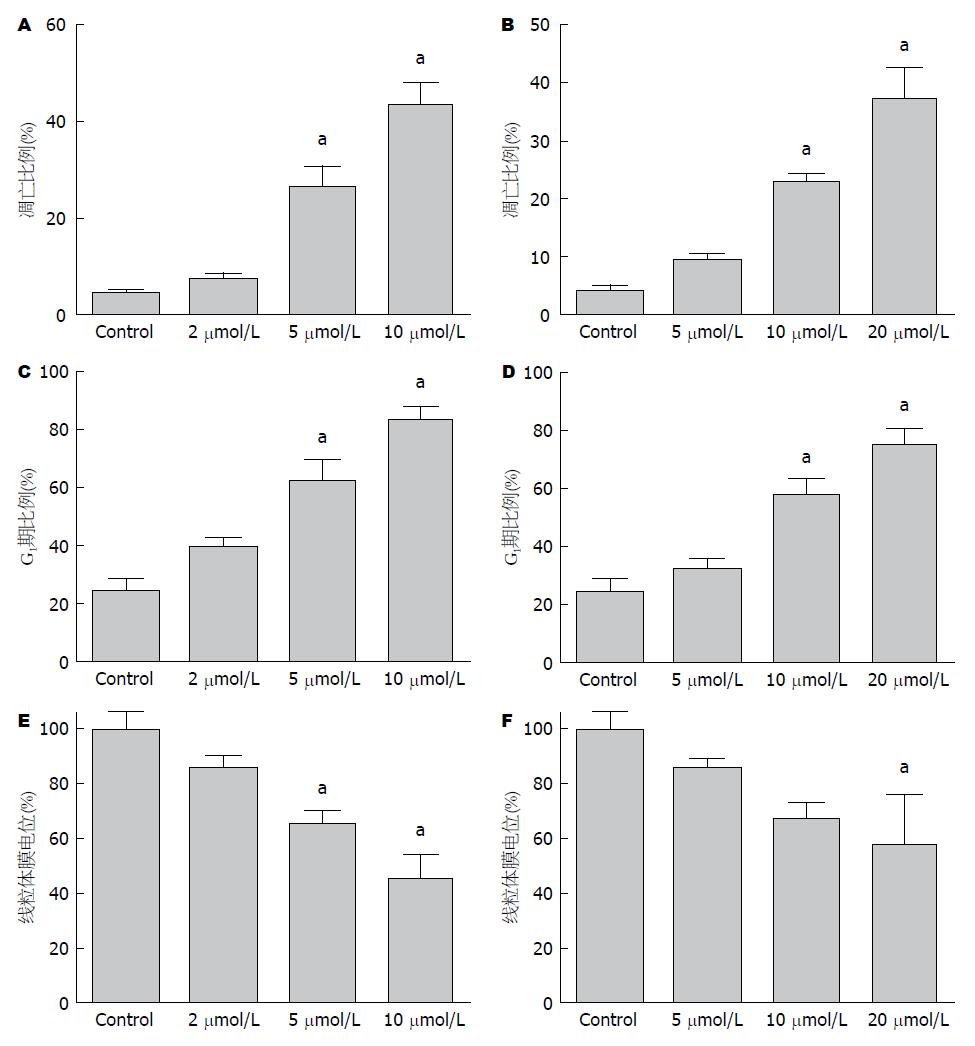
采用不同浓度的扁塑藤素处理MGC803和SGC7901细胞24 h之后, 采用Annexin V-FITC/PI双染细胞凋亡检测试剂盒检测细胞凋亡情况(图2A, B), 扁塑藤素可以诱导细胞出现凋亡. 对于MGC803细胞, 对照组细胞凋亡比例为4.36%, 而给药组(2、5、10 μmol/L)的细胞凋亡比例分别为7.43%、27.10%和43.40%, 其中5 μmol/L和10 μmol/L给药组细胞凋亡比例明显增加, 差异具有统计学意义(P<0.05). 对于SGC7901细胞, 而给药组(5、10、20 μmol/L)的细胞凋亡比例分别为9.70%、23.10%和37.30%, 其中5 μmol/L和10 μmol/L给药组细胞凋亡比例明显增加, 差异具有统计学意义(P<0.05).
为了检测扁塑藤素对细胞周期的影响, 采用不同浓度的扁塑藤素处理MGC803和SGC7901细胞24 h之后, 然后采用流式细胞仪检测细胞周期分布情况(图2C, D), 随着药物浓度的增加, 处于G1期的细胞明显增多, 其中5 μmol/L和10 μmol/L给药组细胞处于G1期的比例明显增加, 差异具有统计学意义(P<0.05). 结果表明扁塑藤素可以诱导MGC803和SGC7901细胞出现G1期阻滞.
细胞接受不同浓度的扁塑藤素处理MGC803和SGC7901细胞24 h之后, 采用罗丹明123对细胞线粒体跨膜电位进行了测定(图2E, F), 随着药物浓度的增加, MGC803细胞线粒体跨膜电位明显下降, 其中5 μmol/L和10 μmol/L给药组细胞线粒体跨膜电位下降明显, 差异具有统计学意义(P<0.05). 同样, SGC7901细胞线粒体跨膜电位也相应下降, 其中20 μmol/L给药组细胞线粒体跨膜电位下降明显, 差异具有统计学意义(P<0.05).
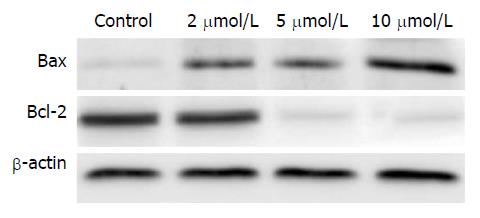
MGC803细胞接受不同浓度的扁塑藤素(2、5、10 μmol/L)处理24 h之后, 采用Western blot对Bax与Bcl-2蛋白表达水平进行了检测(图3), 随着药物浓度的增加, Bax蛋白表达水平上升, 而Bcl-2蛋白表达水平下降. 表明扁塑藤素可以通过上调促凋亡蛋白Bax的表达, 下调抑凋亡蛋白Bcl-2表达, 从而达到促进细胞凋亡的作用.
在扁塑藤素对裸鼠移植瘤生长影响的实验中发现, 高剂量和低剂量的扁塑藤素均可抑制种植瘤的生长, 其中高剂量组与对照组比较差异具有统计学意义(P<0.05). 结果表明扁塑藤素可以显著抑制裸鼠种植瘤生长, 种植瘤体积和质量较对照组明显减小, 其中低剂量组抑瘤率为32.90%, 高剂量组抑瘤率为5.00%, 抑瘤效果明显(表1).
胃癌是常见恶性肿瘤之一, 全球位列第4位, 而我国胃癌患者占全世界胃癌的40%. 在我国, 2012年《中国肿瘤登记年报》的数据显示, 胃癌发病率占全部恶性肿瘤的第2位, 死亡率居第3位[10,11]. 患者初诊时以晚期居多, 晚期胃癌主要依靠全身化疗, 而化疗药物的不良反应仍困扰着临床医生. 因此, 寻找更有效的化疗药物, 改变现有的用药策略, 是近年来的研究方向. 抗癌药物的开发中, 天然化合物正在变得越来越重要, 因为对于患者, 他们具有更好的耐受性, 具有较低的不良反应[12-14].
扁塑藤素为天然化合物, 在本研究中, 我们用扁塑藤素处理胃癌MGC803和SGC7901细胞后, 发现扁塑藤素可以抑制胃癌MGC803和SGC7901细胞的增殖并诱导其凋亡, 并呈现一定的时间和剂量的依赖性. 裸鼠种植瘤实验显示, 10 mg/kg和50 mg/kg的扁塑藤素都可以明显降低裸鼠种植瘤的体积和质量, 最终抑制肿瘤的增长.
细胞凋亡与多种原因有关, 其中线粒体在细胞凋亡过程中发挥重要作用, 在线粒体凋亡途径中处于中心位置, Bcl-2家族蛋白是线粒体介导的细胞凋亡通路上的重要组成成员, Bcl-2家族蛋白是调节细胞凋亡的非常重要的蛋白, 可以通过维持线粒体外膜的完整性来调控细胞凋亡的发生[15,16]. 本实验Western blot中我们观察到, MGC803细胞经过扁塑藤素处理之后, 细胞内的Bcl-2家族中促凋亡蛋白Bax的表达明显上调, 而抑凋亡的Bcl-2的表达却显著下调, 这就会导致线粒体膜的通透性增强. 线粒体膜的通透性的增强是线粒体凋亡的关键过程, 可以使线粒体内释放一系列凋亡因子如细胞色素c和Apaf-1等到细胞质中, 激活下游的Caspase家族, 促使细胞凋亡的发生[17,18].
总之, 扁塑藤素可以抑制胃癌MGC803和SGC7901细胞的增殖并诱导其凋亡, 这种作用的发挥可能是通过调节Bcl-2家族蛋白的表达, 使线粒体膜的通透性增强, 促使凋亡诱导因子的释放, 最终诱导细胞的凋亡.
研究发现扁塑藤素在体外具有具有很好的抑制肿瘤细胞增殖的作用, 但是目前, 扁塑藤素对胃癌细胞增殖及生长影响的研究未见报道, 因此本文以两种胃癌细胞为研究对象进行了抗肿瘤研究.
时永全, 教授, 主任医师, 第四军医大学西京医院消化内科; 李云龙, 副教授, 哈尔滨医科大学附属二院普通外科
通过从中药中提取出来的活性成分进行抗肿瘤活性研究, 以发现天然产物中具有良好抗肿瘤活性的成分.
现有研究发现雷公藤红素在体外能够有效抑制胃癌MG803、SGC7901细胞的增殖并诱导其凋亡.
首次发现扁塑藤素具有良好的抗胃癌细胞增殖的作用, 有望成为新的抗胃癌药物.
本文对于从中草药中寻找新的抗癌药物具有一定的指导作用. 同时对于扁塑藤素的临床抗癌应用具有一定的促进作用.
线粒体: 多种促细胞凋亡信号转导分子的靶点, 同时也是细胞凋亡通路的整合元件, 被称作细胞凋亡的生死开关.
胃癌是我国常见而西方国家低发的恶性肿瘤, 探讨胃癌新疗法或新药具有重要的意义, 本文提示扁塑藤素可能对胃癌细胞具有良好的抗癌作用, 为胃癌治疗新药的研发提供了较好的实验依据.
编辑: 于明茜 电编: 都珍珍
| 2. | Gullo FP, Sardi JC, Santos VA, Sangalli-Leite F, Pitangui NS, Rossi SA, de Paula E Silva AC, Soares LA, Silva JF, Oliveira HC. Antifungal activity of maytenin and pristimerin. Evid Based Complement Alternat Med. 2012;2012:340787. [PubMed] |
| 3. | Luo DQ, Wang H, Tian X, Shao HJ, Liu JK. Antifungal properties of pristimerin and celastrol isolated from Celastrus hypoleucus. Pest Manag Sci. 2005;61:85-90. [PubMed] [DOI] |
| 4. | López MR, de León L, Moujir L. Antibacterial properties of phenolic triterpenoids against Staphylococcus epidermidis. Planta Med. 2011;77:726-729. [PubMed] [DOI] |
| 5. | Jeller AH, Silva DH, Lião LM, Bolzani Vda S, Furlan M. Antioxidant phenolic and quinonemethide triterpenes from Cheiloclinium cognatum. Phytochemistry. 2004;65:1977-1982. [PubMed] [DOI] |
| 6. | Lee JS, Yoon IS, Lee MS, Cha EY, Thuong PT, Diep TT, Kim JR. Anticancer activity of pristimerin in epidermal growth factor receptor 2-positive SKBR3 human breast cancer cells. Biol Pharm Bull. 2013;36:316-325. [PubMed] |
| 7. | Wang Y, Zhou Y, Zhou H, Jia G, Liu J, Han B, Cheng Z, Jiang H, Pan S, Sun B. Pristimerin causes G1 arrest, induces apoptosis, and enhances the chemosensitivity to gemcitabine in pancreatic cancer cells. PLoS One. 2012;7:e43826. [PubMed] [DOI] |
| 8. | Gao X, Liu Y, Deeb D, Arbab AS, Gautam SC. Anticancer activity of pristimerin in ovarian carcinoma cells is mediated through the inhibition of prosurvival Akt/NF-κB/mTOR signaling. J Exp Ther Oncol. 2014;10:275-283. [PubMed] |
| 9. | Liu YB, Gao X, Deeb D, Arbab AS, Gautam SC. Pristimerin Induces Apoptosis in Prostate Cancer Cells by Down-regulating Bcl-2 through ROS-dependent Ubiquitin-proteasomal Degradation Pathway. J Carcinog Mutagen. 2013;Suppl 6:5. [PubMed] [DOI] |
| 10. | 陈 娟, 李 东石, 余 英豪, 王 烈, 欧阳 学农, 谢 飞来, 熊 喜生. Her-2蛋白在胃癌中的表达及其临床意义. 世界华人消化杂志. 2010;18:1375-1379. [DOI] |
| 12. | Kim HS, Kim SO, Kim BS. Use of a clinical pathway in laparoscopic gastrectomy for gastric cancer. World J Gastroenterol. 2015;21:13507-13517. [PubMed] [DOI] |
| 13. | Kinoshita O, Ichikawa D, Ichijo Y, Komatsu S, Okamoto K, Kishimoto M, Yanagisawa A, Otsuji E. Histological evaluation for chemotherapeutic responses of metastatic lymph nodes in gastric cancer. World J Gastroenterol. 2015;21:13500-13506. [PubMed] [DOI] |
| 14. | Zhang M. High antibiotic resistance rate: A difficult issue for Helicobacter pylori eradication treatment. World J Gastroenterol. 2015;21:13432-13437. [PubMed] [DOI] |