修回日期: 2016-01-20
接受日期: 2016-01-25
在线出版日期: 2016-03-08
目的: 探讨双侧膈下迷走神经切断对侧脑室注射nesfatin-1的抑酸作用的影响.
方法: ♂SD大鼠, 侧脑室置管后, 每只大鼠分别给予侧脑室注射1、5和50 pmol的nesfatin-1及等体积的灭菌水(5 μL/rat), 于2 h后处死大鼠, 收集胃液, 测定其胃酸的变化, 用实时定量PCR检测(real-time quantitative PCR, qRT-PCR)检测胃黏膜中H+/K+-ATPase mRNA的表达、测定酶的活性. 另外, 将侧脑室成功置管的♂SD大鼠分成迷走神经切断组和假手术组, 每组分别给予nesfatin-1(50 pmol)及等体积的灭菌水(5 μL/rat), 于2 h后处死大鼠, 观察迷走神经切断术对nesfatin-1引起的胃酸变化的影响.
结果: 大鼠侧脑室注射浓度为5 pmol和50 pmol的nesfatin-1后2 h, 大鼠胃酸分泌减少, 其中50 pmol作用最强(P<0.05). 同时大鼠胃黏膜中H+/K+-ATPase mRNA的表达和活性受到抑制(P<0.05). 另外, 对大鼠行膈下迷走神经切断术, 侧脑室注射nesfatin-1引起的胃酸分泌的减少以及H+/K+-ATPase mRNA的表达和活性的下降等效应也消失, 与对照组相比差异无统计学意义(P>0.05).
结论: 侧脑室注射nesfatin-1可呈剂量依赖性地抑制大鼠胃酸的分泌, 这一效应可能是通过激活迷走神经途径实现的.
核心提示: 本研究通过大鼠侧脑室置管以及迷走神经切断等方法, 发现侧脑室注射nesfatin-1可呈剂量依赖性地抑制大鼠胃酸分泌, 这一效应可能是通过激活迷走神经途径实现的.
引文著录: 黄琳, 汤梦蝶, 李学良, 林琳. 膈下迷走神经切断对大鼠中枢nesfatin-1抑酸作用的影响. 世界华人消化杂志 2016; 24(7): 1002-1008
Revised: January 20, 2016
Accepted: January 25, 2016
Published online: March 8, 2016
AIM: To observe the effect of gastric acid secretion decrease induced by intracerebroventricular (ICV) injection of nesfatin-1.
METHODS: Male Sprague-Dawley rats were randomly and equally divided into a control group and a nesfatin-1 group after implantation of an ICV cannula. The nesfatin-1 group was injected intracerebroventricularly with different concentrations of nesfatin-1, and the control group was treated with the same amount of distilled water (5 μL/rat). The volume of gastric secretion was measured and the amount of gastric acid was determined by titration with NaOH. H+/K+-ATPase mRNA expression was detected by real-time quantitative PCR. Activity of H+/K+-ATPase was determined indirectly by measuring K+-stimulated p-nitrophenyl phosphatase (pNPPase) activity. In another group of animals, rats were divided into a vagotomy and a sham group. The treatments and measurements were the same as above.
RESULTS: Intracerebroventricular infusion of nesfatin-1 significantly reduced gastric acid output, and the maximum inhibitory effect on gastric acid output was detected at a dose of 50 pmol/rat. Furthermore, nesfatin-1 decreased H+/K+-ATPase mRNA expression and activity in gastric mucosal tissue compared to the control group. The inhibitory action of nesfatin-1 on the acid output and H+/K+-ATPase expression and activity was abolished by vagotomy.
CONCLUSION: Nesfatin-1 injected intracerebroventricularly induces a dose-dependent decrease in gastric acid secretion in rats and the vagal nerve may be involved in the process of the effect of nesfatin-1.
- Citation: Huang L, Tang MD, Li XL, Lin L. Effect of vagotomy on central nesfatin-1-induced decrease in gastric acid secretion. Shijie Huaren Xiaohua Zazhi 2016; 24(7): 1002-1008
- URL: https://www.wjgnet.com/1009-3079/full/v24/i7/1002.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i7.1002
Neafatin-1最早是由日本学者OH-I等发现的一种厌食肽[1], 包含82个氨基酸, 起源于前体蛋白, 核组蛋白-2(NUCB2), 在人类、大鼠和小鼠间保持高度同源性[2]. NUCB2/nesfatin-1最初发现表达于调节摄食的下丘脑和脑干核中[1], 免疫荧光双标证实, nesfatin-1在室旁核与促甲状腺激素释放激素(thyrotropin releasing hormone, TRH)、促肾上腺皮质激素释放激素(corticotropin releasing hormone, CRH)、生长抑素(somatostatin)共表达[3], 这些调节肽均参与了胃酸分泌的调控[4-6], 这提示中枢nesfatin-1可能参与胃酸分泌的调节.
此外, 有研究报道[7,8]nesfatin-1免疫反应阳性细胞也在孤束核(nucleus of solitary tract, NTS)和迷走神经背核(dorsal motor nucleus of vagus, DMV)中表达. NTS和DMV参与一系列胃肠道功能, 包括胃酸的分泌[9]. 胃肠道的传入迷走神经纤维的神经突触位于NTS而传出迷走运动神经元位于DMV. 这些传出迷走神经纤维投射到上消化道的神经节, 密度最高的传出终端就在胃[10]. 迷走神经是将中枢性输出信号从大脑传送到胃, 以刺激胃酸分泌的最终共同途径之一. 在酸分泌的机制中, 迷走神经扮演着一个重要的角色, 特别是在中枢神经系统的调节中起着重要作用[11]. 第四脑室内注射nesfatin-1抑制脱氧葡萄糖刺激下的胃酸分泌并刺激迷走神经背核c-Fos的表达[12]. Nesfatin-1也可激活原代培养的迷走神经背核神经元的T型钙离子通道并可通过刺激N型钙通道的Ca2+内流激活迷走神经传入神经元[12,13]. 延髓的孤束核和迷走神经背核是中枢调节胃酸分泌的关键部位[9]. 我们推测迷走神经可能参与了中枢nesfatin-1抑制胃酸分泌的过程. 因此, 本研究通过观察侧脑室注射nesfatin-1后胃酸分泌与关键酶H+/K+-ATPase含量和活性的变化以及迷走神经切除后上述反应的变化, 以初步探讨迷走神经切除术对中枢nesfatin-1抑酸作用的影响.
♂SD大鼠, 清洁级, 体质量为200-250 g, 南京医科大学实验动物中心, 在明暗各12 h(6:00-18:00)周期, 温度21 ℃-23 ℃, 湿度60%的室温环境中3只/笼饲养, 大鼠自由饮食及饮水, 侧脑室置管后予以单笼饲养, 自由恢复5-7 d, 并接受训练, 实验前大鼠禁食24 h, 禁水2 h. 水合氯醛(国药集团化学试剂有限公司), 玻璃离子水门汀(上海医疗器械股份有限公司齿科材料厂), nesfatin-1(Phoneix Pharmaceuticals公司). H+/K+-ATPase和Actin引物(上海英俊公司). 抗H+/K+-ATPase α蛋白抗体(Abcam公司), 抗Actin抗体(Bioword公司). TRIzol试剂、BCA蛋白测定试剂盒和电化学发光(ECL)试剂盒(Invitrogen公司). 反转录试剂盒Primscript™ RT reagent kit及实时定量PCR检测(real-time quantitative PCR, qRT-PCR)试剂盒SYBR Premix Ex Taq™Ⅱ(日本Takara公司)
1.2.1 侧脑室置管: SD大鼠(200-250 g), 5%水合氯醛(0.8 mL/100 g)腹腔麻醉后, 头部正中做一长约0.5-1.0 cm切口, 暴露前囟点, 以棉球蘸取少量双氧水涂擦颅骨表面, 脑立体定位仪, 定位侧脑室(后0.8 mm, 右1.5 mm, 下3.6 mm)[14], 并标记. 用牙科钻将标记点钻开至硬脑膜, 用针尖刺破硬脑膜, 消毒棉签止血, 干燥术野. 置入微量给药套管, 螺丝固定, 牙科水泥再次固定. 单笼饲养, 术后恢复5-7 d. 判断置管是否成功: (1)置管后, 将内芯旋出, 有脑脊液流出; (2)向置入的套管中注入染色剂, 侧脑室染色, 不合格者予以剔除.
1.2.2 胃酸分泌量的测定: 将大鼠随机分为4组, 分别侧脑室注射不同浓度的nesfatin-1(1、5和50 pmol)及等量的灭菌水(5 μL)[1], 参考脑室注射nesfatin-1后可产生抑食的作用时间[1], 于给药后2 h处死大鼠, 留取胃液, 分别用pH计及NaOH滴定法来测定胃液中胃酸的含量[15]. 并最后刮取全部胃黏膜-80 ℃保存.
1.2.3 qRT-PCR检测H+/K+-ATPase mRNA的表达: 按TRIzol试剂说明提取各胃黏膜组织中总RNA, 然后逆转录为cDNA, 以此cDNA为模板行qRT-PCR, 循环条件为: 95 ℃ 15 min; 95 ℃ 20 s, 60 ℃ 30 s, 72 ℃ 60 s, 40个循环. 根据溶解曲线确保其产物的纯度, 采用2-△△Ct法得到各mRNA的浓度. 为标准化, 将各样本H+/K+-ATPase mRNA浓度除以各自actin mRNA的浓度. 引物序列为: H+/K+-ATPase上游: 5'-CTCTGCTTTGCGGGACTT-3'; 下游: 5'-CCTTGGCTGTGATGGGAT-3'; Actin上游: 5'-CTACAATGAGCTGCGTGTGG-3'; 下游: 5'-CGTGAGAAGGTCGGAAGGAA-3'.
1.2.4 H+/K+-ATPase活性的测定: 在不同浓度组, 对照组和nesfatin-1处理组的大鼠胃黏膜: 组织均经匀浆和低速离心. H+/K+-ATPase活性的测定采用间接测定K+刺激下对硝基酚磷酸酶(pNPPase)的活性[16]. 反应体积1 mL, 含50 mol/L的Tris缓冲液(pH 7.5), 2 mol/L MgCl2, 5 mol/L对硝基酚磷酸酶, 分别加和不加25 mol/L KCl, 与提纯的胃黏膜蛋白一起37 ℃孵育15 min, 加入1 mL 1.5 mol/L的NaOH终止反应. 用分光光度计在410 nm波长处比色, K+刺激下对硝基酚磷酸酶(pNPPase)的活性由加和不加KCL所得的光度值之差计算而来.
1.2.5 膈下迷走神经切断: 在另一组, 大鼠分为迷走神经切断组和假手术组. 迷走神经切断组大鼠接受双侧膈下迷走神经切断术[17]. 简单地说, 就是在戊巴比妥钠麻醉(50 mg/kg)下, 在腹侧中线处做一2 cm的切口. 在远离食管处将迷走神经背侧支和腹侧支小心仔细分离暴露. 在迷走神经各分支上相距1 cm的两点处用外科缝线结扎并在其中间将其切断. 同时, 将套管植入侧脑室(如前所述). 假手术组接受同样的手术操作但没有结扎和切断迷走神经. 所有的大鼠术后恢复7 d.
1.2.6 Western blot法检测H+/K+-ATPase α蛋白的表达: 用强裂解液裂解胃黏膜组织, 提取组织蛋白, 用BCA法进行蛋白定量. 每孔40 μg蛋白上样, 12%聚丙烯酰胺凝胶电泳, 转膜至PVDF膜上, 5%脱脂牛奶封闭2 h, 加一抗, 分别为抗H+/K+-ATPase α抗体(1:1000)、抗Actin抗体(1:2000), 4 ℃孵育过夜, 置37 ℃孵育二抗1 h. 用ECL化学发光试剂显影、定影, Image J软件行灰度分析, 以Actin作为内参照, 进行半定量分析.
统计学处理 用SPSS20.0统计软件进行分析, 结果用mean±SD表示, 多组均数比较采用单因素方差分析, 两两比较采用LSD法. P<0.05为差异有统计学意义.
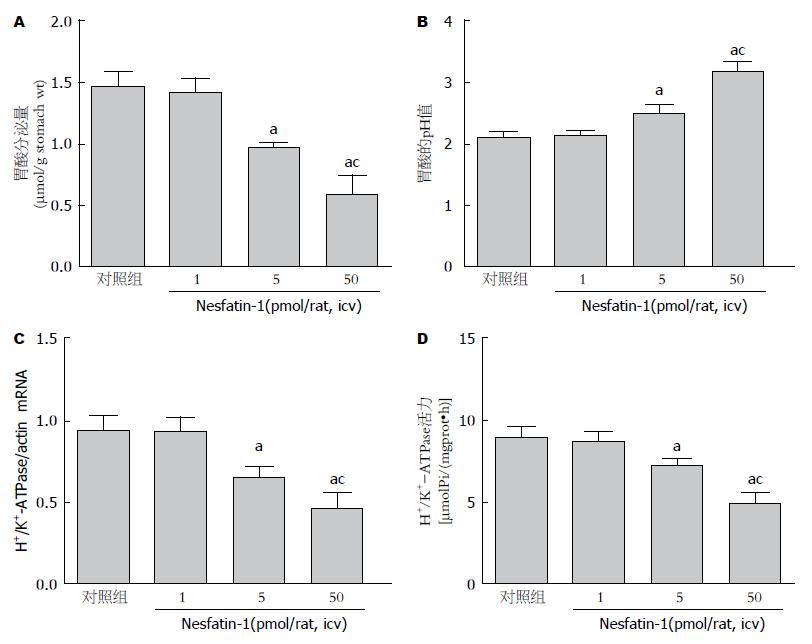
与对照组相比, 侧脑室注射1 pmol nesfatin-1在2 h对大鼠胃液中的酸含量及胃液的pH值无影响, 但注射5 pmol和50 pmol nesfatin-1组在2 h可使大鼠胃液中酸含量减少, 胃液的pH值升高(P<0.05). 其中注射50 pmol nesfatin-1组抑酸作用达到最强(图1A, B).
与对照组相比, 浓度为5 pmol和50 pmol nesfatin-1可使大鼠胃黏膜中H+/K+-ATPase mRNA的相对表达明显降低(P<0.05), 且50 pmol组大鼠胃黏膜中上述指标下降更明显; H+/K+-ATPase活性的变化趋势与mRNA的表达水平一致(图1C, D).
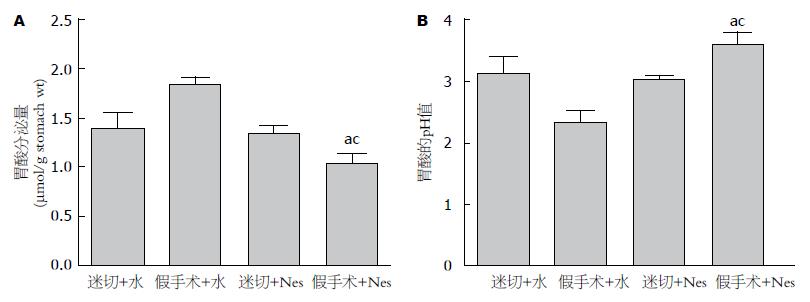
在假手术组, 侧脑室注射50 pmol nesfatin-1显著抑制大鼠胃酸的分泌, 升高胃液的pH值(P<0.05), 而在迷走神经切断组, nesfatin-1的抑酸作用消失(图2).
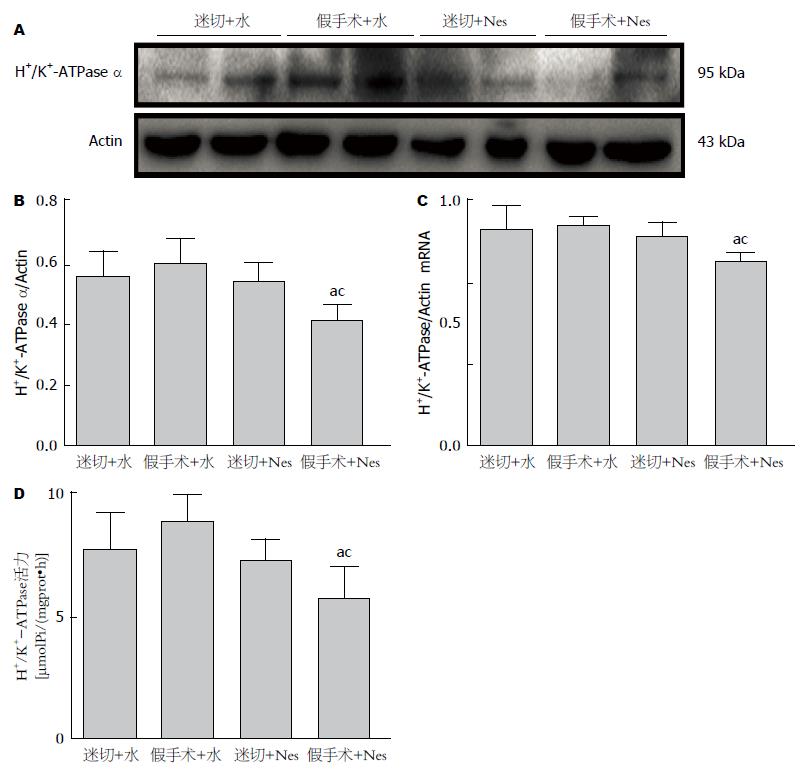
在假手术组, 侧脑室注射50 pmol nesfatin-1可抑制大鼠胃黏膜中H+/K+-ATPase α蛋白的表达(P<0.05), 降低H+/K+-ATPase mRNA的相对表达(P<0.05), H+/K+-ATPase活性的变化趋势与mRNA的表达水平一致. 而在迷走神经切断组, nesfatin-1引起的H+/K+-ATPase表达和活性下降的作用消失(图3).
我们的研究显示, 侧脑室注射nesfatin-1可以呈剂量依赖性地抑制胃酸分泌. 同时, H+/K+-ATPase mRNA的相对表达和活性也被抑制. 膈下迷走神经切断后, 上述提及的由nesfatin-1引起的效应都不存在了, 表明迷走神经途径可能参与了中枢抑酸作用这一过程.
H+/K+-ATPase, 调节胃酸分泌的关键酶, 他的表达和活性均是下调的, 最大抑制反应发生在侧脑室注射50 pmol nesfatin-1后2 h. 有研究[18]已经发现, H+/K+-ATPase表达和活性的变化趋势与胃酸分泌能力一致, 所以, 测定H+/K+-ATPase的表达和活性可以精确地反映胃酸分泌的能力. 目前公认的是刺激迷走神经可以增加胃酸分泌[19], 而迷走神经切断可阻断一些食欲调节肽例如食欲素A, 胃饥饿素引起的胃酸升高[20,21]. 在本研究中, 我们发现, 中枢nesfatin-1呈剂量依赖性地抑制H+/K+-ATPase的表达和胃酸分泌, 然而, 迷走神经切断后这些效应都被阻断了.
胃酸分泌是一个动态且复杂的过程, 壁细胞H+/K+-ATPase是泌酸的最终和最关键环节. 胃酸分泌的调节涉及中枢及外周一系列复杂的调节通路. 在中枢, 延髓的迷走神经运动背核(dorsal motor nucleus of vagus nerve, DMNV)及NTS是调控胃酸分泌的主要神经核团[9]. 在外周, 主要的刺激胃酸分泌的物质为组胺, 胃泌素及乙酰胆碱, 上述3种主要泌酸因子可分别与相应的受体结合, 通过其下游信号通路, 刺激胃酸分泌[22]. 中枢注射nesfatin-1可以抑制大鼠[23]和小鼠[24]胃排空, 同时也能抑制胃肠运动[14]. Xia等[12]的研究发现nesfatin-1对基础胃酸和五肽胃泌素刺激下的胃酸分泌无明显抑制效应, 但却可以呈剂量依赖性地抑制脱氧葡萄糖刺激下的酸分泌. 而脱氧葡萄糖可以通过激活迷走神经刺激胃酸分泌, 可见迷走神经途径可能参与了中枢nesfatin-1的抑酸过程, 与本研究结果相似. 纵然很多食欲肽已经被证实与迷走神经刺激下的胃酸分泌相关, 但nesfatin-1是唯一一个被证实可以抑制迷走神经调节的胃酸分泌的厌食肽[25-27].
吴静等[28]的前期研究发现, 侧脑室注射nesfatin-1可明显抑制大鼠胃黏膜中HDC的表达以及组胺的含量, 其详细途径仍不清楚. 有研究[29]显示, 迷走神经末梢释放垂体腺苷酸环化酶激活肽(pituitary adenylate cyclase activating polypeptide, PACAP), 作用于ECL细胞上的PACAP受体(PAC1), 升高ECL细胞内的Ca2+浓度, 呈剂量依赖性地促进组胺的分泌. 有研究报道[30], PACAP可同时升高ECL细胞和壁细胞内的Ca2+, 但是对壁细胞的作用可被H2受体阻断剂雷尼替丁所阻断[31], 提示PACAP对壁细胞的作用是通过促进ECL细胞释放组胺, 从而升高壁细胞内Ca2+浓度. 那么, 侧脑室注射nesfatin-1对于组胺的作用是否也是通过PACAP途径的? 双侧膈下迷走神经切断对侧脑室注射nesfatin-1对组胺及HDC的表达的抑制作用会有什么影响? 这些均有待于进一步的实验证实.
总之, 侧脑室注射nesfatin-1可抑制大鼠的胃酸分泌, 迷走神经途径可能参与了这一过程, 其作用的具体通路和机制仍需进一步研究.
Nesfatin-1是2006年新发现的一种厌食肽, 是体内调节摄食和胃肠运动的重要脑肠肽之一. 有文献报道, 中枢注射nesfatin-1可抑制胃排空, 减少大鼠摄食, 抑制胃酸分泌, 但具体作用机制尚不明确.
孙光, 副主任医师, 海南省海口市人民医院胃肠外科; 耿明, 主任医师, 济南军区总医院医技楼10楼病理科
酸分泌异常是胃溃疡等疾病的重要病理生理基础. Nesfatin-1是新发现的摄食调节肽, 参与了胃肠道运动及胃酸分泌的调节. 目前关于nesfatin-1对大鼠胃酸分泌的影响及机制的研究较少.
目前关于nesfatin-1与大鼠胃酸分泌的研究较少, 本课题组前期研究结果发现nesfatin-1可能通过乙酰胆碱途径影响大鼠胃黏膜细胞胃酸分泌.
本文首次采用迷走神经切断的方法探究中枢nesfatin-1抑制大鼠胃酸分泌的可能机制, 通过检测胃酸分泌以及H+/K+-ATPase的表达和活性, 探讨迷走神经途径与中枢nesfatin-1抑酸作用的相关性.
本文旨在探讨中枢nesfatin-1对大鼠胃酸分泌的影响的可能机制. 以期在将来为可能开发该物质相关药物用于酸分泌异常相关疾病治疗提供理论基础.
c-Fos: 属于即早基因, 如c-Fos、Arc、zif等, 都可以作为神经活动的标志.
本文采用动物实验侧脑室注射nesfatin-1和迷走神经切断证实侧脑室注射nesfatin-1可抑制大鼠的胃酸分泌, 迷走神经途径可能参与了这一过程. 科学性、创新性和可读性较好, 从临床工作的实际需求出发开展基础性研究, 很好的做到了临床与基础的结合.
编辑: 于明茜 电编: 都珍珍
| 1. | Oh-I S, Shimizu H, Satoh T, Okada S, Adachi S, Inoue K, Eguchi H, Yamamoto M, Imaki T, Hashimoto K. Identification of nesfatin-1 as a satiety molecule in the hypothalamus. Nature. 2006;443:709-712. [PubMed] [DOI] |
| 2. | Miura K, Titani K, Kurosawa Y, Kanai Y. Molecular cloning of nucleobindin, a novel DNA-binding protein that contains both a signal peptide and a leucine zipper structure. Biochem Biophys Res Commun. 1992;187:375-380. [PubMed] [DOI] |
| 3. | Douglas AJ, Johnstone LE, Leng G. Neuroendocrine mechanisms of change in food intake during pregnancy: a potential role for brain oxytocin. Physiol Behav. 2007;91:352-365. [PubMed] [DOI] |
| 4. | Taché Y, Yang H. Brain regulation of gastric acid secretion by peptides. Sites and mechanisms of action. Ann N Y Acad Sci. 1990;597:128-145. [PubMed] [DOI] |
| 5. | Okumura T, Yamada H, Motomura W, Kohgo Y. Cocaine-amphetamine-regulated transcript (CART) acts in the central nervous system to inhibit gastric acid secretion via brain corticotropin-releasing factor system. Endocrinology. 2000;141:2854-2860. [PubMed] [DOI] |
| 6. | Taché Y, Goto Y, Gunion MW, Vale W, River J, Brown M. Inhibition of gastric acid secretion in rats by intracerebral injection of corticotropin-releasing factor. Science. 1983;222:935-937. [PubMed] [DOI] |
| 7. | Könczöl K, Bodnár I, Zelena D, Pintér O, Papp RS, Palkovits M, Nagy GM, Tóth ZE. Nesfatin-1/NUCB2 may participate in the activation of the hypothalamic-pituitary-adrenal axis in rats. Neurochem Int. 2010;57:189-197. [PubMed] [DOI] |
| 8. | Kohno D, Nakata M, Maejima Y, Shimizu H, Sedbazar U, Yoshida N, Dezaki K, Onaka T, Mori M, Yada T. Nesfatin-1 neurons in paraventricular and supraoptic nuclei of the rat hypothalamus coexpress oxytocin and vasopressin and are activated by refeeding. Endocrinology. 2008;149:1295-1301. [PubMed] [DOI] |
| 9. | Browning KN, Travagli RA. Plasticity of vagal brainstem circuits in the control of gastric function. Neurogastroenterol Motil. 2010;22:1154-1163. [PubMed] [DOI] |
| 10. | Berthoud HR, Carlson NR, Powley TL. Topography of efferent vagal innervation of the rat gastrointestinal tract. Am J Physiol. 1991;260:R200-R207. [PubMed] |
| 11. | GROSSMAN MI. Secretion of acid and pepsin in response to distention of vagally innervated fundic gland area in dogs. Gastroenterology. 1962;42:718-721. [PubMed] |
| 12. | Xia ZF, Fritze DM, Li JY, Chai B, Zhang C, Zhang W, Mulholland MW. Nesfatin-1 inhibits gastric acid secretion via a central vagal mechanism in rats. Am J Physiol Gastrointest Liver Physiol. 2012;303:G570-G577. [PubMed] [DOI] |
| 13. | Iwasaki Y, Nakabayashi H, Kakei M, Shimizu H, Mori M, Yada T. Nesfatin-1 evokes Ca2+ signaling in isolated vagal afferent neurons via Ca2+ influx through N-type channels. Biochem Biophys Res Commun. 2009;390:958-962. [PubMed] [DOI] |
| 14. | Atsuchi K, Asakawa A, Ushikai M, Ataka K, Tsai M, Koyama K, Sato Y, Kato I, Fujimiya M, Inui A. Centrally administered nesfatin-1 inhibits feeding behaviour and gastroduodenal motility in mice. Neuroreport. 2010;21:1008-1011. [PubMed] [DOI] |
| 15. | Chandra M, Zhou H, Li Q, Muallem S, Hofmann SL, Soyombo AA. A role for the Ca2+ channel TRPML1 in gastric acid secretion, based on analysis of knockout mice. Gastroenterology. 2011;140:857-867. [PubMed] [DOI] |
| 16. | Karam SM, Ansari HR, Al-Dhaheri WS, Alexander G. Retinol enhances differentiation of the gastric parietal cell lineage in developing rabbits. Cell Physiol Biochem. 2004;14:333-342. [PubMed] [DOI] |
| 17. | Williams DL, Grill HJ, Cummings DE, Kaplan JM. Vagotomy dissociates short- and long-term controls of circulating ghrelin. Endocrinology. 2003;144:5184-5187. [PubMed] [DOI] |
| 18. | Hervatin F, Benkouka F, Robert JC, Péranzi G, Soumarmon A. The ontogeny of rat gastric H+/K+-ATPase. Biochim Biophys Acta. 1989;985:320-324. [PubMed] [DOI] |
| 19. | Blandizzi C, Colucci R, Carignani D, Lazzeri G, Del Tacca M. Positive modulation of pepsinogen secretion by gastric acidity after vagal cholinergic stimulation. J Pharmacol Exp Ther. 1997;283:1043-1050. [PubMed] |
| 20. | Takahashi N, Okumura T, Yamada H, Kohgo Y. Stimulation of gastric acid secretion by centrally administered orexin-A in conscious rats. Biochem Biophys Res Commun. 1999;254:623-627. [PubMed] [DOI] |
| 21. | Yakabi K, Ro S, Onouhi T, Tanaka T, Ohno S, Miura S, Johno Y, Takayama K. Histamine mediates the stimulatory action of ghrelin on acid secretion in rat stomach. Dig Dis Sci. 2006;51:1313-1321. [PubMed] [DOI] |
| 22. | Chen D, Zhao CM. Complexity of gastric acid secretion revealed by targeted gene disruption in mice. Curr Pharm Des. 2010;16:1235-1240. [PubMed] [DOI] |
| 23. | Stengel A, Goebel M, Wang L, Rivier J, Kobelt P, Mönnikes H, Lambrecht NW, Taché Y. Central nesfatin-1 reduces dark-phase food intake and gastric emptying in rats: differential role of corticotropin-releasing factor2 receptor. Endocrinology. 2009;150:4911-4919. [PubMed] [DOI] |
| 24. | Goebel-Stengel M, Wang L, Stengel A, Taché Y. Localization of nesfatin-1 neurons in the mouse brain and functional implication. Brain Res. 2011;1396:20-34. [PubMed] [DOI] |
| 25. | Date Y, Nakazato M, Murakami N, Kojima M, Kangawa K, Matsukura S. Ghrelin acts in the central nervous system to stimulate gastric acid secretion. Biochem Biophys Res Commun. 2001;280:904-907. [PubMed] [DOI] |
| 26. | Matsuda M, Aono M, Moriga M, Okuma M. Centrally administered NPY stimulated gastric acid and pepsin secretion by a vagally mediated mechanism. Regul Pept. 1991;35:31-41. [PubMed] [DOI] |
| 27. | Yamada H, Takahashi N, Tanno S, Nagamine M, Takakusaki K, Okumura T. A selective orexin-1 receptor antagonist, SB334867, blocks 2-DG-induced gastric acid secretion in rats. Neurosci Lett. 2005;376:137-142. [PubMed] [DOI] |
| 29. | Sandvik AK, Cui G, Bakke I, Munkvold B, Waldum HL. PACAP stimulates gastric acid secretion in the rat by inducing histamine release. Am J Physiol Gastrointest Liver Physiol. 2001;281:G997-G1003. [PubMed] |
| 30. | Zeng N, Athmann C, Kang T, Walsh JH, Sachs G. Role of neuropeptide-sensitive L-type Ca(2+) channels in histamine release in gastric enterochromaffin-like cells. Am J Physiol. 1999;277:G1268-G1280. [PubMed] |
| 31. | Athmann C, Zeng N, Scott DR, Sachs G. Regulation of parietal cell calcium signaling in gastric glands. Am J Physiol Gastrointest Liver Physiol. 2000;279:G1048-G1058. [PubMed] |