修回日期: 2016-01-10
接受日期: 2016-01-19
在线出版日期: 2016-02-28
目的: 评价托伐普坦治疗肝硬化并低钠血症和肝性水肿的有效性及安全性.
方法: 检索Embase、PubMed、Medline、Cochrane Library、Google Scholar、中国知网、维普、万方关于托伐普坦治疗肝硬化并低钠血症和肝性水肿的随机对照试验(RCT), 提取相关研究数据, 使用RevMan5.3版软件进行系统评价和Meta分析.
结果: 8项随机对照试验共725例患者符合纳入标准. Meta分析结果显示与安慰剂相比, 托伐普坦能显著升高血清钠浓度[加权均数差(weighted mean difference, WMD) = 7.36 mmol/L, 95%CI: 4.15-10.57, P<0.001], 显著增加24 h尿量(WMD = 1060.98 mL/24 h, 95%CI: 529.43-1592.52, P<0.001), 降低体质量及腹围(体质量: WMD = -1.14 kg, 95%CI: -1.34--0.94, P<0.001; 腹围: WMD = -2.18 cm, 95%CI: -3.02--1.34, P<0.001). 托伐普坦与安慰剂相比对血清钾浓度、血清肌酐、心率、收缩压、舒张压的影响无差异(P>0.05). 在不良反应发生率上, 托伐普坦与安慰剂相比无统计学差异(RR = 1.43, 95%CI: 0.73-2.80, P = 0.300).
结论: 对于肝硬化并低钠血症和肝性水肿患者, 托伐普坦能够在短期内提升血清钠浓度, 增加尿量, 减轻水肿, 且不增加不良反应, 是肝硬化并低钠血症和肝性水肿治疗有价值的新药物.
核心提示: 对于肝硬化并低钠血症和肝性水肿患者, 托伐普坦能够在短期内提升血清钠浓度, 增加尿量, 减轻水肿, 且不增加不良反应, 是肝硬化并低钠血症和肝性水肿治疗有价值的新药物.
引文著录: 郭皓, 吴利娟, 金哲, 李小珍, 金建军. 血管加压素V2受体拮抗剂托伐普坦治疗肝硬化并低钠血症和肝性水肿的系统评价. 世界华人消化杂志 2016; 24(6): 938-946
Revised: January 10, 2016
Accepted: January 19, 2016
Published online: February 28, 2016
AIM: To evaluate the efficacy and safety of vasopressin V2-receptor antagonist tolvaptan in treating cirrhotic patients with hyponatremia and hepatic edema.
METHODS: Randomized controlled trials (RCTs) about tolvaptan in treating cirrhotic patients with hyponatremia and hepatic edema were searched from the following databases: Embase, PubMed, Medline, Cochrane Library, Google Scholar, China National Knowledge Infrastructure (CNKI), VIP and Wanfang Database. The related research data were extracted, and RevMan5.3 was used for systemic review and meta-analysis.
RESULTS: Eight RCTs including 725 patients met the inclusion criteria. Meta-analysis showed that compared with placebo, tolvaptan could significantly increase serum sodium concentration [weighted mean difference (WMD) = 7.36 mmol/L, 95%CI: 4.15-10.57, P < 0.001] and 24-h urine volume (WMD = 1060.98 mL/24 h, 95%CI: 529.43-1592.52, P < 0.001), and reduce the body weight and abdominal circumference (body weight: WMD = -1.14 kg, 95%CI: -1.34--0.94, P < 0.001; abdominal circumference: WMD = -2.18 cm, 95%CI: -3.02--1.34, P < 0.001). The effects of tolvaptan on serum potassium, serum creatinine, heart rate, systolic pressure and diastolic pressure were not statistically different from those of the placebo (P > 0.05). The incidence of adverse reactions were not statistically different between the tolvaptan and placebo groups (RR = 1.43, 95%CI: 0.73-2.80, P = 0.300).
CONCLUSION: Tolvaptan could provide a new drug option for cirrhotic patients with hyponatremia and hepatic edema.
- Citation: Guo H, Wu LJ, Jin Z, Li XZ, Jin JJ. Vasopressin V2-receptor antagonist tolvaptan for treating cirrhotic patients with hyponatremia and hepatic edema: A systemic review. Shijie Huaren Xiaohua Zazhi 2016; 24(6): 938-946
- URL: https://www.wjgnet.com/1009-3079/full/v24/i6/938.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i6.938
肝硬化是各种慢性肝病发展的晚期阶段, 以肝功能减退和门静脉高压为主要临床表现, 在其失代偿期最常伴发低钠血症和肝性水肿(主要表现为腹水)[1]. 有资料显示在确诊为肝硬化10年内, 50%的患者出现腹水, 而腹水患者中并发低钠血症的比例高达50%-60%[2]. 目前针对性腹水的常规治疗措施主要包括限钠限水、利尿剂及腹腔穿刺术等, 但临床实践中, 上述措施会诱发或加重低钠血症、肝肾综合征、腹腔穿刺放液诱发的心功能不全和肝性脑病等并发症[3].
研究[1]证实肝硬化患者门静脉压力增高, 进而血流动力学的改变导致精氨酸血管加压素(arginine vasopressin, AVP)的分泌增加引起腹水及肝性水肿的形成以及稀释性低钠血症. 托伐普坦是新型非肽类选择性精氨酸血管加压素V2受体拮抗剂, 与肾集合管上的V2受体结合并阻断其活性, 增加尿液中不含电解质的游离水排泄[4], 从而用于治疗由于肝硬化、心力衰竭、抗利尿激素分泌失调综合征所导致的高容量性和正常容量性低钠血症. 然而, 自其临床应用以来, 其对临床疗效、生存率、预后仍不确定, 以及存在口渴、口干、血钠纠正过度等不良反应. 本文通过系统评价和Meta分析的方法对托伐普坦治疗肝硬化并低钠血症和肝性水肿的疗效及不良反应进行客观评价, 为其应用提供临床证据.
入选标准: (1)研究设计: 随机对照试验; (2)研究对象: 所有患者为依据肝硬化相关指南及防治方案确诊的病例, 肝功能分级标准采用Child-Pugh分级, 并伴有低钠血症, 腹水、下肢水肿等肝性水肿; (3)试验干预: 托伐普坦; (4)对照干预: 安慰剂; (5)结局测量指标: 主要结局指标: 血清钠浓度、24 h尿量、体质量变化; 次要结局指标: 腹围、血清钾浓度、血清肌酐、心率、血压、不良反应; (6)语种为中文和英文. 排除标准: (1)半随机或非随机对照试验; (2)重复发表的研究; (3)未提供结局指标或数据不完整; (4)文献综述; (5)会议论文.
1.2.1 在线检索英文数据库: Embase、PubMed、Medline、Cochrane Library, Google Scholar, 中文数据库: 中国知网、维普、万方, 检索相关临床研究试验以及相关研究的参考文献. 检索范围自建库至2015-06-01的所有相关文献. 在不同的数据库进行检索时, 针对各个数据库的特点制定相应的检索策略及检索式, 英文检索词为: "tolvaptan"、"cirrhosis"、"hyponatraemia"、"hepatic edema"、"ascites"; 中文检索词为: "托伐普坦"、"肝硬化"、"低钠血症"、"肝性水肿"、"腹水".
1.2.2 数据提取: 由2名作者独立根据提前制定的纳入标准及排除标准对文献进行筛选, 观点不一致时与第3名作者进行协商决定. 完成文献筛选后, 对最终纳入的研究进行信息提取, 项目包括作者、发表年份、地区、样本量、基线情况、试验设计、干预和对照措施、药物剂量、给药方式、疗程、相关结局指标等.
1.2.3 文献质量评价: 由2名作者采用Cochrane协作网推荐的偏倚风险评估工具独立对最终纳入的研究进行质量评价, 观点不一致时与第3名作者进行协商决定. 包括6个方面: (1)随机分配方法(如随机数字表、计算机产生随机数字、抛硬币或抽签等方法); (2)分配方案隐藏(如中心随机、按顺序编码、密封、不透光的信封等); (3)盲法(具体盲法, 以及对患者、主要研究人员、结果测量者采用盲法等); (4)结果数据的完整性(有无数据缺失, 其产生原因以及是否影响结果分析); (5)选择性报告研究结果(研究方案以及制订的结局指标是否均有报告); (6)其他偏倚来源(明显基线不平衡、提前终止研究等). 针对每一项研究结果, 对上述6条作出"低风险"、"高风险"和"不清楚"(缺乏相关信息或偏倚情况不确定)的判断.
统计学处理 采用Cochrane协作网提供的RevMan5.3版软件对所提取的数据进行统计学分析. 对于连续性变量即计量资料采用加权均数差(weighted mean difference, WMD)作为效应指标, 二分类变量即计数资料采用相对危险度(risk ratio, RR)作为效应指标, 两者均以95%CI表示, 以P<0.05为差异有统计学意义. 在进行数据合并之前, 考虑到各研究的固有异质性, 采用I2评价研究间的异质性, 当I2≤50%时, 异质性较小, 采用固定效应模型进行统计分析; 当I2>50%时, 异质性较大, 采用随机效应模型进行统计分析.
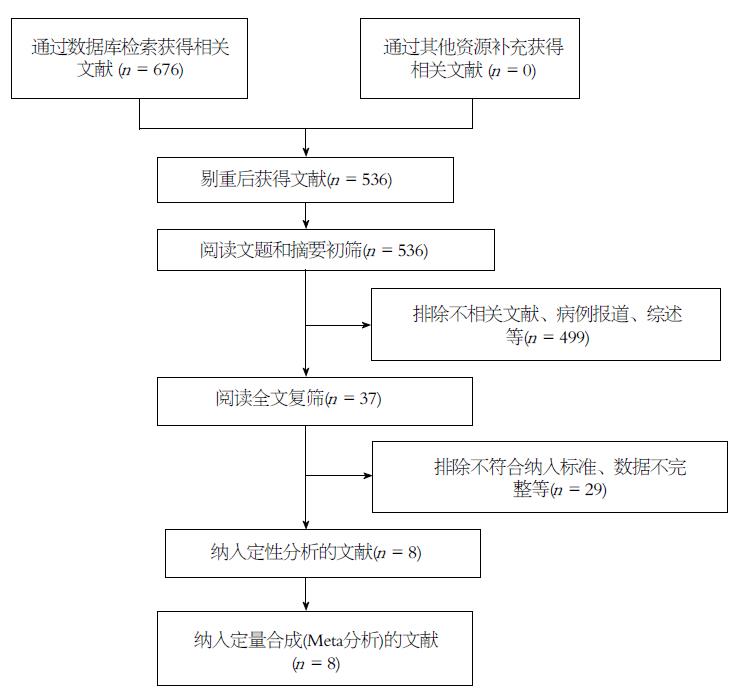
依据制定的检索策略及检索式初步检索到相关文献676篇, 经去重、阅读题目及摘要初筛后排除不相关文献639篇, 再根据纳入以及排除标准仔细阅读全文复筛后剔除29篇, 最终纳入8篇文献[5-12], 具体流程如图1.
所有的研究均为随机对照试验, 以中国和日本为主, 大多数研究旨在评估肝硬化患者低钠血症和肝性水肿的变化情况. 725例肝硬化患者, 其中试验组400例, 对照组325例符合纳入标准, 两组基线资料具有可比性, 年龄范围31-81岁, 男女比例7:3. 所有患者均依据肝硬化相关指南及防治方案确诊, 并伴有低钠血症, 腹水、下肢水肿等肝性水肿. 托伐普坦均以口服方式服用, 剂量从7.5-60.0 mg不等, 疗程从7-37 d(表1).
| 纳入研究 | 药物 | 剂量(mg/d) | n | 疗程(d) | 年龄(岁) | 性别(男/女) |
| 刘映川等[5]2014 | 托伐普坦 | 15-30 | 27 | 10 | 52.3±7.4 | 18/9 |
| 安慰剂 | 27 | 10 | 51.7±6.9 | 不详 | ||
| 唐飞等[6]2014 | 托伐普坦 | 15-60 | 20 | 7 | 32-65 | 32/8 |
| 安慰剂 | 20 | 7 | 32-65 | |||
| 孙磊等[7]2013 | 托伐普坦 | 15-60 | 42 | 7 | 47.2±19.5 | 47/35 |
| 安慰剂 | 40 | 7 | 52.1±20.1 | |||
| 阚晓等[8]2013 | 托伐普坦 | 15-30 | 56 | 7 | 47.2±5.9 | 65/31 |
| 安慰剂 | 40 | 7 | 47.9±5.4 | |||
| 陈武等[9]2013 | 托伐普坦 | 15.0 | 35 | 5 | 不详 | 不详 |
| 安慰剂 | 35 | 5 | 不详 | |||
| Okita等[10]2014 | Tolvaptan | 7.5 | 25 | 24 | 71/30 | |
| 15.0 | 25 | 24 | 64±10 | |||
| 30.0 | 25 | 24 | ||||
| Placebo | 26 | 24 | 65±9 | |||
| Sakaida等[11]2014 | Tolvaptan | 7.5 | 82 | 7 | 31-80 | 101/61 |
| Placebo | 80 | 7 | 46-78 | |||
| Cárdenas等[12]2012 | Tolvaptan | 15-60 | 63 | 37 | 52±8 | 88/32 |
| Placebo | 57 | 37 | 55±9 |
所有纳入研究均提到随机, 其中3项给出随机分配方法[10-12], 2项给出分配隐藏方案[10,11]. 4项研究为双盲[8,10-12], 其中3项报道具体盲法[10-12]. 从纳入研究的试验设计和结果看, 所有研究结果数据完整, 并无选择性报告研究结果, 但由于观察项目及测量方法差异, 各研究间仍有所不同. 对于其他偏倚, 各项研究均未提及(表2).
| 纳入研究 | 随机分配方法 | 分配方案隐藏 | 盲法 | 结果数据的完整性 | 选择性报告研究结果 | 其他偏倚来源 |
| 刘映川等[5]2014 | 高风险 | 不清楚 | 不清楚 | 低风险 | 低风险 | 不清楚 |
| 唐飞等[6]2014 | 高风险 | 不清楚 | 不清楚 | 低风险 | 低风险 | 不清楚 |
| 孙磊等[7]2013 | 高风险 | 不清楚 | 不清楚 | 低风险 | 低风险 | 不清楚 |
| 阚晓等[8]2013 | 高风险 | 不清楚 | 高风险 | 低风险 | 低风险 | 不清楚 |
| 陈武等[9]2013 | 高风险 | 不清楚 | 不清楚 | 低风险 | 低风险 | 不清楚 |
| Okita等[10]2014 | 低风险 | 低风险 | 低风险 | 低风险 | 低风险 | 不清楚 |
| Sakaida等[11]2014 | 低风险 | 低风险 | 低风险 | 低风险 | 低风险 | 不清楚 |
| Cárdenas等[12]2012 | 低风险 | 高风险 | 低风险 | 低风险 | 低风险 | 不清楚 |
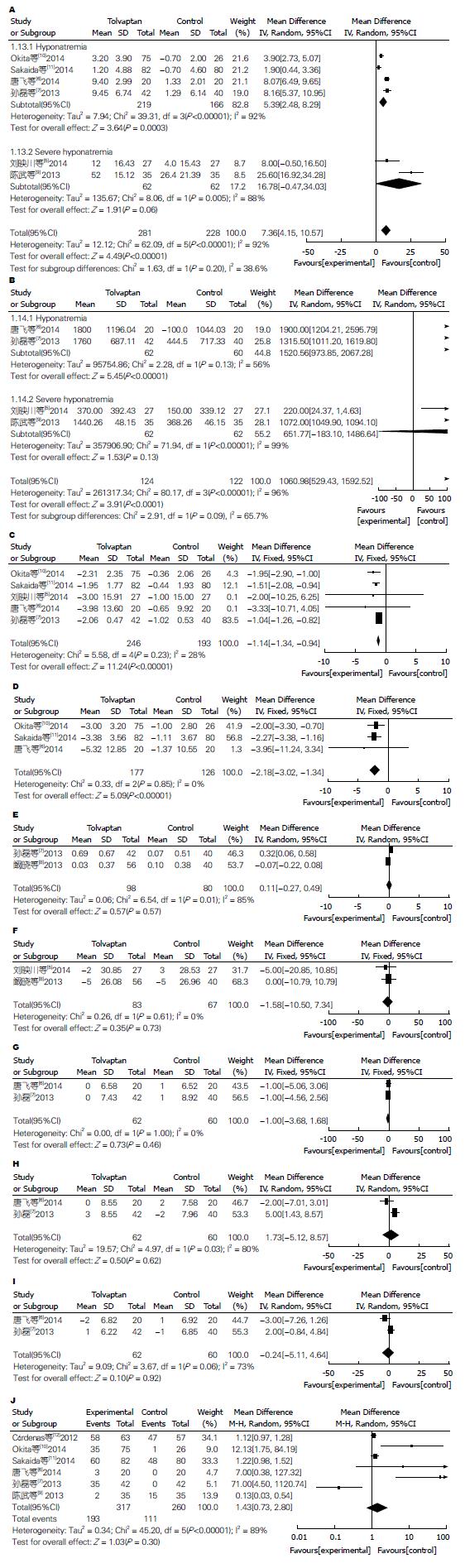
共有6项研究对两组患者血清钠浓度较基线状况的变化进行了评价, 以血清钠浓度<120 mmol/L为标准分为轻、中度低钠血症和重度低钠血症两个亚组, 结果显示: 托伐坦组患者血清钠浓度升高幅度明显大于安慰剂组(WMD = 7.36 mmol/L, 95%CI: 4.15-10.57, P<0.001, I2 = 92%, Random effect), 具有统计学意义(图2A).
共有4项研究对两组患者24 h尿量较基线状况的变化进行了评价, 以血清钠浓度<120 mmol/L为标准分为轻、中度低钠血症和重度低钠血症两个亚组, 结果显示: 托伐普坦组患者24 h尿量较安慰剂组明显增加(WMD = 1060.98 mL/24 h, 95%CI: 529.43-1592.52, P<0.001, I2 = 96%, Random effect), 具有统计学意义(图2B).
共有5项研究对两组患者体质量较基线状况的变化进行了评价, 结果显示: 托伐普坦组患者体质量减少量大于安慰剂组(WMD = -1.14 kg, 95%CI: -1.34--0.94, P<0.001, I2 = 28%, Fixed effect), 具有统计学意义(图2C).
共有3项研究对两组患者腹围较基线状况的变化进行了评价, 结果显示: 托伐普坦组患者腹围周径较安慰剂组明显减少(WMD = -2.18 cm, 95%CI: -3.02--1.34, P<0.001, I2 = 0%, Fixed effect), 具有统计学意义(图2D).
2项研究对两组患者血清钾浓度较基线状况的变化进行了评价, 结果显示: 托伐普坦组患者血清钾浓度变化情况与安慰剂组相比无差别(WMD = 0.11 mmol/L, 95%CI: -0.27-0.49, P = 0.570, I2 = 85%, Random effect, 图2E).
2项研究对两组患者血清肌酐较基线状况的变化进行了评价, 结果显示: 托伐普坦组患者血清肌酐变化情况与安慰剂组相比无差别(WMD = -1.58 μmol/L, 95%CI: -10.50-7.34, P = 0.730, I2 = 0%, Fixed effect, 图2F).
2项研究对两组患者心率较基线状况的变化进行了评价, 结果显示: 托伐普坦组患者心率变化情况与安慰剂组相比无差别(WMD = -1.00次/min, 95%CI: -3.68-1.68, P = 0.460, I2 = 0%, Fixed effect, 图2G).
2项研究对两组患者血压较基线状况的变化进行了评价, 结果显示: 托伐普坦组患者血压(收缩压、舒张压)变化情况与安慰剂组相比无差别(收缩压: WMD = 1.73 mmHg, 95%CI: -5.12-8.57, P = 0.620, I2 = 80%, Random; 舒张压: WMD = -0.24 mmHg, 95%CI: -5.11-4.64, P = 0.920, I2 = 73%, Random effect; 图2H, I).
6项研究对两组患者总体不良反应的发生情况进行了评价, 主要包括口渴、口干等, 结果显示: 托伐普坦组不良反应发生情况与安慰剂组相比无统计学意义(RR = 1.43, 95%CI: 0.73-2.80, P = 0.300, I2 = 89%, Random effect, 图2J).
本系统评价总结了国内外关于托伐普坦在肝硬化并低钠血症和肝性水肿的有效性和安全性. 发现托伐普坦可以短期内提升血清钠浓度, 增加24 h尿量, 降低体质量和腹围, 对长期效果以及生存率的影响仍需进一步明确, 建议对于肝硬化并低钠血症和肝性水肿患者, 托伐普坦可短期应用于对症支持治疗和改善生活质量.
低钠血症作为肝硬化并肝性水肿患者最常见之并发症, 已被证实和低生存率以及肝移植预后相关[13,14], 也有学者认为应该把低钠血症增加为新的终末期肝病模型独立预测因子[15,16], 因此合理纠正低钠血症愈显至关重要. 本研究分析发现托伐普坦短期内可以显著提升血清钠浓度, 尤其在重度低钠血症患者中, 其提升能力与托伐普坦剂量呈正相关[10]. 结合其机制, 可选择性的拮抗肾脏集合管主细胞V2受体, 水通道蛋白从内膜脱落并且表达降低, 对水的重吸收减少, 形成低渗利尿, 降低血容量的同时使血清钠浓度得到回升[17]. 由于本研究纳入的研究疗程为7-37 d, 关于托伐普坦在提升血清钠浓度的长期效果上, 仍需大量RCT进一步明确. 托伐普坦在利尿效果上, 对所纳入研究的患者分析后发现, 可以增加24 h尿量, 且对于重度低钠血症患者更明显. 这种作用可能改善利尿剂低反应性, 降低利尿剂相关不良反应以及腹腔穿刺术的需要, 可对顽固性腹水也能实现有效控制[18]. 肝硬化失代偿期多出现肝性水肿, 主要表现为腹水、胸水以及下肢水肿, 临床症状包括肿胀感、胃纳差、卧位压迫感以及呼吸困难, 严重影响患者的生活质量[19]. 本研究分析显示, 托伐普坦能够在利尿的基础上, 减轻体质量并减少腹围, 缓解临床症状, 从而改善其生活质量[11]. 通常认为, 尿量增加通常易引起电解质紊乱、肾脏以及循环的病理生理改变. 本研究通过对血清钾浓度、血清肌酐、心率以及血压在托伐普坦与安慰剂研究前后变化的分析显示, 托伐普坦并不影响上述结局指标的改变. 虽然目前纳入分析的研究数以及患者例数有限, 但是仍能发现托伐普坦可以高度选择性拮抗V2受体, 促进不含电解质的游离水排泄, 有效改善循环血容量[17].
尽管托伐普坦短期应用在临床各个方面效果显著, 但是, 结合本研究纳入研究的特点, 并未对生存率的改善给出足够数据, 仅有一项研究[12]报道了托伐普坦与安慰剂各组的死亡例数, 并且指出并无明显临床意义. 在不良反应方面, 考虑肝硬化失代偿期本身非药物相关性并发症, 如食管静脉曲张破裂出血、肝肾综合征、肝性脑病等, 以及药物相关主要表现为口渴、口干等, 纳入的各研究对不良反应报告方式不一, 通过对总发生例数的分析显示, 托伐普坦与安慰剂相比并未发现明显差异. 近期英国药监机构的消息[20]警示托伐普坦有导致血清钠升高过快及严重神经系统不良事件(渗透性脱髓鞘综合征)的风险. 在所纳入的研究[12]中有一项出现过血清钠浓度纠正过度, 但并未引起严重神经系统不良事件, 也无研究显示血清钠纠正过度与托伐普坦剂量的相关性. 因此, 托伐普坦的临床应用建议从小剂量开始并连续监测血清钠浓度以避免这种不良反应的发生. 另有研究[21,22]显示托伐普坦可以增加胃肠道出血的几率, 可能与托伐普坦可以消耗维生素K依赖的凝血因子以及抑制血小板的聚集有关, 提示临床应用时应监测血常规、血凝变化并适量补充维生素K.
由于托伐普坦上市时间较短且价格昂贵, 限制其广泛临床应用, 因此本研究纳入的研究数量尚有限, 且存在部分研究随机盲法方法不明确、相关偏倚风险高等不足, 期待更多高质量、多中心、大样本的随机双盲对照临床试验, 以更好的评估托伐普坦的适应证、用法、疗程、长期效益、经济效益以及远期不良反应等, 为临床应用提供更加可靠的循证医学证据.
总之, 托伐普坦能够在短期内提升肝硬化并低钠血症和肝性水肿患者血清钠浓度, 增加尿量, 减轻肝性水肿, 且不增加不良反应, 但其长期疗效以及对生存率的影响仍需进一步明确, 建议在使用时从小剂量开始并监测相关临床指标. 托伐普坦可为肝硬化并低钠血症和肝性水肿的治疗提供新选择.
肝硬化是各种慢性肝病发展的晚期阶段, 在其失代偿期最常伴发低钠血症和肝性水肿, 传统的限钠限水、利尿剂及腹腔穿刺术等对腹水的治疗(尤其是顽固性腹水)存在争议, 托伐普坦为新型非肽类选择性精氨酸血管加压素V2受体拮抗剂, 为肝硬化并低钠血症和肝性水肿的治疗提供新选择.
金博, 主任医师, 中国人民解放军第309医院(总参谋部总医院)消化内科
托伐普坦为新型非肽类选择性精氨酸血管加压素V2受体拮抗剂在肝硬化并低钠血症和肝性水肿的治疗上受到越来越多的关注, 但是其安全性、长期疗效、经济效益比仍需进一步研究.
已有相关研究就血管加压素V2受体拮抗剂这一类药物对肝硬化并低钠血症和肝性水肿的治疗方面进行了临床研究和Meta分析, 本文以托伐普坦为研究对象, 回顾了托伐普坦治疗肝硬化腹水和低钠血症的随机对照研究, 并对数据进行了Meta分析, 对于临床有较好的指导意义.
托伐普坦能够在短期内提升肝硬化并低钠血症和肝性水肿患者血清钠浓度, 增加尿量, 减轻肝性水肿, 且不增加不良反应, 为肝硬化并低钠血症和肝性水肿的治疗提供新选择.
托伐普坦治疗肝硬化腹水是近年来肝硬化顽固性腹水药物治疗的新进展之一. 本文回顾了托伐普坦治疗肝硬化腹水和低钠血症的随机对照研究, 并对数据进行了Meta分析, 对于临床有较好的指导意义.
编辑: 于明茜 电编:闫晋利
| 1. | Hytiroglou P, Snover DC, Alves V, Balabaud C, Bhathal PS, Bioulac-Sage P, Crawford JM, Dhillon AP, Ferrell L, Guido M. Beyond "cirrhosis": a proposal from the International Liver Pathology Study Group. Am J Clin Pathol. 2012;137:5-9. [PubMed] [DOI] |
| 4. | Shoaf SE, Wang Z, Bricmont P, Mallikaarjun S. Pharmacokinetics, pharmacodynamics, and safety of tolvaptan, a nonpeptide AVP antagonist, during ascending single-dose studies in healthy subjects. J Clin Pharmacol. 2007;47:1498-1507. [PubMed] [DOI] |
| 7. | 孙 磊. , 托伐普坦对肝硬化腹水并发低钠血症的疗效观察. 大连: 大连医科大学, 2013. . |
| 10. | Okita K, Kawazoe S, Hasebe C, Kajimura K, Kaneko A, Okada M, Sakaida I. Dose-finding trial of tolvaptan in liver cirrhosis patients with hepatic edema: A randomized, double-blind, placebo-controlled trial. Hepatol Res. 2014;44:83-91. [PubMed] [DOI] |
| 11. | Sakaida I, Kawazoe S, Kajimura K, Saito T, Okuse C, Takaguchi K, Okada M, Okita K. Tolvaptan for improvement of hepatic edema: A phase 3, multicenter, randomized, double-blind, placebo-controlled trial. Hepatol Res. 2014;44:73-82. [PubMed] [DOI] |
| 12. | Cárdenas A, Ginès P, Marotta P, Czerwiec F, Oyuang J, Guevara M, Afdhal NH. Tolvaptan, an oral vasopressin antagonist, in the treatment of hyponatremia in cirrhosis. J Hepatol. 2012;56:571-578. [PubMed] [DOI] |
| 13. | Kim WR, Biggins SW, Kremers WK, Wiesner RH, Kamath PS, Benson JT, Edwards E, Therneau TM. Hyponatremia and mortality among patients on the liver-transplant waiting list. N Engl J Med. 2008;359:1018-1026. [PubMed] [DOI] |
| 14. | Londoño MC, Guevara M, Rimola A, Navasa M, Taurà P, Mas A, García-Valdecasas JC, Arroyo V, Ginès P. Hyponatremia impairs early posttransplantation outcome in patients with cirrhosis undergoing liver transplantation. Gastroenterology. 2006;130:1135-1143. [PubMed] |
| 15. | Londoño MC, Cárdenas A, Guevara M, Quintó L, de Las Heras D, Navasa M, Rimola A, Garcia-Valdecasas JC, Arroyo V, Ginès P. MELD score and serum sodium in the prediction of survival of patients with cirrhosis awaiting liver transplantation. Gut. 2007;56:1283-1290. [PubMed] [DOI] |
| 16. | Iacob S, Gheorghe L, Iacob R, Gheorghe C, Hrehoreţ D, Popescu I. MELD exceptions and new predictive score of death on long waiting lists for liver transplantation. Chirurgia (Bucur). 2009;104:267-273. [PubMed] |
| 17. | Decaux G, Soupart A, Vassart G. Non-peptide arginine-vasopressin antagonists: the vaptans. Lancet. 2008;371:1624-1632. [PubMed] [DOI] |
| 18. | Arroyo V, Ginès P, Gerbes AL, Dudley FJ, Gentilini P, Laffi G, Reynolds TB, Ring-Larsen H, Schölmerich J. Definition and diagnostic criteria of refractory ascites and hepatorenal syndrome in cirrhosis. International Ascites Club. Hepatology. 1996;23:164-176. [PubMed] [DOI] |
| 19. | Solà E, Watson H, Graupera I, Turón F, Barreto R, Rodríguez E, Pavesi M, Arroyo V, Guevara M, Ginès P. Factors related to quality of life in patients with cirrhosis and ascites: relevance of serum sodium concentration and leg edema. J Hepatol. 2012;57:1199-1206. [PubMed] [DOI] |
| 21. | Berl T, Quittnat-Pelletier F, Verbalis JG, Schrier RW, Bichet DG, Ouyang J, Czerwiec FS. Oral tolvaptan is safe and effective in chronic hyponatremia. J Am Soc Nephrol. 2010;21:705-712. [PubMed] [DOI] |
| 22. | FDA. Accessed February 7, 2012.. Available from: http://www.fda.gov/Drugs/default.. |