修回日期: 2016-01-19
接受日期: 2016-01-25
在线出版日期: 2016-02-28
目的: 探讨miR-638在胃癌中的表达及其临床意义.
方法: 从液氮冻存的31例胃癌及31例正常组织中提取总RNA, 应用实时定量PCR(real-time quantitative PCR, qRT-PCR)方法检测miR-638的表达情况, 分析其与胃癌临床病例特征的关系.
结果: miR-638在胃癌组织中有27例(87.10%)低表达, 4例(12.90%)高表达, 在胃癌组织中的表达明显低于正常组织(P<0.01), 其表达与肿瘤浸润深度密切相关(P<0.05), 但与性别、年龄、分化程度、TNM分期、淋巴结转移等均无明显相关性(P>0.05).
结论: miR-638在胃癌中呈低表达, 可能与胃癌的发生、发展密切相关.
核心提示: 本研究通过比较miR-638在正常组织及胃癌组织中的表达差异及与胃癌临床病理参数的相关性, 探讨miR-638作为胃癌诊断和治疗中的临床意义.
引文著录: 黄诗良, 叶桦, 唐有为, 邬丽娜, 郭雯莹, 沈晓伶, 董显文, 张谢. miR-638在胃癌中的表达及其临床意义. 世界华人消化杂志 2016; 24(6): 928-932
Revised: January 19, 2016
Accepted: January 25, 2016
Published online: February 28, 2016
AIM: To investigate the expression of miR-638 in gastric carcinoma and to analyze its clinical significance.
METHODS: Total RNA was extracted from 31 pairs of gastric carcinoma tissues and normal tissues. The expression levels of miR-638 were detected by quantitative real-time polymerase chain reaction (qRT-PCR). The relationship between miR-638 expression and clinicopathological parameters of gastric carcinoma was analyzed.
RESULTS: miR-638 was lowly expressed in 27 (87.10%) cases of gastric carcinoma, and highly expressed in 4 (12.90%) cases. The expression level of miR-638 was significantly lower in gastric carcinoma tissues than in normal tissues (P < 0.01). miR-638 expression in gastric carcinoma was significantly associated with the depth of tumor invasion (P < 0.05), but was not associated with sex, age, degree of differentiation, TNM stage, or lymph node metastasis (P > 0.05).
CONCLUSION: The expression of miR-638 is lower than in normal tissues in gastric carcinoma, which may be associated with the carcinogenesis and development of gastric carcinoma.
- Citation: Huang SL, Ye H, Tang YW, Wu LN, Guo WY, Shen XL, Dong XW, Zhang X. Clinical significance of expression of miR-638 in gastric carcinoma. Shijie Huaren Xiaohua Zazhi 2016; 24(6): 928-932
- URL: https://www.wjgnet.com/1009-3079/full/v24/i6/928.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i6.928
胃癌是世界范围内最常见的恶性肿瘤之一, 其发病率仅次于肺癌、乳腺癌和结肠癌, 位居第4位, 死亡率居恶性肿瘤的第2位[1]. 我国是世界上胃癌高发的国家之一, 发病率占全世界的42%. 目前尽管采取了包括手术切除、化学治疗、放射治疗以及其他综合性的治疗措施, 但是其治疗效果仍不尽人意. 胃癌的发生涉及癌基因/抑癌基因的异常激活/杂合性丢失、免疫改变、表观遗传学改变等, 是一个多因素、多阶段的网络调控过程. 因此, 从分子水平阐述胃癌的发病机制, 筛选治疗的分子指标, 为胃癌治疗提供新的分子靶标, 对提高胃癌患者的预后具有重要意义.
微小RNA(microRNA, miRNA)是一类广泛存在于真核生物中, 长度为21-25个核苷酸, 进化上高度保守的单链非编码RNA小分子. 主要通过与靶mRNA的3'非翻译区互补配对, 抑制蛋白合成, 或诱导mRNA降解, 从而实现在转录后水平对目的基因表达进行负性调控[2], 调节细胞的增殖、分化和凋亡, 参与机体的发育、代谢以及肿瘤的发生、发展等生物学过程. 近年来的研究表明miRNA在各种肿瘤组织中的表达异常, 这初步揭示了肿瘤的发生与miRNA的表达之间存在密切关系. 其中, 已有学者报道[3]miR-638能抑制胃癌细胞增殖, 本研究通过比较miR-638在正常组织及胃癌组织中的表达差异及与胃癌临床病理参数的相关性, 探讨miR-638作为胃癌诊断和治疗中的临床意义.
31例胃癌与31例正常对照组织(距离癌灶边缘5 cm以上, 活检病理证实为非肿瘤正常组织)标本取自西安交通大学第一附属医院和浙江省宁波市医疗中心李惠利医院2012-05/2013-07手术患者, 其中西安交通大学第一附属医院提供12例, 浙江省宁波市医疗中心李惠利医院提供19例, 平均年龄为64.38岁±3.87岁, 60岁以上13例, 60岁以下18例. 男性26例, 女性5例. 所有患者均为原发性病灶切除, 术前均未接受放疗、化疗以及其他针对肿瘤的特殊治疗. 获取标本前均签署了知情同意书. 经过术后病理检查证实后, 对31例患者的临床病理资料进行整理分析. 标本采集后均置于液氮保存. 用于RNA提取的TRIzol购自Invitrogen公司, RNA反转录试剂盒与SYBR实时定量PCR检测(real-time quantitative PCR, qRT-PCR)试剂盒购自Takara公司, miR-638和U6引物由生工生物工程(上海)公司合成.
1.2.1 引物设计与合成: miR-638与内参的反转录及qRT-PCR引物序列由本实验室设计提供. 序列如表1.
| 扩增基因 | 引物序列(5'-3') |
| miR-638: RT | GTCGTATCCAGTGCGTGTCGTGGAGTCGGCAATT |
| miR-638: F | GCACTGGATACGACAGGCCGC |
| miR-638: R | ATCCAGTGCGTGTCGTGTGCTAGGGATCGCGGGCGGGTG |
| U6: RT | CGCTTCACGAATTTGCGTGTCAT |
| U6: F | GCTTCGGCAGCACATATACTAAAAT |
| U6: R | CGCTTCACGAATTTGCGTGTCAT |
1.2.2 RNA的提取: 取液氮冻存的组织, 按照miRNA提取试剂盒说明书提取含有miRNA的总RNA. 紫外可见分光光度计检测RNA溶液260 nm及280 nm处吸光度(A)值, 计算RNA的纯度和浓度, A260/280的值在1.8-2.0之间, 为高纯度RNA, 并调整RNA浓度, 置于-80 ℃保存.
1.2.3 逆转录PCR: 应用本实验室设计的特异性RT引物, 逆转录获取cDNA. 按照试剂盒(PrimeScript®RT reagent Kit)说明, 以20 μL反应体系进行逆转录, RNA为80 ng, 4 μL 5×PrimeScript® Buffer, 1 μL PrimeScript®RT Enzyme MixⅠ, 2 mL Reverse transcription引物, 添加RNase Free water调整体系至20 μL. 逆转录反应条件: 37 ℃ 15 min, 85 ℃ 5 s. 反应结束后将cDNA保存于-20 ℃.
1.2.4 qRT-PCR: 采用试剂盒(SYBR® Premix Ex TaqTMⅡ, Perfect Real Time), 反应体系为20 μL, 1 μL逆转录PCR产物, 10 μL 2×SYBR® Premix Ex TaqTMⅡ, 上下游引物各1 μL, 加RNase Free water调整体系至20 μL, U6作为内参, 每组样本均做3个重复, 反应在IQ-5型(Bio-Rad)qRT-PCR仪上进行. 采用2-△△Ct法计算miR-638的相对表达量, △△Ct = (CtmiR-638-CtU6)胃癌-(CtmiR-638-CtU6)正常.
统计学处理 采用SPSS17.0统计软件进行分析, 各组实验数据均以mean±SD表示. 应用单因素方差分析, 比较miR-638在不同临床分期和病理分级胃癌中表达的差异, 应用GraphPad Prism 5软件进行绘图. 以P<0.05表示差异有统计学意义.
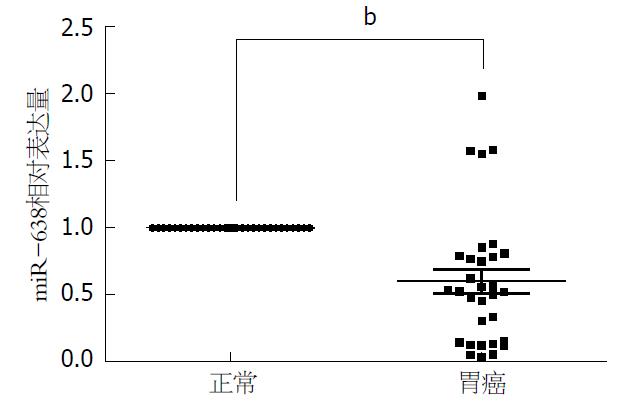
将31对标本一一对应, 分别计算出胃癌组织相对于正常对照组织的2-△△Ct值. 结果表明, 31例胃癌组织标本中仅有4例miR-638表达量高于正常组织, 仅占12.90%, 其他27例(87.10%)标本中的表达显著低于正常组织. 统计学分析表明, miR-638在胃癌及对应非癌组织的表达间具有统计学差异(P<0.01, 图1).
胃癌组织中miR-638低表达与肿瘤浸润深度有相关性(P<0.05), 但是与其他临床病理特征, 如性别、年龄、分化程度、TNM分期、淋巴结转移等均无明显相关性(P>0.05, 表2)
| 临床病理特征 | n | miR-638相对表达量 | P值 |
| 性别 | 0.482 | ||
| 男 | 26 | 0.623±0.642 | |
| 女 | 5 | 0.830±0.045 | |
| 年龄(岁) | 0.145 | ||
| <60 | 13 | 0.452±0.531 | |
| ≥60 | 18 | 0.766±0.589 | |
| 浸润深度(T) | 0.032 | ||
| T1 | 2 | 0.766±0.013 | |
| T2 | 6 | 1.248±0.519 | |
| T3 | 5 | 0.771±0.158 | |
| T4 | 18 | 0.336±0.106 | |
| 分化程度 | 0.327 | ||
| 低 | 18 | 0.813±0.685 | |
| 中 | 9 | 0.378±0.259 | |
| 高 | 4 | 0.400±0.411 | |
| TNM分期 | 0.376 | ||
| Ⅰ | 3 | 0.878±0.609 | |
| Ⅱ | 7 | 0.882±0.893 | |
| Ⅲ | 12 | 0.345±0.303 | |
| Ⅳ | 9 | 0.743±0.518 | |
| 淋巴结转移 | 0.458 | ||
| 阴性(N0) | 3 | 0.878±0.609 | |
| 阳性(N1-N3) | 28 | 0.607±0.592 |
miRNA是一种机体内源性表达的单链小分子RNA, 不编码任何蛋白质, 长度仅为21-25 nt, 具有高度保守性, 时序性和组织特异性. 成熟的miRNA能形成RNA诱导的基因沉默复合体(RNA induced silencing complex, RISC)作用于靶点mRNA, 通过对mRNA剪切或抑制其翻译过程而调控基因的表达[4]. 近年来的研究表明miRNA在各种肿瘤组织中的表达程度不同, 并且与肿瘤患者临床分期密切相关. miRNA通过调控肿瘤细胞增殖、凋亡、转移以及耐药等在肿瘤发生发展的网络调控中发挥广泛而重要的作用[5,6]. 研究[7]发现19%的miRNA所处的位置是在肿瘤中发生缺失、扩增、转位的高发区. miRNA发挥类似原癌基因或抑癌基因两种作用, 如miR-17-92发挥原癌基因的功能[8], let-7发挥抑癌基因的功能[9].
胃癌作为最常见的恶性肿瘤之一, 与其相关miRNAs已成为研究者关注的热点. 研究表明血清miR-1、miR-20a、miR-27a、miR-34、miR-423-5p表达谱异常可作为胃癌诊断与肿瘤分期进展的生物学标记[10]. 对胃癌组织标本的检测分析显示, miR-31、miR-141、miR-143、miR-145、miR-218、let-7a miRNA在癌组织中呈低表达, 可能与胃癌发生有关[11-14]; 而miR-106b-25族高表达可使胃癌对转化生长因子-β诱导的细胞周期阻滞和细胞凋亡产生抵抗[15]. Xia等[16]研究报道, miR-638在体外通过靶向调控Sp2的表达抑制胃癌细胞系AGS增殖. 近期的研究报道[17], 在肺癌组织中miR-638表达下调, miR-638可通过靶向调控SOX2抑制肺癌的侵袭和增殖. 但是miR-638在转移性黑色素瘤中高表达, 他可能通过抑制p53介导的凋亡途径来促进肿瘤发展[17]. 这些研究表明miR-638在胃癌研究中的重要意义. 本研究检测了miR-638在胃癌及其正常组织中的表达量, 发现miR-638在胃癌组织相对于正常组织的表达显著下调, 这种趋势与已有的研究报道一致, 同时这种差异表达与临床病理特征有密切相关性.
本研究利用qRT-PCR方法分析了miR-638在胃癌组织中的表达情况, 发现miR-638在胃癌中的表达较正常组织明显降低(P<0.01). 同时miR-638的低表达与肿瘤浸润深度有着密切的相关性(P<0.05). 以上结果表明, miR-638可能参与了胃癌的发生和发展过程, 然而样本数量不够多, 没有就miR-638与胃癌的病理分级、临床分期及预后情况等进行深入的分析. 但是本研究结果为我们提供了在胃癌分子机制研究中一个潜在的靶点, 下一步我们将就miR-638与其靶基因在胃癌细胞系中的效应进行深入的研究.
总之, 本研究初步证实了miR-638在胃癌患者中表达呈显著下调, 可能与胃癌的发生、发展具有密切关系, 为胃癌细胞进行miR-638的相关功能学研究及可能的信号调控通路研究提供了一定的基础, 为胃癌靶向治疗提供了新的靶点.
西安交通大学第一附属医院向本实验提供12例病例.
胃癌是世界范围内最常见的恶性肿瘤之一, 肿瘤的发生与微小RNA(microRNA, miRNA)的表达之间存在密切关系.
陈卫昌, 教授, 苏州大学附属第一医院消化内科; 张德奎, 主任医师, 兰州大学第二医院消化科
首次发现miR-638与胃癌浸润深度相关, 提示其在胃癌发生发展中的重要作用,可能作为胃癌诊断标志物以及胃癌浸润深度的一个评价指标, 为胃癌细胞进行miR-638的相关功能学研究及可能的信号调控通路研究提供了一定的基础, 为胃癌靶向治疗提供了新的靶点.
微小RNA(miRNA): 是一类广泛存在于真核生物中, 长度为21-25个核苷酸, 发挥调控作用的非编码分子.
本文探讨miR-638在胃癌中的表达及其临床意义, 属于当前胃癌研究的热点.
编辑: 于明茜 电编:闫晋利
| 1. | Arnold M, Moore SP, Hassler S, Ellison-Loschmann L, Forman D, Bray F. The burden of stomach cancer in indigenous populations: a systematic review and global assessment. Gut. 2014;63:64-71. [PubMed] [DOI] |
| 2. | He L, Hannon GJ. MicroRNAs: small RNAs with a big role in gene regulation. Nat Rev Genet. 2004;5:522-531. [PubMed] [DOI] |
| 3. | Zhao LY, Yao Y, Han J, Yang J, Wang XF, Tong DD, Song TS, Huang C, Shao Y. miR-638 suppresses cell proliferation in gastric cancer by targeting Sp2. Dig Dis Sci. 2014;59:1743-1753. [PubMed] [DOI] |
| 4. | Gregory RI, Yan KP, Amuthan G, Chendrimada T, Doratotaj B, Cooch N, Shiekhattar R. The Microprocessor complex mediates the genesis of microRNAs. Nature. 2004;432:235-240. [PubMed] [DOI] |
| 5. | Du W, Ma XL, Zhao C, Liu T, Du YL, Kong WQ, Wei BL, Yu JY, Li YY, Huang JW. Associations of single nucleotide polymorphisms in miR-146a, miR-196a, miR-149 and miR-499 with colorectal cancer susceptibility. Asian Pac J Cancer Prev. 2014;15:1047-1055. [PubMed] |
| 7. | Hu B, Ying X, Wang J, Piriyapongsa J, Jordan IK, Sheng J, Yu F, Zhao P, Li Y, Wang H. Identification of a tumor-suppressive human-specific microRNA within the FHIT tumor-suppressor gene. Cancer Res. 2014;74:2283-2294. [PubMed] [DOI] |
| 8. | Jin HY, Lai M, Xiao C. microRNA-17~92 is a powerful cancer driver and a therapeutic target. Cell Cycle. 2014;13:495-496. [PubMed] [DOI] |
| 9. | Patel K, Kollory A, Takashima A, Sarkar S, Faller DV, Ghosh SK. MicroRNA let-7 downregulates STAT3 phosphorylation in pancreatic cancer cells by increasing SOCS3 expression. Cancer Lett. 2014;347:54-64. [PubMed] [DOI] |
| 10. | Liu R, Zhang C, Hu Z, Li G, Wang C, Yang C, Huang D, Chen X, Zhang H, Zhuang R. A five-microRNA signature identified from genome-wide serum microRNA expression profiling serves as a fingerprint for gastric cancer diagnosis. Eur J Cancer. 2011;47:784-791. [PubMed] [DOI] |
| 11. | Du Y, Xu Y, Ding L, Yao H, Yu H, Zhou T, Si J. Down-regulation of miR-141 in gastric cancer and its involvement in cell growth. J Gastroenterol. 2009;44:556-561. [PubMed] [DOI] |
| 12. | Takagi T, Iio A, Nakagawa Y, Naoe T, Tanigawa N, Akao Y. Decreased expression of microRNA-143 and -145 in human gastric cancers. Oncology. 2009;77:12-21. [PubMed] [DOI] |
| 13. | Gao C, Zhang Z, Liu W, Xiao S, Gu W, Lu H. Reduced microRNA-218 expression is associated with high nuclear factor kappa B activation in gastric cancer. Cancer. 2010;116:41-49. [PubMed] [DOI] |
| 14. | Zhang Y, Guo J, Li D, Xiao B, Miao Y, Jiang Z, Zhuo H. Down-regulation of miR-31 expression in gastric cancer tissues and its clinical significance. Med Oncol. 2010;27:685-689. [PubMed] [DOI] |
| 15. | Petrocca F, Visone R, Onelli MR, Shah MH, Nicoloso MS, de Martino I, Iliopoulos D, Pilozzi E, Liu CG, Negrini M. E2F1-regulated microRNAs impair TGFbeta-dependent cell-cycle arrest and apoptosis in gastric cancer. Cancer Cell. 2008;13:272-286. [PubMed] [DOI] |
| 16. | Xia Y, Wu Y, Liu B, Wang P, Chen Y. Downregulation of miR-638 promotes invasion and proliferation by regulating SOX2 and induces EMT in NSCLC. FEBS Lett. 2014;588:2238-2245. [PubMed] [DOI] |
| 17. | Bhattacharya A, Schmitz U, Raatz Y, Schönherr M, Kottek T, Schauer M, Franz S, Saalbach A, Anderegg U, Wolkenhauer O. miR-638 promotes melanoma metastasis and protects melanoma cells from apoptosis and autophagy. Oncotarget. 2015;6:2966-2980. [PubMed] [DOI] |