修回日期: 2016-01-07
接受日期: 2016-01-19
在线出版日期: 2016-02-28
目的: 研究去甲肾上腺素各受体亚型在非酒精性脂肪性肝病(nonalcoholic fatty liver disease, NAFLD)大鼠肝组织的表达情况.
方法: 应用高脂饮食建立大鼠NAFLD模型, HE染色观察肝脏病理形态学变化, Western blot和Real-time Q-PCR检测α-AR、β1-AR、β2-AR蛋白和mRNA的表达.
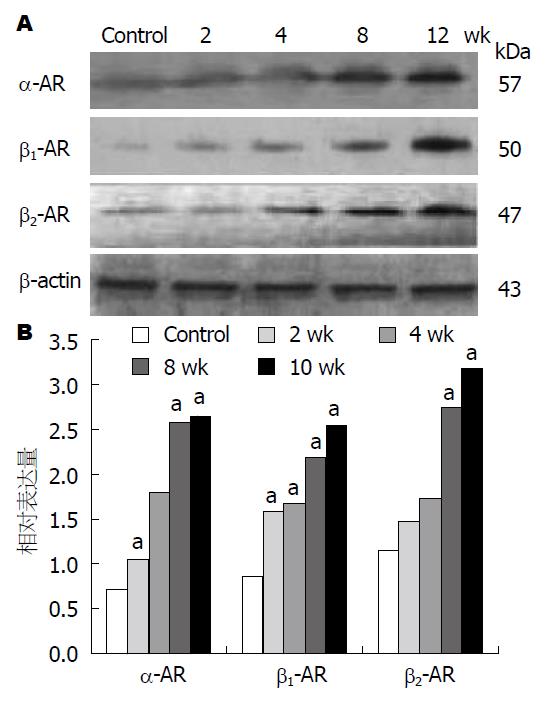
结果: HE染色显示: 大鼠NAFLD模型成功建立, 随着造模时间延长肝脏脂肪变程度逐渐加重. Western blot检测结果显示, 造模2-12 wk大鼠肝组织α-肾上腺素能受体(α-adrenergic receptor, α-AR)、β1-AR、β2-AR蛋白表达量均明显升高(P<0.05). Real-time Q-PCR结果证实, 随着NAFLD病的发展, α-AR、β1-AR、β2-AR mRNA表达均逐渐上调(P<0.01).
结论: 高脂饮食法成功建立大鼠NAFLD模型, 随着肝病进展, α-AR、β1-AR、β2-AR蛋白及mRNA含量明显增加.
核心提示: 本研究首次检测了去甲肾上腺素各受体亚型在非酒精性脂肪性肝病(nonalcoholic fatty liver disease, NAFLD)大鼠肝组织的表达. 结果证实随着疾病发展, α-AR、β1-AR、β2-AR蛋白及mRNA表达均明显增高, 提示交感神经递质确实参与了NAFLD的疾病进展.
引文著录: 刘娜, 穆华, 郑吉敏, 梁传栋. 去甲肾上腺素各受体亚型在非酒精性脂肪肝大鼠肝组织的表达. 世界华人消化杂志 2016; 24(6): 909-914
Revised: January 7, 2016
Accepted: January 19, 2016
Published online: February 28, 2016
AIM: To investigate the expression of α-adrenergic receptor (α-AR), β1-AR and β2-AR in liver tissue of nonalcoholic fatty liver disease (NAFLD) rats.
METHODS: An NAFLD model was developed by feeding a high-fat diet. HE staining was used to determine hepatic morphological changes. Western blot and real-time Q-PCR were used to measure the dynamic changes of α-AR, β1-AR, and β2-AR protein and mRNA expression, respectively, during the development process of NAFLD.
RESULTS: HE staining showed that NAFLD was induced successfully in rats. Western blot analysis showed that the protein expression of α-AR, β1-AR and β2-AR increased with the progression of NAFLD (P < 0.05). Real-time Q-PCR analysis showed that the α-AR, β1-AR and β2-AR mRNA expression increased with the progression of NAFLD, too (P < 0.01).
CONCLUSION: The expression of α-AR, β1-AR, and β2-AR increases at both protein and mRNA levels during the developmental process of NAFLD.
- Citation: Liu N, Mu H, Zheng JM, Liang CD. Expression of α-adrenergic receptor (AR), β1-AR and β2-AR in liver tissue of nonalcoholic fatty liver disease rats. Shijie Huaren Xiaohua Zazhi 2016; 24(6): 909-914
- URL: https://www.wjgnet.com/1009-3079/full/v24/i6/909.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i6.909
非酒精性脂肪性肝病(nonalcoholic fatty liver disease, NAFLD)是一类以肝实质细胞脂肪变性和脂肪贮积为特征的临床病理综合征, 目前尚缺乏防治NAFLD的有效措施[1,2]. 已有研究[3,4]结果证实, 肝硬化患者交感神经系统活性升高、循环儿茶酚胺含量增加. 但是, 关于NAFLD形成过程中, 交感神经递质去甲肾上腺素(norepinephrine, NE)各受体亚型的表达情况仍然未知. 因此, 我们应用高脂饮食建立大鼠NAFLD动物模型, 检测NE各受体亚型的表达与NAFLD发展的关系, 旨在阐明交感神经系统在NAFLD发生发展中的作用及其机制, 从而寻求有效的预防和治疗NAFLD的新策略[5].
健康♂SD大鼠50只, 清洁级, 体质量180-200 g, 由河北医科大学实验动物中心提供(医动字第04057号); 高脂饲料(88%基础饲料+2%胆固醇+10%猪油)购自河北医科大学实验动物中心. α-肾上腺素能受体(α-adrenergic receptor, α-AR)、β1-AR、β2-AR兔多克隆抗体和β-actin山羊多克隆抗体(美国Santa cruz公司); 逆转录反应体系、SYBR Green Real Master Mix、TRIzoL试剂盒(北京天根公司).
1.2.1 动物模型制作及分组: 实验大鼠随机分为5组: 正常对照组10只、模型组40只. 按清洁级大鼠的要求饲养, 自由进食水. 对照组给予基础饲料喂养; 造模组给予高脂饲料喂养[6]. 第2、4、8、12周处死大鼠做肝脏病理HE染色, 肝组织均取自肝左叶的相同部位. 采用HE染色确定模型建立情况.
1.2.2 肝组织病理学染色检查: 肝组织以4%多聚甲醛溶液固定, 石蜡包埋做成5 μm连续切片, 常规HE染色后在光学显微镜下观察肝脂肪变性和炎症程度. 肝细胞脂肪变性程度判断标准参照Diehl法[7], 炎症活动度计分标准参考Knodell提出的慢性肝炎组织学活动指数(histological activity index, HAI).
1.2.3 肝组织蛋白提取液的制备及Western blot检测: 取100 mg肝组织提取组织蛋白, 考马斯亮蓝比色法测定蛋白含量. 以8%的SDS-PAGE凝胶作为分离胶电泳, 转膜, 封闭, 分别以兔抗α-AR、β1-AR、β2-AR多克隆抗体(1:200)和山羊抗β-actin多克隆抗体(1:200)作为第一抗体反应; 辣根过氧化物酶标记的山羊抗兔IgG(1:5000)或兔抗山羊IgG(1:5000)作为第二抗体反应. 采用ECL发光剂, 当条带充分显色后压X光片, 进一步显影、定影, 结果以目的蛋白与β-actin的积分光密度值的比值表示. 密度扫描分析采用美国Kodak公司ID数码成像分析系统软件对Western印迹结果进行定量分析, 灰度值以积分光密度值(IOD)表示.
1.2.4 肝组织mRNA的提取以及实时荧光定量PCR技术: 采用TRIzoL试剂盒, 按说明一步法提取肝组织总RNA, 电泳鉴定RNA并定量, 逆转录合成cDNA; α-AR、β1-AR及β2-AR及内参照甘油醛-3-磷酸脱氢酶(glyceraldehyde phosphate dehydrogenase, GAPDH)引物参照Genbank基因序列自行设计, 由北京赛百盛基因有限公司合成. 引物设计与合成如下: α-AR(正义: 5'-ATCGTGGCCAAGAGGACC-3', 反义: 5'-TTTGGCTGCTTTCTTTTC-3', 扩增产物大小为201 bp). β1-AR(正义: 5'-ATGGGACTGCTGGTGGTGCC-3', 反义: 5'-GAAGGAGACGACGGACGAGG-3', 扩增产物大小为381 bp). β2-AR(正义: 5'-TATCGCTTCCTCTATCGTATCTTT-3', 反义: 5'-AGTTCATTTTCTTTCTCCTGCCCC-3', 扩增产物大小为543 bp). GAPDH(正义: 5'-TCCCTCAAGATTGTCAGCAA-3', 反义: 5'-AGATCCACAACGGATACATT-3', 扩增产物大小为259 bp). 在PE5700实时荧光定量PCR仪(美国ABI公司)上进行实时定量扩增. SYBR反应体系25 μL. 反应条件: 93 ℃ 5 min, 1个循环; 93 ℃ 45 s, 55 ℃ 1 min, 10个循环; 93 ℃ 30 s, 55 ℃ 45 s, 30个循环. 利用实时荧光定量PCR仪自带软件进行分析, 获得产物的Ct值. 采用相对定量2-△△Ct法比较α-AR、β1-AR及β2-AR在对照组及造模不同时间NAFLD大鼠肝组织中的表达情况.
统计学处理 计量资料数据均以mean±SD表示, 用SPSS13.0软件进行统计分析. 多组间均数差异性比较采用单因素方差分析(one-way ANOVA), 组间比较采用q检验. P<0.05为差异有统计学意义.
对照组肝脏肉眼观察呈鲜红色, 边缘锐利, 表面光滑. 模型组肉眼见肝脏体积增大, 边缘变钝, 切面油腻状. 正常对照组大鼠肝组织切片HE染色未见明显异常. 模型组大鼠肝组织切片可见弥漫性肝细胞脂肪变性, 主要为大泡性脂肪变性, 也有部分小泡性脂肪变性, 同时肝小叶内和汇管区有以大量单个核细胞为主的炎性细胞浸润, 以小叶内炎症为主, 部分大鼠肝组织小叶内坏死灶融合成片, 与对照型组相比有统计学意义(P<0.05, 表1).
Western blot分析显示, 分别在大约57、50、47 kDa位置出现α-AR、β1-AR、β2-AR特异性条带, 在43 kDa位置可见β-actin条带. 对照组有少量蛋白表达, 随着NAFLD疾病进展其表达逐渐增加, 造模2-12 wk大鼠肝组织α-AR、β1-AR、β2-AR蛋白含量逐渐升高(P<0.05)(图1).
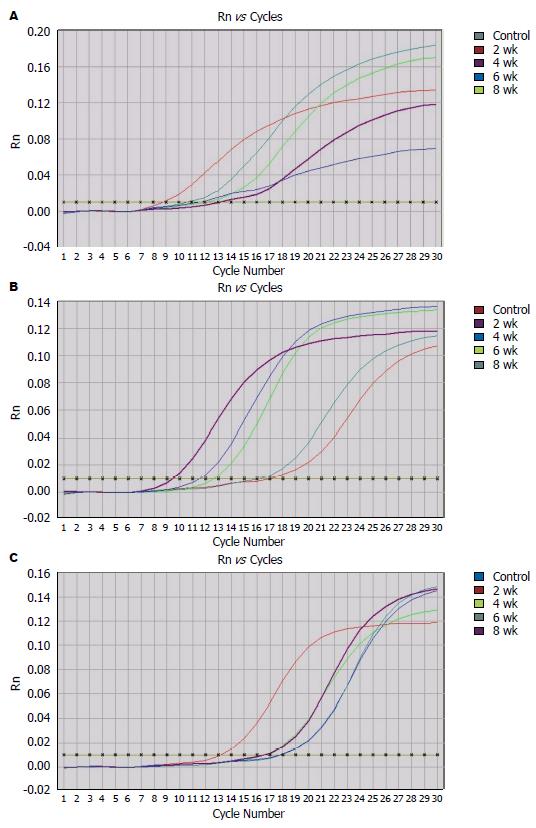
在实时荧光定量PCR过程中, 以荧光值和循环数作图, 自动得到mRNA水平扩增曲线, 可见各样品的重复性好, 扩增效率基本一致. 应用相对定量2-△△Ct法比较α-AR、β1-AR、β2-AR基因在各组大鼠肝组织中的表达. 结果证实, 随着NAFLD的疾病发展α-AR、β1-AR、β2-AR mRNA表达逐渐上调(P<0.01)(表2, 图2).
NAFLD是指除外酒精和其他明确的损肝因素所致的, 以弥漫性肝细胞大泡性脂肪变为主要特征的临床病理综合征[8,9]. 近年来, 随着人民生活水平的提高, 饮食结构的改变, NAFLD的发病率呈明显上升趋势, 已经逐渐成为慢性肝病最主要的病因[10,11]. 大量研究[12-14]显示交感神经系统参与了肝纤维化的发生和发展, 交感神经系统的激活以及循环儿茶酚胺含量的提高可以加重肝脏的损伤, 促进肝纤维化的进程. 同时, 交感神经系统的活化也通过NE、肾上腺素(epinephrine, EPI)、神经肽Y等神经递质对肝星状细胞(hepatic stellate cell, HSC)生物学行为的调节促进了NAFLD的发生和发展过程[15,16]. 已有研究发现, NAFLD患者血液循环中NE、EPI、神经肽Y浓度均增高, 活化的HSC表达功能性α/β肾上腺素受体以及神经肽Y受体明显增加. 体外培养的HSC可以合成和释放NE、EPI, 而外源性NE、EPI主要通过p38、PI3K和MEK信号通路对HSC具有促增殖作用, 并呈剂量依赖性. 肾上腺素受体阻滞剂可以抑制HSC的活化, 从而为NAFLD的治疗提供新的方法[17]. 段瑞娴等[18]研究发现, 血吸虫病肝纤维化小鼠肝组织α1A-AR和β2-AR表达增高, 同时, 血浆中交感神经递质NE及其前体物质多巴胺的含量明显升高, 提示交感神经递质及其受体表达的上调可能是血吸虫肝纤维化发展的作用机制之一. McKee等[19]研究发现, NAFLD小鼠肝细胞可以表达α-AR和β-AR, α1-AR阻滞剂哌唑嗪可以减轻非酒精性脂肪性肝炎小鼠的肝损伤, 可能为NAFLD的治疗提供新的途径; 而β-AR阻滞剂普萘洛尔可以使非酒精性脂肪性肝炎小鼠的转氨酶升高, 肝脏坏死评分增加, 导致肝细胞释放乳酸脱氢酶、乙型跨膜糖蛋白以及TNF-α增加, 上调Fas受体以及Caspase8蛋白, 激活肝细胞凋亡通路, 从而加重肝脏的损伤.
在本实验中我们发现, NAFLD大鼠肝组织中NE各受体的表达均呈增高趋势, α-AR、β1-AR、β2-AR蛋白及mRNA含量明显增加, 这与我们前期研究肝纤维化过程中去甲肾上腺素各受体亚型的表达升高相一致[20]. NAFLD的发展过程中, 肝组织各受体表达均增加, 并且具有时间依赖性, 充分说明了交感神经系统在NAFLD疾病进展过程中发挥了重要作用. 但是, 交感神经系统的活化, 交感神经递质的释放以及受体表达的增加具体的机制以及相互作用仍然需要进一步的探讨, 从而为寻求有效的预防和治疗NAFLD提供新的理论根据[21].
非酒精性脂肪性肝病(nonalcoholic fatty liver disease, NAFLD)是一类以肝实质细胞脂肪变性和脂肪贮积为特征的临床病理综合征. 研究证实, 肝硬化患者交感神经系统活性升高、循环儿茶酚胺含量增加. 但是, 随着疾病进展交感神经递质去甲肾上腺素(norepinephrine, NE)各受体亚型的表达情况仍然未知.
张炜, 副教授, 主任医师, 江苏大学附属医院消化科
交感神经系统参与了肝纤维化的发生和发展, 交感神经系统的激活以及循环儿茶酚胺含量的提高可以加重肝脏的损伤, 促进肝纤维化的进程. 但是, 交感神经递质NE各受体亚型在NAFLD进展过程的表达情况仍不明确.
NAFLD患者血液循环中NE浓度增高, 活化的HSC表达功能性α/β肾上腺素受体增加. NAFLD小鼠肝细胞可以表达α-AR和β-AR; α1-AR阻滞剂哌唑嗪可以减轻NAFLD小鼠的肝损伤; 而β-AR阻滞剂普萘洛尔可以使NAFLD小鼠的转氨酶升高, 从而加重肝脏的损伤.
本研究首次证实NAFLD大鼠肝组织中NE各受体的表达均呈增高趋势, 并且具有时间依赖性, 充分说明了交感神经系统在NAFLD疾病进展过程中发挥了重要作用.
本研究发现, NAFLD的发展过程中, 肝组织各受体表达均增加, 说明交感神经系统在肝病进展中发挥了重要作用. 从而为寻求有效的预防和治疗NAFLD提供新的理论根据.
本文研究方向具有创新性、研究方法和结论科学、文章撰写具有可读性, 能较好地反映我国NAFLD基础研究的先进水平.
编辑: 郭鹏 电编:闫晋利
| 1. | Haas JT, Francque S, Staels B. Pathophysiology and mechanisms of nonalcoholic fatty liver disease. Annu Rev Physiol. 2015; Nov 30. [Epub ahead of print]. [PubMed] |
| 2. | Haga Y, Kanda T, Sasaki R, Nakamura M, Nakamoto S, Yokosuka O. Nonalcoholic fatty liver disease and hepatic cirrhosis: Comparison with viral hepatitis-associated steatosis. World J Gastroenterol. 2015;21:12989-12995. [PubMed] [DOI] |
| 3. | Sigala B, McKee C, Soeda J, Pazienza V, Morgan M, Lin CI, Selden C, Vander Borght S, Mazzoccoli G, Roskams T. Sympathetic nervous system catecholamines and neuropeptide Y neurotransmitters are upregulated in human NAFLD and modulate the fibrogenic function of hepatic stellate cells. PLoS One. 2013;8:e72928. [PubMed] [DOI] |
| 5. | Yuan L, Bambha K. Bile acid receptors and nonalcoholic fatty liver disease. World J Hepatol. 2015;7:2811-2818. [PubMed] [DOI] |
| 8. | Stål P. Liver fibrosis in non-alcoholic fatty liver disease - diagnostic challenge with prognostic significance. World J Gastroenterol. 2015;21:11077-11087. [PubMed] [DOI] |
| 9. | Liu H, Lu HY. Nonalcoholic fatty liver disease and cardiovascular disease. World J Gastroenterol. 2014;20:8407-8415. [PubMed] [DOI] |
| 10. | Neuman MG, Cohen LB, Nanau RM. Biomarkers in nonalcoholic fatty liver disease. Can J Gastroenterol Hepatol. 2014;28:607-618. [PubMed] |
| 11. | Karim MF, Al-Mahtab M, Rahman S, Debnath CR. Non-alcoholic fatty liver disease (NAFLD) - A review. Mymensingh Med J. 2015;24:873-880. [PubMed] |
| 12. | Oben JA, Diehl AM. Sympathetic nervous system regulation of liver repair. Anat Rec A Discov Mol Cell Evol Biol. 2004;280:874-883. [PubMed] |
| 13. | Newton JL, Pairman J, Wilton K, Jones DE, Day C. Fatigue and autonomic dysfunction in non-alcoholic fatty liver disease. Clin Auton Res. 2009;19:319-326. [PubMed] [DOI] |
| 15. | Newton JL. Systemic symptoms in non-alcoholic fatty liver disease. Dig Dis. 2010;28:214-219. [PubMed] [DOI] |
| 16. | Armstrong MJ, Hazlehurst JM, Hull D, Guo K, Borrows S, Yu J, Gough SC, Newsome PN, Tomlinson JW. Abdominal subcutaneous adipose tissue insulin resistance and lipolysis in patients with non-alcoholic steatohepatitis. Diabetes Obes Metab. 2014;16:651-660. [PubMed] [DOI] |
| 17. | Sancho-Bru P, Bataller R, Colmenero J, Gasull X, Moreno M, Arroyo V, Brenner DA, Ginès P. Norepinephrine induces calcium spikes and proinflammatory actions in human hepatic stellate cells. Am J Physiol Gastrointest Liver Physiol. 2006;291:G877-G884. [PubMed] |
| 19. | McKee C, Soeda J, Asilmaz E, Sigalla B, Morgan M, Sinelli N, Roskams T, Oben JA. Propranolol, a β-adrenoceptor antagonist, worsens liver injury in a model of non-alcoholic steatohepatitis. Biochem Biophys Res Commun. 2013;437:597-602. [PubMed] [DOI] |