修回日期: 2015-12-27
接受日期: 2016-01-06
在线出版日期: 2016-02-18
目的: 随着各种消化内镜和薄层计算机断层扫描(computed tomography, CT)等技术的临床广泛应用, 消化道黏膜下病变(submucosal lesion, SML)的检出率越来越高. 针对SML治疗的内镜黏膜下层剥离术(endoscopic submucosal dissection, ESD)、外科手术数量越来越多. 对于SML临床转归、ESD或外科手术的必要性及患者是否受益存在争论. 本研究主要针对上消化道黏膜下病变的性质、生长速度、恶变可能及ESD或外科手术的必要性、疗效.
方法: 回顾性分析安徽医科大学附属安徽省立医院2004-01/2014-12经超声内镜(endoscopic ultrasonography, EUS)诊断为消化道SML的1915例患者的临床资料. 运用超声内镜观察病变部位(食管、胃), 病变大小, 回声表现、来源等特征. 根据黏膜下病变性质、大小、患者意愿等选择不同治疗方案. 包括EUS的随访观察、内镜下治疗[ESD、内镜下黏膜剥离切除术、内镜黏膜下挖除术(endoscopic submucosalexcavation, ESE)、内镜经黏膜下隧道肿瘤切除术]和外科手术(开放手术、胸腔镜腹腔镜)(内镜或外科手术的指证是病灶短期内明显增大或相关内镜或影像评估怀疑有恶变的可能或患者主观要求内镜或手术切除). 随访记录病灶的大小变化、切除病变的性质、大小、来源及并发症发生情况(出血、穿孔)、中转手术情况.
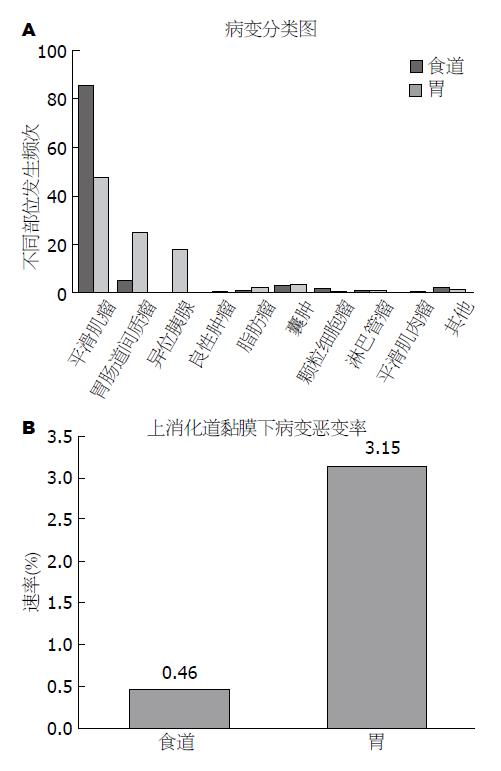
结果: 超声随访1135例SML患者(食道687例, 胃448例), 平均年龄50.7岁±10.3岁, 男女比例为1.16:1; 食道SML初始病灶大小为: 0.82 cm±0.24 cm, 共计18例病灶随访过程中明显增大包括5例显著增大发生在6 mo内病理结果诊断为3例良性病变(固有肌层平滑肌瘤1例, 囊肿2例)及两例恶性病变(平滑肌肉瘤1例, 恶性颗粒细胞瘤1例). 胃SML初始病灶大小为: 1.31 cm±0.44 cm, 16例病灶明显增大, 包括10例病灶明显增大, 病理诊断为2例平滑肌瘤病灶增大发生于12 mo内, 8例间质瘤. 病灶增大均在6 mo内发生. 内镜下手术患者668例(食道412例, 胃256例), 6例(4例ESE组, 2例ESD组)于术中发生穿孔, 2例(均为ESE组)于术中发生出血, 2例病变未完整剥离, 内镜下治疗成功率为98.5%. 外科手术患者112例(食道19例, 胃93例)两例(GIST及食道平滑肌肉瘤)发生迟发性出血, 手术成功率为98.2%. 食道SML中, 平滑肌瘤占86.1%, GIST占4.9%, 囊肿占3%. 胃SML中, GIST占48.1%, 平滑肌瘤占24.9%, 异位胰腺占17.3%, 囊肿占3.4%, 脂肪瘤占2.6%.
结论: 不论食管还是胃部黏膜下瘤, 病灶的显著增大多发生于初次随访后6 mo内, 6 mo后变化不明显. 食管黏膜下肿瘤以平滑肌瘤为主, 间质瘤少见, 生长迅速的病灶及恶性病变罕见, 食管病变无论外科手术或ESD术创伤及经济代价较大, 不建议常规施行. 胃部黏膜下病灶以间质瘤多见, 迅速生长病灶较食管增多, 建议12 mo内随访期间对生长迅速病灶施行ESD或外科手术.
核心提示: 本文阐述了超声内镜检查, 在上消化道黏膜下病变(submucosal lesion, SML)病变生长速度、病变性质、ESD或外科手术必要性及疗效中的重要的位置, 为SML治疗原则提供一定的临床指导原则及价值, 为对SML诊治提供了良好的理论基础.
引文著录: 常琳琳, 张开光, 张明黎, 宋继中, 王业涛, 王巧民, 解丽, 吴正祥. 上消化道黏膜下肿瘤的诊治和随访. 世界华人消化杂志 2016; 24(5): 765-774
Revised: December 27, 2015
Accepted: January 6, 2016
Published online: February 18, 2016
AIM: To explore the nature, growth, and malignant transformation of upper gastrointestinal submucosal lesions (SMLs), and evaluate the clinical efficacy, necessity and safety of surgery or endoscopic therapy for SMLs.
METHODS: We retrospectively collected 1915 cases of upper gastrointestinal submucous lesions, which were evaluated by endoscopic ultrasonography from January 2014 to December 2014 at our department. This diagnostic modality provided features about lesion location (esophagus and stomach), size, echo performance, layer of origin, etc. Different therapeutic methods were chosen according to the size, origin, and location of SMLs as well as patient's preferences. Clinical treatments included follow-up, endoscopic therapy (endoscopic snare resection, endoscopic resection, endoscopic submucosal resection, endoscopic submucosal dissection (ESD), endoscopic submucosal excavation (ESE), submucosal tunneling endoscopic resection, etc.), and surgery (open surgery, laparoscopy, and thoracoscopy). Endoscopic or surgical treatment of SMLs was performed when lesion size was significantly increased or suspected to have malignant transformation. Successful cases, size of the mass and layer of origin (mucosa layer, muscularis mucosa layer, submucosa layer, and serosal layer), complications (bleeding, perforation) and conversion surgery or not were recorded.
RESULTS: In 1135 cases followed by EUS, median age was 50.7 years ± 10.3 years (range, 19-78 years), and male/female ratio was 1.16. There were 687 esophageal SMLs and 448 gastric SMLs followed by regular endoscopy (range, 3-60 mo). Esophageal cases at initial measurement had a mean size of 0.82 cm ± 0.24 cm, and gastric cases had an initial mean size of 1.31 cm ± 0.44 cm. Of the followed cases of esophagus SMLs, 18 showed an obviously increased size (>2 cm), including 5 significantly increased cases (>3 cm) over a period of 6 mo and 13 moderately increased cases (>2 cm and <3 cm) during 12 mo. Surgical resection was performed in 5 lesions ≥3 cm in size, which were diagnosed as benign lesions in 3 (one leiomyoma and two cysts) and malignant lesions in 2 (1 leiomyosarcoma and 1 malignant granular cell tumor). Of the followed cases of gastric SMLs, 16 had an obviously increased size (>2 cm), including 10 significantly increased cases (>3 cm). Traditional surgery and endoscopic therapy were performed in 10 lesions ≥3 cm in size, which were diagnosed as gastrointestinal stromal tumors (GISTs) in 8 and leiomyomas in 2. A total of 780 cases underwent endoscopic or surgical therapy. Of 112 cases (19 esophageal cases and 93 gastric cases) treated by surgery, 2 (GIST and leiomyosarcoma) developed delayed bleeding, and the success rate of surgical treatment was 98.2%. Of 668 cases who underwent endoscopic therapy, 6 (4 in ESE group and 2 in ESD group) ended up with perforation and 4 of them (4 in ESE group) were converted to surgery; 2 (both in ESE group) developed intraoperative bleeding, which was managed by endoscopic spraying of drugs, electric coagulation and clips to achieve hemostasis; 2 cases in ESE group had failed dissection and then followed by EUS. The success rate of endoscopic therapy was 98.5%. Of 431 esophageal SMLs, there were 371 (86.08%) leiomyomas, 21 (4.87%) GISTs, and 13 (3.02%) cysts. Of 349 gastric SMLs, there were 168 (48.13%) GISTs, 87 (24.92%) leiomyomas, and 60 (17.91%) cases of ectopic pancreas.
CONCLUSION: No matter where the lesion is located, the esophagus or stomach, lesion size significantly increased over a period of 6 mo after initial measurement. However, few further change were observed in size, shape and EUS finding such as echo pattern or regularity of the outer margin over a period of 6-60 mo. Leiomyoma is the most common gastrointestinal SML in the esophagus, while GISTs are common in the stomach. Leiomyoma lesions rarely showed significant change as shown by endoscopic examination. Excessive medical therapy involves known issues associated with cost-effectiveness, patient compliance and risk of complications, and conservative treatment with regular clinical follow-up is recommended.
- Citation: Chang LL, Zhang KG, Zhang ML, Song JZ, Wang YT, Wang QM, Xie L, Wu ZX. Therapy and follow-up of upper gastrointestinal subepithelial lesions. Shijie Huaren Xiaohua Zazhi 2016; 24(5): 765-774
- URL: https://www.wjgnet.com/1009-3079/full/v24/i5/765.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i5.765
上消化道黏膜下病变(submucosal lesion, SML)指一类表面被正常黏膜上皮所覆盖的隆起型消化道病变. 目前报道的有关SML的发病率由0.3%-1.0%不等[1,2]. 大多数SML为良性病变, 如脂肪瘤、淋巴瘤、异位胰腺、神经鞘瘤等, 少数为恶性病变, 如癌、淋巴瘤及潜在恶性病变的GIST[3]. 黏膜下病变在白光内镜下活检几乎不能判断肿瘤性质. 内镜超声检查术(endoscopic ultrasonography, EUS)等大大提高了SML的检出率并提高了SML的诊断水平[4,5]. 然而单纯的超声内镜检查难以准确判病灶的性质和具有潜在恶变的概率, 不可避免带来了发现SML即设法切除的倾向, 尤其是内镜下以内镜黏膜下层剥离术(endoscopic submucosal dissection, ESD)为代表的技术的进步, 导致部分患者过度医疗的问题. 针对该问题, 我们从2004年即开始开展超声内镜下的SML的随访研究, 旨在研究上消化道黏膜下病变的性质、生长速度、恶变可能及ESD或外科手术的必要性.
选取安徽省立医院2004-01/2014-12收治的1915例上消化道SML患者作为研究对象, 男性1028例, 女性887例, 男女比例1.16:1, 平均年龄为50.7岁±5.6岁(12-78岁). 其中超声随访患者1135例(食道: 687例, 胃: 448例), 内镜下黏膜剥离切除术(endoscopic mucosal resection, EMR)、ESD、内镜黏膜下挖除术(endoscopic submucosal excavation, ESE)及外科手术患者780例. 排除患者: 心肺功能不全不能耐受超声内镜随访检查患者、不能耐受气管插管下麻醉及存在凝血障碍者. 术前需与患者共同商定治疗方式, 充分告知内镜下治疗相关并发症风险, 如气胸皮下气肿大出血, 及必要时外科手术治疗的可能性. 详细记录患者的基本信息(姓名、年龄、性别、联系方式等)、超声内镜检查及后续随访结果、活检信息、治疗过程(外科手术或内镜治疗)、术后病理. 本回顾性研究经本地区伦理委员会批准所有患者均签署知情同意书. 使用型号为EU-M2000的内镜超声系统. 超声探头为Olympus UM-2R和UM-3R, 频率分别为12 MHz和20 MHz.
1.2.1 超声内镜随访检查方法: 详细记录病灶的超声图像特征: 病变的部位、大小、来源层次及边界等, 并得出病变的初步诊断. 定期进行超声内镜随访3-60 mo, 随访期限按最后一次超声内镜检查时间计算, 是否施行内镜或外科手术切除术取决于病灶变化以及患者强烈意愿.
1.2.2 治疗: 外科及内镜下手术患者共780例: 内镜下手术患者668例(食道412例, 胃256例), 外科手术患者112例(食道19例, 胃93例). 外科手术患者112例(食道19例, 胃93例). 除2例(GIST及食道平滑肌肉瘤)发生迟发性出血外, 其余病灶均成功予以切除. 251例SML在EUS检查后施行EMR(食管: 177例, 胃: 74例)病灶来源于黏膜肌层及黏膜下层, 均无并发症. 138例施行ESE, 包括食管: 103例, 胃: 35例, 来源于黏膜肌层及黏膜下层. 142例施行ESD组(食管: 85例, 胃: 57例)成功实施140例, 位于胃固有基层的2例SML出现术中穿孔, 所有穿孔患者用钛夹缝合, 经禁食、补液、抗生素保守治疗成功, 无需外科手术治疗. 39例施行内镜经黏膜下隧道肿瘤切除术(submucosal tunnel endoscopic resection, STER)食管: 16例, 胃: 23例, 来源于黏膜下层及固有肌层.
1.2.3 术后标本处理及病理检查: 固定标本送病理检查. 常规石蜡包埋切片, HE染色, 随后免疫组织化学. 上消化道SML内镜下治疗患者术后半卧位, 术后禁食、胃肠减压2-3 d, 严密观察生命征, 注意观察有无出血、穿孔等并发症. 常规使用质子泵抑制剂, 酌情使用抗生素.
统计学处理 采用统计软件SSPS19.0软件进行数据处理. 数值变量采用mean±SD表示. 随访情况中增长率之间比较用χ2检验, P<0.05为差异有统计学意义.
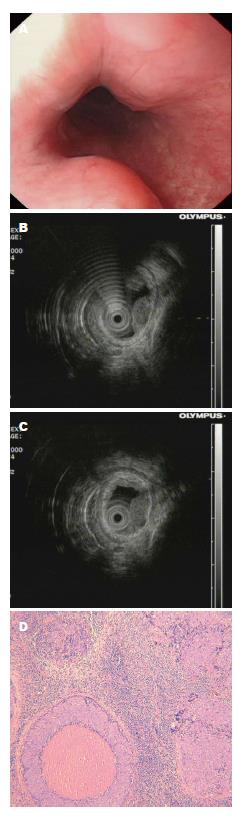
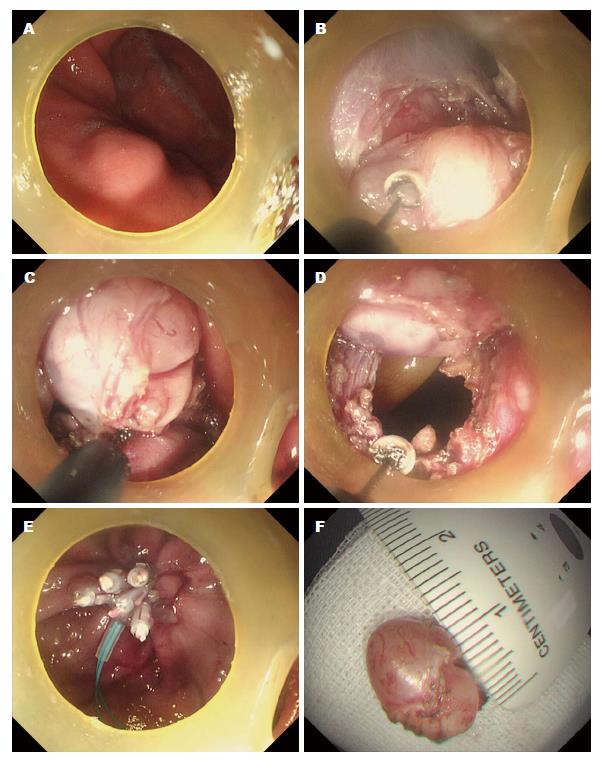
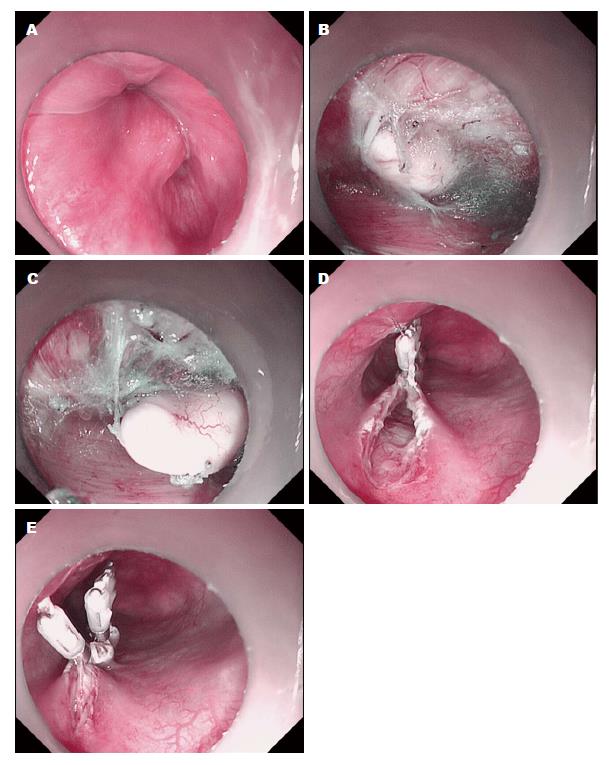
外科手术患者112例(食道19例, 胃93例), 肿瘤平均大小4.55 cm±0.70 cm(2.0-7.0 cm). 除2例(GIST及食道平滑肌肉瘤)发生迟发性出血外, 其余病灶均成功予以切除. 总体而言, 外科手术成功率为98.2%. 251例SML在EUS检查后施行EMR(食管: 177例, 胃: 74例)病灶来源于黏膜肌层及黏膜下层, 均无并发症. 术后随访未发现病灶残留(图1). 成功率为100%. 138例施行ESE, 包括食管: 103例, 胃: 35例, 来源于黏膜肌层及黏膜下层, 成功实施130例, 其余4例因术中穿孔, 手术失败转外科手术, 2例病变未完整剥离, 与患者沟通建议外科手术治疗, 患者拒绝, 选择随访. 2例出现出血, 给予内镜下喷洒止血药物、电凝、金属夹夹闭止血, 其余病灶均成功切除, 未出现相关并发症. ESE组成功率为94.2%, 穿孔率为2.9%, 出血率为1.4%. 142例施行ESD组(食管: 85例, 胃: 57例)成功实施140例, 位于胃固有基层的2例SML出现术中穿孔, 所有穿孔患者用钛夹缝合, 经禁食、补液、抗生素保守治疗成功, 无需外科手术治疗. 其余病灶均无穿孔及迟发性出血(图2). ESD组成功率为98.6%, 穿孔率为1.4%. 39例施行内镜经黏膜下隧道肿瘤切除术(submucosal tunnel endoscopic resection, STER)食管: 16例, 胃: 23例, 来源于黏膜下层及固有肌层, 无并发症, 成功率为100%(图3).
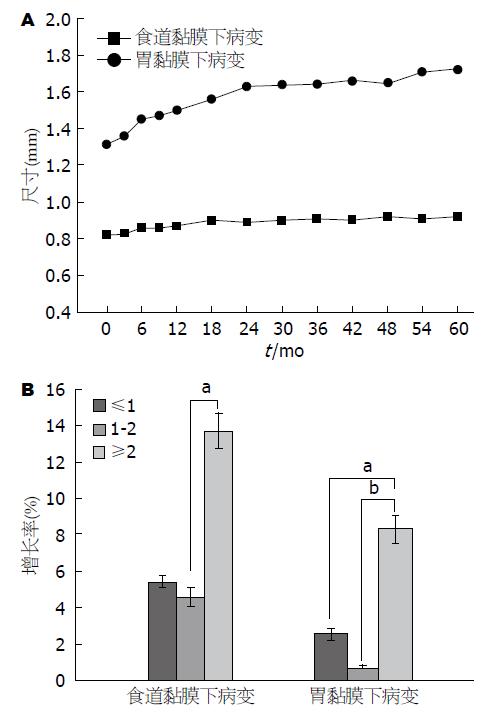
超声共随访1135例上消化道SML患者, 其中食道SML患者687例、胃SML患者448例. 完成复查的患者例数和检查时的病灶最大直径如表1所示. 我们分别根据初始病灶大小对完成随访60 mo内的393例食道SML及253例胃SML进行分组, 肿瘤大小范围在0.4-3.5 cm之间, 分为: ≤1 cm组, 1-2 cm组, >2 cm组. 胃253例SML病变中, ≤1 cm组92例, 1-2 cm组90例, ≥2 cm组71例. 食道393例SML病变中, ≤1 cm组157例, 1-2 cm组132例, ≥2 cm组104例. 完成随访60 mo的患者, 胃SML病变患者肿瘤总体增长率为7.1%(18/253), 分别与≤1 cm组、1-2 cm组增长率进行比较, 与1-2 cm组之间差异有统计学意义(P = 0.028). 食道SML病变患者肿瘤总体增长率为3.3%(13/393), 略低于胃SML病变患者总体增长率. 初始病变大小≥2 cm组的SML病变增长率均显著高于≤1 cm组、1-2 cm组增长率(P = 0.03、P = 0.008)(表2, 图4).
| 检查时间 | 病灶最大径(cm) | 完成(n) | ||
| 食道SML | 胃SML | 食道SML | 胃SML | |
| 第1次检查 | 0.82±0.24 | 1.31±0.44 | ||
| 复查时间(mo) | ||||
| 3 | 0.83±0.27 | 1.36±0.47 | 687 | 448 |
| 6 | 0.86±0.30 | 1.45±0.45 | 676 | 432 |
| 9 | 0.86±0.32 | 1.47±0.42 | 655 | 420 |
| 12 | 0.87±0.35 | 1.50±0.48 | 643 | 411 |
| 18 | 0.90±0.36 | 1.56±0.52 | 620 | 403 |
| 24 | 0.89±0.35 | 1.63±0.55 | 588 | 385 |
| 30 | 0.90±0.39 | 1.64±0.59 | 577 | 371 |
| 36 | 0.91±0.44 | 1.64±0.60 | 559 | 359 |
| 42 | 0.90±0.41 | 1.66±0.61 | 501 | 326 |
| 48 | 0.92±0.45 | 1.65±0.65 | 465 | 303 |
| 54 | 0.91±0.44 | 1.71±0.72 | 427 | 275 |
| 60 | 0.92±0.47 | 1.72±0.83 | 393 | 253 |
| 肿瘤大小(cm) | n | 复查时间(mo) | 合计 | 肿瘤增长率(%) | |||||
| 6 | 12 | 24 | 36 | 48 | 60 | ||||
| ≤1 | 194/87 | 3/4 | 1/1 | 0/0 | 1/0 | 0/0 | 0/0 | 5/5 | 1.5/5.7 |
| 1-2 | 115/120 | 0/4 | 1/1 | 0/0 | 0/0 | 0/1 | 0/0 | 1/6 | 0.8/5.0 |
| ≥2 | 84/46 | 3/4 | 3/2 | 0/0 | 1/0 | 0/0 | 0/0 | 7/7 | 8.3/15.2 |
| 合计 | 393/253 | 6/12 | 5/4 | 0/0 | 2/0 | 0/1 | 0/0 | 13/18 | 3.3/7.1 |
外科及内镜下手术共780例(食道431例, 胃349例), 其中食道SML平滑肌瘤371例(86.08%)、GIST21例(4.87%)、囊肿13例(3.02%); 胃SML GIST168例(48.13%)、平滑肌瘤87例(24.92%)、异位胰腺60例(17.19%). 完整完成60 mo超声内镜下随访的393例食道SML患者中, 随访期间直径明显增大(>2 cm)占18例, 显著增大占5例(>3 cm). 5例超过3cm病例均接受外科手术, 良性病变3例(固有肌层平滑肌瘤1例, 囊肿2例), 病变生长均发生在12 mo内; 恶性病变2例(基底样鳞状细胞癌2例), 快速增大在6 mo内发生. 胃349例SML患者中, 16例随访期间直径明显增大(>2 cm), 其中显著增大10例(>3 cm), 2例平滑肌瘤病变生长发生在12 mo内, 8例间质瘤快速增大在6 mo内发生. 10例超过3 cm病例均接受外科手术和内镜下ESD术, 其中间质瘤8例, 固有肌层平滑肌瘤2例. 外科及内镜下手术治疗的食道及胃SML中, 食道恶性病变共2例(基底样鳞状细胞癌2例), 恶变率为0.46%, 胃恶性病变共11例(平滑肌肉瘤1例, 间质瘤8例, 脂肪肉瘤1例, 淋巴瘤1例, 恶变率为3.15%(图5).
SML指一类表面被正常黏膜上皮所覆盖的隆起型消化道病变, 又称为上皮下病变. 随着各种消化内镜和薄层计算机断层扫描(computed tomography, CT)等技术的临床广泛应用, SML的检出率大量增加. 随之针对SML治疗的ESD、外科手术数量越来越多. SML临床转归是什么, ESD或外科手术是否必要是存在争议的. 因此对SML转归和随访研究是有价值的.
超声内镜由于具有较高的敏感性、特异性成为目前SML最常用的检查方法[6,7], 因此成为随访研究较好的工具. 可以清晰地观察病变的大小、边界、回声特性及起源, 毗邻淋巴结的情况, 并区分壁内及壁外的病变. 然而EUS并不能完全准确诊断SML的病变性质. Seo等[8]在对超声内镜准确率的研究中, 选取胃SML226例患者进行超声内镜检查, 超声内镜对GIST、异位胰腺、平滑肌瘤脂肪瘤的敏感度和特异度分别为: 75.8% vs 85.4%、84.6% vs 73.1%、75.9% vs 99.5%、91.7% vs 96.7%. 另由EUS发展而来的EUS-FNA同样存在取材不充分, 免疫组织化学受限、无法计算病变的有丝分裂, 进一步的鉴别诊断SML性质难以取得令人满意的结果[9]. 相关学者报道[10]其诊断率由34%-80%不等. 超声引导下切割针穿刺活检作为一项新兴技术近年来逐步发展应用, EUS-TCB能同时获得充足的细胞学及病理学样本. 尤其对于胰腺及淋巴转移的相关肿瘤诊断具有前景意义. 然而, 对于如类癌和间质瘤等具有恶性或潜在恶性、病灶较小的SML, 即使是EUS-FNA和EUS-TCB等先进技术也很难获得足够组织, 以及无法计算病变的有丝分裂以明确SML性质的弊端, 其诊断效力有待更大量的临床研究探讨证实. 除此之外, 上消化道SML具有不稳定的生物学特征, 即使组织病理学诊断为良性, 也可能只是暂时性的. 因此SML患者需要制定进一步的临床管理方案.
目前, 国内外对上消化道SML如何选择最佳的治疗决策, 尚未形成完全统一的意见. 美国胃肠病协会制定的标准, 直径<3 cm的消化道黏膜下肿瘤无需治疗, 只需定期行内镜或超声内镜随访即可[11].同样的, 美国国家癌症综合网络指南推荐对于GIST<2 cm且不具有超声高风险特征的病变内镜监督随访是临床管理的有效手段[12]. 根据本资料相关数据, 我们认为, 食管黏膜下病变以平滑肌瘤为主, 明显生长及恶性病变相对罕见, 本资料仅2例食道恶性病变(基底样鳞状细胞癌), 其快速增大均在6 mo内发生, 平均直径为3.8 cm. 仔细研究可发现, 普通白光内镜下虽表现为黏膜下病变, 但超声内镜可见病灶表现为低回声, 黏膜上皮和黏膜肌层无分界, 该病灶并非明确来源于黏膜肌层, 而是可能来源黏膜上皮层. 因此黏膜下病灶若来源黏膜上皮或固有层、与黏膜肌层无关、短期明显增大, 则应警惕恶性可能. 除此之外食道SML病灶无明显恶性倾向. 同样的, 对于直径较小的胃SML病变, 大多数患者在随访中肿瘤的大小及内镜下特征均无明显改变, 而且随着随访时间的延长, 肿瘤也无明显增长, 可选择定期随访. 有研究[13]表明>3 cm的GIST恶性潜能较高, 应采取外科或内镜切除. Bruno等[14]随访了49例EUS诊断为GIST、最长径<3 cm的患者, 平均随访30 mo, 患者的肿瘤增长率分别为10%. Lachter等[15]随访了100例经细胞学或组织学诊断为GIST的患者, 发现肿瘤>1.7 cm的患者中肿瘤增大更常见. 建议对于>1.7 cm的GIST予以EUS的随访和更积极的治疗. 我们建议对于初始病灶≥2 cm的SML患者, 初次随访时间应在6 mo内进行, 以后则根据病灶特征变化灵活调整随访时间, 以半年至1年随访间期为宜, 对于病变≥2 cm, 尤其超声内镜下有恶性病变表现的患者, 应密切超声内镜随访, 进一步制定临床管理方案, 选择合理治疗术式. 而如何选择又是近年来具有争议的焦点问题.
SML的治疗经历了传统开放手术-腔镜技术-内镜下手术的过程. 以往, 开放性外科手术是传统治疗SML的首选方案, 但因其具有高侵入性, 且不可避免存在相关并发症, 如迟发性出血, 胃食管返流, 或是吻合口狭窄等. 在本资料1915例上消化道SML患者中, 外科手术患者112例(食道19例、胃93例), 2.0-7.0 cm, 除2例(GIST及食道平滑肌肉瘤)发生迟发性出血外, 其余病灶均成功予以切除, 切除病变基底及边缘未见肿物残留, 且未见肿瘤复发. 成功率较高(98.2%). 考虑术前进行详细的病情了解包括患者既往病史、辅助检查资料、患者及家属的积极配合、医务人员丰富的操作经验等都是手术成功率的重要保证. 内镜治疗的范围在不断拓宽, 内镜治疗的水平也在不断提高, 不仅达到与外科手术相同的效果, 更具有操作时间短, 并发症风险低, 相对短的住院时间、及较少的手术开销的优势. 常见方法有EMR、ESD. 内镜下治疗对于消化系SML的价值已经得到了认可, 多数研究报道[13]证实其具有较高的安全及可靠性本资料中分别对251例SML施行EMR, 均无并发症, 术后随访未发现病灶残留, 成功率为100%. 138例施行ESE, 成功实施130例, 其余4例因穿孔转外科手术, 2例病变未完整剥离, 患者拒绝手术, 选择随访, 2例出现出血, 给予内镜下喷洒止血药物、电凝、金属夹夹闭止血, 其余病灶均成功切除, 未出现相关并发症. ESE组成功率为94.2%, 穿孔率为2.9%, 出血率为1.4%. 出血率(8%)与既往学者研究(4%-5%)基本持平. ESD组共142例成功实施140例, 位于胃固有基层的2例SML出现术中穿孔, 对于穿孔患者予以钛夹缝合, 经禁食、补液、抗生素保守治疗成功, 无需外科手术治疗. 其余病灶均无穿孔及迟发性出血. ESD组成功率为98.6%, 穿孔率为1.4%. STER组共39例, 来源于黏膜下层及固有肌层, 无并发症. STER组成功率为100%. 因此ESD、ESE及STER可以作为上消化道黏膜下肿瘤特别是固有肌层肿瘤常规方法.
总之, 不论食管还是胃部黏膜下瘤, 发现最初的6 mo内生长速度有显著增大, 6 mo后变化不明显. 食管黏膜下肿瘤以平滑肌瘤为主, 间质瘤少见, 生长迅速的病灶及恶性病变罕见, 同时食管病变无论ESD或外科手术创伤及经济代价较大, 不建议常规施行. 胃部黏膜下病灶以间质瘤多见, 迅速生长病灶较食管明显增多, 建议12 mo内随访期间对生长迅速病灶在条件允许下优先施行ESD或ESE手术, 在病灶较大或并发症时选择腹腔镜或开腹手术.
目前各种消化内镜和薄层计算机断层扫描(computed tomography, CT)等技术在临床广泛应用, 消化道黏膜下病变(submucosal lesion, SML)的检出率越来越高. 针对SML治疗的内镜黏膜下层剥离术(endoscopic submucosal dissection, ESD)、外科手术数量越来越多.
李子禹, 教授, 主任医师, 北京大学肿瘤医院肿瘤外科; 朴龙镇, 副教授, 延边大学附属医院肿瘤科; 关泉林, 教授, 兰州大学第一医院肿瘤外科
Lachter等随访了100例经细胞学或组织学诊断为GIST的患者, 发现肿瘤>1.7 cm的患者中肿瘤增大更常见. 建议对于>1.7 cm的GIST予以超声内镜(endoscopic ultrasonography, EUS)的随访和更积极的治疗.
本文样本量大, 提供了充足的、有说服力的临床证据, 充分说明了超声内镜检查在上消化道黏膜下病变的性质、生长速度、恶变、ESD、外科手术的必要性及疗效中的重要地位.
SML: 指一类表面被正常黏膜上皮所覆盖的隆起型消化道病变, 又称为上皮下病变.
本文分析经EUS诊断为消化道黏膜下肿瘤的1915例患者的临床资料, 针对不同治疗方式及随访结果分析上消化道黏膜下肿瘤的处理原则. 属于样本量较大的回顾性研究, 探讨内容是目前临床诊治中的热点话题. 通过随访患者的病灶情况变化及不同治疗方式结局对于治疗策略加以分析, 结论证据较有说服力, 具有一定临床实践指导价值.
编辑: 于明茜 电编:都珍珍
| 1. | Hedenbro JL, Ekelund M, Wetterberg P. Endoscopic diagnosis of submucosal gastric lesions. The results after routine endoscopy. Surg Endosc. 1991;5:20-23. [PubMed] [DOI] |
| 2. | Polkowski M, Gerke W, Jarosz D, Nasierowska-Guttmejer A, Rutkowski P, Nowecki ZI, Ruka W, Regula J, Butruk E. Diagnostic yield and safety of endoscopic ultrasound-guided trucut [corrected] biopsy in patients with gastric submucosal tumors: a prospective study. Endoscopy. 2009;41:329-334. [PubMed] [DOI] |
| 3. | Polkowski M. Endoscopic ultrasound and endoscopic ultrasound-guided fine-needle biopsy for the diagnosis of malignant submucosal tumors. Endoscopy. 2005;37:635-645. [PubMed] [DOI] |
| 4. | Sun S, Wang M, Sun S. Use of endoscopic ultrasound-guided injection in endoscopic resection of solid submucosal tumors. Endoscopy. 2002;34:82-85. [PubMed] [DOI] |
| 5. | Wu A, Li R, Shi D, Li L, Zhang D, Wang C, Yan S. [Diagnostic value of endoscopic ultrasonography for submucosal tumors of upper gastrointestinal tract]. Zhonghua Weichang Waike Zazhi. 2015;18:1136-1138. [PubMed] |
| 6. | Ponsaing LG, Kiss K, Loft A, Jensen LI, Hansen MB. Diagnostic procedures for submucosal tumors in the gastrointestinal tract. World J Gastroenterol. 2007;13:3301-3310. [PubMed] |
| 7. | Sakamoto H, Kitano M, Kudo M. Diagnosis of subepithelial tumors in the upper gastrointestinal tract by endoscopic ultrasonography. World J Radiol. 2010;2:289-297. [PubMed] [DOI] |
| 8. | Seo SW, Hong SJ, Han JP, Choi MH, Song JY, Kim HK, Lee TH, Ko BM, Cho JY, Lee JS. Accuracy of a scoring system for the differential diagnosis of common gastric subepithelial tumors based on endoscopic ultrasonography. J Dig Dis. 2013;14:647-653. [PubMed] [DOI] |
| 9. | Dumonceau JM, Polkowski M, Larghi A, Vilmann P, Giovannini M, Frossard JL, Heresbach D, Pujol B, Fernández-Esparrach G, Vazquez-Sequeiros E. Indications, results, and clinical impact of endoscopic ultrasound (EUS)-guided sampling in gastroenterology: European Society of Gastrointestinal Endoscopy (ESGE) Clinical Guideline. Endoscopy. 2011;43:897-912. [PubMed] [DOI] |
| 10. | Sekine M, Imaoka H, Mizuno N, Hara K, Hijioka S, Niwa Y, Tajika M, Tanaka T, Ishihara M, Ito S. Clinical course of gastrointestinal stromal tumor diagnosed by endoscopic ultrasound-guided fine-needle aspiration. Dig Endosc. 2015;27:44-52. [PubMed] [DOI] |
| 11. | Hwang JH, Rulyak SD, Kimmey MB. American Gastroenterological Association Institute technical review on the management of gastric subepithelial masses. Gastroenterology. 2006;130:2217-2228. [PubMed] |
| 12. | Demetri GD, von Mehren M, Antonescu CR, DeMatteo RP, Ganjoo KN, Maki RG, Pisters PW, Raut CP, Riedel RF, Schuetze S. NCCN Task Force report: update on the management of patients with gastrointestinal stromal tumors. J Natl Compr Canc Netw. 2010;8 Suppl 2:S1-41; quiz S42-4. [PubMed] |
| 13. | Wehrmann T, Martchenko K, Nakamura M, Riphaus A, Stergiou N. Endoscopic resection of submucosal esophageal tumors: a prospective case series. Endoscopy. 2004;36:802-807. [PubMed] |
| 14. | Bruno M, Carucci P, Repici A, Pellicano R, Mezzabotta L, Goss M, Magnolia MR, Saracco GM, Rizzetto M, De Angelis C. The natural history of gastrointestinal subepithelial tumors arising from muscularis propria: an endoscopic ultrasound survey. J Clin Gastroenterol. 2009;43:821-825. [PubMed] [DOI] |
| 15. | Lachter J, Bishara N, Rahimi E, Shiller M, Cohen H, Reshef R. EUS clarifies the natural history and ideal management of GISTs. Hepatogastroenterology. 2008;55:1653-1656. [PubMed] |