修回日期: 2016-01-05
接受日期: 2016-01-11
在线出版日期: 2016-02-18
目的: 探究胶原纤维在酒精性肝损伤发展过程中各个阶段的变化规律及其与酒精性肝损伤的关系.
方法: 饲养清洁健康BALB/c♂小鼠40只, 随机分为对照组(n = 3)与模型组(n = 37). 将对照组3只小鼠处死, 取肝; 模型组小鼠每日给予0.15 mL/10 kg 56°红星二锅头白酒灌胃, 持续4 wk, 于开始灌胃后1、2、3、4 wk各取3只小鼠进行肝脏取材. 天狼星红染色法观察小鼠肝组织胶原纤维病理变化情况, 蛋白印迹法检测小鼠肝脏增殖细胞核抗原(proliferating cell nuclear antigen, PCNA)蛋白表达及变化趋势. 运用Image-ProPlus6.0对病理切片样本进行积分光密度(IOD)定量分析, Gel Pro4.0软件对目标蛋白条带灰度值进行测定. 运用SPSS16.0对数据进行处理, 用ANOVE法和非参数秩和检验法进行显著性分析.
结果: 第1、2周组小鼠肝组织胶原纤维含量持续显著增高(852.21±10.65 vs 345.24±65.94, 1054.15±10.80 vs 852.21±10.65, P<0.01), 第2周达到最高, 随后第3、4周小鼠肝组织胶原纤维含量依次降低(588.75±17.18 vs 1054.15±10.80, 559.40±14.17, P<0.01); 小鼠肝组织中PCNA蛋白含量前2 wk明显下降, 第2周时达到最小值, 第3周较第2周增加显著, 差异有统计学意义(P<0.05). 第4周与第3周变化无明显差异.
结论: 在酒精诱导小鼠肝脏损伤的过程中, 肝脏胶原纤维的变化规律是先增加后减少, 变化明显; PCNA的表达出现显著动态变化, 二者均可能与肝脏的损伤修复机制密切相关.
核心提示: 酒精性肝损伤过程中肝组织胶原纤维的变化与肝细胞的凋亡与增殖有密切关系. 实验通过酒精诱导的肝脏损伤模型, 观察得出胶原纤维含量先增加后减少的规律与肝脏的损伤修复密切相关, 对今后研究胶原纤维与酒精性肝损伤之间的关系有一定理论意义.
引文著录: 姜雅坤, 李三强, 卢华杰, 尚付梅, 李倩倩, 侯松林, 白晓洁, 潘勇阳. 胶原纤维在小鼠酒精性肝损伤过程中的表达变化. 世界华人消化杂志 2016; 24(5): 731-736
Revised: January 5, 2016
Accepted: January 11, 2016
Published online: February 18, 2016
AIM: To observe the change of collagen fibers in the development of alcohol induced liver injury in mice, and investigate the relationship between the change of collage fibers and the stage of alcoholic liver injury.
METHODS: Forty BALB/c mice were randomly divided into two groups: a normal group (n = 3) and a model group (n = 37). Mice of the normal group were sacrificed after adapting the environment for one week, and all the mice of the model group were given 0.15 mL/10 kg Red Star Erguotou (56 degrees) daily by gavage for 4 weeks. Each three mice were sacrificed at 1, 2, 3, and 4 weeks after alcohol administration (n = 37). Sirius red staining was used to observe collagen fibers in the liver tissue. Western blot was used to detect liver proliferation cell nuclear antigen (PCNA) protein expression. Image-ProPlus6.0 software was used to analyze the integral optical density (IOD) of the samples, and the gray levels of target protein bands were measured with Gel Pro4.0 software. ANOVE and nonparametric rank sum test were used to analyze the significance of the data.
RESULTS: The contents of collagen fibers increased significantly at 1 and 2 weeks (852.21 ± 10.65 vs 345.24 ± 65.94, 1054.15 ± 10.80 vs 852.21 ± 10.65, P < 0.01), peaked at 2 weeks, and then decreased at 3 and 4 weeks (588.75 ± 17.18 vs 1054.15 ± 0.80, 559.40 ± 14.17, P < 0.01). The content of PCNA protein in the liver tissue of mice decreased significantly in the first two weeks, reached the minimum value at 2 weeks, and then increased at 3 and 4 weeks (P < 0.05).
CONCLUSION: In the process of alcohol induced liver injury in mice, the content of collagen fibers in the liver increases first and then decreases, and the expression of PCNA shows significant dynamic changes. The changes may be closely related to the mechanism of liver injury.
- Citation: Jiang YK, Li SQ, Lu HJ, Shang FM, Li QQ, Hou SL, Bai XJ, Pan YY. Changes of collagen fibers in development of alcoholic liver injury. Shijie Huaren Xiaohua Zazhi 2016; 24(5): 731-736
- URL: https://www.wjgnet.com/1009-3079/full/v24/i5/731.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i5.731
中国是肝病大国, 最近10年以来, 过量饮酒已经发展成严重的公共问题. 大量乙醇在人体中主要在肝脏进行代谢, 因此, 肝脏也成为酒精性肝病普遍的受累器官. 据统计, 中国酒民中酒精性肝损伤(酒精肝、脂肪肝、肝硬化等)的发病率约为20%[1]. 酗酒人数不断攀升, 慢性酒精性肝病(alcoho1ic liver disease, ALD)发病率逐年升高[2]. 大量研究表明酒精性肝病在发展过程中, 胶原纤维的合成主要与肝星状细胞(hepatic stellate cell, HSC)的活化增殖有关. 而HSC的活化主要由于乙醇和代谢产物乙醛改变了机体的氧化还原反应状态, 活化库普弗细胞, 释放细胞因子造成的[3]. 正常肝组织中胶原纤维的生成和降解是一种动态平衡. 胶原纤维增多是由于平衡被打破, 生产量增长剧烈而降解严重不足造成的[4]. 但现阶段研究对胶原纤维的产生及降解具体机制不完善, 为了更好的模拟临床酒精性肝损伤的过程, 本实验通过56°红星二锅头白酒灌胃诱导肝脏损伤, 通过对各阶段肝脏的胶原纤维染色和定量分析, 及损伤过程中增殖细胞核抗原(proliferating cell nuclear antigen, PCNA)的表达研究, 观察在酒精性肝损伤过程中小鼠肝脏内胶原纤维的变化规律, 探究在酒精性肝损伤的发生与肝脏胶原纤维变化规律之间的相互关系.
清洁健康BALB/c♂小鼠40只, 体质量25 g±5 g(河南科技大学医学院动物实验中心). 56°红星二锅头(北京红星股份有限公司), 抗PCNA单克隆抗体、辣根过氧化物酶标记的羊抗鼠抗体(北京中杉金桥生物技术有限公司), DAB显色剂(上海宝曼生物科技有限公司产品), 天青石蓝B(上海蓝季科技发展有限公司进口分装), 天狼星红(中国Solarbio公司), 其余化学试剂均为市售分析纯. JY300C基础电泳仪电源和双垂直电泳仪(槽)(北京君易东方电泳设备有限公司), UV-5200型紫外可见分光光度计(上海元析仪器有限公司), H1850R离心机(日本Tome公司), Motic 102M光学显微镜、Moticam Pro 285A显微照相机(麦克奥迪中国实业有限公司), 石蜡切片机(德国Leica公司), GNP-9080BS-Ⅲ隔水式恒温培养箱(上海新苗医疗器械制造有限公司), DW-HW50 -80 ℃超低温冰箱(中科美菱低温科技有限公司).
1.2.1 酒精诱导小鼠肝损伤模型的建立: 取40只正常BALB/♂小鼠, 随机分为2组, 正常组(n = 3)和模型组(n = 37). 分笼、标准饲料喂养, 定期更换垫料, 自由喂养1 wk. 正常组3只小鼠处死取肝脏; 模型组每只小鼠每天用56°红星二锅头灌胃0.15 mL/10 kg, 连续喂养4 wk.
1.2.2 实验取材: 在灌胃后的第1、2、3、4周时间点各随机取3只小鼠采用颈部脱臼法处死, 取肝脏, 分2份, 一份制备10%匀浆液, 另一份用1×PBS冲洗干净, 于40 g/L甲醛固定液中固定, 于-80 ℃冰箱中保存.
1.2.3 天狼星红染色检测各组小鼠在诱导过程中肝组织胶原纤维含量的变化: 取各组肝组织制作病理切片, 用天狼星红法染色, 观察胶原纤维变化. 肝组织取材, 于甲醛固定液中固定, 冲洗24 h后经脱水、固定进行常规石蜡包埋, 连续切片5 μm, 裱片并烤干. 常规脱蜡、水化后用天青石蓝染液染色5-10 min, 蒸馏水冲洗5次, 每次2 min; 再用天狼星红饱和溶液染色10-20 min; 无水乙醇分化后用中性树胶固定封片. 在显微镜下观察各时间点切片肝胶原纤维含量的变化, 按统一参数拍照.
1.2.4 蛋白印迹法检测肝组织PCNA蛋白表达: 取适量小鼠肝脏与PBS溶液按1:10匀浆, 在4 ℃、1×104 r/min条件下匀浆10 min, 取其上清液作为蛋白样品. 运用考马斯亮蓝G250蛋白定量后, 以蛋白样品70 μg为上样量, 经SDS-PAGE电泳、以200 mA稳定电流转膜2 h后, 蛋白已转移至硝酸纤维素膜上. 用5%脱脂奶粉/0.1% Tween20/PBS(PBST) 37 ℃封闭1 h, PBST洗3次, 每次3 min; 用抗小鼠PCNA(1:500) 37 ℃孵育1 h, PBST洗3次, 每次3 min; 用辣根过氧化物酶标记的羊抗鼠抗体(1:800)孵育1 h, PBST洗3次, 每次3 min, DAB显色检测阳性表达[5]. 应用Image-ProPlus6.0软件(美国Media Cybernetics公司)对图片进行统一分析. 首先, 在软件光密度校准后, 选择测量参数(select measurement)为面积(area)、IOD, 其中面积选择参数为过滤10以下的阳性显色. 然后, 选择胶原纤维表达的阳性结果, 运用Histogram based模式中的HIS(H = 130-255; I = 255; S = 255)进行阳性显色. 选出阳性区域后回到Count/size, 点击Count, 即可得到IOD. 为了便于分析多个图片, 可以编写宏文件进行图片批量处理[6]; 运用GelPro4.0软件计算已扫描的蛋白条带灰度值. 目标蛋白的相对表达量等于目标条带灰度值与内参蛋白(β-actin)条带灰度值的比值.
统计学处理 用SPSS16.0统计软件对所获得的病理切片IOD值进行Kruskal-Wallis H非参数秩和检验, 灰度值显著性分析用ANVOE法, 组间比较用Duncan's test, 以P<0.05为差异有统计学意义.
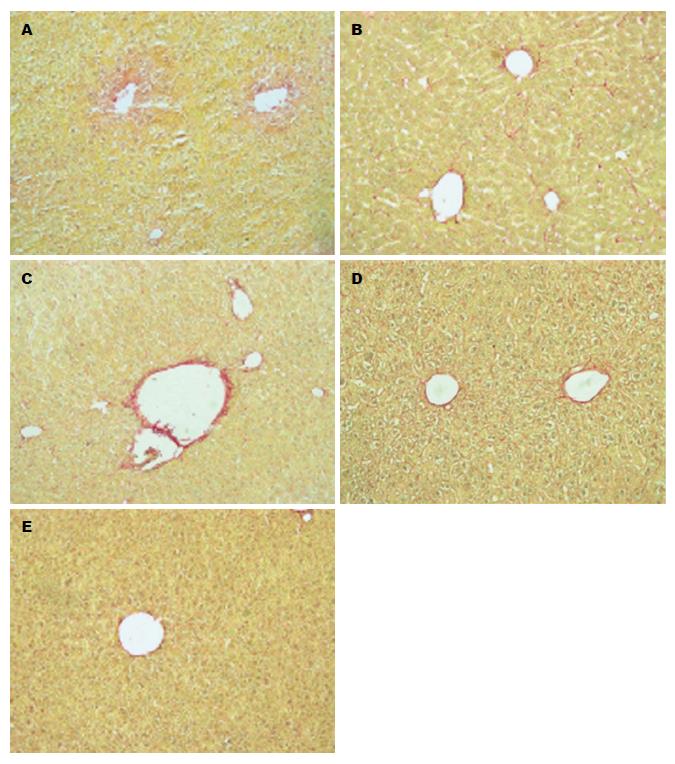
正常组, 肉眼观肝脏颜色鲜红, 表面光滑, 外观无异常. 光镜下观察肝组织细胞结构正常, 间质少, 肝细胞呈条索状排列, 细胞呈多边形, 肝小叶明显. 经天狼星红染色后, 切片中几乎无呈红染的胶原纤维, 唯沿中央静脉周围有极少量胶原纤维存在(图1A). 模型组: 1 wk小鼠, 肝脏肉眼观正常; 光镜下观察, 肝小叶结构可辨, 肝索排列正常, 肝细胞轻度水肿, 中央静脉周围、细胞间红染的呈细丝状胶原纤维明显(图1B). 2 wk小鼠, 肝脏肉眼观体积稍大; 光镜下观察, 肝索排列正常但轻微变窄, 肝细胞肿大, 中央静脉周围偶见空泡, 胶原纤维沉积增厚(图1C). 3 wk小鼠, 肉眼观体积变大, 颜色偏黄; 光镜下观察, 肝小叶结构可辨, 肝索排列紊乱, 肝细胞明显水肿, 有少量中性粒细胞浸润, 可见胶原纤维在中央静脉周围沉积, 但较第2周明显减少(图1D). 4 wk小鼠, 肉眼观, 肝脏体积明显增大, 质软, 颜色呈黄色, 表面有油腻感; 光镜下观察, 肝索紊乱, 肝窦变窄, 细胞肿大, 胞浆疏松化, 严重气球样变. 胞浆稀少, 透亮, 细胞核多位于中央区, 增大, 可见少量灶状坏死. 门管区及中央静脉区可见胶原纤维, 但较第3周减少(图1E).
胶原纤维定量是整个视野中阳性信号强度的总和. 运用Image-ProPlus6.0软件对图片中阳性信号进行处理, 计算得出积分光密度值然后进行分析. 随着小鼠肝脏损伤程度加重, 各组胶原纤维含量之间的差异有统计学意义(P<0.01). 正常组和模型组1、3、4 wk组, 肝脏胶原纤维含量明显低于模型组2 wk组(P<0.01). 在损伤不断加重的过程中, 1、2 wk肝脏胶原纤维含量增加显著, 但3、4 wk减少显著. 酒精性肝诱导损伤第1周胶原纤维含量较第0周增加明显(852.21±10.65 vs 345.24±65.94, P<0.01). 第2周胶原纤维含量较第1周持续增加(1054.15±10.80 vs 852.21±10.65, P<0.01). 到第3周时胶原纤维含量显著下降(588.75±17.18 vs 1054.15±10.80, P<0.01). 第4周持续下降. 实验表明, 在酒精性肝损伤的诱导过程中肝组织胶原纤维的含量是先增多后减少的变化规律(表1).
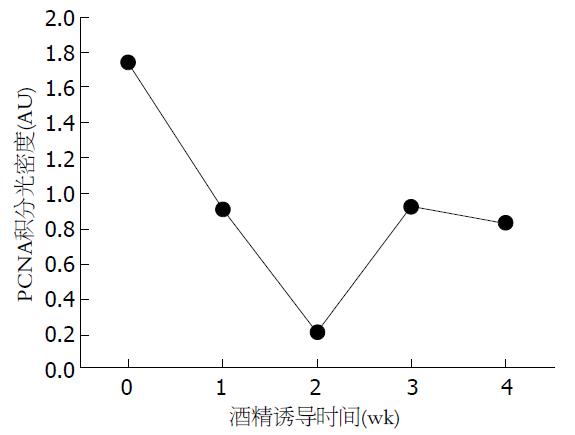
在诱导酒精性肝损伤后2 wk, 小鼠肝组织PCNA蛋白水平迅速降低, 在第2周达到最低值, 差异有统计学意义(P<0.05). 2 wk后PCNA蛋白水平升高明显, 差异有统计学意义(P<0.05). 3 wk和4 wk PCNA表达无差异, 整体变化趋势先减少后增加(图2).
人们对过量饮酒造成的肝脏损伤已非常重视. 研究[7]显示, 酗酒者中65%以上有发展为脂肪肝、肝纤维化的可能, 其中已患肝病者更有可能发展为肝硬化或肝细胞癌. 酒精对肝脏的损伤机制可能与酒精引起的炎性反应、肝脏的应激反应、炎性介质、细胞因子及其传导通路等多种因素相关[8].
本实验诱导小鼠酒精性肝损伤的过程中, 发现肝组织胶原纤维的变化与PCNA蛋白表达趋势密切相关. PCNA是一种标记细胞周期的蛋白, 与细胞增殖有关, 可用于标记增殖细胞, 同时也是评价肝脏再生的一个指标[9]. 肝组织细胞中PCNA的变化可表明肝细胞的增殖与凋亡, 且PCNA的变化与肝组织的损伤修复关系密切. 相关研究[10]表明, 肝细胞凋亡是促进肝组织纤维化过程的可能机制. 在肝组织损伤初期(第1、2周), 细胞轻度水肿、变性, 有较少炎性细胞浸润, 胶原纤维含量增加显著, 而其PCNA表达量剧烈下降, 第2周达到最低值. 说明此时肝细胞损伤及凋亡明显. 一般情况下认为, 为保持器官正常生理功能, 细胞的凋亡与增殖基本维持恒定, 胶原纤维的迅速增加可能与肝细胞损伤及凋亡有关. 诱导损伤第3、4周, 肝细胞明显水肿, 肝索排列紊乱, 炎性细胞浸润, 胶原纤维含量迅速降低. 而PCNA表达量的迅速上升, 说明此时肝细胞增殖能力代偿性增加, 肝组织开始修复过程. 此时, 肝组织胶原纤维含量的降低可能与肝脏损伤修复中转化生长因子TGF的变化相关. 数据表明, 肝组织胶原纤维的增多, 肝组织纤维化过程主要由HSC促进完成[11]. 在肝损伤的过程中, HSC是炎性细胞以及再生的肝实质细胞释放的细胞因子的作用靶点. 在众多促进胶原纤维增多的介质中, 转化生长因子β1(transforming growth factor-β1, TGF-β1)效果最强. TGF-β1可以刺激HSC产生细胞外基质, 从而加速胶原纤维的生产和累积[12]. 在肝组织胶原纤维不断增加的过程中, HSC活化程度不断升高, TGF-βl的表达也不断增加. 在TGF-βl含量增加到一定程度时TGF-β3可以通过下调TGF-β1蛋白的表达来抑制HSC合成Ⅰ型胶原, 使胶原纤维生成量减少, 阻止肝纤维化的出现[13]. 唐世杰等[14]的研究结果也表明: 外源性TGF-β3通过下调增生性瘢痕组织中成纤维细胞的TGF-βl蛋白表达, 胶原纤维的合成显著减少. 在动脉损伤处增加TGF-β3含量后Ⅲ型胶原纤维含量明显减少[15]. 其机制可能也与内源性TGF-β3下调TGF-βl蛋白表达从而抑制HSC合成胶原纤维生成有关. 另一方面相关研究[16]表明为保持器官正常生理功能, 细胞凋亡与增殖基本维持恒定; 在早期损伤中, 肝细胞反应增生迟钝, TGF反应迅速, 胶原纤维先于肝细胞增生; 而后, 肝脏在持续损伤过程中, 修复也同时进行, 肝细胞增生显著, 胶原纤维反而减少.
总之, 本实验通过酒精诱导的肝脏损伤模型, 观察得出胶原纤维含量先增加后减少的规律与肝脏的损伤修复密切相关, 对今后研究胶原纤维与酒精性肝损伤之间的关系有一定理论意义.
随着人们生活方式和饮食结构的改变, 我国酒精性肝病的发病率逐渐升高. 据报道, 酗酒者可发展为脂肪肝、肝纤维化, 严重的可发展为肝硬化. 肝硬化的前期改变是肝组织胶原纤维增多导致肝纤维化, 而肝纤维化早期是可逆过程, 因此肝组织胶原纤维的变化可作为研究治疗肝脏病变的重点.
姚继红, 教授, 大连医科大学药学院
酒精性肝损伤的发病机制、疾病转归与疾病治疗是当前酒精性肝损伤的研究热点,但酒精性肝损伤后肝细胞应激反应与修复过程机制尚待研究.
叶伟东等在肝纤维化大鼠肝脏Bcl-2、Bax、增殖细胞核抗原的表达及重组转化生长因子β1疫苗对其表达的影响一文中提出"肝细胞凋亡是促进肝纤维化的可能机制之一"为本实验结果讨论提供了理论依据, 也为进一步的研究打下基础.
本文着重研究胶原纤维在酒精性肝损伤早期的变化, 实验结果表明胶原纤维的变化与肝细胞的凋亡与增殖, 肝组织的损伤与修复关系密切, 但具体机制尚不明, 需要进一步研究.
肝纤维化是发展成肝硬化、肝细胞癌的重要阶段, 而肝纤维化是由于肝组织胶原纤维增多沉积造成的. 大量研究表明肝纤维化早期是可逆的, 所以肝损伤早期胶原纤维的变化规律对于临床治疗肝纤维化有重要参考价值.
肝脏胶原纤维: 正常肝组织中胶原纤维的生产和降解是平衡的, 胶原纤维的沉积是由于某些因素造成胶原纤维生成增多而降解减少. 肝脏胶原纤维的沉积是肝纤维化的重要过程.
本文建立BALB/c ♂小鼠酒精性肝损伤模型, 符合伦理学要求, 通过组织病理学结果分析, 在一定程度上可说明胶原纤维在酒精性肝损伤发展过程中各个阶段的变化规律.
编辑: 于明茜 电编:都珍珍
| 2. | 孙 玉生, 林 波, 王 思谦, 刘 悦, 张 优敬, 郑 乃芮, 皇甫 超申. 慢性酒精摄入所致的肝细胞上皮一间充质转化参与小鼠肝纤维化形成. 中国病理生理杂志. 2014;30:77-84. |
| 5. | Li SQ, Li RF, Xi SM, Hu S, Jia ZQ, Li SP, Wen XL, Song YK, Li S, Li SP. Systematical analysis of impacts of heat stress on the proliferation, apoptosis and metabolism of mouse hepatocyte. J Physiol Sci. 2012;62:29-43. [PubMed] [DOI] |
| 8. | Wang HJ, Zakhari S, Jung MK. Alcohol, inflammation, and gut-liver-brain interactions in tissue damage and disease development. World J Gastroenterol. 2010;16:1304-1313. [PubMed] [DOI] |
| 9. | Naryzhny SN. Proliferating cell nuclear antigen: a proteomics view. Cell Mol Life Sci. 2008;65:3789-3808. [PubMed] [DOI] |
| 10. | Takehara T, Tatsumi T, Suzuki T, Rucker EB, Hennighausen L, Jinushi M, Miyagi T, Kanazawa Y, Hayashi N. Hepatocyte-specific disruption of Bcl-xL leads to continuous hepatocyte apoptosis and liver fibrotic responses. Gastroenterology. 2004;127:1189-1197. [PubMed] [DOI] |
| 12. | Gressner AM, Weiskirchen R. Modern pathogenetic concepts of liver fibrosis suggest stellate cells and TGF-beta as major players and therapeutic targets. J Cell Mol Med. 2006;10:76-99. [PubMed] [DOI] |
| 15. | Ghosh J, Baguneid M, Khwaja N, Murphy MO, Turner N, Halka A, Ferguson MW, Kielty CM, Walker MG. Reduction of myointimal hyperplasia after arterial anastomosis by local injection of transforming growth factor beta3. J Vasc Surg. 2006;43:142-149. [PubMed] [DOI] |