修回日期: 2015-12-26
接受日期: 2016-01-06
在线出版日期: 2016-02-08
目的: 通过分析60例2型糖尿病(diabetes mellitus type 2, T2DM)患者炎症和氧化应激的变化, 探讨脾虚(spleen deficiency)对糖尿病病理状态的影响.
方法: 选取糖尿病脾虚患者和非脾虚患者患者各30例, 采集血清, 检测胰型淀粉酶(pancreatic amylase, P-AMY), 超敏C反应蛋白(high sensitivity C-reactive protein, hs-CRP), 白介素-6(interleukin 6, IL-6), 肿瘤坏死因子α(tumor necrosis factor-α, TNF-α), 丙二醛(malondialdehyde, MDA), 蛋白质羰基含量(protein carbonyls content, PCO). 其中, 测定P-AMY采用酶联免疫吸附测定法; 测定hs-CRP、IL-6、TNF-α采用双抗体夹心法(ELISA), 测定MDA采用硫代巴比妥酸(2-Thiobarbituric acid, TBA)法, 测定PCO采用2,4二硝基苯肼(DNPH)比色法.
结果: 糖尿病脾虚患者的P-AMY含量及高水平病例分布均低于糖尿病非脾虚患者; 糖尿病脾虚患者的hs-CRP、IL-6、TNF-α、MDA、PCO含量及高水平病例分布均高于糖尿病非脾虚患者.
结论: 脾虚可能降低糖尿病患者血清P-AMY水平, 加重糖尿病患者的炎症和氧化应激.
核心提示: 糖尿病的发生发展与氧化应激和炎症密切相关. 近来, 将糖尿病定义为一种氧化还原性疾病或炎症性疾病已得到学者的广泛认可. 本文立足于炎症和氧化应激的角度, 探讨脾虚对2型糖尿病的影响, 结果发现, 脾虚会降低糖尿病患者血清胰型淀粉酶水平, 加重糖尿病患者的炎症和氧化应激.
引文著录: 徐红星, 朱海龙, 许彬, 刘晓秋. 脾虚加重2型糖尿病的氧化应激及炎症. 世界华人消化杂志 2016; 24(4): 648-652
Revised: December 26, 2015
Accepted: January 6, 2016
Published online: February 8, 2016
AIM: To explore the effect of spleen deficiency on pathological state in diabetes by analyzing the inflammation and oxidative stress in type 2 diabetics.
METHODS: Sixty patients were selected, including 30 patients with type 2 diabetes with spleen deficiency and 30 patients with type 2 diabetes without spleen deficiency. Blood samples were collected to measure serum pancreatic amylase (P-AMY), high sensitivity C-reactive protein (hs-CRP), interleukin 6 (IL-6), and tumor necrosis factor-α (TNF-α) by enzyme linked immunosorbent assay (ELISA). Malondialdehyde (MDA) was measured by the method of thiobarbituric acid reaction (TBA), and protein carbonyls (PCOs) were measured by treatment with 2,4-dinitrophenylhydrazine (DNPH), which reacts with protein carbonyl derivatives to form stable hydrazones.
RESULTS: P-AMY in type 2 diabetes with spleen deficiency was lower than that in type 2 diabetes without spleen deficiency, and the distribution of lower levels of P-AMY in type 2 diabetes with spleen deficiency was more than that in type 2 diabetes without spleen deficiency. hs-CRP, IL-6, TNF-α, MDA, and PCOs in type 2 diabetes with spleen deficiency were higher than those in type 2 diabetes without spleen deficiency, and the distribution of higher levels of hs-CRP, IL-6, TNF-α, MDA, PCO in type 2 diabetes with spleen deficiency was more than that in type 2 diabetes without spleen deficiency.
CONCLUSION: Spleen deficiency may decrease the level of serum P-AMY and aggravate inflammation and oxidative stress in type 2 diabetes.
- Citation: Xu HX, Zhu HL, Xu B, Liu XQ. Spleen deficiency aggravates oxidative stress and inflammation in type 2 diabetics. Shijie Huaren Xiaohua Zazhi 2016; 24(4): 648-652
- URL: https://www.wjgnet.com/1009-3079/full/v24/i4/648.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i4.648
糖尿病是一种以高血糖为主要特点的内分泌代谢性疾病, 典型症状是多饮、多食、多尿和体质量减轻等症候群. 由于糖尿病对人和社会有很大的影响[1], 并且在未来的几年形势会更加严峻[2], 其中又以2型糖尿病为主, 所以一直颇受关注. 糖尿病基本病理是胰岛细胞凋亡或胰岛素抵抗导致胰岛素分泌绝对或相对不足[3]. 近来, 糖尿病与炎症和氧化应激的关系得到了更为深入的认识, 有研究发现糖尿病患者的胰岛有炎性细胞浸润、炎症因子、细胞凋亡同时存在[4]. 氧化应激致使骨骼肌细胞胰岛素抵抗[5], 糖尿病许多方面与氧化应激[6-9]和炎症[7,10,11]密切相关, 抗氧化治疗可以预防和改善糖尿病及某些并发症[12,13]. 将糖尿病定义为一种氧化还原性疾病[14]或炎症性疾病[15,16]已得到学者的广泛认可. 在中医学上, 脾和胰的关系密不可分[17,18], 糖尿病的发生发展与脾虚密切相关[19-21], 但糖尿病中脾虚与氧化应激和炎症的研究却颇为少见, 本文重点从炎症和氧化应激的角度, 研究脾虚对于糖尿病的影响及机制, 探讨脾虚致糖尿病的发生机制.
脾虚型2型糖尿病患者血清、非脾虚型2型糖尿病患者血清各30例, 由广州中医药大学第一附属医院住院患者中采集. 丙二醛(malondialdehyde, MDA)试剂盒(南京建成生物工程研究所); 蛋白质羰基含量试剂盒(南京建成生物工程研究所); 白介素6(interleukin 6, IL-6)酶联免疫试剂盒(进口分装); 人高敏C反应蛋白酶联免疫试剂盒(进口分装); 人肿瘤坏死因子α(tumor necrosis factor-α, TNF-α)酶联免疫试剂盒(进口分装); 人α淀粉酶酶联免疫试剂盒(武汉华美生物工程有限公司); 人胰淀粉酶酶联免疫试剂盒(武汉华美生物工程有限公司); 芬兰可调式移液器(Y38302, KZ21517); 酶标仪(Multiskan Mk3); 实验室超纯水系统Unique系列超纯水机.
1.2.1 诊断标准: 糖尿病诊断标准采用目前国际上通用的WHO1999年糖尿病专家委员会修订的糖尿病诊断标准; 脾虚中医辨证标准: 参照卫生部药政局颁布《中药治疗脾虚证的临床研究指导原则》, 结合临床制定有关脾虚证标准如下: 脾虚主症: (1)胃纳减少或食欲差; (2)大便不正常(溏、烂、先硬后溏、时溏时硬); (3)食后腹胀、或下午腹胀. 次症: 口淡不渴、喜热饮、水泛清涎、腹痛绵绵、或喜按喜温、或得食则减、或遇劳则发、恶心呕吐、脘闷、肠鸣、消瘦或虚胖、面色萎黄、唇淡、短气、排便无力、白带清稀、浮肿、小便清长、咳痰多清稀、失眠不寐. 诊断: 主症3项, 或主症2项(胃纳减少或食欲差), 次症2项即可诊断脾虚证.
1.2.2 指标测定: 胰型淀粉酶(pancreatic amylase, P-AMY)、超敏C反应蛋白(high sensitivity C-reactive protein, hs-CRP)、IL-6、TNF-α测定: 采用酶联免疫吸附法(ELISA)测定, 按照试剂盒说明书操作; MDA测定: 采用硫代巴比妥酸(2-thiobarbituric acid, TBA)法[22,23]测定; PCO测定: 采用2,4二硝基苯肼(DNPH)比色法测定[24,25].
统计学处理 所有数据分析用SPSS17.0统计软件. 各组试验数据以mean±SD表示, 统计学显著性通过非配对Student t检验进行计算, 病例分布用频率分布直方图描述.
脾虚和非脾虚糖尿病患者年龄、病史、血糖等一般资料的平均水平如表1所示. 血清P-AMY水平糖尿病脾虚患者低于糖尿病非脾虚患者; 血清炎症指标(hs-CRP、IL-6、TNF-α)、血清氧化应激指标(MDA、PCO)糖尿病脾虚患者均高于糖尿病非脾虚患者. 糖尿病脾虚患者的P-AMY中位数低于糖尿病非脾虚患者; 糖尿病脾虚患者的血清hs-CRP、IL-6、TNF-α、MDA、PCO中位数高于糖尿病非脾虚患者. 且相对于两组均值的差异来说, 中位数的差异更明显(表2).
| 分组 | 年龄(岁) | 病史(年) | 血糖(mmol/L) | 总胆固醇(mmol/L) | 甘油三酯(mmo/L) |
| 脾虚组 | 54.3 | 7.54 | 8.26 | 4.74 | 1.86 |
| 非脾虚组 | 55.5 | 7.12 | 8.52 | 4.57 | 1.97 |
| 分组 | P-AMY(μm/mL) | hsCRP(μg/L) | IL-6(ng/L) | TNF-α(ng/L) | MDA(nmoL/mL) | PCO(nmoL/mgprot) |
| 平均水平 | ||||||
| 脾虚组 | 363.52±176.43 | 6.12±3.03 | 2.82±0.87 | 103.48±43.23 | 4.61±1.54 | 0.644±0.148 |
| 非脾虚组 | 363.95±169.37 | 5.39±3.41 | 2.29±0.94 | 98.67±44.38 | 4.36±1.46 | 0.617±0.153 |
| 中位数 | ||||||
| 脾虚组 | 383.03 | 5.51 | 2.79 | 100.37 | 4.56 | 0.660 |
| 非脾虚组 | 394.86 | 4.11 | 1.99 | 79.08 | 4.13 | 0.603 |
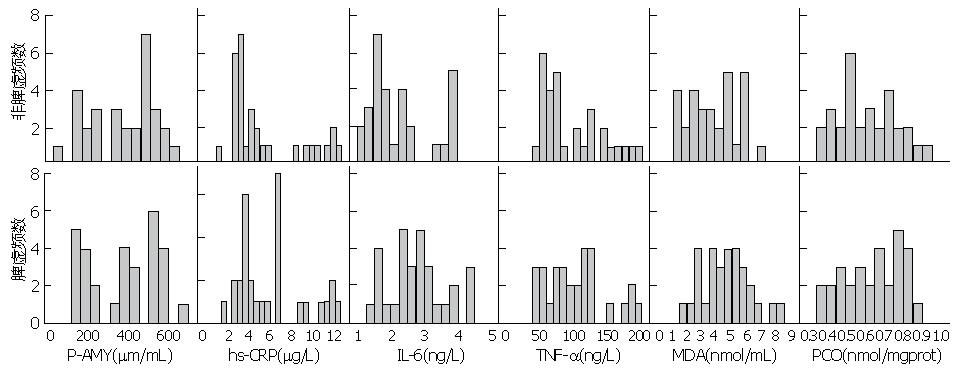
P-AMY在450-650 μm/mL之间脾虚糖尿病患者有10(33.3%)例, 非脾虚糖尿病患者有14(46.7%)例, 高水平有相对多的分布; hs-CRP在6.0-12.5 μg/L之间脾虚糖尿病患者有14(46.7%)例, 非脾虚糖尿病患者有8(26.7%)例, IL-6在2.75-4.50 ng/L之间脾虚糖尿病患者有15(50%)例, 非脾虚糖尿病患者有7(23.3%)例, TNF-α在100-200 ng/L之间脾虚糖尿病患者有15(50%)例, 非脾虚糖尿病患者有13(43.3%)例, MDA在5.0-8.5 nmol/mL之间脾虚糖尿病患者有12例, 非脾虚亦是, 但在低水平1.5-3.5 nmol/mL之间脾虚糖尿病患者有7(23.3%)例, 而非脾虚糖尿病患者有10(33.3%)例, PCO在0.65-0.95 nmol/mg prot之间脾虚糖尿病患者有16(53.3%)例, 非脾虚糖尿病患者有12(40%)例. 糖尿病炎症和氧化应激指标在高水平的百分比, 脾虚患者均多于非脾虚患者(图1).
氧化应激和炎症在糖尿病中是普遍存在的, 并且在其并发症机制中占有很重要的成分, 胰岛素抵抗(insulin resistance, IR)[7], β细胞功能损伤和凋亡[8,16], 并发症[26]也和炎症密切相关, 作为炎症水平标志物的hs-CRP、IL6、TNF-α在糖尿病病理改变中发挥着不同的作用[27-29]. 由于胰岛β细胞合成氧化物解毒酶的能力有限[30], 因此对氧化应激比较敏感, 活性氧(reactive oxygen species, ROS)可以直接损伤β细胞, 还可以引发应激敏感通路的改变, 调节相关因子引起β细胞凋亡或坏死. 氧化应激可以使线粒体产生大量ROS, 还可以作用于胰岛素信号传导通路, 诱发、加重IR. MDA是脂质氧化终产物, 能使蛋白质、核酸、脂类交联, 致生物膜变性、细胞衰老、凋亡. PCO是蛋白质的氧化产物, 他会使蛋白容易交联且不易折叠, 从而使蛋白的免疫活性、酶活性等降低.
本次结果中炎症因子和氧化应激指标平均水平脾虚组未见显著高于非脾虚组, 但脾虚组在高水平阶段有更多的病例分布, 非脾虚组却更多的分布于低水平, 这表明相同人数的糖尿病兼脾虚的患者和单纯糖尿病患者中, 前者有更多患者体内氧化应激和炎症处于一个相对高的水平. P-AMY高水平非脾虚组多于脾虚组, 低水平反之, 可能是"脾胰同源"脾虚致使胰腺合成或分泌减少, 具体机制有待进一步探索. 总之, 对脾虚状态的调整虽不能降低所有患者体内的炎症和氧化应激水平, 但是可以在一定程度上改善部分糖尿病患者的氧化应激和炎症状态, 有助于糖尿病的治疗和改善糖尿病的并发症.
目前在糖尿病的最新研究中, 炎症和氧化应激颇受关注, 并取得很大进展, 在中医学上, 脾和胰的关系密不可分, 糖尿病的发生发展与脾虚密切相关, 近年来的研究也发现, 脾虚与氧化应激和炎症亦密切相关, 通过健脾疗法以治疗糖尿病卓有成效, 但尚未研究相关机制. 本文从炎症和氧化应激的角度, 研究脾虚对于糖尿病的影响及机制, 探讨脾虚致糖尿病的发生机制.
王兵, 主任医师, 上海交通大学附属第六人民医院中医科; 王学美, 研究员, 北京大学第一医院中西医结合研究室
氧化应激和炎症在糖尿病胰岛素抵抗, 胰岛细胞凋亡, 以及各种并发症之中的地位与作用机制越来越清晰, 但目前大部分研究均在动物实验中展开, 临床研究相对缺乏. 此外, 糖尿病的发生发展与脾虚密切相关, 通过健脾疗法以治疗糖尿病卓有成效, 但目前亦较少结合中医药, 在这一领域开展研究.
古代、近代、现代的研究均显示, 脾虚与糖尿病的发生发展密切相关, 分子机制涉及神经、内分泌、免疫、代谢, 较少从氧化应激和炎症角度进行研究, 氧化应激和炎症及其相互作用, 在疾病发生发展中的重要作用已获得广泛研究证实, 有大量研究报道, 但目前尚较少结合中医进行相关研究.
本文思路较新颖, 从氧化应激和炎症角度分析脾虚对于糖尿病的作用, 初步认识了脾虚对糖尿病氧化应激和炎症的影响, 对了解中医健脾疗法治疗糖尿病的微观机制有一定的帮助.
氧化应激和炎症对糖尿病的发生发展有极重要影响. 此外, 糖尿病的发生发展与脾虚密切相关, 通过健脾疗法以治疗糖尿病卓有成效, 这一领域受到越来越广泛的关注, 已成为临床医学和临床药理学的重要领域, 在这一领域进行中医药机制的研究有重要实际应用价值.
脾虚: 出自《素问.脏气法时论》, 泛指脾之阴阳、气血不足的各种病证, 多因饮食失调、寒温不适、忧思、劳倦过度或久病伤脾所致. 症见消瘦面黄、四肢乏力、食不消化、腹痛、肠鸣、泄泻、浮肿、便血、崩漏等, 治以健脾为大法; 超敏C反应蛋白: 是血浆中的一种C反应蛋白, 是由肝脏合成的一种全身性炎症反应急性期的非特异性标志物.
本文研究思路有一定创新性, 该研究设计合理, 数据翔实可信. 该研究着眼于糖尿病的氧化应激和炎症及其与脾虚的密切关系, 为探索脾虚与糖尿病密切关系的分子机制提供了临床研究资料.
编辑: 于明茜 电编: 闫晋利
| 1. | Bukhari SA, Shamshari WA, Ur-Rahman M, Zia-Ul-Haq M, Jaafar HZ. Computer aided screening of secreted frizzled-related protein 4 (SFRP4): a potential control for diabetes mellitus. Molecules. 2014;19:10129-10136. [PubMed] [DOI] |
| 2. | Fernández-Millán E, Ramos S, Alvarez C, Bravo L, Goya L, Martín MÁ. Microbial phenolic metabolites improve glucose-stimulated insulin secretion and protect pancreatic beta cells against tert-butyl hydroperoxide-induced toxicity via ERKs and PKC pathways. Food Chem Toxicol. 2014;66:245-253. [PubMed] [DOI] |
| 3. | Kerner W, Brückel J. Definition, classification and diagnosis of diabetes mellitus. Exp Clin Endocrinol Diabetes. 2014;122:384-386. [PubMed] [DOI] |
| 4. | Donath MY, Schumann DM, Faulenbach M, Ellingsgaard H, Perren A, Ehses JA. Islet inflammation in type 2 diabetes: from metabolic stress to therapy. Diabetes Care. 2008;31 Suppl 2:S161-S164. [PubMed] [DOI] |
| 5. | Maurya CK, Arha D, Rai AK, Kant Kumar S, Pandey J, Avisetti DR, Kalivendi SV, Klip A, Tamrakar AK. NOD2 activation induces oxidative stress contributing to mitochondrial dysfunction and insulin resistance in skeletal muscle cells. Free Radic Biol Med. 2015;89:158-169. [PubMed] [DOI] |
| 6. | El-Refaei MF, Abduljawad SH, Alghamdi AH. Alternative Medicine in Diabetes - Role of Angiogenesis, Oxidative Stress, and Chronic Inflammation. Rev Diabet Stud. 2014;11:231-244. [PubMed] [DOI] |
| 7. | Heeba GH, Morsy MA. Fucoidan ameliorates steatohepatitis and insulin resistance by suppressing oxidative stress and inflammatory cytokines in experimental non-alcoholic fatty liver disease. Environ Toxicol Pharmacol. 2015;40:907-914. [PubMed] [DOI] |
| 8. | Choudhury S, Ghosh S, Gupta P, Mukherjee S, Chattopadhyay S. Inflammation-induced ROS generation causes pancreatic cell death through modulation of Nrf2/NF-κB and SAPK/JNK pathway. Free Radic Res. 2015;49:1371-1383. [PubMed] [DOI] |
| 9. | Bonomini F, Rodella LF, Rezzani R. Metabolic syndrome, aging and involvement of oxidative stress. Aging Dis. 2015;6:109-120. [PubMed] [DOI] |
| 10. | Gariballa S, Kosanovic M, Yasin J, El Essa A. Oxidative damage and inflammation in obese diabetic Emirati subjects. Nutrients. 2014;6:4872-4880. [PubMed] [DOI] |
| 11. | Aljwaid H, White DL, Collard KJ, Moody AJ, Pinkney JH. Non-transferrin-bound iron is associated with biomarkers of oxidative stress, inflammation and endothelial dysfunction in type 2 diabetes. J Diabetes Complications. 2015;29:943-949. [PubMed] [DOI] |
| 12. | Khanra R, Dewanjee S, K Dua T, Sahu R, Gangopadhyay M, De Feo V, Zia-Ul-Haq M. Abroma augusta L. (Malvaceae) leaf extract attenuates diabetes induced nephropathy and cardiomyopathy via inhibition of oxidative stress and inflammatory response. J Transl Med. 2015;13:6. [PubMed] [DOI] |
| 13. | Ebrahimpour Koujan S, Gargari BP, Mobasseri M, Valizadeh H, Asghari-Jafarabadi M. Effects of Silybum marianum (L.) Gaertn. (silymarin) extract supplementation on antioxidant status and hs-CRP in patients with type 2 diabetes mellitus: a randomized, triple-blind, placebo-controlled clinical trial. Phytomedicine. 2015;22:290-296. [PubMed] [DOI] |
| 16. | Donath MY, Shoelson SE. Type 2 diabetes as an inflammatory disease. Nat Rev Immunol. 2011;11:98-107. [PubMed] [DOI] |
| 21. | 沈 玉国. 从脾虚探讨糖尿病前期的基本病机. 中国中医基础医学杂志. 2013;19:740-741. |
| 22. | Mihara M, Uchiyama M. Determination of malonaldehyde precursor in tissues by thiobarbituric acid test. Anal Biochem. 1978;86:271-278. [PubMed] [DOI] |
| 23. | Ohkawa H, Ohishi N, Yagi K. Assay for lipid peroxides in animal tissues by thiobarbituric acid reaction. Anal Biochem. 1979;95:351-358. [PubMed] [DOI] |
| 24. | Reznick AZ, Packer L. Oxidative damage to proteins: spectrophotometric method for carbonyl assay. Methods Enzymol. 1994;233:357-363. [PubMed] [DOI] |
| 25. | Mercier Y, Gatellier P, Renerre M. Lipid and protein oxidation in vitro, and antioxidant potential in meat from Charolais cows finished on pasture or mixed diet. Meat Sci. 2004;66:467-473. [PubMed] |
| 26. | 光 敏, 宋 滇平. 炎症因子与糖尿病及其血管并发症. 中华临床医师杂志(电子版). 2013;7:264-266. |
| 27. | Dauriz M, Trombetta M, Boselli L, Santi L, Brangani C, Pichiri I, Bonora E, Bonadonna RC. Interleukin-6 as a potential positive modulator of human beta-cell function: an exploratory analysis-the Verona Newly Diagnosed Type 2 Diabetes Study (VNDS) 6. Acta Diabetol. 2015; Nov 4. [Epub ahead of print]. [PubMed] |
| 28. | Parker BL, Thaysen-Andersen M, Fazakerley DJ, Holliday M, Packer NH, James DE. Terminal Galactosylation and Sialylation Switching on Membrane Glycoproteins upon TNF-Alpha-Induced Insulin Resistance in Adipocytes. Mol Cell Proteomics. 2016;15:141-153. [PubMed] |
| 29. | den Ouden H, Berends J, Stellato RK, Beulens JW, Rutten GE. Effect of six years intensified multifactorial treatment on levels of hs-CRP and adiponectin in patients with screen detected type 2 diabetes: the ADDITION-Netherlands randomized trial. Diabetes Metab Res Rev. 2015;31:758-766. [PubMed] [DOI] |