修回日期: 2015-12-07
接受日期: 2015-12-14
在线出版日期: 2016-02-08
目的: 本研究尝试使用添加无外泌体血清(Exosome-depleted FBS)的培养基培养细胞并提取外泌体, 比较无外泌体血清和传统的无血清两种不同的培养条件对结肠癌HCT116细胞外泌体分泌的影响, 旨在优化外泌体提取条件, 使之有利于后续功能研究.
方法: 采用提取前24 h无血清和添加无外泌体血清培养基培养结肠癌细胞, 普通光学显微镜下观察两种培养条件下细胞的生长和形态, 用超速离心法分步提取分泌到细胞培养上清中的外泌体, 透射电子显微镜下观察外泌体的形态, 蛋白免疫印迹法分析外泌体标志蛋白, 以及纳米颗粒追踪计数分析外泌体大小和含量.
结果: 与无血清培养条件相比, 添加无外泌体血清培养的HCT116细胞生长状态良好, 细胞无明显死亡现象. 两种培养条件分泌的外泌体形态相近, 均呈圆形或椭圆形, 由脂质双分子层包裹的小囊泡, 直径为40-100 nm. 无外泌体血清培养条件分泌的外泌体大约是无血清培养的6倍, 二种培养条件下提取的外泌体直径均为90 nm左右, 与电镜结果一致. 两种培养条件提取的外泌体中均检测到HSP70和CD63外泌体标志蛋白.
结论: 添加无外泌体血清培养HCT116细胞分泌的外泌体与无血清培养相比无明显差异, 但添加无外泌体血清培养的细胞状态比无血清培养的细胞状态好, 外泌体的分泌可能更接近生理条件下的生长环境, 分泌的外泌体数量更多, 因此无外泌体血清培养条件较无血清培养更适合结肠癌来源外泌体的提取和研究.
核心提示: 细胞经去除外泌体血清培养较血清饥饿条件细胞外泌体分泌量增加, 其结构和特征不变, 提示无外泌体血清培养条件更适合结肠癌来源外泌体的提取和研究.
引文著录: 高佳佳, 李薇, 鞠强, 周兰萍, 赵晓航. 血清饥饿对结肠癌HCT116细胞外泌体分泌的影响. 世界华人消化杂志 2016; 24(4): 566-572
Revised: December 7, 2015
Accepted: December 14, 2015
Published online: February 8, 2016
AIM: To investigate the influence of serum starvation on secretion of exosomes, to find a more conducive way to get more exosomes.
METHODS: Fetal bovine serum (FBS)-free medium and medium containing exosome-depleted FBS were used to culture HCT116 cells. Ultracentrifugation was used to extract exosomes, and ordinary optical microscope was used to observe the physiological state of the cells. Exosome markers were detected by Western blot. Exosomes were observed by transmission electron microscopy and counted with Nanosight.
RESULTS: Ordinary optical microscopy showed that cells cultured in medium containing exosome-depleted FBS grew in good state, and there was no obvious cell death compared with those cultured in FBS-free condition.Transmission electron microscopy showed that the exosomes secreted by cells had a diameter of 40-100 nm and were protected by a lipid bilayer. Western blot analysis showed that the exosomes were positive for CD63 and heat shock protein 70 in two kinds of culture conditions. The quantity of exosomes secreted by cells cultured in medium containing exosome-depleted FBS was about 6 times more than that by cells cultured in FBS-free medium.
CONCLUSION: Exosomes secreted by HCT116 cells cultured in medium containing exosome-depleted FBS have no obvious differences from those by HCT116 cells cultured in FBS-free medium. However, the cells grow better and more exosomes can be obtained when cultured in medium containing exosome-depleted FBS.
- Citation: Gao JJ, Li W, Ju Q, Zhou LP, Zhao XH. Effect of serum starvation on secretion of exosomes in colorectal cancer HCT116 cells. Shijie Huaren Xiaohua Zazhi 2016; 24(4): 566-572
- URL: https://www.wjgnet.com/1009-3079/full/v24/i4/566.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i4.566
外泌体(exosome)是细胞分泌的直径介于40-100 nm之间多形性囊泡样小体, 由细胞内吞系统中的晚期小体(late endosome)或多囊泡内体发源而来, 包括肿瘤细胞、干细胞、免疫细胞和神经细胞等多种细胞可以分泌外泌体[1]. 外泌体是多种功能性生物大分子的运载体, 可携带如DNA、RNA(非编码RNA和miRNA)、蛋白质和脂质等, 研究表明其RNA和蛋白质可广泛参与对肿瘤侵袭和转移的调控[2]. 肿瘤患者血清外泌体含量显著高于健康对照人群, 肿瘤细胞来源或肿瘤相关外泌体对肿瘤发生发展具有重要的调控作用[3,4]. 通过改变肿瘤微环境, 促进血管生成和肿瘤转移, 或直接作用于肿瘤细胞而影响肿瘤进展[5]. 近期研究[6]提示, 即使同一肿瘤来源的外泌体其作用也并不完全相同, 可能与机体的免疫状态、肿瘤恶性程度以及外泌体本身的分子特征等多种因素相关. 对外泌体结构和功能的认识是肿瘤学研究领域的新热点, 引起科学家广泛的兴趣[7]. 目前对肿瘤相关外泌体的研究多来源于细胞学实验, 认识十分有限. 因此, 如何获得高纯度、更接近体内状态的外泌体是进一步探寻其组成和功能的基础[8].
基于从体外培养细胞上清中提取外泌体是研究外泌体普遍使用的方法之一. 为避免细胞培养中添加血清会引入外源外泌体的污染, 通常在提取外泌体前24 h细胞需经历无血清培养. 但无血清培养也会改变细胞生长状态, 在血清饥饿(serum starvation)的刺激下培养细胞因缺乏血清生长因子而不能分裂, 部分细胞在培养过程中死亡, 使外泌体不能连续分泌, 提取效率低, 实验周期长. 为了解决这个技术问题, 人们尚试将用于细胞培养的血清经多步超速离心, 以去除血清本身的外源外泌体, 但此方法需超速离心, 耗时较长, 普通实验室可能不具备这些条件.
本文尝试, 在细胞培养基中添加一种商品化的去除外泌体血清(Exosome-depleted FBS, 无外泌体但含有生长因子)并比较细胞经历血清饥饿与否对其外泌体分泌量和特性的影响, 探讨一种接近体内生理状态的最佳外泌体提取方法. 结果提示, 细胞经去除外泌体血清培养较血清饥饿条件细胞外泌体分泌量增加, 其结构和特征不变.
人结肠癌HCT116细胞(ATCC CCL-247)购自美国标准生物品收藏中心(American type culture collection, ATCC, Rockville, MD, USA); 去除外泌体血清Exo-FBS™ Exosome-depleted FBS购自美国SBI(System Biosciences, San Francisco, CA, USA)公司; 兔抗人CD63和HSP70多克隆抗体购自美国Santa Cruz Biotech(Santa Cruz, CA)公司; 辣根过氧化物酶标记的山羊抗兔抗体购自中杉金桥生物技术公司(北京, 中国); LAS4000型荧光图像分析仪、CM120型透射电子显微镜、Optima™ L80 XP超速离心机和NanoSight® NS500纳米颗粒追踪计数仪分别为日本FUJIFILM、荷兰PHILIPS、美国Beckman和英国Malvern公司产品.
1.2.1 细胞培养: HCT116细胞培养于含10%胎牛血清(FBS)的RPMI 1640完全培养基中, 于含50 mL/L CO2的37 ℃细胞培养箱中培养, 依细胞生长情况大约每隔2-3 d传代1次.
1.2.2 培养上清的收集: 观察HCT116细胞的贴壁生长情况, 待细胞融合度达90%左右(约1.8×107个细胞)弃去原有的培养基, 用无菌的1×PBS溶液清洗3遍, 加入无血清RPMI 1640培养基(血清饥饿组)或添加2%Exosome-depleted FBS的RPMI 1640培养基(非血清饥饿组), 37 ℃培养24 h后, 在50 mL离心管中收集培养上清.
1.2.3 外泌体的提取和鉴定: 将收集的培养上清300 g, 4 ℃离心10 min, 将上清转移至新的50 mL离心管中; 2000 g, 4 ℃离心20 min, 再将上清转移至新的50 mL离心管中; 10000 g, 4 ℃离心30 min, 将上清转入超速离心管中; 再用100000 g, 4 ℃离心2 h, 弃除上清, 用1 mL 1×PBS洗沉淀2次; 最后将沉淀用1×PBS重悬. 取25 μL外泌体滴于直径2 mm的载样铜网上, 在室温下静置l min, 从侧面用滤纸吸干液体, 在铜网上滴加约30 μL的1%醋酸双氧铀, 室温负染3-5 min, 用滤纸吸干负染液, 室温放置2 h晾干后, 将铜网放在透射电镜下, 于120 kV电压下观察外泌体形态, 在镜下用标尺量取外泌体的直径并拍照, 最后用photoshop CS5作图.
1.2.4 外泌体的计数: 取重悬在1×PBS中的外泌体溶液50 μL, 10倍稀释, NanoSight® NS500检测外泌体样本, 用Nanoparticle Tracking Analysis (NTA) Version 2.3 Build 0034软件分析溶液中颗粒的大小分布和浓度, 统计外泌体的数量并用Prism 5作图.
1.2.5 蛋白免疫印迹: 在富集的外泌体沉淀中, 加入50 μL的蛋白裂解液(25 mmol/L Tris-HCl pH 7.6; 150 mmol/L NaCl; 1%NP-40; 1%脱氧胆酸钠; 0.1%SDS), 使用前按说明加入蛋白酶抑制剂cocktail(Roche)混匀, 冰上放置30 min以充分裂解外泌体. 考马斯亮蓝法测定蛋白质浓度, 50 μg外泌体蛋白裂解液经10%SDS-PAGE电泳, 110 V恒压转膜, 10%脱脂牛奶室温封闭3 h, 加入稀释抗体于4 ℃摇床上孵育过夜, 经TBST洗膜后加入二抗室温孵育1 h, 加入ECL化学发光试剂显色并在LAS4000图像分析仪中曝光和采集图像, 检测外泌体的标志性蛋白HSP70和CD63.
统计学处理 计量资料以mean±SD表示, 用t检验比较无血清和无外泌体血清两种培养方法分泌的外泌体的数量差异, P<0.05为差异具有统计学意义.
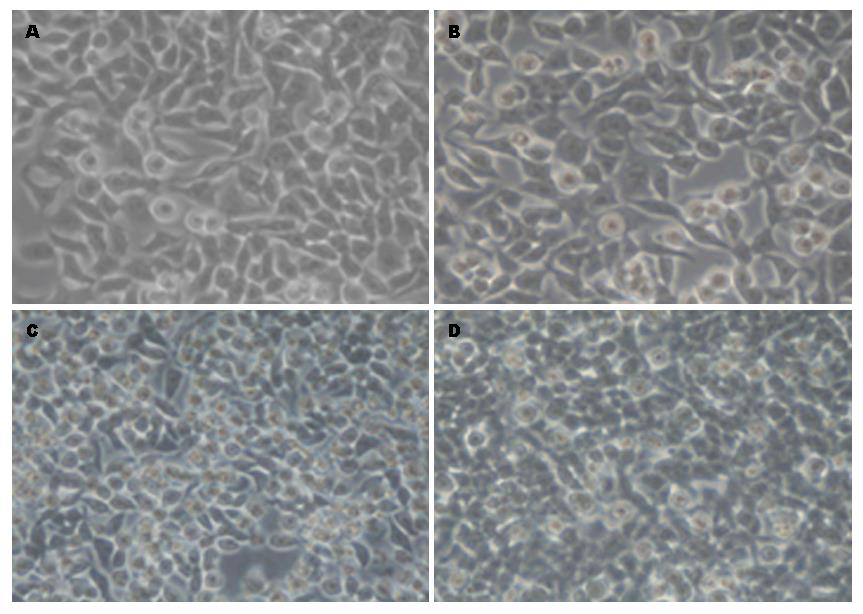
用完全培养基培养HCT116细胞, 待细胞融合度达到90%左右(约1.8×107个细胞)后, 弃去原有培养基, 分别用无血清(血清饥饿)和添加无外泌体血清(非血清饥饿)两种培养条件培养HCT116细胞系24 h. 培养24 h后, 在普通光学显微镜下观察细胞形态, 发现在无血清培养的细胞大部分呈多角形的上皮样结构, 部分细胞发生皱缩, 贴壁不牢, 另有部分细胞死亡. 添加无外泌体血清的培养细胞呈多角形的上皮样结构, 贴壁及生长情况良好, 无细胞死亡现象(图1).
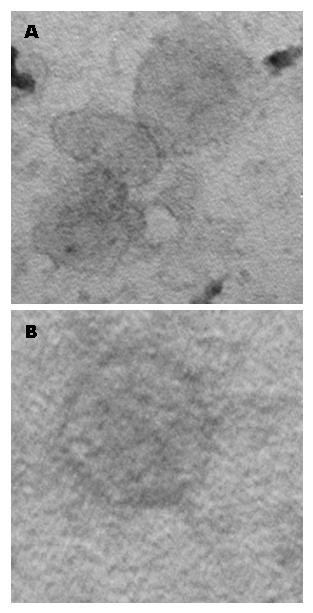
透射电镜观察外泌体, 结果显示血清饥饿和非血清饥饿培养条件下分泌的外泌体形态相近, 均呈圆形或椭圆形, 由脂质双分子层包裹的小囊泡, 直径为40-100 nm. 提示两种培养条件对外泌体的大小和形态无明显差别(图2).
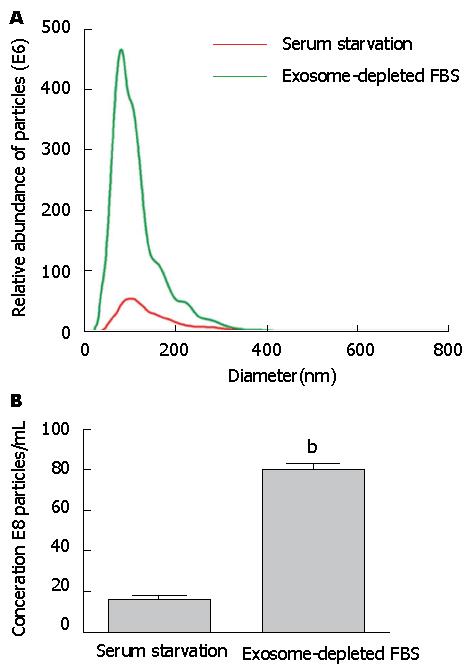
相同数量的细胞分别经血清饥饿(无血清RPMI 1640)和非血清饥饿(无外泌体血清Exosome-depleted FBS/RPMI 1640)培养条件培养24 h后提取外泌体, 经NanoSight分析外泌体含量发现, 非血清饥饿组外泌体含量约为无血清培养组的6倍, 两组样本外泌体直径约为90 nm, 无差异, 与电镜结果一致(图3).
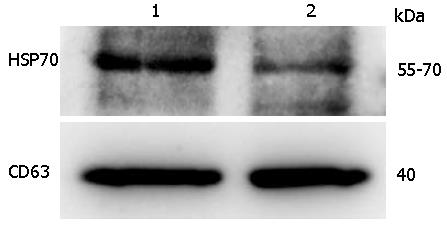
蛋白免疫印迹分析血清饥饿(无血清RPMI 1640)和非血清饥饿(无外泌体血清Exosome-depleted FBS/RPMI 1640)培养条件下提取的外泌体蛋白, 结果显示在分子量为70 kDa和40 kDa处均检测到外泌体标志分子HSP70和CD63, 提示两种培养条件提取的蛋白质均为外泌体(图4).
结肠癌是世界和我国常见恶性肿瘤之一, 发病率仅次于胃癌和食管癌[9], 全世界每年大约有100万新发病例, 且发病率近年来仍呈现上升的趋势[10]. 在结直肠癌患者中, 25%在首次确诊时已发现存在肝转移, 另外25%在随后的病程中发生肝转移[11]. 转移作为恶性肿瘤的一个重要特征, 其与肿瘤微环境密切相关[12].
分泌蛋白是肿瘤微环境中细胞间主要的通讯分子[13]. 此外, 细胞还分泌膜囊泡等更复杂的结构, 其中就包括外泌体. 外泌体是由细胞内吞系统中的晚期小体(late endosome)或多囊泡内体发源而来的, 直径介于40-100 nm之间, 呈多形性囊泡样的小体, 包括肿瘤细胞、干细胞、免疫细胞和神经细胞等均可分泌[1]. 外泌体的组成复杂, 可携带包括DNA、非编码 RNA、蛋白质和脂质等多种功能信号分子[14]. 研究[15,16]表明, 大多数外泌体中含有相同的蛋白质, 如膜转运和融合相关蛋白(Rab GTPase、Annexins、Flotillin等)、分子伴侣(HSP70和HSP90)、整合素和四跨膜蛋白超家族(CD63、CD9、CD81、CD82)等, 可以作为外泌体的标志分子. 这些携带包括DNA、蛋白质和脂质等多种功能成分的外泌体, 形成了一种全新的细胞间信息传递体系, 参与肿瘤细胞对其周围细胞的调控[17], 影响细胞的生理状态并与多种疾病的发生发展密切相关[18], 因此近年来人们对外泌体的研究兴趣逐年增加. 外泌体可通过表面受体蛋白和具有生物活性的脂质配体激活细胞表面受体, 通过膜融合释放内含物以及内吞作用进入靶细胞等方式进行信息传递和交换, 调节细胞生理活动[19]. 例如, 胃癌细胞来源的外泌体能通过MAPK/ERK信号通路诱导Jurkat T细胞的凋亡[20]. 肿瘤来源或肿瘤相关的外泌体参与调控肿瘤发生发展的过程[3,4], 其通过改变肿瘤微环境, 促进肿瘤血管新生和肿瘤转移, 以及直接作用于肿瘤细胞等途径, 影响肿瘤的进展[21]. 大量研究表明, 外泌体可以促进肿瘤转移, 调控肿瘤进展. 随着肿瘤的生长外泌体被源源不断地释放进入肿瘤微环境[22], 在癌症患者的体液中外泌体含量显著高于健康对照人群, 提示外泌体可能对肿瘤的发生发展起着重要作用.
目前外泌体的提取方法有离心法、密度梯度离心法、过滤离心法、色谱法和免疫磁珠法等, 但没有一种方法既能保证外泌体的含量和纯度, 又能保证其生物活性. 离心法是外泌体常用的提取方法, 虽然得到的外泌体量多, 但纯度不足, 而且外泌体结构和大小有可能被改变. 目前外泌体广泛应用的提取方法是超速离心法和纳米材料ExoQuick试剂提取法. 其中, 超速离心法分离得到的外泌体纯度较高, 但前期准备工作繁杂, 耗时, 含量较低[23]; 纳米材料ExoQuick提取法, 提取效率高, 省时, 但会含有杂蛋白, 方法各有利弊[8]. 在电子显微镜下, 外泌体呈现囊泡状结构. 通常由于样品在提取的过程中囊泡发生塌陷, 在低温电镜和扫描电镜下外泌体也呈杯状或瘪足球状[24].
为了更好地研究外泌体的生物学功能, 建立合适的培养体系十分必要. 前期实验室在研究结肠癌外泌体时发现血清饥饿培养条件提取外泌体效率低, 耗时长, 结肠癌细胞系HCT116是研究人员常用的研究结直肠癌外泌体的细胞模型[25,26], 故本文以HCT116为模型研究添加无外泌体血清培养条件和无血清培养对结肠癌外泌体分泌的影响, 为后续的相关研究奠定基础. 当前外泌体的研究中, 普遍采取的方法是无血清培养基, 这种培养方法虽然避免了普通胎牛血清自身含有的外源性外泌体的干扰, 但血清饥饿环境缺少细胞生长所必需的生长因子, 导致细胞在培养过程中生理状态改变或部分死亡, 不能连续分泌外泌体, 与体内生理状态相却甚远. 针对上述问题, 本研究尝试了在细胞培养基中添加一种商品化的去除外泌体血清并比较细胞经历血清饥饿与否对其外泌体分泌量和特性的影响, 探讨一种接近体内生理状态的最佳外泌体提取方法.
去除外泌体的血清去除了胎牛血清中外源性外泌体大小的囊泡、CD63阳性的牛来源的外泌体以及牛microRNAs等外源性特殊信号分子, 既满足了细胞正常生长所必需的培养条件, 又不会对要研究的外泌体产生干扰, 且比自己从传统血清中去除外泌体的方法更快捷, 安全, 理论上更适合于细胞的培养和外泌体的提取. 本实验用无外泌体血清和无血清两种培养条件培养结肠癌HCT116细胞, 比较了细胞生长和分泌外泌体情况. 普通光学显微镜下观察培养24 h后细胞的生理状态, 无血清培养的细胞部分死亡, 且细胞形态改变; 无外泌体血清培养的细胞生长良好, 无死亡细胞. 结果提示, 细胞经去除外泌体血清培养较血清饥饿条件细胞外泌体分泌量增加, 其结构和特征不变. 说明无外泌体血清培养条件更有利于细胞的生长, 且可以连续培养, 从而缩短了实验周期. 通过透射电镜观察外泌体的形态, 两种培养条件分泌的外泌体形态相近, 均呈圆形或椭圆形, 由脂质双分子层包裹的小囊泡, 直径为40-100 nm. 说明添加无外泌体血清不影响外泌体的形态和大小. 同时利用蛋白免疫印迹检测其标志蛋白HSP70和CD63, 均在理论分子量处有明显条带, 说明两种培养条件均可提取到外泌体蛋白. 相同的培养时间、细胞数量和培养基量, 添加无外泌体血清培养条件分泌的外泌体大约是无血清培养的6倍, 同时二者大小一致, 直径约为90 nm, 与电镜观察结果一致.
本研究通过实验证实了新培养条件的可行性, 该方法能够较好的保持细胞的生长状态, 外泌体的分泌可能更接近实际生长环境中的情况, 并显著提高外泌体的分泌量, 缩短了外泌体的提取周期, 为结肠癌来源外泌体的进一步研究奠定了基础.
结肠癌是世界和我国常见恶性肿瘤之一, 发病率仅次于胃癌和食管癌, 25%在首次确诊时已发现存在肝转移. 大量研究表明, 外泌体可以促进肿瘤转移, 调控肿瘤进展. 目前对肿瘤相关外泌体的研究多来源于细胞学实验, 认识十分有限. 因此, 如何获得高纯度、更接近体内状态的外泌体是进一步探寻其组成和功能的基础.
陈绍勤, 副教授, 主任医师, 福建医科大学附属第一医院胃肠外科二病区
外泌体是肿瘤学研究的新兴领域, 外泌体结构和功能的认识是肿瘤学研究领域的新热点, 在转化医学的研究背景下, 将极大推动肿瘤学研究进展.
本文作者前期研究结肠癌外泌体时发现, 应用传统的血清饥饿培养方法提取的外泌体效率低, 周期长, 故本实验尝试优化细胞的培养条件.
本研究尝试使用添加无外泌体血清的培养基培养细胞并提取外泌体, 优化了结肠癌外泌体的提取条件, 为后续的相关研究奠定了基础.
本文探究了一种更适合结肠癌外泌体提取的细胞培养方法-添加无外泌体血清, 此方法与血清饥饿方法相比外泌体分泌量增加, 其结构和特征不变, 为研究人员研究外泌体提供了更适合的细胞培养方法.
无外泌体血清: 去除了胎牛血清中外源性外泌体大小的囊泡、CD63阳性的牛来源的外泌体以及牛microRNAs等外源性特殊信号分子的血清.
本文设计较合理, 研究表明无外泌体血清培养条件较无血清培养更适合结肠癌外泌体的提取和研究.
编辑: 郭鹏 电编: 闫晋利
| 1. | Lässer C, Alikhani VS, Ekström K, Eldh M, Paredes PT, Bossios A, Sjöstrand M, Gabrielsson S, Lötvall J, Valadi H. Human saliva, plasma and breast milk exosomes contain RNA: uptake by macrophages. J Transl Med. 2011;9:9. [PubMed] [DOI] |
| 2. | Yang Y, Yang X, Yang Y, Zhu H, Chen X, Zhang H, Wang F, Qin Q, Cheng H, Sun X. Exosomes: A Promising Factor Involved in Cancer Hypoxic Microenvironments. Curr Med Chem. 2015;22:4189-4195. [PubMed] |
| 3. | Krause M, Samoylenko A, Vainio SJ. Exosomes as renal inductive signals in health and disease, and their application as diagnostic markers and therapeutic agents. Front Cell Dev Biol. 2015;3:65. [PubMed] [DOI] |
| 4. | Zhang M, Zhang CG, Ding W. [Exosome in cancer diagnosis and treatment]. Shengli Kexue Jinzhan. 2014;45:372-378. [PubMed] |
| 6. | Hannafon BN, Ding WQ. Intercellular communication by exosome-derived microRNAs in cancer. Int J Mol Sci. 2013;14:14240-14269. [PubMed] [DOI] |
| 7. | Vella LJ. The emerging role of exosomes in epithelial-mesenchymal-transition in cancer. Front Oncol. 2014;4:361. [PubMed] [DOI] |
| 8. | 王 仁峰, 耿 振, 李 朝阳, 鲍 会静, 李 雪, 周 迪苏, 宋 士伟, 刘 运德. ExoQuick提取人血清外泌体方法改良及比较. 实用医学杂志. 2015;31:2458-2462. |
| 9. | Evans JP, Sutton PA, Winiarski BK, Fenwick SW, Malik HZ, Vimalachandran D, Tweedle EM, Costello E, Palmer DH, Park BK. From mice to men: Murine models of colorectal cancer for use in translational research. Crit Rev Oncol Hematol. 2015; Nov 1. [Epub ahead of print]. [PubMed] [DOI] |
| 10. | Aune D, Chan DS, Lau R, Vieira R, Greenwood DC, Kampman E, Norat T. Dietary fibre, whole grains, and risk of colorectal cancer: systematic review and dose-response meta-analysis of prospective studies. BMJ. 2011;343:d6617. [PubMed] [DOI] |
| 12. | Hoshino A, Costa-Silva B, Shen TL, Rodrigues G, Hashimoto A, Tesic Mark M, Molina H, Kohsaka S, Di Giannatale A, Ceder S. Tumour exosome integrins determine organotropic metastasis. Nature. 2015;527:329-335. [PubMed] [DOI] |
| 13. | Lindoso RS, Sandim V, Collino F, Carvalho AB, Dias J, da Costa MR, Zingali RB, Vieyra A. Proteomics of cell-cell interactions in health and disease. Proteomics. 2016;16:328-344. [PubMed] [DOI] |
| 14. | Couzin J. Cell biology: The ins and outs of exosomes. Science. 2005;308:1862-1863. [PubMed] [DOI] |
| 15. | Aliotta JM. Tumor exosomes: a novel biomarker? J Gastrointest Oncol. 2011;2:203-205. [PubMed] [DOI] |
| 16. | Petersen SH, Odintsova E, Haigh TA, Rickinson AB, Taylor GS, Berditchevski F. The role of tetraspanin CD63 in antigen presentation via MHC class II. Eur J Immunol. 2011;41:2556-2561. [PubMed] [DOI] |
| 17. | Øverbye A, Skotland T, Koehler CJ, Thiede B, Seierstad T, Berge V, Sandvig K, Llorente A. Identification of prostate cancer biomarkers in urinary exosomes. Oncotarget. 2015;6:30357-30376. [PubMed] [DOI] |
| 18. | Coakley G, Maizels RM, Buck AH. Exosomes and Other Extracellular Vesicles: The New Communicators in Parasite Infections. Trends Parasitol. 2015;31:477-489. [PubMed] [DOI] |
| 20. | 曲 晶磊, 赵 明芳, 曲 秀娟, 侯 科佐, 姜 又红, 杨 向红, 刘 云鹏. MAPK/ERK信号通路在胃癌细胞来源的外来体诱导Jurkat T细胞凋亡中的作用. 世界华人消化杂志. 2010;18:1969-1973. [DOI] |
| 21. | Kumar B, Garcia M, Murakami JL, Chen CC. Exosome-mediated microenvironment dysregulation in leukemia. Biochim Biophys Acta. 2015; Sep 15. [Epub ahead of print]. [PubMed] [DOI] |
| 22. | Smyth T, Kullberg M, Malik N, Smith-Jones P, Graner MW, Anchordoquy TJ. Biodistribution and delivery efficiency of unmodified tumor-derived exosomes. J Control Release. 2015;199:145-155. [PubMed] [DOI] |
| 23. | Taylor DD. Isolation and molecular characterization of extracellular vesicles. Methods. 2015;87:1-2. [PubMed] [DOI] |
| 24. | Mathivanan S, Fahner CJ, Reid GE, Simpson RJ. ExoCarta 2012: database of exosomal proteins, RNA and lipids. Nucleic Acids Res. 2012;40:D1241-D1244. [PubMed] [DOI] |
| 25. | Ragusa M, Statello L, Maugeri M, Barbagallo C, Passanisi R, Alhamdani MS, Li Destri G, Cappellani A, Barbagallo D, Scalia M. Highly skewed distribution of miRNAs and proteins between colorectal cancer cells and their exosomes following Cetuximab treatment: biomolecular, genetic and translational implications. Oncoscience. 2014;1:132-157. [PubMed] |
| 26. | Silva J, Garcia V, Rodriguez M, Compte M, Cisneros E, Veguillas P, Garcia JM, Dominguez G, Campos-Martin Y, Cuevas J. Analysis of exosome release and its prognostic value in human colorectal cancer. Genes Chromosomes Cancer. 2012;51:409-418. [PubMed] |