修回日期: 2016-10-18
接受日期: 2016-10-24
在线出版日期: 2016-12-18
研究氟尿嘧啶植入剂(中人氟安, Sinofuan)和注射液对胃癌细胞腹腔播散化疗疗效的差异及其机制.
♀BALB/c(nu/nu)裸鼠, 每只腹腔注射0.5 mL(含2×106个)MKN-45细胞悬液建立裸鼠腹膜移植瘤模型. 选取51只成瘤裸鼠, 随机数字法分为对照组、氟尿嘧啶注射液组(2 mg/只)和氟尿嘧啶植入剂组(2 mg/只). 严密观察各组裸鼠的一般状态、体质量变化和生存期, 测量腹水体积, 显微镜下计数每毫升腹水中的肿瘤细胞数, 流式细胞仪检测腹水肿瘤细胞凋亡率.
与对照组相比, 氟尿嘧啶注射液组和氟尿嘧啶植入剂组裸鼠的一般状态良好, 体质量增长缓慢, 全身症状出现较晚, 生存期延长(与对照组相比, 均P<0.05), 其中, 氟尿嘧啶植入剂组中位生存期较氟尿嘧啶注射液组亦延长(25 d vs 19 d, P<0.01). 氟尿嘧啶植入剂组的腹水体积少于氟尿嘧啶注射液组[(5.66 mL±1.00 mL) vs (8.78 mL±1.19 mL), P<0.01]; 但两组每毫升腹水中的肿瘤细胞数差异无统计学意义[(2.75×108/mL±0.71×108/mL) vs (3.46×108/mL±0.69×108/mL)]. 氟尿嘧啶植入剂组的肿瘤细胞凋亡率高于氟尿嘧啶注射液组(14.49%±0.80% vs 2.03%±0.64%, P<0.01).
氟尿嘧啶植入剂对胃癌腹腔播散有更明显的抑制作用.
核心提要: 腹腔播散是晚期胃癌常见的转移方式, 5-氟尿嘧啶是最主要的胃癌腹腔化疗药物, 其缓释剂型释药时间长, 有研究显示氟尿嘧啶植入剂局部药物浓度高而血药浓度低. 本文旨在研究氟尿嘧啶植入剂及注射液腹腔化疗疗效的差异, 为临床治疗提供实验基础.
引文著录: 朱金峰, 曾薇, 葛磊, 王海江. 氟尿嘧啶植入剂和注射液在MKN-45裸鼠腹膜移植瘤腹腔化疗中的差异. 世界华人消化杂志 2016; 24(35): 4684-4690
Revised: October 18, 2016
Accepted: October 24, 2016
Published online: December 18, 2016
To compare the inhibitory effect of sustained-release fluorouracil (Sinofuan) and fluorouracil injection on peritoneally transplanted MKN-45 tumors in nude mice.
Fifty-one nude mice peritoneally transplanted with MKN-45 cells were randomly divided into three groups: control group, fluorouracil injection group (2 mg/nude mouse), and sustained-release fluorouracil group (2 mg/nude mouse). The general status of the nude mice, body mass changes and survival were observed. Ascites volume was measured, the number of tumor cells per milliliter of ascites was counted, and tumor cell apoptosis was detected.
Compared with the control group, the general status of nude mice from the fluorouracil injection group and sustained-release fluorouracil group were better with regard to slower weight gain, delayed systemic symptoms and prolonged survival (P < 0.05). The median survival of mice in the sustained-release fluorouracil group was prolonged compared with the fluorouracil injection group (25 d vs 19 d, P < 0.01). Ascites volume in the sustained-release fluorouracil group was less than that in the fluorouracil injection group [(5.66 mL ± 1.00 mL) vs (8.78 mL ± 1.19 mL), P < 0.01], but the difference in the number of ascitic tumor cells per milliliter between the two groups was not statistically significant [(2.75 × 108/mL ± 0.71 × 108/mL) vs (3.46 × 108/mL ± 0.69 × 108/mL)]. Tumor cell apoptosis rate was significantly higher in the sustained-release fluorouracil group than in the fluorouracil injection group (14.49% ± 0.80% vs 2.03% ± 0.64%, P < 0.01).
Sustained-release fluorouracil is better than fluorouracil injection in intraperitoneal chemotherapy for peritoneally transplanted MKN-45 tumors in nude mice.
- Citation: Zhu JF, Zeng W, Ge L, Wang HJ. Inhibitory effect of intraperitoneal chemotherapy with sustained-release fluorouracil vs fluorouracil injection on peritoneally transplanted MKN-45 tumors in nude mice. Shijie Huaren Xiaohua Zazhi 2016; 24(35): 4684-4690
- URL: https://www.wjgnet.com/1009-3079/full/v24/i35/4684.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i35.4684
胃癌是我国也是全世界最常见的恶性肿瘤之一, 居恶性肿瘤发病率和死亡率的前列[1,2]. 我国新发胃癌患者中, 早期者仅占5%-10%[3], 大多数患者就诊时病期较晚[4]. 腹腔播散是晚期胃癌常见的转移方式, 可出现癌性腹水, 消化道、泌尿系、胆道梗阻, 甚至恶病质, 预后很差[5-10], 中位生存期一般不超过6 mo[11-13]. 因常规治疗方式效果均不理想[14,15], 而腹腔化疗因腹腔内局部药物浓度高, 血药浓度低, 代谢慢, 作用时间长, 全身不良反应少等优点而成为目前研究较多的治疗方法[16-19]. 5-氟尿嘧啶(5-Fluorouracil, 5-FU)是最主要的胃癌化疗药物[20], 但其半衰期短, 不良反应较大, 其疗效不仅与药物浓度有关, 而且更与作用时间密切相关[21]. 中人氟安(氟尿嘧啶植入剂, Sinofuan)为5-FU的缓释剂型, 植入体内后, 释药时间长, 局部药物浓度高而血药浓度低[19,22]. 课题组前期实验建立了胃癌腹腔播散的动物实验模型, 确定了中人氟安用于裸鼠腹膜移植瘤腹腔化疗的最佳剂量[23]. 本实验在此成熟的动物模型中进行治疗实验研究, 揭示氟尿嘧啶注射液及植入剂腹腔化疗疗效的差异, 为临床治疗提供实验基础.
♀BALB/c(nu/nu)裸小鼠(4-5 wk, 18-20 g)均购自上海斯莱克实验动物公司(上海, 中国). 自由饮食, 饲养于SPF级环境中, 温度控制在25 ℃. 12 h光照周期. MKN-45细胞株由新疆肿瘤防治研究所提供. 氟尿嘧啶植入剂(商品名:中人氟安, 每粒约含2 mg 5-FU; 芜湖先声中人药业有限公司)、5-FU注射液(25 mg/mL; 10 mL/支; 上海旭东海普制药厂)、PE Annexin V 凋亡检测试剂盒(美国BD公司)、胎牛血清(以色列Biological Industries公司)、胰蛋白酶(以色列Biological Industries公司)、RPMI-1640(以色列Biological Industries公司).
1.2.1 动物模型的建立: 低分化高转移性人胃腺癌细胞系MKN-45细胞复苏后, 以含10%胎牛血清的RPMI-1640培养, 胰酶消化传代后, 取对数生长期的细胞, 经胰酶消化后, 800 rpm, 3 min离心后, 以0.9%氯化钠注射液重悬, 800 rpm, 3 min离心洗涤两次后, 以0.9%氯化钠注射液调整活细胞浓度为4×106/mL, 每只裸鼠腹腔注射0.5 mL(含2×106个)MKN-45细胞悬液, 以此作为实验第1天.
1.2.2 实验分组和给药方法: 在前期实验中, 32只裸小鼠, 每组8只, 分别为赋型剂对照组、氟尿嘧啶植入剂低剂量组(2 mg/只)、中剂量组(4 mg/只)和高剂量组(6 mg/只). 低剂量(2 mg/只)的氟尿嘧啶植入剂对于裸鼠MKN-45腹膜移植瘤的形成具有良好的抑制作用, 可以延长腹膜移植瘤裸鼠的生存期, 且安全性好. 此剂量下, 可以观察到的化疗不良反应主要为腹泻. 裸鼠对中剂量(4 mg/只)和高剂量(6 mg/只)的氟尿嘧啶植入剂耐受性差, 腹泻、纳差、消瘦等不良反应明显, 裸鼠很快出现体质量减轻及死亡. 因此, 在本实验中, 5-FU注射液及氟尿嘧啶植入剂的剂量定为2 mg/只, 化疗不良反应主要观察指标为腹泻.
裸鼠按体质量由小至大编号1-51, 随机数字法分为3组: 氟尿嘧啶植入剂组, 氟尿嘧啶注射液组, 生理盐水对照组, 每组17只(5只用于检测, 另12只用于生存期观察). 根据前期实验结果选择中人氟安组和氟尿嘧啶注射液组的给药剂量为2 mg/只. 于MKN-45细胞腹腔接种第4天开始给予干预措施. 生理盐水及氟尿嘧啶注射液以1 mL注射器给药, 氟尿嘧啶植入剂以植入针给药. 氟尿嘧啶植入剂组: 每只裸鼠腹腔植入中人氟安1粒(含5-FU约2 mg); 氟尿嘧啶注射液组: 每只裸鼠腹腔注射含2 mg的5-FU注射液0.5 mL(5-FU注射液160 μL+0.9%氯化钠注射液340 μL); 生理盐水组: 每只裸鼠腹腔注射0.5 mL 0.9%氯化钠注射液.
1.2.3 裸鼠腹水体积和肿瘤细胞数的计数: 于接种后第13天以断髓法随机处死各组中的5只. 无菌条件下开腹, 收集腹水, 计算体积. 每份标本取200 μL用4 ℃PBS稀释10倍, 按血细胞计数法记录每毫升腹水中的肿瘤细胞数. 剩余腹水以流式细胞术分析凋亡情况.
1.2.4 流式细胞仪检测: 按照PE Annexin V试剂盒说明书, 以Vantage SE型流式细胞仪(美国BD公司)检测肿瘤细胞凋亡率; 以4 ℃PBS调整细胞浓度为2.0×105个/mL, 检测肿瘤细胞凋亡.
1.2.5 一般情况及生存期观察: 每组另12只裸鼠在实验期间, 每日观察裸鼠饮食、化疗不良反应, 隔日记录体质量、腹围变化至化疗组全部裸鼠死亡, 绘制小鼠体质量变化曲线. 记录各组小鼠的生存时间.
统计学处理 采用SPSS 20.0软件. 计量资料正态分布用mean±SD表示, 对所有的样本进行正态检验, 各组间均数比较采用方差分析, 组间两两比较采用Bonfferoni t检验; 用Kaplan-Meier法绘制生存曲线. P<0.05为差异有统计学意义.
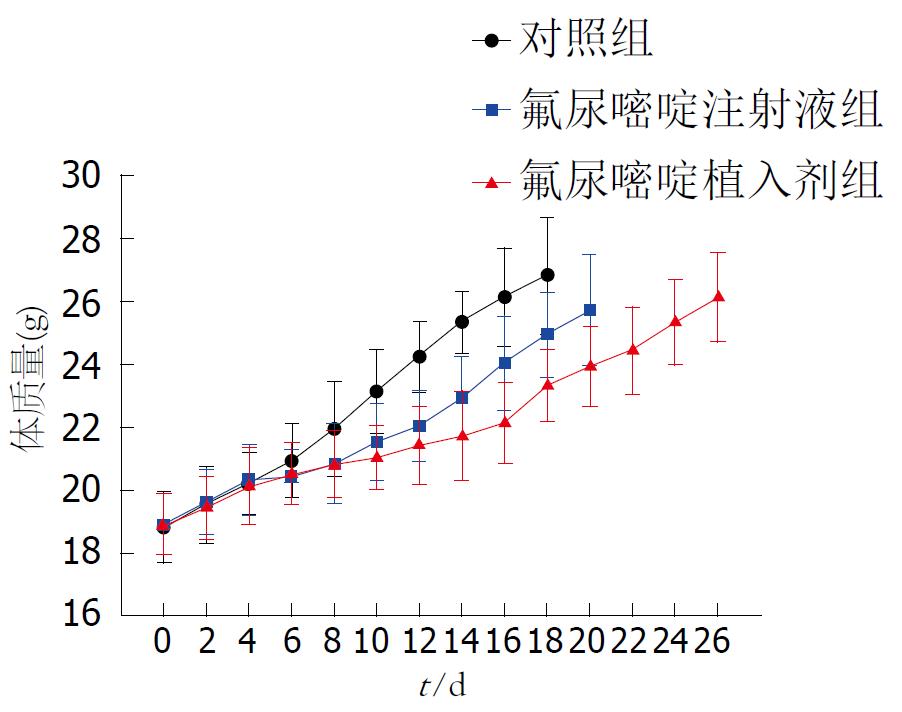
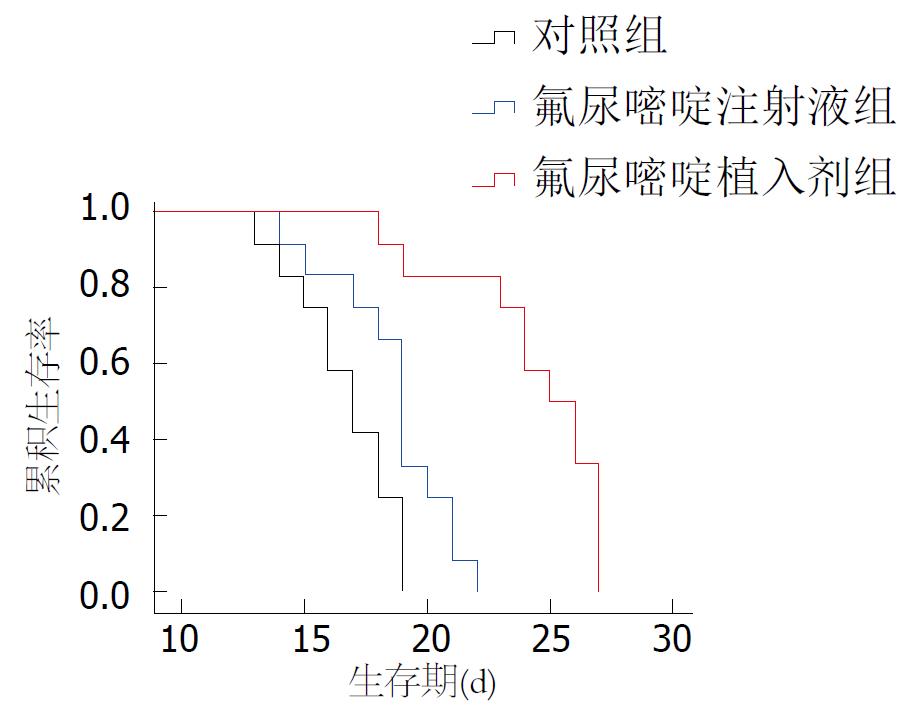
接种后第1-4天对照组裸鼠的体质量随腹水的增多呈快速增加, 但一般状态尚可, 与对照组相比, 给药后氟尿嘧啶植入剂组裸鼠体质量增加较平缓, 氟尿嘧啶注射液组体质量增加较快(图1). 第6天后裸鼠逐渐表现为精神萎靡不振、活动减少, 进食进水减少, 晚期腹部膨隆明显, 并呈恶液质状态, 至第13天对照组裸鼠开始死亡, 第19天全部死亡. 与对照组相比, 用药后氟尿嘧啶注射液组裸鼠第14天开始出现死亡, 至第22天全部死亡, 氟尿嘧啶植入剂组裸鼠的一般状态良好, 腹水生长缓慢, 全身症状出现较晚, 第18天开始死亡, 直至第27天全部死亡. 3组裸鼠的生存曲线如图2.
与氟尿嘧啶植入剂组组相比, 氟尿嘧啶注射液组裸鼠出现化疗相关不良反应(主要观察指标为腹泻)的比例较高(50.00% vs 8.33%, χ2 = 4.832, P<0.05), 腹腔化疗后第4天观察到出现腹泻, 持续1-3 d, 化疗第8天以后未再观察到腹泻.
对照组和氟尿嘧啶注射液组、氟尿嘧啶植入剂组裸鼠的中位生存期分别为17、19和25 d. 与对照组相比, 氟尿嘧啶注射液组及氟尿嘧啶植入剂生存期均有明显延长(均P<0.05), 且氟尿嘧啶植入剂组的生存期长于氟尿嘧啶注射液组(P = 0.000, 表1).
氟尿嘧啶注射液及植入剂组的腹水体积均较对照组减少(均P<0.05); 氟尿嘧啶植入剂组的腹水体积较氟尿嘧啶注射液组减少得更为显著(P<0.01). 3组之间每毫升腹水肿瘤细胞数无明显差异(表2).
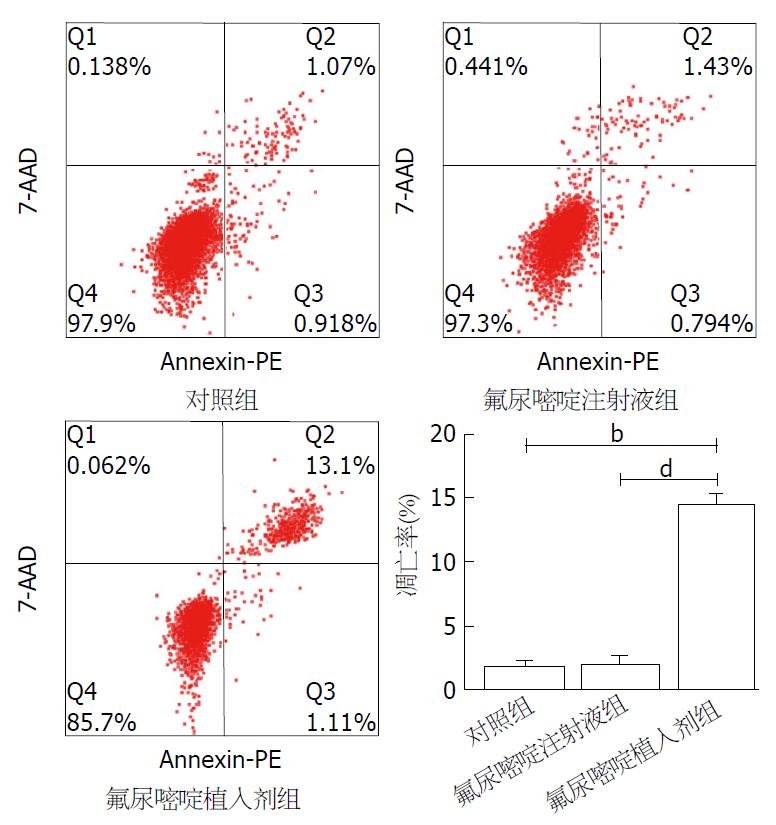
3组凋亡率分别为: 对照组1.77%±0.44%, 氟尿嘧啶植入剂组2.03%±0.64%, 氟尿嘧啶植入剂组14.49%±0.80%. 氟尿嘧啶植入剂组的腹水肿瘤细胞凋亡率较氟尿嘧啶注射液组及对照组均明显增高(均P<0.01), 而氟尿嘧啶注射液组和对照组间无明显差异(图3).
对于胃癌腹膜转移的患者, 全身系统化疗和腹腔局部化疗是目前主要的治疗方法[16-18], 但患者往往因为明显的不良反应且不甚显著的疗效而放弃全身系统化疗. 由于腹膜-血液屏障, 腹腔化疗时化疗药物在腹腔内的局部药物浓度远远高于血药浓度, 因而其代谢减慢, 作用时间延长, 而全身不良反应相对降低[17,19], 患者耐受性较好, 故腹腔化疗更为临床医生和患者的青睐[24]. 有研究[25]发现, 化疗药物腹腔给药后其药物浓度曲线下面积是静脉给药的10-1000倍.
5-FU是最常用的尿嘧啶抗代谢药, 干扰细胞核酸代谢导致肿瘤细胞凋亡及阻滞细胞周期使其停滞在S期. 5-FU可以静脉及腔内注射, 单独或与其他药物联合应用于胃癌术中治疗、辅助化疗及姑息治疗, 很多联合化疗均以其为基础, 是胃肠道肿瘤腹腔化疗最经典、研究最多的药物, 包括术中腹腔局部化疗及癌性腹水的腹腔内化疗. 但其半衰期短(在血浆中仅为10-20 min), 通常以持续静点或以其衍生物长程口服维持其有效的血药深度[21]. 为延长作用时间及降低不良反应, 多年来, 国内外学者对5-FU做了大量的改性研究, 其中, 我国学者自主研发的氟尿嘧啶植入剂(中人氟安)临床应用较广. 中人氟安系以5-FU为原料, 医用高分子聚合物L-聚乳酸为骨架, 制成的新型抗肿瘤固体植入剂. 植入体内后, 体液逐层渗入药粒微囊, 溶解膜内的药物, 在膜内形成高浓度, 在浓度梯度的作用下向膜外扩散(即渗透-扩散机制) , 释药时间的长短由膜层数控制, 形成较稳定的释放速度, 使得局部药物浓度高而血药浓度低[19,22,26-28]. 刘华顶等[29,30]研究显示中人氟安在人体局部组织液中通过渗透-扩散机制使5-FU向组织间质扩散, 有效药物浓度扩散距离3-7 cm, 其所含5-FU可在1 d内释放20%, 5 d释放50%, 15 d释放>75%. 洪艳艳等[31]的研究显示恶性胸腹水患者腔内植入尿嘧啶植入剂后, 胸腹水中5-FU在4-8 h达峰值, 有效作用时间达到15 d以上. 有学者[27,32]将缓释氟尿嘧啶腹腔化疗应用于晚期胃癌腹膜转移中, 临床结果显示疗效肯定.
我们通过腹腔内给予氟尿嘧啶注射液及植入剂, 观察其对裸鼠腹膜转移瘤的抑制作用, 探讨不同剂型氟尿嘧啶的疗效, 寻找合适的剂型, 为临床提供实验依据. 实验结果表明不同剂型的氟尿嘧啶对裸鼠腹膜移植瘤均具有抑制作用, 改善了腹膜移植瘤裸鼠的一般生活状态, 延缓了腹水生成速度, 延长了生存. 实验第13天时氟尿嘧啶注射液组及氟尿嘧啶植入剂组的腹水量均较对照组少(P<0.05). 氟尿嘧啶植入剂组的效果最佳, 其中位生存期可长达25 d, 而对照组仅为17 d, 而氟尿嘧啶注射液组对延长生存时间有限, 其中位生存期为19 d, 仅较对照组延长2 d. 而且, 与氟尿嘧啶注射液组相比, 氟尿嘧啶植入剂组腹泻的发生率更低. 由此, 我们可以说, 单次给药, 同样剂量的氟尿嘧啶植入剂较氟尿嘧啶注射液有更好的耐受性, 较低的不良反应, 较长的生存时间.
通过检测腹水中肿瘤细胞的凋亡率来探讨不同剂型的氟尿嘧啶对裸鼠腹膜移植瘤凋亡的影响, 我们发现, 单次给药后10 d时, 氟尿嘧啶植入剂组凋亡率明显高于氟尿嘧啶注射液组(14.49%±0.80% vs 2.03%±0.64%), 差异有统计学意义(P = 0.000). 提示单次给药氟尿嘧啶植入剂能维持更长时间有效腹腔内药物浓度, 对腹膜移植瘤的抑制作用更为明显, 而这种更为明显的对腹膜转移瘤及腹水的抑制可能与氟尿嘧啶植入剂更长的作用时间及能增高肿瘤细胞凋亡率相关.
总之, 本研究表明氟尿嘧啶植入剂对裸鼠MKN-45腹膜移瘤及腹水的形成具有良好的抑制作用, 可以延长腹膜移植瘤裸鼠的生存期, 且不良反应轻, 安全性好. 因此, 提示在临床上对于胃癌腹膜转移及癌性腹水的患者进行局部治疗时, 使用氟尿嘧啶植入剂可能优于氟尿嘧啶注射液.
临床上在预防胃癌术中腹腔播散以及控制晚期胃癌癌性腹水时, 常使用氟尿嘧啶的不同剂型, 但缺乏相关的基础研究. 本文通过在胃癌腹腔播散的动物模型中进行实验, 揭示氟尿嘧啶注射液及植入剂腹腔化疗疗效的差异, 为临床治疗提供实验基础.
本文探讨了在动物实验中氟尿嘧啶植入剂与注射液腹腔化疗疗效差异, 以期在临床工作中为胃癌的术中化疗、晚期胃癌癌性腹水的腹腔化疗的药物剂型选择提供依据.
近年较多研究证实氟尿嘧啶注射液及植入剂在胃癌的术中化疗及腹水治疗中起着重要的作用, 但对于剂型选择及依据鲜少实验研究.
氟尿嘧啶植入剂的临床应用和研究有一定的报道, 但动物实验研究相对较少, 因此具有一定的新意.
本文比较氟尿嘧啶植入剂和氟尿嘧啶注射液2种剂型对MKN-45裸鼠腹膜移植瘤模型的抑制作用及其机制, 为临床应用氟尿嘧啶植入剂提供实验依据.
5-氟尿嘧啶(5-Fluorouracil, 5-FU)是尿嘧啶抗代谢药, 使DNA合成障碍, 干扰细胞核酸代谢导致肿瘤细胞凋亡及阻滞细胞周期使其停滞在S期, 亦可干扰RNA的合成, 从而干扰蛋白质合成. 中人氟安为5-FU的缓释剂型.
崔梅花, 主任医师, 航天中心医院消化科, 北京大学航天临床医学院; 范跃祖, 教授, 主任医师, 同济大学附属同济医院大外科/外科教研室; 王凯峰, 副主任医师, 浙江大学医学院附属邵逸夫医院
研究设计合理, 研究方法科学, 数据较为详实, 讨论较为全面, 为临床应用氟尿嘧啶植入剂提供实验依据.
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 新疆维吾尔自治区
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C
D级 (一般): D
E级 (差): 0
编辑: 马亚娟 电编:李瑞芳
| 1. | Torre LA, Bray F, Siegel RL, Ferlay J, Lortet-Tieulent J, Jemal A. Global cancer statistics, 2012. CA Cancer J Clin. 2015;65:87-108. [PubMed] [DOI] |
| 2. | Chen W, Zheng R, Baade PD, Zhang S, Zeng H, Bray F, Jemal A, Yu XQ, He J. Cancer statistics in China, 2015. CA Cancer J Clin. 2016;66:115-132. [PubMed] [DOI] |
| 3. | Jemal A, Bray F, Center MM, Ferlay J, Ward E, Forman D. Global cancer statistics. CA Cancer J Clin. 2011;61:69-90. [PubMed] [DOI] |
| 4. | Chen S, Li YF, Feng XY, Zhou ZW, Yuan XH, Chen YB. Significance of palliative gastrectomy for late-stage gastric cancer patients. J Surg Oncol. 2012;106:862-871. [PubMed] [DOI] |
| 5. | Kinoshita J, Fushida S, Tsukada T, Oyama K, Watanabe T, Shoji M, Okamoto K, Nakanuma S, Sakai S, Makino I. Comparative study of the antitumor activity of Nab-paclitaxel and intraperitoneal solvent-based paclitaxel regarding peritoneal metastasis in gastric cancer. Oncol Rep. 2014;32:89-96. [PubMed] [DOI] |
| 6. | Yuan M, Wang Z, Hu G, Yang Y, Lv W, Lu F, Zhong H. A retrospective analysis of hyperthermic intraperitoneal chemotherapy for gastric cancer with peritoneal metastasis. Mol Clin Oncol. 2016;5:395-399. [PubMed] [DOI] |
| 7. | Jo JC, Ryu MH, Koo DH, Ryoo BY, Kim HJ, Kim TW, Choi KD, Lee GH, Jung HY, Yook JH. Serum CA 19-9 as a prognostic factor in patients with metastatic gastric cancer. Asia Pac J Clin Oncol. 2013;9:324-330. [PubMed] [DOI] |
| 8. | Shirao K, Boku N, Yamada Y, Yamaguchi K, Doi T, Goto M, Nasu J, Denda T, Hamamoto Y, Takashima A. Randomized Phase III study of 5-fluorouracil continuous infusion vs. sequential methotrexate and 5-fluorouracil therapy in far advanced gastric cancer with peritoneal metastasis (JCOG0106). Jpn J Clin Oncol. 2013;43:972-980. [PubMed] [DOI] |
| 9. | Sukumaran S, Patel HJ, Patel BM. Evaluation of role of telmisartan in combination with 5-fluorouracil in gastric cancer cachexia. Life Sci. 2016;154:15-23. [PubMed] [DOI] |
| 10. | Yang S, Li S, Yu H, Li S, Liu W, Liu X, Ma H. Metronomic chemotherapy with 5-fluorouracil and cisplatin for inoperable malignant bowel obstruction because of peritoneal dissemination from gastric cancer. Curr Oncol. 2016;23:e248-e252. [PubMed] [DOI] |
| 11. | Yonemura Y, Elnemr A, Endou Y, Hirano M, Mizumoto A, Takao N, Ichinose M, Miura M, Li Y. Multidisciplinary therapy for treatment of patients with peritoneal carcinomatosis from gastric cancer. World J Gastrointest Oncol. 2010;2:85-97. [PubMed] [DOI] |
| 12. | Yonemura Y, Endou Y, Sasaki T, Hirano M, Mizumoto A, Matsuda T, Takao N, Ichinose M, Miura M, Li Y. Surgical treatment for peritoneal carcinomatosis from gastric cancer. Eur J Surg Oncol. 2010;36:1131-1138. [PubMed] [DOI] |
| 13. | Thomassen I, van Gestel YR, van Ramshorst B, Luyer MD, Bosscha K, Nienhuijs SW, Lemmens VE, de Hingh IH. Peritoneal carcinomatosis of gastric origin: a population-based study on incidence, survival and risk factors. Int J Cancer. 2014;134:622-628. [PubMed] [DOI] |
| 14. | Kitayama J, Ishigami H, Yamaguchi H, Yamashita H, Emoto S, Kaisaki S, Watanabe T. Salvage gastrectomy after intravenous and intraperitoneal paclitaxel (PTX) administration with oral S-1 for peritoneal dissemination of advanced gastric cancer with malignant ascites. Ann Surg Oncol. 2014;21:539-546. [PubMed] [DOI] |
| 15. | Glockzin G, Piso P. Current status and future directions in gastric cancer with peritoneal dissemination. Surg Oncol Clin N Am. 2012;21:625-633. [PubMed] [DOI] |
| 16. | Montori G, Coccolini F, Ceresoli M, Catena F, Colaianni N, Poletti E, Ansaloni L. The treatment of peritoneal carcinomatosis in advanced gastric cancer: state of the art. Int J Surg Oncol. 2014;2014:912418. [PubMed] [DOI] |
| 17. | Braam HJ, Schellens JH, Boot H, van Sandick JW, Knibbe CA, Boerma D, van Ramshorst B. Selection of chemotherapy for hyperthermic intraperitoneal use in gastric cancer. Crit Rev Oncol Hematol. 2015;95:282-296. [PubMed] [DOI] |
| 18. | Canbay E, Mizumoto A, Ichinose M, Ishibashi H, Sako S, Hirano M, Takao N, Yonemura Y. Outcome data of patients with peritoneal carcinomatosis from gastric origin treated by a strategy of bidirectional chemotherapy prior to cytoreductive surgery and hyperthermic intraperitoneal chemotherapy in a single specialized center in Japan. Ann Surg Oncol. 2014;21:1147-1152. [PubMed] [DOI] |
| 19. | Yuan H, Zheng B, Tu S. Clinical research of intraperitoneal implantation of sustained-release 5-fluorouracil in advanced colorectal cancer. World J Surg Oncol. 2015;13:320. [PubMed] [DOI] |
| 20. | Kang BW, Kim JG, Kwon OK, Chung HY, Yu W. Non-platinum-based chemotherapy for treatment of advanced gastric cancer: 5-fluorouracil, taxanes, and irinotecan. World J Gastroenterol. 2014;20:5396-5402. [PubMed] [DOI] |
| 21. | Huang Y, Wei Y, Yang H, Pi C, Liu H, Ye Y, Zhao L. A 5-fluorouracil-loaded floating gastroretentive hollow microsphere: development, pharmacokinetic in rabbits, and biodistribution in tumor-bearing mice. Drug Des Devel Ther. 2016;10:997-1008. [PubMed] [DOI] |
| 22. | Li JQ, Yang JC, Liang JX, Wang SL. Pharmacokinetic study and clinical evaluation of a slow-release 5-fluorouracil implant in pancreatic cancer patients. Anticancer Drugs. 2016;27:60-65. [PubMed] [DOI] |
| 24. | Brücher BL, Piso P, Verwaal V, Esquivel J, Derraco M, Yonemura Y, Gonzalez-Moreno S, Pelz J, Königsrainer A, Ströhlein M. Peritoneal carcinomatosis: cytoreductive surgery and HIPEC--overview and basics. Cancer Invest. 2012;30:209-224. [PubMed] [DOI] |
| 25. | Sugarbaker PH, Mora JT, Carmignani P, Stuart OA, Yoo D. Update on chemotherapeutic agents utilized for perioperative intraperitoneal chemotherapy. Oncologist. 2005;10:112-122. [PubMed] [DOI] |
| 26. | 梅 魁敏, 秦 叔逵, 殷 晓进, 陈 亚利, 魏 红梅, 张 改琴, 李 苏宜. 不同剂量氟尿嘧啶缓释植入剂腹腔给药治疗H22小鼠腹水瘤疗效的实验研究. 临床肿瘤学杂志. 2011;5:389-392. |