修回日期: 2016-09-20
接受日期: 2016-10-08
在线出版日期: 2016-11-28
探讨甲胎蛋白(α-fetoprotein, AFP)阳性或阴性的肠道肝样腺癌(hepatoid adenocarcinoma, HAC)的病理特征、诊断治疗及预后.
收集2010-01/2016-07就诊于西京医院并经病理科确诊为肠道HAC的病例3例, 观察记录患者临床相关症状, 用电化学发光方法检测血清内肿瘤标志物, 影像科检查肝及肺转移情况, 手术后标本行常规病理及免疫组织化学验查染色, 观察分析病理特征, 随访预后并进行回顾性分析.
术前患者血清学AFP检查, 1例呈高浓度阳性, 并发生肝转移, 1例为阴性, 1例未查. 3例患者均行肠癌根治术, 病理学特征为可见到肝细胞样和腺样两种分化, 肝细胞样分化区瘤胞浆内可见嗜酸性玻璃样小体, 免疫表型为AFP和/或Hepatocyte阳性. 术后临床病理分期为3期2例、4期1例, 淋巴结转移2例, 均可见或经免疫组织化学染色提示脉管、神经侵犯. 患者术后随访时间为2-16 mo, 1例死亡, 2例生存.
HAC患者临床症状无特异性, 具有特征性的病理学特征和免疫表型, 需与肝细胞癌及卵黄囊瘤相鉴别. 依靠血清学诊断肠道HAC不可行, 但其可能预测肿瘤的生物学行为及转移、复发情况, AFP阴性的患者预后可能要比阳性的好.
核心提要: 本文对罕见病例肠道肝样腺癌(hepatoid adenocarcinoma, HAC)病例的病理及临床特征进行分析探讨, 发现HAC患者临床症状无特异性, 但具有特征性的病理学特征和免疫表型, 需与肝细胞癌及卵黄囊瘤相鉴别. 依靠血清学诊断肠道HAC不可行, 但其可能预测肿瘤的生物学行为及转移、复发情况, 甲胎蛋白阴性的患者预后可能要比阳性的好.
引文著录: 王志宏, 顾立萍, 宋锦文, 徐红. AFP阳性或阴性的肠道肝样腺癌的病理及临床特征. 世界华人消化杂志 2016; 24(33): 4519-4525
Revised: September 20, 2016
Accepted: October 8, 2016
Published online: November 28, 2016
To explore the clinical and pathological characteristics of α-fetoprotein (AFP) positive and negative hepatoid adenocarcinoma (HAC) of the intestinal tract.
A retrospective analysis was performed of three cases of HAC of the intestinal tract diagnosed at Xijing Hospital from January 2010 to July 2016. The clinical symptoms of patients were recorded. Serum tumor markers were tested by electrochemical luminescence. Imaging examinations of liver and lung metastases were performed. Carcinoma tissues were subjected to pathological and immunohistochemical analyses. Postoperative pathological characteristics and prognosis were assessed.
Before treatment, AFP was highly positive in one case with liver metastasis. All three cases underwent surgical treatment, and pathological staging suggested stage 3 in two cases and stage 4 in one case. Lymph node metastasis was detected in two cases. Vascular and nerve invasion was found in all cases by immunohistochemistry. Tumors consisted of glandular and hepatoid components. Eosinophilic vitreous bodies were found in the cytoplasm of some tumor cells. One patient died, and two cases survived between 2 and 16 mo.
HAC patients have no specific symptoms, but have clinicopathological features and immune phenotype. HAC should be differentiated from hepatocellular carcinoma and yolk sac tumors. Although a diagnosis of HAC cannot be achieved by AFP, AFP may be able to help predict the biological behavior, metastasis and recurrences of HAC; AFP negative patients may have better prognosis than positive ones.
- Citation: Wang ZH, Gu LP, Song JW, Xu H. Clinical and pathological characteristics of α-fetoprotein positive and negative hepatoid adenocarcinomas of the intestinal tract. Shijie Huaren Xiaohua Zazhi 2016; 24(33): 4519-4525
- URL: https://www.wjgnet.com/1009-3079/full/v24/i33/4519.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i33.4519
肝样腺癌(hepatoid adenocarcinoma, HAC), 一种发病率很低的肿瘤, 在组织学上跟肝细胞癌十分相似, 往往与普通型腺癌相混合存在, 两者间可存在移行区, 可以呈实性、索状及假腺管状结构, 瘤细胞呈圆形或多边形, 部分文献报道[1]该肿瘤可产生大量的甲胎蛋白(α-fetoprotein, AFP). HAC可以发生于多种器官, 如胃[2]、卵巢、肾盂、子宫、胰腺[3]、胆囊、膀胱、结肠、肺[4]等部位, 但以发生于胃的最为常见. HAC是一种十分罕见的特殊亚型的癌, 据目前的文献汇报, 其发病率在0.38%-0.73%, 而发生在肠道的HAC则更是罕见[5], 大多文献报道发生在结肠. 由于其发病机制还不是很清楚, 在初次病理活检时通常被诊断为普通型腺癌, 在根治标本中可见到肝细胞样分化区, 仍易于肝细胞癌相混淆, 也容易漏诊, 作为罕见病例, 许多医生对其认识不足. 遂本文就选择就诊于西京医院的3例肠道HAC病例进行分析, 以提高对本瘤的认识及诊断.
收集2010-01/2016-07就诊于西京医院并经该院病理科诊断为胃HAC的病例3例, 活检及根治病例仅计数为1个病例, 均为男性, 年龄分布51-74岁, 平均年龄62.7岁. 在此期间, 西京医院共收治肠癌并行手术治疗患者3719例, HAC诊断以病理形态学及免疫组织化学染色相结合为准, 不论AFP水平是否有升高. 免疫组织化学抗体包括: Hepatocyte、AFP、Glypican-3、CgA、Syn、CD56、Her-2、S-100、CD34、D2-40、Ki-67、CK8/18、CK19、CK7、CK20、CDX-2、Villin、TTF-1、SALL4、MLH1、MSH2、MSH6、PMS2、c-Met, 其中Hepatocyte、Glypican-3购自上海基因公司; Her-2、c-Met购自罗氏公司; AFP、CD34购自北京中杉金桥生物技术有限公司; 其余抗体购自福州迈新生物技术开发有限公司.
3例患者入院后均进行详细的病史采集及体格检查, 并具备完善的实验室检查(主要包括AFP等肿瘤标志物检测)、影像学检查(主要包括肝脏检查)结果, 所有患者均行手术治疗, 其中病例2采取达芬奇机械系统腹腔镜行癌根治术, 术后3例标本经病理科诊断为肠道HAC, 包括常规HE染色、免疫组织化学染色及特殊染色(包括PAS染色、PAS+消化染色、AB染色). 术后均定期复查肿瘤标志物检查及全身检查且随访.
患者相关症状包括乏力、下腹部胀痛不适、大便带血或便血、腹泻、间断性腹痛. 起病据就诊时间为1-24 mo. 基础疾病包括高血压、冠状动脉硬化性心脏病, 腔隙性脑梗死、贫血、结核(表1).
| 分组 | 病例1 | 病例2 | 病例3 |
| 性别 | 男 | 男 | 男 |
| 年龄(岁) | 74 | 51 | 63 |
| 临床相关症状 | 乏力, 大便潜血阳性 | 下腹胀痛不适, 大便带血 | 腹泻, 间断性腹痛 |
| 基础疾病 | 高血压, 冠状动脉硬化性心脏病, 腔隙性脑梗死 | 结核 | 结核 |
| 术前AFP(ng/mL) | 无 | 39447 | 0.86 |
| 其他阳性肿瘤标志物(ng/mL) | 无 | CEA: 9173, CA19-9: 115.3 | CEA: 7.18 |
| 起病至治疗时间(mo) | 1 | 2 | 24 |
病例1术前未查肿瘤标志物, 影像资料示右肺中叶及左肺舍叶多发结节影, 纵膈淋巴结肿大, 但未能明确是否存在转移瘤. 病例2在术前肿瘤标志物检查显示AFP阳性(39447 ng/mL), 且呈高浓度阳性(>400 ng/mL), 其他肿瘤标志物中CEA(9173 ng/mL)及CA19-9(115.3 ng/mL)值也很高, 在初次就诊时就腹部增强CT提示肠癌并周围淋巴结肿大, 肝脏易发现多发转移瘤, 右肺中叶可见小结节影, 但未明确性质. 病例3AFP阴性, CEA值(7.18 ng/mL)稍高于正常值, 余无阳性发现(表1).
3例患者均住院并行肿瘤根治性切除术治疗. 病例1仅行手术治疗, 据目前为止仅为术后2 mo, 暂未行化疗. 病例2在手术前行1次化疗, 方案为氟尿嘧啶500 mg和亚叶酸钙200 mg, 其余2例术前未行化疗. 病例2采取达芬奇机械系统腹腔镜直肠癌根治手术, 术后化疗方案为奥沙利铂加卡培他滨, 在首次肠道肿瘤切除并化疗2个周期后行肝脏肿瘤切除手术, 术后仍用原化疗方案治疗. 病例3在根治术后行腹腔循环灌注热化疗, 过程如下: 患者取仰卧位, 常规消毒铺巾, 2%利多卡因2.5 mL自穿刺点浸润麻醉至腹膜, 沿穿刺点处垂直进针3 cm后, 接生理盐水、顺铂20 mg行腹腔循环灌注, 术给予顺铂20 mg、白介素-2 200万IU、速尿20 mg、地塞米松10 mg留置腹腔. 术后均定期复查肿瘤标志物技全身检查且随访(表2).
| 病理特征 | 病例1 | 病例2 | 病例3 |
| 手术方式 | 右半结肠切除术 | 直肠切除术 | 部分小肠切除术 |
| 肿瘤部位 | 回盲部 | 直肠 | 小肠 |
| 肿瘤长径(cm) | 11 | 3.5 | 6.0 |
| 生长方式 | 缩窄型 | 溃疡型 | 溃疡型 |
| 组织学类型 | 低分化腺癌+肝样腺癌 | 中-低分化腺癌+肝样腺癌 | 低分化腺癌+肝样腺癌 |
| 免疫组织化学 | AFP(局部+), | AFP(弥漫+), | AFP(-), |
| Hep(局部+) | Hep(局部+) | Hep(局部+) | |
| 病理分期 | T4aN0 | T3N2a | T3N2 |
| 淋巴结转移 | 0/18 | 4/16 | 11/16 |
| 脉管侵犯 | 可见 | 可见 | 可见 |
| 神经侵犯 | 可见 | 可见 | 可见 |
| 肝转移 | 无 | 有 | 无 |
| 术后随访 | 术后2 mo生存 | 术后9 mo死亡 | 术后16 mo生存 |
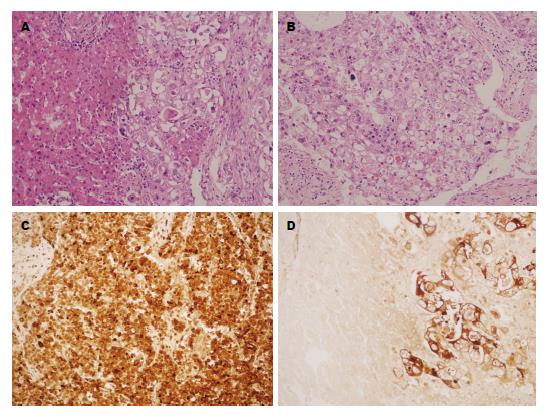
本组3例患者术后标本均行常规病理检查, 符合HAC. 患者的切片中可看到由肝样分化区和腺样分化区两种结构构成, 可见到两者移行. 在肝样分化区的肿瘤细胞呈片状或梁索状排列, 细胞大且呈多边形, 胞浆丰富、红染, 胞界清楚, 细胞核深染, 异型性显著, 核分裂易见, 在部分瘤细胞胞浆内可见到大小不等的嗜伊红玻璃样小体, 部分区域可见血窦样结构. 肝样分化区可表达AFP和/或Hepatocyte. 病例2, 在肝脏肿瘤切除标本中, 仍可见到腺样分化及肝样分化区域(图1A), 部分瘤细胞内可见嗜酸性玻璃样小体(图1B), 且肝样分化区域瘤细胞异型性显著, 免疫组织化学验查结果显示: 肝样分化区瘤细胞Hepatocyte(局灶+)、Glypican-3(+)、AFP(弥漫+)(图1C)、CK8/18(+)、CK19(+)、CK7(-)、CK20(局灶+)、CDX-2(+)、Villin(+)、CD56(-)、CgA(局灶+)、Syn(-)、TTF-1(-)、SALL4(灶+), 而肝细胞Hepatocyte(-)、Glypican-3(-)、AFP(-)(图1D), 符合直肠HAC肝转移. 3例根治患者中, 肿瘤部位分别为回盲部、直肠、小肠, 溃疡型2例, 缩窄型1例, 中-低分化腺癌+HAC1例, 低分化腺癌+HAC2例. 根据《临床实践指南》的相关小肠和结直肠的相关规定, 3例患者的术后临床病理分期为3期2例、4期1例, 淋巴结转移2例, 可见或经免疫组织化学染色提示脉管、神经侵犯(表2).
本患者术后随访时间为2-16 mo, 1例死亡, 2例生存(表2).
AFP可以由胚胎肝、卵黄囊及胚胎胃肠道细胞产生, 在血清学检查中显著提高, 但在出生后会急剧降低. 在肝细胞癌患者的血内可检查到AFP水平显著升高, 他可以由再生的肝细胞产生. 一些除肝细胞癌的外的肿瘤细胞也可以产生AFP. 早在1970年, Bourreille等[6]就首次报道了约1.3%-15.0%的胃腺癌可以产生AFP, 之后Ishikura等[7]提出了"肝样腺癌"的概念, 提出他的组织形态学不单一, 由腺样及肝样分化的癌细胞构成. 据文献报道[1]HAC的癌细胞可以产生大量的AFP, 在血清中可以查到或可以用组织病理检测到AFP阳性表达, 但也有报道[8]发现有些癌细胞与肝细胞癌在组织学上很相似, 但不产生AFP. HAC的诊断还是依靠肿瘤组织形态学和免疫组织化学来确诊, 大多文献均发现其预后较普通型腺癌要差[9].
从本组患者的临床资料来看, 肠道HAC患者特点如下: (1)患者均为中老年人(年龄分别为74、51、63岁), 与文献报道[10]相一致; (2)本组病例患者临床症状无特异性, 多表现为消化道不适及便血; (3)检验科肿瘤标志物检查结果显示: AFP、CEA及CA19-9均可升高, 但仅占1/3, 其中病例2的AFP为9447 ng/mL, 其他肿瘤标志物中CEA及CA19-9值也很高, 与其他类型的胃肠道腺癌没有显著不同, 病例3的AFP阴性; (4)影像学资料显示在初次就诊时就腹部增强CT均提示肠壁异常增厚, 病例2同时发现肝脏多发转移灶, 右肺中叶可见小结节影. 通过本组患者的临床资料, 发现HAC患者从血清检查(AFP值)来诊断HAC, 本组研究认为不可行, 与先前的文献以AFP升高来诊断HAC不同[11]. 本研究组还对胃HAC的病例也做过研究, 发现在血清学检查中检测到AFP升高的病例并不是很多, 仅3/14, 而且仅2例为高浓度阳性(>400 ng/mL).
本组病例发病部位为回盲部、直肠、小肠, 与文献报道[12]常见的结肠部位不同. 就诊时肿物最长径分别为11.0、3.5、6.0 cm, 呈溃疡型或缩窄型, 与普通型肠道腺癌无差异[13]. HAC患者术后的病理切片具有相对特异的组织形态学特征: 具有肝样分化区和腺样分化区, 在部分瘤细胞胞浆内可见到大小不等的嗜伊红玻璃样小体, 此种结构是诊断HAC的典型结构, 与文献报道[14]相一致. 病例2中部分瘤细胞呈片状或梁索状排列, 细胞大且呈多边形, 胞浆丰富、红染, 胞界清楚, 细胞核深染, 异型性显著, 部分区域可见血窦样结构, 部分区域可见血窦样结构, 首先需要与肝细胞癌相鉴别, 免疫组织化学验查结果显示: 肝样分化区瘤细胞显示局部或一定强度的显示肝细胞癌的一些标志物, 如Hepatocyte、Glypican-3和AFP, 但同时弥漫强阳性的表达消化系肿瘤的一些标志物, 如CK8/18、CK19、CDX-2及Villin, 而肿瘤侵蚀的残存正常肝组织未见肝细胞癌的标志物, 所以肝脏肿物支持为转移灶而非肝脏原发肿瘤. 其次, 在部分瘤细胞胞浆内可见到大小不等的嗜伊红玻璃样小体, 这与卵黄囊瘤[15]的组织形态学存在交叉, 需要与其相鉴别, 且卵黄囊瘤也可以AFP弥漫阳性, 在组织学上在也可见到腺样、肝样等结构, 瘤细胞也可呈索状排列、间隔以血窦, 瘤细胞胞浆也很丰富, 在胞浆内可见到嗜酸性透明小体, 但本例SALL4仅局灶阳性, 特染色亦不支持, 遂排除卵黄囊瘤. 总之, HAC的诊断金标准仍未病理, 但其虽具有相对特异的组织形态学特征, 仍难以与肝细胞癌肠道转移及卵黄囊瘤相区分, 免疫组织化学染色为诊断和鉴别诊断的最力手段, 抗体可选择Hepatocyte、Glypican-3、AFP、CK8/18、CK19、CDX-2、Villin及SALL4等.
患者的治疗仍以肿物的根治性切除为主, 鉴于病例1患者年龄偏大, 现未行化疗. 病例2采取化疗方案, 但患者仍于根治性切除及肝转移灶切除后9 mo死亡, 在初次就诊即发现肝转移, 与文献报道[16](HAC易于肝脏转移、预后差)相一致. 该例患者血清学肿瘤标志物显著升高, 尤其是AFP, 该肿瘤的恶性程度高, 预后很差. 虽然AFP是否阳性, 并非诊断HAC的必要条件, 但Hiroshima等[17]的研究发现, AFP与VEGF呈正相关, 可诱导和调节肿瘤血管的形成, 也是其导致其恶性生物学行为的一个因素, 但具体的作用机制还不是很清楚. 病例3虽然没有AFP的升高、肿瘤呈T3期、而且有11枚淋巴结转移, 但随访16 mo仍生存, 也未检测到复发或转移, 提示AFP可能能够预测肿瘤的生物学行为及转移情况、复发情况, 可能AFP阴性的患者预后要比阳性的好. 但因此肿瘤十分罕见, 无法得到明确的结论, 如果多家医院共同研究, 可能能得到可靠的结论. 病例3患者术后采取腹腔循环灌注热化疗, 取得良好的治疗效果, 术后16 mo无复发、转移, 值得推广, 可能是治疗HAC患者可行的有效治疗方案, 但仍需要大量的病例资料来证实.
因HAC十分罕见[18], 本组病例来自西京医院6年多的病例, 在此期间, 西京医院共根治肠癌3719例, 仅占0.08%, 病例极少, 可能不能代表此种肿瘤在肠道的所有生物学行为, 但希望本文能增强各医师对本肿瘤的认识, 及早诊断、治疗患者, 改善患者预后.
作为肠癌的特殊亚型-肝样腺癌(hepatoid adenocarcinoma, HAC), 目前研究多显示预后较普通型腺癌差, 但具体机制不清楚, 且易与肝细胞癌相混淆. 对于血清学甲胎蛋白(α-fetoprotein, AFP)的观察, 可能有一定的意义.
本文对罕见病例肠道HAC的诊断及影响预后的因素进行了探讨与研究.
目前关于HAC的报道多关注于胃, 对于肠道HAC的研究很少, 值得深入研究其诊治.
本文发现依靠血清学诊断肠道HAC不可行, 但其可能预测肿瘤的生物学行为及转移、复发情况, AFP阴性的患者预后可能要比阳性的好.
因肠道HAC十分罕见且预后差, 本文有望增强各医师对本肿瘤的认识, 及早诊断、治疗患者, 改善患者预后, 有利于提高大家对该病的认识.
肝样腺癌(HAC): 一种发病率很低的肿瘤, 在组织学上跟肝细胞癌十分相似, 往往与普通型腺癌相混合存在, 两者间可存在移行区, 可以呈实性、索状及假腺管状结构, 瘤细胞呈圆形或多边形, 部分文献报道该肿瘤可产生大量的AFP.
危安, 主任医师, 硕士生导师, 湖南省人民医院超声科; 王学梅, 教授, 中国医科大学附属第一医院超声科
本文选题具有一定的新颖性, 肠道HAC罕见, 且易与肝细胞癌相混淆, 也容易漏诊, 研究内容有一定临床意义.
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 甘肃省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C
D级 (一般): 0
E级 (差): 0
编辑: 闫晋利 电编:李瑞芳
| 1. | Mao X, Luo F1, Chen Z, Wang Z, Wang J, Guo F. To improve the understanding on gastric hepatoid carcinoma and AFP-producing gastric cancer. Zhonghua Zhongliu Zazhi. 2015;37:401-403. [PubMed] |
| 2. | Shen Z, Liu X, Lu B, Ye M. Hepatoid adenocarcinoma of the stomach: A case report of a rare type of gastric cancer. Oncol Lett. 2016;11:1077-1080. [PubMed] [DOI] |
| 3. | Kuo PC, Chen SC, Shyr YM, Kuo YJ, Lee RC, Wang SE. Hepatoid carcinoma of the pancreas. World J Surg Oncol. 2015;13:185. [PubMed] [DOI] |
| 4. | Sun JN, Zhang BL, Li LK, Yu HY, Wang B. Hepatoid adenocarcinoma of the lung without production of α-fetoprotein: A case report and review of the literature. Oncol Lett. 2016;12:189-194. [PubMed] [DOI] |
| 5. | Ogbonna OH, Sakruti S, Sulieman M, Ali A, Shokrani B, Oneal P. Hepatoid Adenocarcinoma of the Duodenum: An Unusual Location. Case Rep Oncol. 2016;9:182-187. [PubMed] [DOI] |
| 6. | Bourreille J, Metayer P, Sauger F, Matray F, Fondimare A. Existence of alpha feto protein during gastric-origin secondary cancer of the liver. Presse Med. 1970;78:1277-1278. [PubMed] |
| 7. | Ishikura H, Fukasawa Y, Ogasawara K, Natori T, Tsukada Y, Aizawa M. An AFP-producing gastric carcinoma with features of hepatic differentiation. A case report. Cancer. 1985;56:840-848. [PubMed] |
| 8. | Xie Y, Zhao Z, Li P, Wang Y, Guo C, Wang X, Tang W, Liu Q, Lu N, Xue L. Hepatoid adenocarcinoma of the stomach is a special and easily misdiagnosed or missed diagnosed subtype of gastric cancer with poor prognosis but curative for patients of pN0/1: the experience of a single center. Int J Clin Exp Med. 2015;8:6762-6772. [PubMed] |
| 9. | Gaeta R, Ugolini C, Castagna M. Case Report of an Hepatoid Adenocarcinoma of the Stomach. Appl Immunohistochem Mol Morphol. 2016;24:e6-e8. [PubMed] [DOI] |
| 10. | Zhou RU, Cai Y, Yang YI, Xiang J, Chen Z. Hepatoid adenocarcinoma of the stomach: A case report and review of the literature. Oncol Lett. 2015;9:2126-2128. [PubMed] [DOI] |
| 11. | Søreide JA, Greve OJ, Gudlaugsson E, Størset S. Hepatoid adenocarcinoma of the stomach--proper identification and treatment remain a challenge. Scand J Gastroenterol. 2016;51:646-653. [PubMed] [DOI] |
| 12. | Armaghani A, Hernandez Gonzalo D, Daily K. Hepatoid adenocarcinoma of the colon. BMJ Case Rep. 2015;2015:pii bcr2014206222. [PubMed] [DOI] |
| 13. | Liu XM, Chen GQ, Li SL, Zai TS. Hepatoid adenocarcinoma of the stomach: A case report and literature review. Exp Ther Med. 2015;9:2133-2136. [PubMed] [DOI] |
| 14. | Xiao C, Wu F, Jiang H, Teng L, Song F, Wang Q, Yang H. Hepatoid adenocarcinoma of the stomach: Nine case reports and treatment outcomes. Oncol Lett. 2015;10:1605-1609. [PubMed] [DOI] |
| 15. | Young RH. The yolk sac tumor: reflections on a remarkable neoplasm and two of the many intrigued by it-Gunnar Teilum and Aleksander Talerman-and the bond it formed between them. Int J Surg Pathol. 2014;22:677-687. [PubMed] [DOI] |
| 16. | Lin CY, Yeh HC, Hsu CM, Lin WR, Chiu CT. Clinicopathologial features of gastric hepatoid adenocarcinoma. Biomed J. 2015;38:65-69. [PubMed] [DOI] |
| 17. | Hiroshima K, Iyoda A, Toyozaki T, Haga Y, Baba M, Fujisawa T, Ishikura H, Ohwada H. Alpha-fetoprotein-producing lung carcinoma: report of three cases. Pathol Int. 2002;52:46-53. [PubMed] [DOI] |
| 18. | Baek S K, Han S W, Oh D Y, Im SA, Kim TY, Bang YJ. Clinicopathologic characteristics and treatment outcomes of hepatoid adenocarcinoma of the stomach, a rare but unique subtype of gastri ccancer. BMC Gastroenterol. 2011;11:56. [PubMed] [DOI] |