修回日期: 2016-07-11
接受日期: 2016-07-19
在线出版日期: 2016-11-08
脂质体靶向治疗主要分为主动靶向、被动靶向及物理化学靶向. 在脂质体肝靶向方面, 主动肝靶向脂质体以其专一性逐渐受到关注, 可用于肝纤维化、肝炎等多种肝脏疾病, 尤其对于慢性肝脏疾病. 同时, 粒径可控制脂质体的被动肝靶向, 而物理化学肝靶向脂质体对治疗肝癌有一定优势. 本文主要以近年来国内外的文献为依据进行了阐述和分析.
核心提要: 脂质体药物递送系统生物相容性良好, 可改善药物的稳定性、溶解性, 增强药物疗效, 降低给药频率, 近年来在基础及临床医学领域逐渐受到关注. 虽然其临床成果仍较少, 但其低毒, 易批量生产, 低批次间差异的特性符合医药制造业的要求, 前景广大.
引文著录: 汤晗霄, 赵天文, 郑婷, 盛云杰, 郑杭生, 张永生. 脂质体肝靶向递药系统及其在肝脏疾病中的研究进展. 世界华人消化杂志 2016; 24(31): 4238-4246
Revised: July 11, 2016
Accepted: July 19, 2016
Published online: November 8, 2016
Liposome-based targeted therapy is mainly divided into active targeting, passive targeting, and physical and chemical targeting. In terms of liver targeting, because of specificity, active liver-targeting liposomes have received more and more attention, and these types of liposomes can be used in liver fibrosis, hepatitis and other chronic liver diseases. In addition, the particle size could control the passive liver targeting of liposomes, while the liver-targeted liposomes of the physical and chemical targeting type have advantages in treating hepatic carcinoma. In this paper, we focus on the basics and application of liver-targeting liposome drug delivery system in hepatic diseases.
- Citation: Tang HX, Zhao TW, Zheng T, Sheng YJ, Zheng HS, Zhang YS. Liver-targeting liposome drug delivery system and its research progress in liver diseases. Shijie Huaren Xiaohua Zazhi 2016; 24(31): 4238-4246
- URL: https://www.wjgnet.com/1009-3079/full/v24/i31/4238.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i31.4238
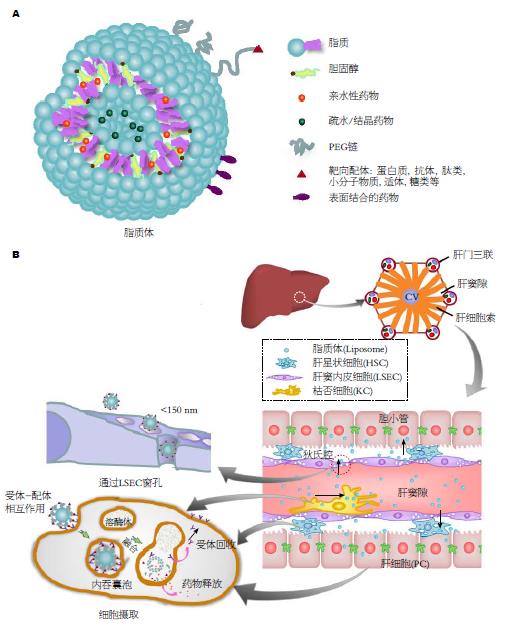
脂质体通常由磷脂类分子构成, 是至少含有一层磷脂双分子层的人造球形囊泡, 直径为25-1000 nm不等(图1A). 由于磷脂类同时具有两亲性的分子结构, 脂质体可包封亲水性或亲脂性的药物通过注射[1]、口服[2]、鼻腔[3]、经皮给药[4]等方式作用于有机体, 也可用于转运DNA、RNA、质粒等进入靶器官[5]. 脂质体一旦进入血液循环, 血清蛋白作为调理素促使单核巨噬细胞系统(mononuclear phagocyte system, MPS)摄取脂质体[6], MPS中肝脏Kupffer细胞(Kupffer cells, KC)和脾巨噬细胞的摄取作用最显著[7], 且肝窦内皮细胞(liver sinusoidal endothelial cells, LSEC)也有一定的吞噬功能. 然而, KC及LSEC均属肝脏非实质细胞, 因此, 脂质体本身具有的肝靶向性并非作用于肝实质细胞及其他肝非实质细胞, 如肝星状细胞(hepatic stellate cell, HSC)等. 目前, 控制脂质体粒径可能使其通过LSEC窗孔到达狄氏(Disse)腔而被肝实质细胞或HSC所摄取, 而脂质体表面的配体及细胞表面受体的受体-配体相互作用与脂质体摄取密切相关(图1B). 本文主要阐述了配体介导的主动肝靶向脂质体、粒径控制的脂质体被动肝靶向及肝癌相关的物理化学肝靶向脂质体.
靶向递药系统(targeted drug delivery system, TDDS), 又称智能递药系统, 能在病变局部形成相对较高的药物浓度. 近年来, 无论是药品研发还是临床研究, 均证实了利用纳米微粒作为药物载体可提高药物在体内的药效[8], 而脂质体就是其中一种重要的纳米微粒. 脂质体可作为药物载体成功递送抗炎药、抗癌药、抗生素药、抗真菌药等不同类别的药物, 亦可提高药物稳定性, 增加药物的溶解度[9]. 并且, 脂质体具有良好的生物相容性[10], 可通过膜融合、内吞等方式被细胞摄取[11]. 因此, 作为被广泛关注的新型靶向给药技术的产物, 脂质体是药物递送、靶位释药的良好载体.
主动靶向, 即通过各种配体(抗体, 适体, 肽类, 糖类等)修饰纳米粒子, 特异性识别靶区而实现靶向递送[12]. 配体靶头一般可连接于隐形脂质体上的聚乙二醇(polyethylene glycol, PEG)链的外端, 同时PEG可减少MPS清除而使脂质体具有长循环性[13]. 肝脏细胞表面高度表达多种载体和细胞内吞作用的受体, 配体修饰的脂质体通过定位于肝脏内细胞膜上的特定位点, 以受体-配体的相互作用实现主动靶向作用. 主要有以下类型.
乙型肝炎病毒(hepatitis B virus, HBV)作为一种嗜肝DNA病毒, 具有明显的肝趋向性, HBV编码核壳(C)蛋白, 多聚酶(P)蛋白, X蛋白, 以及包膜(S)蛋白[13], 其中, 包膜蛋白中的preS1肽对HBV附着到肝实质细胞起重要作用, 体外实验表明, preS1结合到纳米级的蛋白质笼表面后, 相比其他细胞系(HeLa及MCF7)对人类肝细胞系(HepG2)具有更强的特异性, 可通过网格蛋白介导的内吞作用进入细胞[14]. 从ICR小鼠分离出的原代肝实质细胞体外实验表明, HBVpreS/2-48myr(HBVP)-PEG-脂质体比PEG-脂质体具有更高的肝实质细胞摄取率. 同时, 在ICR小鼠尾静脉注射HBVP-PEG-脂质体1 h后, 其在肝实质细胞中的含量是PEG-脂质体的8倍, 且24 h后, HBVP-脂质体仍能在肝脏中保持34%的含量, 肝滞留性明显[15]. 可见, 源于HBV的某些多肽具有特异性肝靶向作用, 并能延长脂质体在肝脏的滞留时间.
甘草次酸(glycyrrhetinic acid, GA)是甘草酸(glycyrrhizin, GL)的水解产物, GA与GL是甘草中的主要生物活性成分. Negishi等[16]于1991年发现肝实质细胞膜上具有GA与GL的特异性结合位点. 但在体外实验中, GA与大鼠肝实质细胞的细胞膜特异结合位点数目远高于GL[17]. 研究[18]显示, 采用GA修饰汉黄芩素(wogonin, WG)脂质体(GA-WG-Lip)相较于WG-Lip, HepG2细胞的摄取率显著提高, 同时, 具有更高的肝癌抑制率. 研究[19]显示, 包载质粒的GA-PEG-阳离子脂质体的GA配基密度从0%、1%上升到5%时, 其对HepG2的转染效率逐渐递增. 另有研究[17]显示, 奥沙利铂(OX)-脂质体与GA-OX-脂质体以静脉注射到小鼠体内后, 相较于心、脾、肺、肾等器官, GA-OX-脂质体主要分布在肝脏, 并且聚集迅速, 注射后仅1 h肝脏中的OM浓度已达到较高水平. 因此, GA修饰的脂质体具有肝靶向作用, 能优化脂质体包封药物的肝组织分布.
去唾液酸糖蛋白受体(asialoglycoprotein receptors, ASGPR)是一种C型凝集素, 高度表达于(1×105-5×105受体/细胞)肝细胞窦状隙面. ASGPR具有受体介导的内吞作用, 可内化并清除血液循环中具有半乳糖端基或N-乙酰半乳糖胺残基的糖蛋白[19]. 由于该过程具有快速和特异性的特点[20], 可用半乳糖修饰脂质体通过受体介导的内吞作用靶向递送于肝实质细胞[21]. 研究[22]显示, 包载DOX且表面含PEG2000-CHEMS和CHS-ED-LA的脂质体(PEG-GalL DOX)可通过结合过表达的ASGPR靶向肝癌细胞, 同时通过PEG链的水解避免药物在肝脏过度蓄积以降低载药脂质体肝毒性. Jiang等[23]制备了半乳糖修饰的脂质体纳米粒子(Gal-LipoNP)用于递送TLR4-siRNA治疗大鼠肝热缺血再灌注损伤, 与普通脂质体(LipoNP)相比, Gal-LipoNP增加了iRNA在肝实质细胞的摄取, 促进TLR4基因沉默, 并减少了iRNA在其他器官的分布. 由此, ASGPR是良好的肝靶向结合位点, 利用半乳糖修饰脂质体可达到特异性的肝靶向作用.
适体是指数富集的配基系统进化技术(systematic evolution of ligands by exponential enrichment, SELEX)筛选出的单链寡核苷酸片段(RNA或DNA), 易合成且能选择性地与目标分子(蛋白或其他小分子)结合, 同时具有高亲和性[24]. 一般认为, 适体是非免疫原性的, 可通过酶逐渐降解并从血液中清除, 其本身除了具有治疗作用外, 还能介导靶向递药, 尤其是与纳米粒的结合应用. 研究[25]显示, 以适体作为PEG化脂质体靶头, 可提高PEG化脂质体的细胞摄取率, 增强包封药物疗效. Du等[26]利用SELEX技术筛选出7种与肝癌细胞MEAR有高亲和力的适体(TLS1、TLS3、TLS4、TLS6、TLS7、TLS9和TLS11), 除了有利于肝癌早期诊断及其机制研究外, 提示适体存在肝靶向作用的可能. 总的来说, 适体技术只有二十余年的历史, 是一种新兴技术, 但基于脂质体递送系统的优势及适体的高特异性和无免疫原性, 适体修饰脂质体实现肝靶向颇有前景.
载脂蛋白A1(apolipoprotein A1, ApoA1)是高密度脂蛋白(high-density lipoprotein, HDL)的主要蛋白组成部分, 参与胆固醇从外周组织到肝脏的逆向转运过程. ApoA1及HDL引导胆固醇从外周细胞(尤其单核巨噬细胞)流出, 经血液循环到达肝脏后, ApoA1可结合肝实质细胞上清道夫受体B类Ⅰ型, 介导胆固醇进入肝脏再循环或排泄[27]. Chen等[28]制备了包载抗HBV iRNA的脂质体(DTC)及ApoA1修饰的DTC-Apo, 研究显示, DTC-Apo相较于DTC更显著地减少了HBV病毒蛋白表达, 具有肝脏特异性, 小鼠低剂量(≤2 mg/kg)单次注射后抗病毒效果长达8 d. 由此, ApoA1可作为特异性配体与肝实质细胞结合, 实现脂质体肝靶向药物递送的目的.
精氨酸-甘氨酸-天冬氨酸(arg-gly-asp, RGD)序列是绝大多数整合素结合配体的最常见识别位点[24]. RGD可修饰脂质体实现药物肝靶向, 尤其是靶向HSC治疗肝纤维化方面. Chai等[25]制备的RGD-氧化苦参碱(oxymatrine, OM)-脂质体可通过抑制HSC的活性及诱导其凋亡达到抗肝纤维化的作用, 其中RGD-OM-脂质体降低CCl4诱导的肝纤维化大鼠血清碱性磷酸酶的能力明显高于OM-脂质体. 另有研究[26]显示, 在肝纤维化大鼠模型中, RGD环肽修饰的立体稳定脂质体选择性地被活化的HSC摄取, 并且其包载的IFNδ-1b显著抑制了肝纤维化进程. 由此, RGD-脂质体具有明显肝趋向性, RGD可提高脂质体包封药物抗HSC活化及抗肝纤维化的治疗效果.
胆盐一般是钠盐或钾盐, 由肝实质细胞分泌的胆汁酸与甘氨酸或牛磺酸结合而成, 胆汁淤积和脂肪肝疾病的治疗中常以胆汁酸受体作为药物靶点[27]. 研究[28]显示, PEG结合胆盐(BP2B)修饰的脂质体BP2BL, 可靶向递送联苯双酯到肝脏, 维持药物在体内的持续释放效果优于无BP2B修饰的脂质体, 相较于一般长循环脂质体制备更简便, 成本更低. 另外, 由于胆盐的肠-肝循环能促使肠道内胆盐重吸收后通过血液循环回到肝脏, He等[29]通过大豆分离蛋白和胆盐(乳化剂)制备了纳米乳剂递药系统, 可通过肠上皮屏障渗透进入体循环, 原位大鼠肠灌注1 h后, 肝、肾的分布显著高于心、脾、肺, 该系统作为难溶性药物的口服递送颇有前景, 尤其是基于肠-肝循环这一特殊现象, 可能对通过肠道给药实现脂质体肝靶向具有启发性意义.
根据脂质体的粒径, 脂质体可分为小单室脂质体(SUV, 直径20-50 nm)及大单室脂质体(LUV, 直径100 nm-1 μm)[30]. 由于粒径500 nm以上的微粒需要受体介导, 涉及肌动蛋白驱动才能被细胞内化[31], 因此较大的脂质体不利于被细胞吞噬并胞内释药. 并且, 大脂质体的清除速率快于小脂质体, 其粒径临界值在100 nm左右[32]. 另外, 穿越上皮细胞是脂质体靶向定位的首要前提[33], 而粒子在100 nm内具有高透膜性[34]. 研究[35]显示, 肝窦状隙内皮细胞的孔隙一般约为150 nm, 足够小的(<100 nm)小单室脂质体才可通过肝窦状隙. 然而, 一些带负电荷的较大粒径脂质体亦可通过结合清道夫受体被挤压后进入肝窦状隙而被肝实质细胞所摄取[36]. 因此, 较小的脂质体的粒径对脂质体被动肝靶向、延长循环时间及被细胞充分摄取有重要意义.
由于肿瘤细胞的糖酵解率较高, 肿瘤组织的pH值一般低于正常组织(pH值为7.4), 其pH从5.7到7.8不等, 因此pH敏感脂质体可作为环境敏感的药物递送系统靶向治疗肝癌等癌症[37]. 在亚细胞水平, 晚期核内体和溶酶体具有更低的pH值(4.5-5.5), 某些抗肿瘤药物最终通过内吞作用进入核内体和溶酶体[38]. 物理靶向脂质体实现了外部控释, 如光控、超声控制、磁控、热控等, 有利于引发脂质体于靶位释药, 提高载药脂质体的生物活性[39], 并且某些物理疗法(热疗、射频消融等)本身可用于癌症治疗. 而化学靶向脂质体, 如pH敏感脂质体可基于肿瘤组织的微酸环境[40]来实现靶位激活释放, 并可促进脂质体的胞内释药.
pH敏感脂质体可实现溶酶体逃逸而作用于其他细胞器, 如多级pH响应的级联线粒体递药脂质体(HHG2C18-L)[39], "序贯化"的胞膜及核内递药脂质体(TRAIL/Dox-Gelipo)[40]. 在肝癌方面, Hatakeyama等[41]所制备的含pH敏感材料YSK05的多功能信封式纳米载体(YSK05-MEND)相较于Lipofectamine2000(LFN2k), 在肝癌细胞中表现出更高的活性, 由于YSK05-MEND对早期内体的pH敏感性诱发了自身与内涵体/溶酶体的膜融合, 从而释放包封药物进入胞浆或胞核, 其机制即内涵体/溶酶体逃逸作用. 由此, pH敏感脂质体可靶向于肿瘤组织的酸化环境, 提高癌细胞摄取, 并通过溶酶体逃逸实现细胞器靶向递药.
肿瘤的治疗法中, 温和热疗常作为放射疗法和化疗的辅助治疗方法[42]. 热消融法是热疗中的一种, 利用热消融法治疗小型的、无法切除的肿瘤已成为普遍现象[43]. 然而, 热消融治疗肝癌具有一定局限性, 尤其是对大病灶的边缘复发与血管瘤的治疗, 研究表明热消融与化疗药物联合治疗具有协同作用[44], 同时温和热疗和热敏脂质体能提高脂质体在肿瘤部位的聚集[45]. 有研究[46]显示, 射频消融(radio frequency ablation, RFA)结合可溶性热敏多柔比星脂质体(LTLD)可将药物快速聚集于>3 cm的肝癌肿瘤部位, 当温度>39.5 ℃时可释放其包载的多柔比星, 达到靶向抗肝癌的效果. 另外, 由Celsion公司开发的多柔比星热敏靶向脂质体Thermodox®(Celsion)在温和热疗的肿瘤部位(41 ℃)能显着改善药物释放率及药物吸收率[47]. 可见, 热敏脂质体可结合热疗及脂质体药物递送, 进一步提高药物在肿瘤部位的释放, 有助于肝癌的治疗.
脂质体与低毒、可降解的磁性材料(Fe3O4和γ-Fe2O3等)制备形成的递药系统称为磁性脂质体, 在外磁场作用下可使脂质体向靶位聚集, 同时可被磁共振所标记[48], 实现成像定位与药物治疗相结合. 研究[49]显示, 相较于rh-IFNα2b处理组, 包封rh-IFNα2b的磁性脂质体具有更显著的抑制肝癌细胞生长的效果, 在荷瘤裸鼠(人肝癌)中, 磁性脂质体处理组的肿瘤大小减少到对照组(生理盐水处理)的38%, 而rh-IFNα2b处理组肿瘤大小只减少了28%. Kullberg等[50]制备的EGF修饰的磁性脂质体在肿瘤治疗中, 除了利用脂质体双分子层中的磁性材料进行选择性加热, 还能在振荡磁场下促进药物的释放. 另外, 将磁性脂质体注射到肝肿瘤周围的肝动脉, 在外加磁场的同时结合肿瘤热疗, 即铁磁栓塞热疗, 也适用于肝癌的治疗[51]. 因此, 由于磁性脂质体的磁响应能力, 外加磁场可提高磁性脂质体的靶向性和包封药物释放率, 并且磁性脂质体还能与热疗结合用于治疗肝癌.
脂质体药物递送系统生物相容性良好, 可改善药物的稳定性、溶解性, 增强药物疗效, 降低给药频率, 近年来在基础及临床医学领域逐渐受到关注. 虽然其临床成果仍较少, 但其低毒, 易批量生产, 低批次间差异的特性符合医药制造业的要求, 前景广大. 研究者可通过对粒径、靶头、处方等脂质体递药系统设计使载药脂质体在肝组织靶向富集、释药, 充分发挥药物对肝脏的专一性治疗作用. 肝靶向脂质体可减少包封药物对正常组织的不良反应, 精确的脂质体设计还可减少给药剂量, 实现微量药物的靶向浓集, 对某些特效药或高毒性药物尤其适宜.
本文旨在综合近年来脂质体肝TDDS的研究进展及展望脂质体在肝脏疾病中的应用, 以下方面值得进行深入探究: (1)新的肝靶向特异性配体及其结合位点的挖掘仍有广阔的研究前景, 尤其是靶向不同肝脏疾病对应的特定类型细胞, 如靶向HSC治疗肝纤维化, 靶向肝癌癌细胞治疗肝脏肿瘤等; (2)物理化学疗法与肝靶向脂质体技术的结合对肝癌治疗具有积极的推动作用, 潜力巨大; (3)目前对肝靶向脂质体纳米毒理学领域的研究仍显不足, 关于脂质体蓄积于肝脏的安全性评价及对肝组织微环境的影响的研究较少, 尤其是长循环脂质体; (4)大量脂质体开发还处于实验研究阶段, 脂质体包载药物与直接给药之间的疗效差异能否达到临床预期, 即生物等效性值得考察; (5)由于肝纤维化/硬化及肝癌组织的病理生理学、组织学改变, 提高局部病变组织渗透率的肝靶向脂质体仍需进一步研究; (6)脂质体反复注射后将引起MPS加快对其的清除, 如何进一步避免枯否细胞吞噬, 长效靶向其他肝脏变性细胞是未来可探究的方向.
脂质体靶向治疗主要分为主动靶向、被动靶向及物理化学靶向. 在脂质体肝靶向方面, 主动肝靶向脂质体以其专一性逐渐受到关注, 可用于肝纤维化、肝炎等多种肝脏疾病, 尤其对于慢性肝脏疾病.
谭华炳, 教授, 主任医师, 湖北医药学院附属人民医院感染性疾病科
本文介绍了脂质体肝靶向递药系统(targeted drug delivery system, TDDS)及其在肝脏疾病中的应用, 具有重要的科学意义, 对脂质体肝TDDS的更深入研究具有重要的参考价值.
手稿来源: 邀请约稿
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): 0
D级 (一般): 0
E级 (差): 0
编辑: 于明茜 电编:李瑞芳
| 1. | Cortes JE, Goldberg SL, Feldman EJ, Rizzeri DA, Hogge DE, Larson M, Pigneux A, Recher C, Schiller G, Warzocha K. Phase II, multicenter, randomized trial of CPX-351 (cytarabine: daunorubicin) liposome injection versus intensive salvage therapy in adults with first relapse AML. Cancer. 2015;121:234-242. [PubMed] [DOI] |
| 2. | Qi R, Zhang H, Xu L, Shen W, Chen C, Wang C, Cao Y, Wang Y, van Dongen MA, He B. G5 PAMAM dendrimer versus liposome: a comparison study on the in vitro transepithelial transport and in vivo oral absorption of simvastatin. Nanomedicine. 2015;11:1141-1151. [PubMed] [DOI] |
| 3. | Fan Y, Sahdev P, Ochyl LJ, J Akerberg J, Moon JJ. Cationic liposome-hyaluronic acid hybrid nanoparticles for intranasal vaccination with subunit antigens. J Control Release. 2015;208:121-129. [PubMed] [DOI] |
| 4. | Tyagi RK, Garg NK, Jadon R, Sahu T, Katare OP, Dalai SK, Awasthi A, Marepally SK. Elastic liposome-mediated transdermal immunization enhanced the immunogenicity of P. falciparum surface antigen, MSP-119. Vaccine. 2015;33:4630-4638. [PubMed] [DOI] |
| 5. | Zhang F, Li HY. Preparation of lipid: peptide: DNA (LPD) nanoparticles and their use for gene transfection. Methods Mol Biol. 2012;906:329-336. [PubMed] [DOI] |
| 6. | Johnstone SA, Masin D, Mayer L, Bally MB. Surface-associated serum proteins inhibit the uptake of phosphatidylserine and poly(ethylene glycol) liposomes by mouse macrophages. Biochim Biophys Acta. 2001;1513:25-37. [PubMed] [DOI] |
| 7. | Maruyama K, Yuda T, Okamoto A, Kojima S, Suginaka A, Iwatsuru M. Prolonged circulation time in vivo of large unilamellar liposomes composed of distearoyl phosphatidylcholine and cholesterol containing amphipathic poly(ethylene glycol). Biochim Biophys Acta. 1992;1128:44-49. [PubMed] [DOI] |
| 8. | Torchilin VP. Multifunctional, stimuli-sensitive nanoparticulate systems for drug delivery. Nat Rev Drug Discov. 2014;13:813-827. [PubMed] [DOI] |
| 9. | Garg T. Liposomes: targeted and controlled delivery system. Drug delivery letters. 2014;4:62-71. [DOI] |
| 10. | Mallick S, Choi JS. Liposomes: versatile and biocompatible nanovesicles for efficient biomolecules delivery. J Nanosci Nanotechnol. 2014;14:755-765. [PubMed] [DOI] |
| 11. | Yao L, Daniels J, Wijesinghe D, Andreev OA, Reshetnyak YK. pHLIP®-mediated delivery of PEGylated liposomes to cancer cells. J Control Release. 2013;167:228-237. [PubMed] [DOI] |
| 12. | Singh S, Sharma A, Robertson GP. Realizing the clinical potential of cancer nanotechnology by minimizing toxicologic and targeted delivery concerns. Cancer Res. 2012;72:5663-5668. [PubMed] [DOI] |
| 13. | Barman RK, Saha S, Das S. Prediction of interactions between viral and host proteins using supervised machine learning methods. PLoS One. 2014;9:e112034. [PubMed] [DOI] |
| 14. | Murata M, Narahara S, Umezaki K, Toita R, Tabata S, Piao JS, Abe K, Kang JH, Ohuchida K, Cui L. Liver cell specific targeting by the preS1 domain of hepatitis B virus surface antigen displayed on protein nanocages. Int J Nanomedicine. 2012;7:4353-4362. [PubMed] [DOI] |
| 15. | Zhang X, Zhang Q, Peng Q, Zhou J, Liao L, Sun X, Zhang L, Gong T. Hepatitis B virus preS1-derived lipopeptide functionalized liposomes for targeting of hepatic cells. Biomaterials. 2014;35:6130-6141. [PubMed] [DOI] |
| 16. | Negishi M, Irie A, Nagata N, Ichikawa A. Specific binding of glycyrrhetinic acid to the rat liver membrane. Biochim Biophys Acta. 1991;1066:77-82. [PubMed] [DOI] |
| 17. | Chen J, Jiang H, Wu Y, Li Y, Gao Y. A novel glycyrrhetinic acid-modified oxaliplatin liposome for liver-targeting and in vitro/vivo evaluation. Drug Des Devel Ther. 2015;9:2265-2275. [PubMed] [DOI] |
| 18. | Tian J, Wang L, Wang L, Ke X. A wogonin-loaded glycyrrhetinic acid-modified liposome for hepatic targeting with anti-tumor effects. Drug Deliv. 2014;21:553-559. [PubMed] [DOI] |
| 19. | Pathak PO, Nagarsenker MS, Barhate CR, Padhye SG, Dhawan VV, Bhattacharyya D, Viswanathan CL, Steiniger F, Fahr A. Cholesterol anchored arabinogalactan for asialoglycoprotein receptor targeting: synthesis, characterization, and proof of concept of hepatospecific delivery. Carbohydr Res. 2015;408:33-43. [PubMed] [DOI] |
| 20. | Li Y, Huang G, Diakur J, Wiebe LI. Targeted delivery of macromolecular drugs: asialoglycoprotein receptor (ASGPR) expression by selected hepatoma cell lines used in antiviral drug development. Curr Drug Deliv. 2008;5:299-302. [PubMed] [DOI] |
| 21. | Zhang H, Xiao Y, Cui S, Zhou Y, Zeng K, Yan M, Zhao C. Novel Galactosylated Poly(ethylene glycol)-Cholesterol for Liposomes as a Drug Carrier for Hepatocyte-Targeting. J Nanosci Nanotechnol. 2015;15:4058-4069. [PubMed] [DOI] |
| 22. | Wang S, Xu H, Xu J, Zhang Y, Liu Y, Deng YH, Chen D. Sustained liver targeting and improved antiproliferative effect of doxorubicin liposomes modified with galactosylated lipid and PEG-lipid. AAPS PharmSciTech. 2010;11:870-877. [PubMed] [DOI] |
| 23. | Jiang N, Zhang X, Zheng X, Chen D, Zhang Y, Siu LK, Xin HB, Li R, Zhao H, Riordan N. Targeted gene silencing of TLR4 using liposomal nanoparticles for preventing liver ischemia reperfusion injury. Am J Transplant. 2011;11:1835-1844. [PubMed] [DOI] |
| 24. | Ruoslahti E. RGD and other recognition sequences for integrins. Annu Rev Cell Dev Biol. 1996;12:697-715. [PubMed] [DOI] |
| 25. | Chai NL, Fu Q, Shi H, Cai CH, Wan J, Xu SP, Wu BY. Oxymatrine liposome attenuates hepatic fibrosis via targeting hepatic stellate cells. World J Gastroenterol. 2012;18:4199-4206. [PubMed] [DOI] |
| 26. | Du SL, Pan H, Lu WY, Wang J, Wu J, Wang JY. Cyclic Arg-Gly-Asp peptide-labeled liposomes for targeting drug therapy of hepatic fibrosis in rats. J Pharmacol Exp Ther. 2007;322:560-568. [PubMed] [DOI] |
| 27. | Mishra N, Yadav NP, Rai VK, Sinha P, Yadav KS, Jain S, Arora S. Efficient hepatic delivery of drugs: novel strategies and their significance. Biomed Res Int. 2013;2013:382184. [PubMed] [DOI] |
| 28. | Chen ZP, Zhu JB, Chen HX, Xiao YY, Feng MS, Cai H, Chen J, Cai BC. Synthesis of a novel polymer bile salts-(polyethylene glycol)2000-bile salts and its application to the liver-selective targeting of liposomal DDB. Drug Dev Ind Pharm. 2010;36:657-665. [PubMed] [DOI] |
| 29. | He W, Yang K, Fan L, Lv Y, Jin Z, Zhu S, Qin C, Wang Y, Yin L. Denatured globular protein and bile salt-coated nanoparticles for poorly water-soluble drugs: Penetration across the intestinal epithelial barrier into the circulation system and enhanced oral bioavailability. Int J Pharm. 2015;495:9-18. [PubMed] [DOI] |
| 30. | Monteiro N, Martins A, Reis RL, Neves NM. Liposomes in tissue engineering and regenerative medicine. J R Soc Interface. 2014;11:20140459. [PubMed] [DOI] |
| 31. | Groves E, Dart AE, Covarelli V, Caron E. Molecular mechanisms of phagocytic uptake in mammalian cells. Cell Mol Life Sci. 2008;65:1957-1976. [PubMed] [DOI] |
| 32. | Lasic DD, Papahadjopoulos D. Medical applications of liposomes. Holland: Elsevier Science 1998; 1-779. [DOI] |
| 33. | des Rieux A, Fievez V, Théate I, Mast J, Préat V, Schneider YJ. An improved in vitro model of human intestinal follicle-associated epithelium to study nanoparticle transport by M cells. Eur J Pharm Sci. 2007;30:380-391. [PubMed] [DOI] |
| 34. | Desai MP, Labhasetwar V, Amidon GL, Levy RJ. Gastrointestinal uptake of biodegradable microparticles: effect of particle size. Pharm Res. 1996;13:1838-1845. [PubMed] [DOI] |
| 35. | Wu J, Zern MA. Modification of liposomes for liver targeting. J Hepatol. 1996;24:757-763. [PubMed] [DOI] |
| 36. | Chen WG, Liu YG, Wang SB, Chen AZ. [Research progress in co-delivery of gene and chemotherapy drugs with cationic liposome carrier for cancer therapy]. Yaoxue Xuebao. 2012;47:986-992. [PubMed] |
| 37. | Liu J, Huang Y, Kumar A, Tan A, Jin S, Mozhi A, Liang XJ. pH-sensitive nano-systems for drug delivery in cancer therapy. Biotechnol Adv. 2014;32:693-710. [PubMed] [DOI] |
| 38. | Bae YM, Park YI, Nam SH, Kim JH, Lee K, Kim HM, Yoo B, Choi JS, Lee KT, Hyeon T. Endocytosis, intracellular transport, and exocytosis of lanthanide-doped upconverting nanoparticles in single living cells. Biomaterials. 2012;33:9080-9086. [PubMed] [DOI] |
| 39. | Mo R, Sun Q, Xue J, Li N, Li W, Zhang C, Ping Q. Multistage pH-responsive liposomes for mitochondrial-targeted anticancer drug delivery. Adv Mater. 2012;24:3659-3665. [PubMed] [DOI] |
| 40. | Jiang T, Mo R, Bellotti A, Zhou J, Gu Z. Gel-liposome-mediated co-delivery of anticancer membrane-associated proteins and small-molecule drugs for enhanced therapeutic efficacy. Advanced Functional Materials. 2014;24:2295-2304. [DOI] |
| 41. | Hatakeyama H, Murata M, Sato Y, Takahashi M, Minakawa N, Matsuda A, Harashima H. The systemic administration of an anti-miRNA oligonucleotide encapsulated pH-sensitive liposome results in reduced level of hepatic microRNA-122 in mice. J Control Release. 2013; Oct 25. [Epub ahead of print]. [PubMed] [DOI] |
| 42. | Ta T, Porter TM. Thermosensitive liposomes for localized delivery and triggered release of chemotherapy. J Control Release. 2013;169:112-125. [PubMed] [DOI] |
| 43. | Chu KF, Dupuy DE. Thermal ablation of tumours: biological mechanisms and advances in therapy. Nat Rev Cancer. 2014;14:199-208. [PubMed] [DOI] |
| 44. | Dewhirst MW, Landon CD, Hofmann CL, Stauffer PR. Novel approaches to treatment of hepatocellular carcinoma and hepatic metastases using thermal ablation and thermosensitive liposomes. Surg Oncol Clin N Am. 2013;22:545-561. [PubMed] [DOI] |
| 45. | Dicheva BM, Koning GA. Targeted thermosensitive liposomes: an attractive novel approach for increased drug delivery to solid tumors. Expert Opin Drug Deliv. 2014;11:83-100. [PubMed] [DOI] |
| 46. | Poon RT, Borys N. Lyso-thermosensitive liposomal doxorubicin: an adjuvant to increase the cure rate of radiofrequency ablation in liver cancer. Future Oncol. 2011;7:937-945. [PubMed] [DOI] |
| 47. | May JP, Li SD. Hyperthermia-induced drug targeting. Expert Opin Drug Deliv. 2013;10:511-527. [PubMed] [DOI] |
| 48. | Frascione D, Diwoky C, Almer G, Opriessnig P, Vonach C, Gradauer K, Leitinger G, Mangge H, Stollberger R, Prassl R. Ultrasmall superparamagnetic iron oxide (USPIO)-based liposomes as magnetic resonance imaging probes. Int J Nanomedicine. 2012;7:2349-2359. [PubMed] [DOI] |
| 49. | Ye H, Tong J, Wu J, Xu X, Wu S, Tan B, Shi M, Wang J, Zhao W, Jiang H. Preclinical evaluation of recombinant human IFNα2b-containing magnetoliposomes for treating hepatocellular carcinoma. Int J Nanomedicine. 2014;9:4533-4550. [PubMed] [DOI] |
| 50. | Kullberg M, Mann K, Owens JL. Improved drug delivery to cancer cells: a method using magnetoliposomes that target epidermal growth factor receptors. Med Hypotheses. 2005;64:468-470. [PubMed] |
| 51. | Wang L, Zhang J, An Y, Wang Z, Liu J, Li Y, Zhang D. A study on the thermochemotherapy effect of nanosized As2O3/MZF thermosensitive magnetoliposomes on experimental hepatoma in vitro and in vivo. Nanotechnology. 2011;22:315102. [PubMed] [DOI] |
| 52. | Bao QY, Zhang N, Geng DD, Xue JW, Merritt M, Zhang C, Ding Y. The enhanced longevity and liver targetability of Paclitaxel by hybrid liposomes encapsulating Paclitaxel-conjugated gold nanoparticles. Int J Pharm. 2014;477:408-415. [PubMed] [DOI] |
| 53. | Zhang N, Chen H, Liu AY, Shen JJ, Shah V, Zhang C, Hong J, Ding Y. Gold conjugate-based liposomes with hybrid cluster bomb structure for liver cancer therapy. Biomaterials. 2016;74:280-291. [PubMed] [DOI] |
| 54. | Ren S, Li C, Dai Y, Li N, Wang X, Tian F, Zhou S, Qiu Z, Lu Y, Zhao D. Comparison of pharmacokinetics, tissue distribution and pharmacodynamics of liposomal and free doxorubicin in tumour-bearing mice following intratumoral injection. J Pharm Pharmacol. 2014;66:1231-1239. [PubMed] [DOI] |