修回日期: 2016-05-27
接受日期: 2016-06-03
在线出版日期: 2016-10-28
胃肠间质瘤(gastrointestinal stromal tumors, GIST)是消化系最常见的间叶性肿瘤, 其中60%-70%来源于胃. 所有的GIST都具有恶性生物学行为潜能, 可表现为微小病灶到进展性肉瘤. GIST极少发生淋巴结转移, 术中无需常规行淋巴结清扫. 正因为这些生物学特性, 使得腹腔镜、内镜等微创手术的优势在GIST的手术治疗上得以充分体现. 腹腔镜内镜联合技术的出现拓宽了微创手术治疗GIST的适用范围、提高了手术安全性. 本文将介绍目前腹腔镜、内镜以及双镜联合技术在GIST治疗中的应用.
核心提要: 胃肠间质瘤(gastrointestinal stromal tumors, GIST)是消化系最常见的间叶性肿瘤, 其中60%-70%来源于胃. 近年来, 小GIST(直径<2 cm)和微小GIST(直径≤1 cm)的检出率显著提高. 内镜、腹腔镜技术提供了消化管腔内、外不同视野与手术入路, 合理地选择手术方式, 灵活地联合运用双镜技术; 在根治肿瘤的前提下, 进一步降低手术风险、减轻手术创伤、加快术后康复、提高生活质量是GIST手术治疗追求的目标.
引文著录: 王昊, 石磊, 陈平. 腹腔镜、内镜及双镜联合技术在胃肠间质瘤治疗中的应用. 世界华人消化杂志 2016; 24(30): 4133-4143
Revised: May 27, 2016
Accepted: June 3, 2016
Published online: October 28, 2016
Gastrointestinal stromal tumors (GISTs) constitute the most common mesenchymal neoplasms of the gastrointestinal tract, among which 60%-70% are located in the stomach. All GISTs have malignant potential, varying from small lesions to aggressive sarcomas. Surgical resection with negative margins remains the best treatment for GISTs. Lymphadenectomy is not necessary because GISTs rarely metastasize to lymph nodes. Because of these biological behavior characteristics, the advantages of minimally invasive surgeries such as laparoscopic surgery and endoscopic surgery can be fully reflected in the surgical management of GISTs. The advent of laparoscopic and endoscopic cooperative surgery has broadened the scope and enhanced the safety of minimally invasive surgical treatment of GISTs. In this paper we will discuss the application of laparoscopy, endoscopy and laparoscopic and endoscopic cooperative surgery in the treatment of GISTs.
- Citation: Wang H, Shi L, Chen P. Application of laparoscopy, endoscopy and laparoscopic and endoscopic cooperative surgery in gastrointestinal stromal tumors. Shijie Huaren Xiaohua Zazhi 2016; 24(30): 4133-4143
- URL: https://www.wjgnet.com/1009-3079/full/v24/i30/4133.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i30.4133
胃肠间质瘤(gastrointestinal stromal tumors, GIST)是胃肠道最常见的间叶性肿瘤, 生物学行为多样, 可表现为微小病灶, 也可表现为进展性肉瘤[1]. 手术完整切除是目前可能根治GIST的唯一办法. 酪氨酸激酶抑制剂甲磺酸伊马替尼的出现改变了GIST单一的治疗模式, 开启了GIST分子靶向治疗时代. 然而日益凸显的耐药问题给GIST治疗带来了新的挑战. 大约在5年前, 我们遇到的GIST还以5-10 cm的中、大GIST为主, 多采用开放手术. 如今, 随着消化内镜的普及和超声内镜(endoscopic ultrasonography, EUS)的推广, 小和微小GIST的检出率大幅提高. GIST大多来源于胃, 且极少发生淋巴结转移, 无需常规行淋巴结清扫, 这些生物学特点为微创外科在GIST的手术治疗提供了广阔的探索空间.
已有回顾性研究[2-6]证实了腹腔镜切除GIST的安全性、可行性及良好的中短期效果. 但这些研究主要集中在胃GIST的腹腔镜手术治疗, 其他部位的GIST较少述及. 最近, 一项纳入19项研究结果、共计1060例胃GIST患者的Meta分析[7]比较了开放手术与腹腔镜手术的安全性及疗效, 其结果显示, 在手术时间相似的情况下[加权均数差(weighted mean difference, WMD): 7.20 min, 95%CI: 25.65-11.25, P = 0.44], 腹腔镜手术具有术中出血少(WMD: 54.21 mL, 95%CI: 82.65-25.77, P<0.01)、术后排气早(WMD: 1.34 d, 95%CI: 1.62-1.06, P<0.01)、经口进食早(WMD: 1.80 d, 95%CI: 2.18-1.42, P<0.01)、住院时间短(WMD: 3.68 d, 95%CI: 4.52-2.85, P<0.01)、总体并发症少(相对危险度: 0.51, 95%CI: 0.32-0.80, P<0.01)的优点, 且长期随访结果表明, 两组患者预后无差异.
GIST瘤体质脆、易破裂, 生长迅速者常伴有肿瘤内部出血、坏死、囊性变, 更易破溃. GIST一旦破裂即属高危风险, 术后需行格列卫辅助治疗. 由于腹腔镜操作缺乏精细触觉反馈, 容易引起医源性肿瘤破裂、播散, 国内外指南均未做常规推荐. 2004年, 欧洲肿瘤协会(European Society of Medical Oncology, ESMO)指南建议腹腔镜手术仅用于肿瘤直径<2 cm的GIST[8]. 美国国立综合癌症网络(National Comprehensive Cancer Network, NCCN)指南指出直径<2 cm的GIST可考虑行腹腔镜手术[9], 之后该手术指征被放宽至5 cm[10]. 2014年NCCN指南指出对于特定部位(胃大弯、前壁、空肠以及回肠)的GIST可考虑行腹腔镜手术, 对肿瘤大小未做强调. 中国GIST诊断治疗专家共识(2011年版)指出, 肿瘤直径≤5 cm者, 可考虑行腹腔镜切除[11]. 中国GIST诊断治疗共识(2013年版)则强调腹腔镜手术一般用于胃GIST治疗, 不主张应用于其他部位GIST的治疗, 在有经验的医疗中心, 可以根据肿瘤部位和大小考虑进行腹腔镜切除[12].
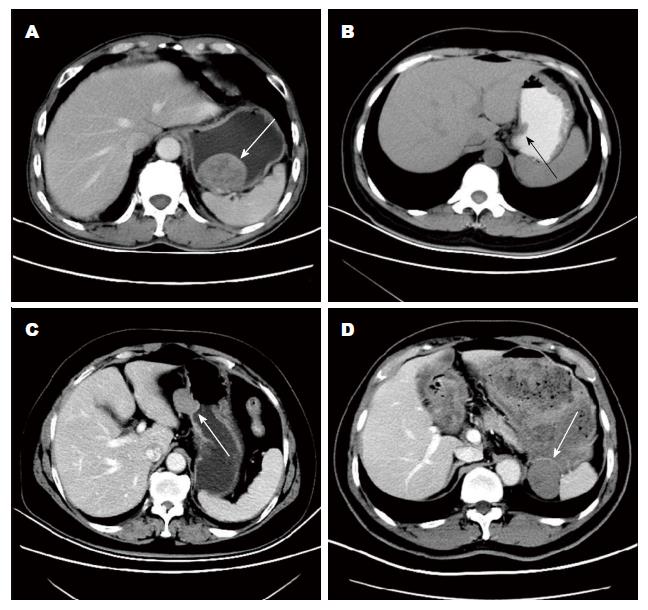
我们认为, GIST腹腔镜手术的适用应在术前综合评估GIST肿瘤大小、发生部位、生长方式及破裂风险: (1)肿瘤大小: 尽管国内外指南已不再强调将肿瘤大小作为腹腔镜手术适应证的限定条件, 但>10 cm的GIST患者腹部操作空间小, 且常伴有肿瘤内部出血、坏死、囊性变, 术中易出血破裂, 增加医源性播散风险, 因此腹腔镜手术应谨慎用于肿瘤直径<10 cm的胃GIST患者[6]; (2)发生部位: 目前关于应用腹腔镜治疗GIST的报道多数为胃GIST, 小肠GIST的报道较少[5,13]. 首先, 同等大小的小肠GIST危险度明显高于胃GIST[14], 更易破溃; 其次, 虽然在腹腔镜下可完成肠管切除吻合, 但仍需一定切口取出肿瘤, 而开放下直接将肿瘤拖出行切除吻合更为便捷安全; 再次, 与胃GIST不同的是, 小肠GIST不易早期发现, 待出现占位效应或出血症状时, 肿瘤往往较大, 医源性肿瘤破裂风险明显高于胃GIST; 因此胃体前后壁、大弯侧的GIST最适合行腹腔镜切除; (3)生长方式: 按生长方式的不同, GIST可分为: 腔内生长型(内生型)、腔外生长型(外生型)和混合生长型(混合型)(图1). 对于内生型GIST, 腹腔镜难以定位, 不宜行腹腔镜手术, 或需内镜辅助方能完成手术; (4)破裂风险: 肿瘤富血供、瘤体内出血、坏死、囊性变等是GIST破裂的高危因素, 术前应结合影像学(CT、MRI、EUS)资料充分评估肿瘤破裂风险.
目前, 腹腔镜胃GIST切除手术方式有: 腹腔镜胃楔形切除术(laparoscopic wedge resection, LWR)、腹腔镜胃腔内手术(laparoscopic intra-gastric surgery, LIGS)和腹腔镜经胃壁胃腔内手术(laparoscopic trans-gastric surgery, LTGS)[15].
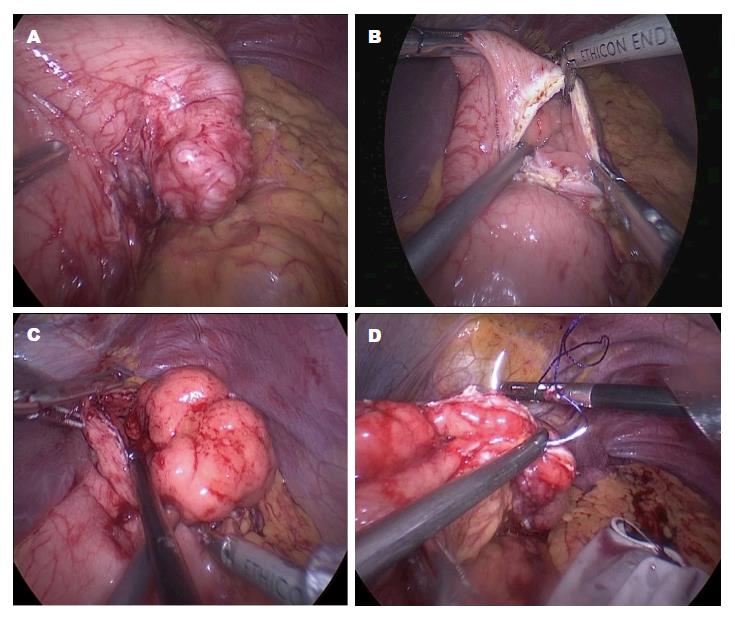
LWR是在腹腔镜直视下探查并定位肿瘤, 游离出肿瘤周围足够的胃壁, 提起肿瘤基底部以腹腔镜直线切割闭合器在距肿瘤边缘1-2 cm处楔形切除肿瘤. 该方法主要适用于胃前壁、胃大弯侧的外生型GIST. 对于胃后壁的GIST, 打开胃脾韧带、胃膈韧带、胃结肠韧带, 沿胃长轴掀起胃壁, 也能行相应切除, 对于难以行闭合器闭合者, 可以倒刺线缝合(图2). 对于混合型GIST, 可在预闭合线两端胃壁各悬吊1针, 使胃壁形成山脊样隆起, 超声刀打开一侧胃壁全层, 将瘤体外翻至胃腔外, 再以切割闭合器闭合胃壁缺损; 也可在距肿瘤基底部1-2 cm处环形切开胃壁浆肌层(不切开黏膜层), 提起肿瘤使混合型GIST转变为"外生型GIST", 再以切割闭合器切割黏膜层, 以缝线缝合胃壁浆肌层. 对于内生型GIST, 单纯应用腹腔镜难以定位. 对于胃小弯侧、近贲门或幽门处的GIST, 楔形切除有导致术后狭窄可能.
LIGS则是将腹腔镜光源和器械置入胃腔, 在胃腔内建立气腔, 在腹腔镜直视下切除肿瘤[16], 可用于胃后壁、近贲门或幽门的内生型GIST的切除.
LTGS的手术入路介于LWR和LIGS之间, 在建立气腹并置入腹腔镜器械后, 打开胃前壁进入胃腔, 适用于胃底近贲门处的内生型GIST的切除. LIGS和LTGS因技术原因的限制, 目前应用较少.
腹腔镜GIST切除手术过程中应注意: (1)动作轻柔, 避免直接夹持肿瘤; (2)使用取物袋, 避免肿瘤播散、种植; (3)确保完整切除, 取出标本后应检查手术切缘.
GIST起源于固有肌层, 瘤体与周围肌层组织界限不清, 内镜下治疗难以达到根治性切除之目的. ESMO和NCCN指南缺乏内镜治疗的相关表述. 我国2011、2013版共识虽有所述及, 但不作常规推荐. 近年来, 内镜治疗技术不断发展, 出现了内镜黏膜下剥除术(endoscopic submucosal dissection, ESD)、内镜黏膜下挖除术(endoscopic submucosal excavation, ESE)、内镜全层切除术(endoscopic full-thickness resection, EFR)和内镜经黏膜下隧道肿瘤切除术(submucosal tunneling endoscopic resection, STER)等技术, 包括我中心在内的国内多家单位进行了内镜治疗GIST的有益尝试与探索, 取得了良好的中、短期疗效.
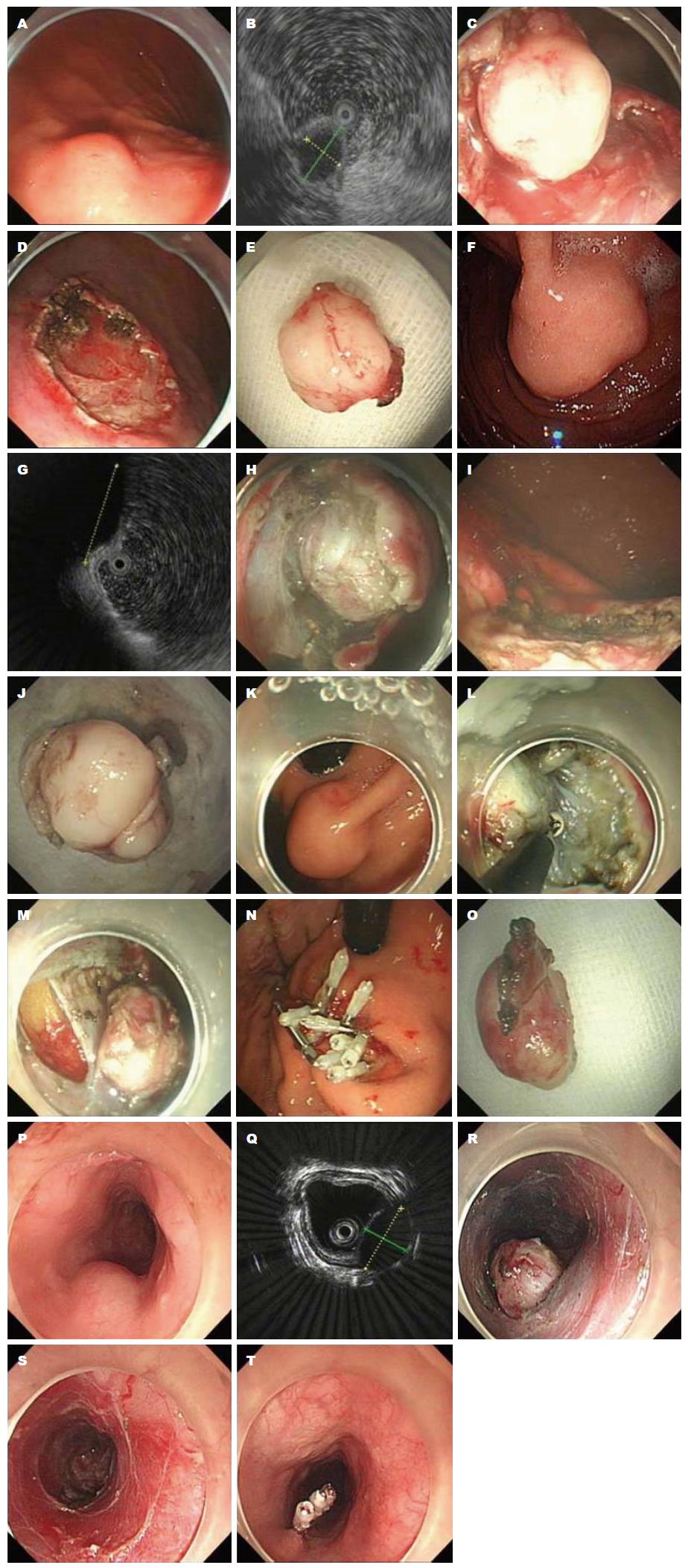
ESD首先对肿瘤表面黏膜进行标记, 黏膜下注射抬高病变, 再以钩刀、针形刀、海博刀等切开病灶基底周围黏膜, 于肿瘤下方对黏膜层进行剥除、完整切除病灶(图3). ESD不能满足完整切除GIST的要求.
ESE采用ESD技术预切开病变周围黏膜, 在瘤体基底部逐步剥离黏膜下层及部分固有肌层, 完整切除病灶[17](图3).
EFR采用ESD技术沿肿瘤周围分离至浆膜层, 直视下应用电切刀或圈套器完整切除瘤体及部分浆膜, 应用金属夹封闭胃壁缺损[18](图3).
STER是在距肿瘤头侧5 cm处食管黏膜切开, 黏膜下注射, 纵行切开黏膜1.5-2.0 cm, 分离切口处黏膜下组织, 借助头端透明帽沿切口进入黏膜下, 在黏膜层和肌层之间形成纵形隧道, 逐步分离直至跨过肿瘤尾侧1-2 cm, 完整切除肿瘤, 创面止血, 退出隧道, 金属夹关闭黏膜切口[19](图3). STER的优点在于保持了黏膜的完整性, 降低了术后消化道瘘、创面感染等可能性, 其主要并发症是气胸、纵隔气肿、皮下气肿、肺部少量炎症反应等[20].
以往, 穿孔被视为内镜手术的严重并发症, 但EFR技术打破了这一观念. 通过主动制造穿孔, EFR技术在内镜下全层切除胃壁, 满足了GIST根治性切除的要求. EFR的难点在于消化道壁缺损的修补和医源性腹膜炎的预防. 这对术者的内镜操作技术、患者的术前准备和术后治疗提出了更高的要求. 出血也是内镜手术的主要并发症之一. 术中即使极少量的出血都可能影响操作, 盲目的止血易导致穿孔, 止血失败则需要外科干预, 因此术中出血的预防与处理十分重要[21].
内镜治疗GIST方案的选择应从以下几个方面综合考虑: (1)发生部位: 对于齿状线以上的食管GIST可考虑内镜手术治疗, 通常选择STER; 胃食管连接部的GIST行腹腔镜手术易导致狭窄, 可考虑行内镜手术治疗; 齿状线以下的胃GIST, 可选择ESE、EFR; (2)生长方式: 通常内生型和2/3瘤体位于胃腔内的混合型GIST可选择内镜手术; 超过1/2瘤体以上位于胃腔外的混合型和外生型GIST, 内镜难以定位, 且切除后标本易落入腹腔, 可选择腹腔镜或双镜联合手术; (3)恶性潜能: 凡怀疑有恶性倾向者均应避免行内镜手术. 但事实上, 绝大多数胃黏膜下肿块在术前难以明确诊断, 准确评估恶性潜能更加困难; (4)肿瘤大小: 肿瘤大小与GIST危险度密切相关, 同时与内镜手术的可行性有关; (5)内镜医师的技术水平: 相比于ESD和ESE, EFR手术难度大, 对手术医生技术要求高, 尤其是对切开浆膜层后的止血和胃壁缺损的关闭有着更高的要求.
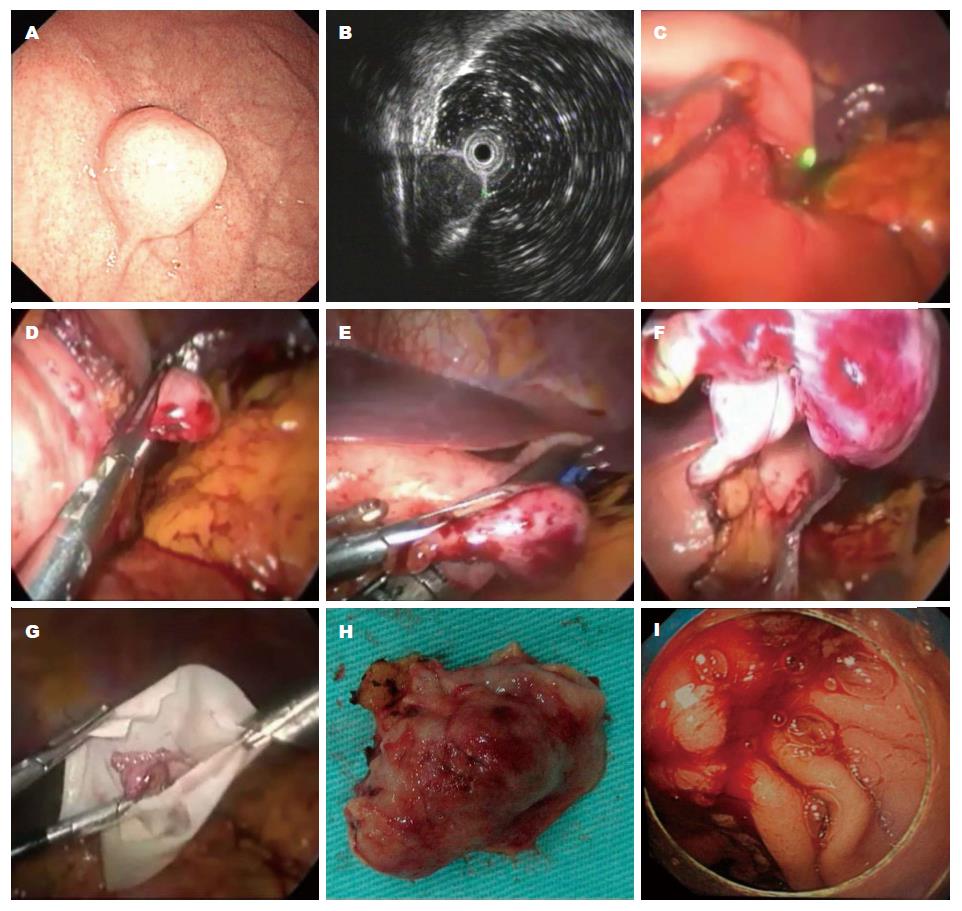
腹腔镜内镜联合手术(laparoscopic and endoscopic cooperative surgery, LECS)诞生的早期是指腹腔镜辅助内镜技术(laparoscope assisted endoscopic technique, LAET)和内镜辅助腹腔镜技术(endoscopy assisted laparoscopic technique, EALT)[22,23]. LAET是以内镜技术切除肿瘤, 腹腔镜辅助定位、协助显露、及时处理术中出血、穿孔等并发症[24,25]. EALT是利用腹腔镜技术切除肿瘤, 内镜辅助定位、协助暴露、监视腔内出血的手术方法(图4). EALT又包括: 内镜辅助下楔形切除术(endoscope-assisted wedge resection, EAWR)、内镜辅助下腹腔镜经胃壁胃腔内手术(endoscope-assisted LTGS, EALTGS)、内镜辅助下腹腔镜胃腔内手术(endoscope-assisted LIGS, EALIGS)、单孔LIGS等等. 还有学者报道了内镜辅助下的机器人GIST切除术[26,27]. EAWR是目前最常用的双镜技术, 被应用于胃SMT和胃GIST的切除[3,28-31]. 对于近贲门处或幽门环处的GIST, 可将胃镜末端置于胃或十二指肠内, 以起到支撑作用, 从而避免闭合后狭窄[32]. EALTGS和EALIGS主要用于胃后壁GIST的切除[33-35].
第3类LECS技术则是同步运用内镜技术和腹腔镜技术. 有学者将其称为"真正意义上的LECS"[36]或"经典LECS"[37]. 该手术2008年由Hiki等[37]首先提出, 具体手术方式是以内镜技术进行黏膜及黏膜下层切开, 以腹腔镜技术进行浆肌层切开, 将肿瘤翻转至浆膜外, 最后以闭合器或腹腔镜缝线闭合胃壁, 经腹腔取出标本. 经典LECS的优点在于以最小损伤切除肿瘤的同时, 保证了足够的切缘[38]. 该技术已得到了日本学界的广泛认可, 2014-02被正式写入该国指南, 应用于胃SMT(包括胃GIST)的切除[39]. 其不足是打开胃壁后有造成医源性腹膜炎及肿瘤播散的可能.
近年来, 在经典LECS的基础上又衍生出了一些改良术式: (1)反向LECS(Inverted LECS)[40]以内镜技术切开黏膜层后, 在腹腔镜下以缝线似皇冠样悬吊肿瘤周边胃壁, 在悬吊线内侧行浆肌层切开, 将肿瘤置入胃腔后闭合胃壁缺损, 经口取出标本; (2)腹腔镜辅助下内镜全层切除术(laparoscopic-assisted EFR, LAEFR)[41]采用内镜技术全层切开胃壁, 腹腔镜下手工缝合胃壁缺损; (3)清洁非暴露技术[42]是一种不打开胃壁的全层切除术, 内镜定位肿瘤后, 在腹腔镜下切开浆肌层而不切开黏膜层, 利用胃黏膜的延展性, 将肿瘤拖至浆膜外, 以闭合器闭合胃壁, 标本经腹腔取出; (4)非暴露内镜下胃壁翻转术(non-exposed endoscopic wall-inversion surgery, NEWS)[43,44]是一种新颖的胃局部切除术, 他是在腹腔镜下以超声刀梭形切开肿瘤外缘浆肌层后, 做浆肌层的内翻缝合(肿瘤连同其周围部分胃壁组织似荷包缝合样整体内翻至胃腔内)而浆膜层又同时得以封闭, 再以内镜技术完整切除肿瘤, 钛夹夹闭腔内创面, 经口取出标本[45]. 这些改良LECS技术既保证了内镜下胃壁全层的R0切除, 又不同程度地避免肿瘤播散及医源性腹膜炎.
在理论上, LECS的优势显而易见, 一系列小样本量临床研究显示[23,38,46]经典LECS平均手术时间为156-172 min, 平均失血量: 3.5-7.0 mL, 术后平均住院时间为7.4-11.6 d, 且无并发症报道. 当然, LECS的安全性仍需要大样本量、长期随访资料支持的随机对照研究的循证医学证据支持.
在技术上, LECS可用于直径<5 cm、无黏膜缺损的胃GIST的手术治疗, 并且不受肿瘤部位的限制[39]. 未来, 对于有黏膜缺损的胃GIST的双镜联合治疗, LECS相关技术仍有待进一步改进.
2010年NCCN指南提出了小GIST的概念: 直径<2 cm的GIST. 我国2013版GIST专家共识将直径≤1 cm的GIST定义为微小GIST. 大约在5年前, 我们遇到的GIST还以5-10 cm的中、大GIST为主, 多采用开放手术. 如今, 随着消化内镜的普及和EUS的推广, 小GIST和微小GIST的检出率大幅提高. 从技术角度而言, 小GIST和微小GIST特别适合行内镜和腹腔镜治疗, 但缺乏询证医学证据的佐证.
另一方面, 对于此类GIST的生物学行为, 目前存在两种观点: (1)所有GIST均具有潜在恶性潜能[47], 一经发现应尽早手术治疗; (2)小GIST存在良、恶性之分[48]. 应当认识到, 肿瘤存在异质性: 肿瘤间异质性和肿瘤内异质性, 我们曾遇到过小胃GIST在术后短短数月即发生肝、脑多发转移的极端个案, 这提示虽然小GIST多表现为良性过程, 但不能完全排除恶性的可能. 因此, 准确地评估小GIST的预后风险, 进而制定个体化治疗策略就显得尤为重要.
目前常用的评估方法主要是EUS. EUS下GIST可能的高危表现包含边界不规则、回声不均匀、囊性变、溃疡形成、强回声灶等[49]. NCCN指南建议对于EUS高危表现者行手术完整切除, 无高危表现者可考虑内镜下密切监测[50].
随着内镜检查的普及以及对GIST认识的提高, 小GIST(直径<2 cm)、微小GIST(直径≤1 cm)检出率逐年上升, 巨大GIST将越来越少见. 内镜和腹腔镜提供了消化管腔内、外不同视野与手术入路, 充分了解GIST的生物学特性, 合理地选择手术方式; 在根治肿瘤的前提下, 进一步降低手术风险, 减轻手术创伤、加快术后康复、提高生活质量是GIST手术治疗追求的目标.
传统消化内科与消化外科的专科分野已日益模糊, 越来越多的外科医生学习掌握了内镜技术, 而手术也不再为外科医生所垄断. 未来, 建立以疾病为中心的多学科诊疗模式将成为消化科的发展方向. GIST手术治疗的发展体现并实践着这一特点和趋势, 为此: (1)需要建立以GIST为中心的外科治疗团队: 一种模式是内镜医师参与到GIST外科手术团队中来; 另一种模式是外科医生同时掌握腹腔镜技术和内镜技术; (2)需要建设可同时开展腹腔镜手术、内镜手术和介入手术的复合手术室; (3)需要加强专科麻醉师、护士的培训, 提高手、麻、护三方协作默契度.
此外, 目前腹腔镜、内镜、双镜联合手术的研究还集中在胃GIST, 未来还需探索内镜与胸腔镜联合治疗食管GIST、肠镜与腹腔镜结合治疗结直肠GIST的新方法, 以扩大内镜、腹腔镜和双镜手术的适用范围. 对于不同部位GIST的最佳手术方式, 仍需要更多的临床研究加以确定.
大约在5年前, 胃肠间质瘤(gastrointestinal stromal tumors, GIST)还以5-10 cm甚至是>10 cm的中、大GIST为主, 多采用开放手术. 如今, 随着消化内镜的普及和超声内镜的推广, 小GIST、微小GIST检出率的大幅提高. 另一方面, GIST大多来源于胃(60%-70%), 且极少发生淋巴结转移, 无需常规行淋巴结清扫, 这些生物学特点为微创外科在GIST的手术治疗提供了广阔的探索空间.
对于小GIST的生物学行为, 目前存在两种观点: (1)所有GIST均具有潜在恶性潜能, 一经发现应尽早手术治疗; (2)小GIST存在良、恶性之分, 对于无恶性表现者可定期随访.
本文系统阐述了腹腔镜、内镜以及双镜联合技术在GIST, 特别是小和微小GIST中的应用.
充分了解GIST的生物学特性, 合理地选择手术方式; 在根治肿瘤的前提下, 进一步降低手术风险, 减轻手术创伤、加快术后康复、提高生活质量是GIST手术治疗追求的目标.
邱成志, 教授, 主任医师, 福建医科大学附属第二医院普外科
本文内容有一定的实用性和重要意义, 文稿的科学性和可读性较好, 反映了我国的胃肠病学临床的先进水平.
手稿来源: 邀请约稿
学科分类: 胃肠病学和肝病学
手稿来源地: 江苏省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): 0
D级 (一般): 0
E级 (差): 0
编辑: 于明茜 电编:胡珊
| 1. | Joensuu H, Vehtari A, Riihimäki J, Nishida T, Steigen SE, Brabec P, Plank L, Nilsson B, Cirilli C, Braconi C. Risk of recurrence of gastrointestinal stromal tumour after surgery: an analysis of pooled population-based cohorts. Lancet Oncol. 2012;13:265-274. [PubMed] [DOI] |
| 2. | Novitsky YW, Kercher KW, Sing RF, Heniford BT. Long-term outcomes of laparoscopic resection of gastric gastrointestinal stromal tumors. Ann Surg. 2006;243:738-745; discussion 745-747. [PubMed] [DOI] |
| 3. | Sasaki A, Koeda K, Obuchi T, Nakajima J, Nishizuka S, Terashima M, Wakabayashi G. Tailored laparoscopic resection for suspected gastric gastrointestinal stromal tumors. Surgery. 2010;147:516-520. [PubMed] [DOI] |
| 4. | Pucci MJ, Berger AC, Lim PW, Chojnacki KA, Rosato EL, Palazzo F. Laparoscopic approaches to gastric gastrointestinal stromal tumors: an institutional review of 57 cases. Surg Endosc. 2012;26:3509-3514. [PubMed] [DOI] |
| 5. | 张 信华, 宋 武, 韩 方海, 陈 创奇, 宋 新明, 陈 剑辉, 蔡 世荣, 何 裕隆, 詹 文华. 腹腔镜手术治疗胃和小肠胃肠间质瘤疗效分析. 中华胃肠外科杂志. 2014;17:340-343. |
| 7. | Chen K, Zhou YC, Mou YP, Xu XW, Jin WW, Ajoodhea H. Systematic review and meta-analysis of safety and efficacy of laparoscopic resection for gastrointestinal stromal tumors of the stomach. Surg Endosc. 2015;29:355-367. [PubMed] [DOI] |
| 8. | Casali PG, Jost L, Reichardt P, Schlemmer M, Blay JY. Gastrointestinal stromal tumors: ESMO clinical recommendations for diagnosis, treatment and follow-up. Ann Oncol. 2008;19 Suppl 2:ii35-ii38. [PubMed] [DOI] |
| 9. | Demetri GD, Benjamin R, Blanke CD, Choi H, Corless C, DeMatteo RP, Eisenberg BL, Fletcher CD, Maki RG, Rubin BP. NCCN Task Force report: optimal management of patients with gastrointestinal stromal tumor (GIST)--expansion and update of NCCN clinical practice guidelines. J Natl Compr Canc Netw. 2004;2 Suppl 1:S-1-26; quiz 27-30. [PubMed] |
| 10. | Demetri GD, von Mehren M, Antonescu CR, DeMatteo RP, Ganjoo KN, Maki RG, Pisters PW, Raut CP, Riedel RF, Schuetze S. NCCN Task Force report: update on the management of patients with gastrointestinal stromal tumors. J Natl Compr Canc Netw. 2010;8 Suppl 2:S1-S41; quiz S42-S44. [PubMed] |
| 14. | Belfiori G, Sartelli M, Cardinali L, Tranà C, Bracci R, Gesuita R, Marmorale C. Risk stratification systems for surgically treated localized primary Gastrointestinal Stromal Tumors (GIST). Review of literature and comparison of the three prognostic criteria: MSKCC Nomogramm, NIH-Fletcher and AFIP-Miettinen. Ann Ital Chir. 2015;86:219-227. [PubMed] |
| 15. | 李 文迪, 姚 宏伟, 贾 易木, 袁 炯, 王 德臣, 张 同琳, 付 卫, 修 典荣. 腹腔镜经胃壁胃腔内手术治疗胃底近贲门处胃肠间质瘤. 中华胃肠外科杂志. 2014;17:399-400. |
| 16. | Sahm M, Pross M, Lippert H. Intraluminal resection of gastric tumors using intragastric trocar technique. Surg Laparosc Endosc Percutan Tech. 2011;21:e169-e172. [PubMed] [DOI] |
| 18. | Zhou PH, Yao LQ, Qin XY, Cai MY, Xu MD, Zhong YS, Chen WF, Zhang YQ, Qin WZ, Hu JW. Endoscopic full-thickness resection without laparoscopic assistance for gastric submucosal tumors originated from the muscularis propria. Surg Endosc. 2011;25:2926-2931. [PubMed] [DOI] |
| 20. | Ye LP, Zhang Y, Mao XL, Zhu LH, Zhou X, Chen JY. Submucosal tunneling endoscopic resection for small upper gastrointestinal subepithelial tumors originating from the muscularis propria layer. Surg Endosc. 2014;28:524-530. [PubMed] [DOI] |
| 22. | Hiki N. [Feasible technique for laparoscopic wedge resection for gastric submucosal tumor-laparoscopy endoscopy cooperative surgery (LECS)]. Gan To Kagaku Ryoho. 2011;38:728-732. [PubMed] |
| 23. | Hoteya S, Haruta S, Shinohara H, Yamada A, Furuhata T, Yamashita S, Kikuchi D, Mitani T, Ogawa O, Matsui A. Feasibility and safety of laparoscopic and endoscopic cooperative surgery for gastric submucosal tumors, including esophagogastric junction tumors. Dig Endosc. 2014;26:538-544. [PubMed] [DOI] |
| 24. | Qiu WQ, Zhuang J, Wang M, Liu H, Shen ZY, Xue HB, Shen L, Ge ZZ, Cao H. Minimally invasive treatment of laparoscopic and endoscopic cooperative surgery for patients with gastric gastrointestinal stromal tumors. J Dig Dis. 2013;14:469-473. [PubMed] [DOI] |
| 25. | Acker S, Dishop M, Kobak G, Vue P, Somme S. Laparoscopic-Assisted Endoscopic Resection of a Gastric Leiomyoma. European J Pediatr Surg Rep. 2014;2:003-006. [PubMed] [DOI] |
| 26. | Buchs NC, Bucher P, Pugin F, Hagen ME, Morel P. Robot-assisted oncologic resection for large gastric gastrointestinal stromal tumor: a preliminary case series. J Laparoendosc Adv Surg Tech A. 2010;20:411-415. [PubMed] [DOI] |
| 27. | Moriyama H, Ishikawa N, Kawaguchi M, Hirose K, Watanabe G. Robot-assisted laparoscopic resection for gastric gastrointestinal stromal tumor. Surg Laparosc Endosc Percutan Tech. 2012;22:e155-e156. [PubMed] [DOI] |
| 28. | Huguet KL, Rush RM, Tessier DJ, Schlinkert RT, Hinder RA, Grinberg GG, Kendrick ML, Harold KL. Laparoscopic gastric gastrointestinal stromal tumor resection: the mayo clinic experience. Arch Surg. 2008;143:587-590; discussion 591. [PubMed] [DOI] |
| 29. | Marano L, Torelli F, Schettino M, Porfidia R, Reda G, Grassia M, Braccio B, Petrillo M, Di Martino N. Combined laparoscopic-endoscopic "Rendez-vous" procedure for minimally invasive resection of gastrointestinal stromal tumors of the stomach. Am Surg. 2011;77:1100-1102. [PubMed] |
| 30. | Mochizuki Y, Kodera Y, Fujiwara M, Ito S, Yamamura Y, Sawaki A, Yamao K, Kato T. Laparoscopic wedge resection for gastrointestinal stromal tumors of the stomach: initial experience. Surg Today. 2006;36:341-347. [PubMed] [DOI] |
| 31. | Shimizu S, Noshiro H, Nagai E, Uchiyama A, Mizumoto K, Tanaka M. Laparoscopic wedge resection of gastric submucosal tumors. Dig Surg. 2002;19:169-173. [PubMed] [DOI] |
| 32. | Privette A, McCahill L, Borrazzo E, Single RM, Zubarik R. Laparoscopic approaches to resection of suspected gastric gastrointestinal stromal tumors based on tumor location. Surg Endosc. 2008;22:487-494. [PubMed] [DOI] |
| 33. | Hepworth CC, Menzies D, Motson RW. Minimally invasive surgery for posterior gastric stromal tumors. Surg Endosc. 2000;14:349-353. [PubMed] [DOI] |
| 34. | Dong HY, Wang YL, Li J, Pang QP, Li GD, Jia XY. New-style laparoscopic and endoscopic cooperative surgery for gastric stromal tumors. World J Gastroenterol. 2013;19:2550-2554. [PubMed] [DOI] |
| 37. | Hiki N, Yamamoto Y, Fukunaga T, Yamaguchi T, Nunobe S, Tokunaga M, Miki A, Ohyama S, Seto Y. Laparoscopic and endoscopic cooperative surgery for gastrointestinal stromal tumor dissection. Surg Endosc. 2008;22:1729-1735. [PubMed] [DOI] |
| 38. | Kawahira H, Hayashi H, Natsume T, Akai T, Uesato M, Horibe D, Mori M, Hanari N, Aoyama H, Nabeya Y. Surgical advantages of gastric SMTs by laparoscopy and endoscopy cooperative surgery. Hepatogastroenterology. 2012;59:415-417. [PubMed] [DOI] |
| 39. | Hiki N, Nunobe S, Matsuda T, Hirasawa T, Yamamoto Y, Yamaguchi T. Laparoscopic endoscopic cooperative surgery. Dig Endosc. 2015;27:197-204. [PubMed] [DOI] |
| 40. | Nunobe S, Hiki N, Gotoda T, Murao T, Haruma K, Matsumoto H, Hirai T, Tanimura S, Sano T, Yamaguchi T. Successful application of laparoscopic and endoscopic cooperative surgery (LECS) for a lateral-spreading mucosal gastric cancer. Gastric Cancer. 2012;15:338-342. [PubMed] [DOI] |
| 41. | Abe N, Takeuchi H, Yanagida O, Masaki T, Mori T, Sugiyama M, Atomi Y. Endoscopic full-thickness resection with laparoscopic assistance as hybrid NOTES for gastric submucosal tumor. Surg Endosc. 2009;23:1908-1913. [PubMed] [DOI] |
| 42. | Inoue H, Ikeda H, Hosoya T, Yoshida A, Onimaru M, Suzuki M, Kudo SE. Endoscopic mucosal resection, endoscopic submucosal dissection, and beyond: full-layer resection for gastric cancer with nonexposure technique (CLEAN-NET). Surg Oncol Clin N Am. 2012;21:129-140. [PubMed] [DOI] |
| 43. | Goto O, Mitsui T, Fujishiro M, Wada I, Shimizu N, Seto Y, Koike K. New method of endoscopic full-thickness resection: a pilot study of non-exposed endoscopic wall-inversion surgery in an ex vivo porcine model. Gastric Cancer. 2011;14:183-187. [PubMed] [DOI] |
| 44. | Mitsui T, Niimi K, Yamashita H, Goto O, Aikou S, Hatao F, Wada I, Shimizu N, Fujishiro M, Koike K. Non-exposed endoscopic wall-inversion surgery as a novel partial gastrectomy technique. Gastric Cancer. 2014;17:594-599. [PubMed] [DOI] |
| 45. | Kim DW, Kim JS, Kim BW, Jung JY, Kim GJ, Kim JJ. Non-Exposed Endoscopic Wall-Inversion Surgery for Gastrointestinal Stromal Tumor of the Stomach: First Case Report in Korea. Clin Endosc. 2016;49:475-478. [PubMed] [DOI] |
| 46. | Tsujimoto H, Yaguchi Y, Kumano I, Takahata R, Ono S, Hase K. Successful gastric submucosal tumor resection using laparoscopic and endoscopic cooperative surgery. World J Surg. 2012;36:327-330. [PubMed] [DOI] |
| 47. | Fletcher CD, Berman JJ, Corless C, Gorstein F, Lasota J, Longley BJ, Miettinen M, O'Leary TJ, Remotti H, Rubin BP. Diagnosis of gastrointestinal stromal tumors: A consensus approach. Hum Pathol. 2002;33:459-465. [PubMed] [DOI] |
| 48. | Muenst S, Thies S, Went P, Tornillo L, Bihl MP, Dirnhofer S. Frequency, phenotype, and genotype of minute gastrointestinal stromal tumors in the stomach: an autopsy study. Hum Pathol. 2011;42:1849-1854. [PubMed] [DOI] |
| 49. | Yegin EG, Duman DG. Small EUS-suspected gastrointestinal stromal tumors of the stomach: An overview for the current state of management. Endosc Ultrasound. 2016;5:69-77. [PubMed] [DOI] |
| 50. | Sepe PS, Brugge WR. A guide for the diagnosis and management of gastrointestinal stromal cell tumors. Nat Rev Gastroenterol Hepatol. 2009;6:363-371. [PubMed] [DOI] |