修回日期: 2015-12-17
接受日期: 2015-12-21
在线出版日期: 2016-01-28
目的: 探讨乙型肝炎肝硬化患者树突状细胞(dendritic cells, DCs)表面标志物表达异常与小肠细菌过度生长(small intestinal bacteria overgrowth, SIBO)的关系.
方法: 乙型肝炎肝硬化患者47例, 健康对照者15例, 作为研究对象. 乳果糖氢呼气试验(lactulose hydrogen breath test, LHBT)评估小肠细菌过生长情况. 采集外周血体外诱导、培养DCs, 采用流式细胞仪检测DCs表型. 多组间比较采用单因素方差分析.
结果: 47例肝硬化中22例有SIBO, 患病率(46.8%)显著高于正常对照组的6.7%(P = 0.005). Child-Pugh A、Child-Pugh B、Child-Pugh C的SIBO患病率分别为18.2%、43.8%、65.0%; 肝硬化失代偿期(Child-PughB、C级)SIBO患病率55.6%, 显著高于肝硬化代偿期(A级)的18.2%(P = 0.030). 乙型肝炎肝硬化组DCs表面标志物HLA-DR阳性率与对照组比较无显著性差异(P = 0.338), CD80、CD83、CD1a的表达率与健康对照组比较有显著性差异(P<0.05). 肝硬化SIBO阳性组患者CD80、CD83、CD1a表达率(分别为17.22%±2.08%、24.65%±1.47%、14.05%±1.33%)显著低于SIBO阴性组(22.13%±2.34%、34.52%±2.84%、17.40%±3.22%, P<0.05), 肝硬化SIBO阳性组患者HLA-DR表达率高于SIBO阴性组(81.47%±7.56% vs 70.15%±6.32%, P<0.05).
结论: 肝硬化患者SIBO发生率明显升高, 这种小肠菌群的异常与DCs异常存在相关性.
核心提示: 慢性乙型肝炎患者体内存在树突状细胞(dendritic cells, DCs)数量和功能下降、成熟障碍, 抗原提呈功能缺陷, 不能有效发挥其在抗乙型肝炎病毒免疫应答中的作用, 促进了肝纤维化、肝硬化的发生. 研究发现, 肝硬化的程度与小肠细菌过度生长(small intestinal bacteria overgrowth, SIBO)的发生率有关, 因此我们推断DCs的表面标志物和SIBO的发生率也有一定的关系.
引文著录: 马英杰, 高晓, 魏新朋, 杨丽, 韩际奥, 王志凌, 韩丽. 乙型肝炎肝硬化患者小肠细菌过度生长与外周血树突状细胞异常的相关性. 世界华人消化杂志 2016; 24(3): 443-448
Revised: December 17, 2015
Accepted: December 21, 2015
Published online: January 28, 2016
AIM: To investigate the relationship between dendritic cells (DCs) and small intestinal bacterial overgrowth (SIBO) in cirrhotic patients with hepatitis B.
METHODS: Flow cytometry was used to analyze the counts of peripheral blood DCs in 47 cirrhotic patients with HBV infection and 15 healthy volunteers. SIBO was determined by lactulose hydrogen breath test (LHBT).
RESULTS: Of the 47 cirrhotic patients, 22 (46.8%) had SIBO, which was significantly higher than that in healthy controls (6.7%, P = 0.005). The prevalence of SIBO increased with the Child-Pugh classification of cirrhosis (A: 18.2%, B: 43.8% and C: 65%). The prevalence of SIBO in patients with decompensated cirrhosis was significantly higher than that in patients with compensated cirrhosis (55.6% vs 18.2%, P = 0.030). The expression of CD80, CD83, and CD1a on the surface of DCs in cirrhotic patients was significantly lower than that in healthy controls (P < 0.05). The expression rates of CD80, CD83, CD1a and HLA-DR on the surface of DCs in SIBO positive cirrhotic patients were lower than those in SIBO negative cirrhotic patients (17.22% ± 2.08% vs 22.13% ± 2.34%, 24.65% ± 1.47% vs 34.52% ± 2.84%, 14.05% ± 1.33% vs 17.40% ± 3.22%, 81.47% ± 7.56% vs 70.15% ± 6.32%, P < 0.05).
CONCLUSION: The functional abnormality of DCs in cirrhotic patients with hepatitis B is associated with the presence of SIBO.
- Citation: Ma YJ, Gao X, Wei XP, Yang L, Han JA, Wang ZL, Han L. Correlation between small intestinal bacterial overgrowth and dendritic cell phenotype and function in cirrhotic patients with hepatitis B. Shijie Huaren Xiaohua Zazhi 2016; 24(3): 443-448
- URL: https://www.wjgnet.com/1009-3079/full/v24/i3/443.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i3.443
乙型肝炎肝硬化患者存在程度不同、形式多样的树突状细胞(dendritic cells, DCs)异常. 由于肝硬化时门脉高压、肝功能减退、肠道黏膜充血水肿、运动障碍、胆盐肝肠循环障碍等一系列病理生理改变, 影响了肠道内菌群的种属、定植能力及代谢能力, 促进肠道菌群紊乱和细菌易位的发生, 但是有关肝硬化肠道菌群与DCs功能研究较少, 本课题就乙型肝炎肝硬化患者小肠细菌过度生长与外周血DCs表面标记进行研究, 报告如下.
2014-06/2015-09收住院的乙型肝炎肝硬化患者47例, 其中肝功能Child-Pugh分级A级11例、B16例、C级20例, 男30例, 女17例, 年龄32-75岁, 平均年龄45.91岁±12.40岁, 诊断符合2010年版慢性乙型肝炎防治指南[1]的诊断标准. 同期选择15例健康人作为正常对照, 其中男9例, 女6例, 年龄23-78岁, 平均42.25岁±14.18岁. 均无腹腔外科手术史、肾功能不全; 无合并可能引起胃肠动力不良的肝外疾病(如糖尿病, 假性肠梗阻等); 近2 wk未使用抗生素、乳果糖、制酸药或其他促胃肠动力的药物. RPMI 1640培养基、人淋巴细胞分离液(北京索莱宝科技有限公司产品); rhIL-4、rhGM-CSF(Pepro Tech公司); 抗原递呈细胞(antigen presenting cell, APC)标记的CD83(eBioscience公司); 鼠抗人单克隆抗体FITC标记的CD80、PE标记的CD1a及PerCP标记的HLA-DR(美国BD公司), 流式细胞仪(FACSAiia, 美国BD公司). 设备为英国Bedfont公司生产的EC60Gastrolyzer氢气检测仪, 底物为乳果糖口服液(杜密克).
1.2.1 小肠细菌生长评估: 通过乳果糖氢呼气试验(lactulose hydrogen breath test, LHBT)气体检测, 受试者试验前1 d禁食牛奶制品和豆制品、粗纤维食物以及辛辣刺激食物, 晚餐以淀粉类食物为主. 检测当日禁食. 按照操作手册的操作规程, 先测空腹氢气浓度, 然后口服乳果糖10 g(可加少许温水送服), 每15 min测试1次呼气氢浓度, 共2 h. 基础值超过20 ppm或口服乳果糖后呼气氢浓度上升超过12 ppm为小肠细菌过度生长(small intestinal bacteria overgrowth, SIBO)阳性.
1.2.2 外周血培养DCs: 无菌条件抽取研究对象外周血20 mL, 肝素抗凝, Hanks液对倍稀释, 将稀释后的抗凝血沿管壁加在人淋巴细胞分离液上(1:1), 室温2000 r/min离心20 min. 离心后用吸管轻轻吸出位于血浆层与淋巴细胞分离液层之间的单个核细胞层. 将所得悬液用5倍体积的Hanks液洗涤2次, 依次以1800 r/min、1200 r/min离心5 min. 末次离心后弃上清, 用RPMI 1640培养液(含2%自体血清)重悬混匀, 调整细胞浓度为4×106/mL-5×106/mL, 置于37 ℃、50 mL/L CO2培养箱培养2 h. 洗去非贴附细胞, 在剩余含贴壁细胞的培养瓶中, 加入AIM-V无血清培养基及细胞因子(1000 U/mL GM-CSF、1000 U/mL白介素-4)置于37 ℃、50 mL/L CO2培养箱培养. 第3天半量换液1次并补充细胞因子. 培养的第7天收获DCs.
1.2.3 DCs表型检测: 在培养的第7天收集细胞培养液于5 mL PBS中, 1000 r/min, 8 min离心洗去血清等特异抗原, 调整细胞浓度至1.5×106/mL, 1000 μL/管分装, 分别加入20 μL鼠抗人单克隆抗体(PE-CD1a、FITC-CD80、APC-CD83、PerCp-HLA-DR), 4 ℃, 15 min. 以3 mL PBS 1000 r/min, 8 min离心洗涤2次, 最后以PBS重悬调浓度至1.0×106细胞/mL. 用流式细胞仪进行免疫表型分析.
统计学处理 采用SPSS17.0进行数据处理, 计数资料以率(%)表示, 用χ2检验或Fisher确切概率法检验. P<0.05为差异有统计学意义.
肝硬化患者47例中有22例SIBO阳性, 阳性率为46.8%, 显著高于正常对照组6.7%(χ2 = 7.852, P = 0.005). 患者肝硬化患者Child-Pugh A级、B级、C级的SIBO阳性率分别为18.2%、43.8%、65.0%. 肝硬化B级组和肝硬化C级组较健康对照组差异有统计学意义(P = 0.037、0.001), 肝硬化A级组较对照组差异无统计学意义(P = 0.556), 肝硬化代偿期(Child-Pugh A级)和肝硬化失代偿期(Child-Pugh B级、Child-Pugh C级)比较差异有统计学意义(χ2 = 4.727, P = 0.030, 表1).
| 分组 | n | 阳性 | 阳性率(%) | χ2/Fisher确切概率 |
| 对照组 | 15 | 1 | 6.7 | |
| 肝硬化 | 47 | 22 | 46.8 | 0.005 |
| A级组 | 11 | 2 | 18.2 | 0.556 |
| B级组 | 16 | 7 | 43.8 | 0.037 |
| C级组 | 20 | 13 | 65.0 | 0.001 |
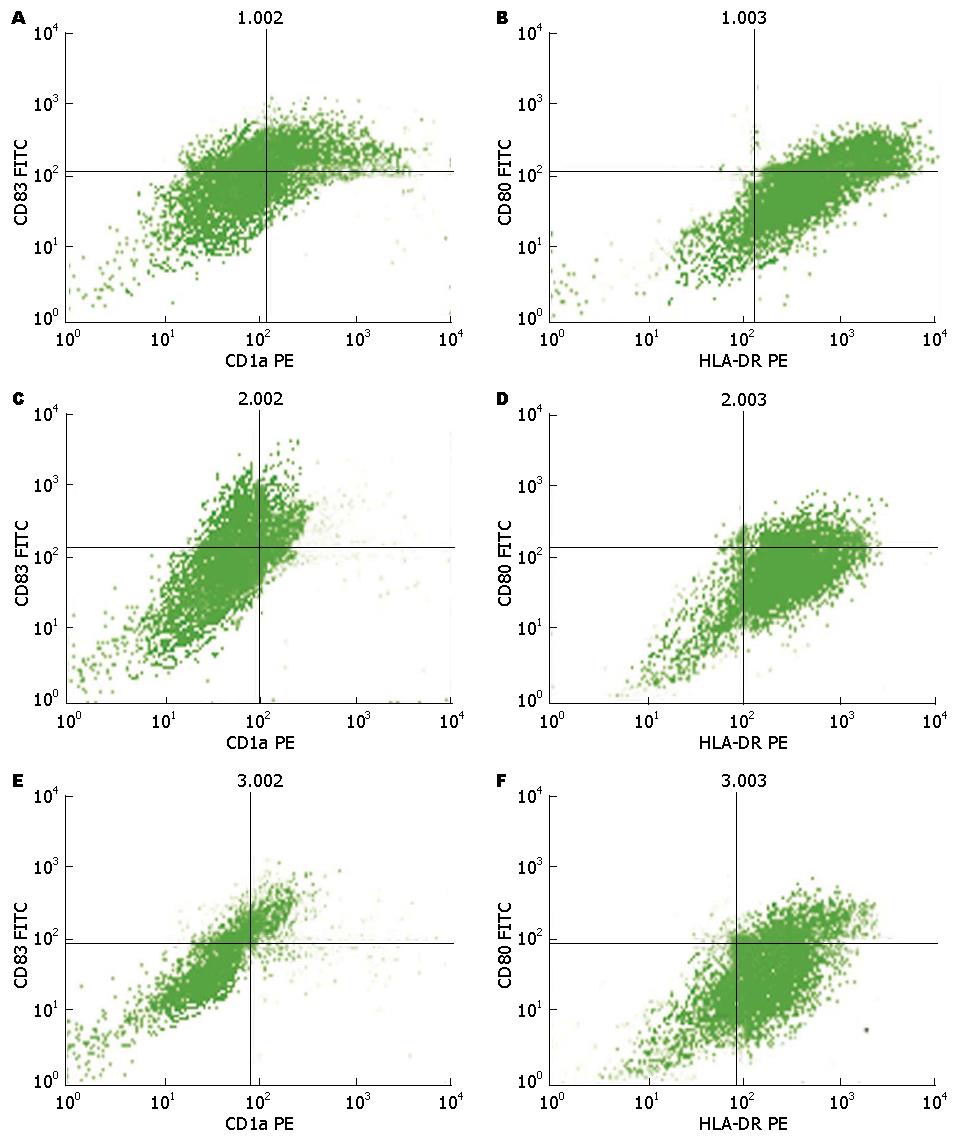
DCs表面标示在正常人、肝硬化患者有无合并SIBO有不同水平表达(图1). 乙型肝炎肝硬化组DCs表面标志物HLA-DR阳性率与对照组比较无显著性差异(P>0.05), CD1a、CD80及CD83阳性率显著低于对照组(P<0.01); 肝硬化SIBO阳性者DCs表面标志CD1a、HLA-DR、CD80及CD83阳性率均显著低于未合并SIBO者组(P<0.05, 表2).
| 分组 | n | CD80 | CD83 | CD1a | HLA-DR |
| 健康对照组 | 15 | 26.79±3.40 | 41.57±7.26 | 25.21±2.48 | 74.56±7.47 |
| 肝硬化患者 | 47 | 19.85±2.01a | 30.19±3.04a | 15.76±1.55a | 76.82±8.03 |
| SIBO阴性 | 25 | 22.13±2.34 | 34.52±2.84 | 17.40±3.22 | 70.15±6.32 |
| SIBO阳性 | 22 | 17.22±2.08c | 24.65±1.47c | 14.05±1.33c | 81.47±7.56c |
DCs是一种最强的抗原提呈细胞, 起源于骨髓, 广泛分布于人体的多个部位, 如血液以及肝脾、淋巴结、肺、肾、胃肠道等组织间质中, 但正常组织里面含量极微. DCs通过其表面的Toll样受体选择性地识别侵入机体的细菌、病毒等病原微生物中共有、保守的致病原相关分子, 还表达主要组织相容性复合体类分子、辅助刺激分子CD80及CD86等, 诱导和激发特异性免疫应答. 在抗病原微生物、抗肿瘤免疫反应及维持正常机体免疫系统稳定中发挥着十分重要的作用[2,3].
慢性乙型肝炎患者体内存在DCs数量和功能下降、成熟障碍, 抗原提呈功能缺陷, 不能有效地把病毒抗原传递给T淋巴细胞, 不能有效发挥其在抗乙型肝炎病毒(hepatitis B virus, HBV)免疫应答中的作用, 导致机体对HBV的清除不足从而使感染持续存在, 进而进展为肝纤维化、肝硬化[4-8]. 研究[9,10]也发现肝硬化发生后DCs数量和功能存在更严重的异常. 已知肝肠在结构功能上密切关联, 肝脏通过门静脉系统和胆道系统与肠道建立了直接输入和输出关系; 通过分泌胆汁和胆汁肝肠循环影响肠道的功能; 肠道通过门静脉把其吸收的物质(包含细菌及细菌产物)输送到肝脏, 激活、影响肝脏的功能[11]. 肝硬化由于肠道运动异常、胃肠道淤血等因素, 导致胃肠道生态紊乱, 并影响肝硬化预后[12,13]. 有学者认为SIBO的出现和肝脏疾病严重程度有关[14]. DCs在维持对肠道共生菌、食物抗原的免疫耐受, 启动对肠道病原微生物的免疫应答反应, 预防控制宿主体内的感染的过程中发挥着重要作用. 肠道DCs诱导T细胞表达CCR9、整合素等相对特异趋化因子受体, 是决定细胞毒性T细胞向肠道弥散淋巴组织和非淋巴区域迁移, 而非向脾等处迁移的关键因素[15]. 本课题进行了研究有无SIBO的肝硬化DCs表面标识的差异, 探讨SIBO与肝硬化互相影响的可能机制.
本组资料显示肝硬化患者SIBO患病率46.8%, 与国内外文献报道[16-18]相近. 肝硬化代偿期(Child-Pugh A级)和肝硬化失代偿期(Child-Pugh B级、Child-Pugh C级)比较差异有统计学意义, 提示SIBO有病情严重程度有关.
DCs表达丰富的免疫分子, 目前主要用CD1a阳性细胞的多少来反映DCs的数量, CD83是DCs的成熟标志[19], 当成熟时才表达CD83分子, 此时DCs激活T细胞功能最强. 乙型肝炎肝硬化组DCs表面标志物HLA-DR阳性率与对照组比较无显著性差异(P>0.05), CD1a、CD80及CD83阳性率显著低于对照组(P<0.01); 肝硬化SIBO阳性者DCs表面标志CD1a、HLA-DR、CD80及CD83阳性率均显著低于未合并SIBO者组(P<0.05), 提示DCs表面标志物表达在肝硬化SIBO阳性和阴性者中不同. 研究[20]表明DCs数量随病程进展而进行性降低, 表现为慢性肝炎、低于健康人, 肝硬化低于慢性肝炎患者, 这种DCs数量随病程进展而进行性降低的原因有白细胞减少、细胞凋亡增加、转移等. DCs细胞表面标志表达不同与其功能缺陷有关, 也与其来源不同、成熟度不同而异[21]. 在肝硬化有无SIBO者DCs表面标志物表达差异, 原因尚不清楚. 但是DCs功能的差异, 尚可成为肠道细菌容易能进入血液、淋巴液以及肝脏的因素, 这也是该研究的意义所在. 进一步研究DCs在肝硬化并发症和SIBO关联中的确切身份.
树突状细胞(dendritic cells, DCs)在机体的原始及获得性免疫应答中起着重要的作用, 近年来, 越来越多关于DCs表型和功能与肝硬化、肝硬化与肠道菌群的研究, 但有关乙型肝炎肝硬化肠道菌群与DCs表型和功能研究较少.
向邦德, 主任医师, 广西医科大学附属肿瘤医院肝胆外科二病区; 庄林, 主任医师, 昆明市第三人民医院肝病科
DCs在免疫应答的诱导中发挥着重要的作用. 然而恢复慢乙型肝炎患者DCs的功能或DCs疫苗的应用能否重新启动机体的免疫应答, 是否有利于改善慢乙型肝炎患者免疫功能缺陷或低下的状态, 是否有助于体内乙型肝炎病毒的清除, 是否能够减少小肠细菌过度生长(small intestinal bacteria overgrowth, SIBO)的发生等仍有待进一步研究.
通过相关研究报道发现, 慢乙型肝炎患者DCs功能缺陷、发育成熟障碍、抗原提呈能力下降, 不能有效的诱导机体的免疫应答, 不能有效的清除病毒, 进而导致乙型肝炎的迁延.
本研究不仅用乳果糖氢呼气试验(lactulose hydrogen breath test, LHBT)评估SIBO的发生率, 而且用LHBT集值评估小肠细菌生长情况, 并研究了小肠细菌生长情况与白蛋白和胆红素的关系. 另外研究了DCs表面标志物在肝硬化SIBO阳性和阴性中的表达.
通过检测肝硬化患者和健康人外周血DCs表面标志物的变化以及肝硬化患者SIBO的发生率, 了解乙型肝炎肝硬化患者DCs表面标志物与SIBO的关系. 说明肝硬化患者DCs表型及功能的变化影响机体的免疫功能, 导致SIBO的发生, 进而导致肠道细菌进入血液、肝脏、淋巴结, 为肝硬化患者SIBO的发生机制有了更进一步的研究.
本文有科学性、创新性和可读性, 可以较好反映我国胃肠病学临床和基础研究的先进水平. 该研究具有以下特点: (1)本组资料显示肝硬化患者SIBO患病率与国内外文献相近; (2)研究结果提示SIBO的发生与病情严重程度相关; (3)DCs表面标志物表达在肝硬化SIBO阳性和阴性者中不同.
编辑: 于明茜 电编: 都珍珍
| 2. | Yao V, Platell C, Hall JC. Dendritic cells. ANZ J Surg. 2002;72:501-506. [PubMed] [DOI] |
| 3. | Hu J, Wan Y. Tolerogenic dendritic cells and their potential applications. Immunology. 2011;132:307-314. [PubMed] [DOI] |
| 4. | Holmannova D, Kolackova M, Kunes P, Krejsek J, Mandak J, Andrys C. Impact of cardiac surgery on the expression of CD40, CD80, CD86 and HLA-DR on B cells and monocytes. Perfusion. 2015; Oct 25. [Epub ahead of print]. [PubMed] [DOI] |
| 5. | Wang K, Fan X, Fan Y, Wang B, Han L, Hou Y. Study on the function of circulating plasmacytoid dendritic cells in the immunoactive phase of patients with chronic genotype B and C HBV infection. J Viral Hepat. 2007;14:276-282. [PubMed] [DOI] |
| 6. | Chisari FV, Ferrari C. Hepatitis B virus immunopathogenesis. Annu Rev Immunol. 1995;13:29-60. [PubMed] [DOI] |
| 7. | Ma YJ, He M, Han JA, Yang L, Ji XY. A clinical study of HBsAg-activated dendritic cells and cytokine-induced killer cells during the treatment for chronic hepatitis B. Scand J Immunol. 2013;78:387-393. [PubMed] [DOI] |
| 8. | 朱 斌, 张 平, 禹 萌, 王 天宝, 毛 乾国. 替比夫定对HBeAg慢性乙型肝炎患者外周血树突状细胞及淋巴细胞亚群的影响. 世界华人消化杂志. 2011;19:2577-2582. [DOI] |
| 11. | Goel A, Gupta M, Aggarwal R. Gut microbiota and liver disease. J Gastroenterol Hepatol. 2014;29:1139-1148. [PubMed] [DOI] |
| 12. | Muñoz L, José Borrero M, Ubeda M, Lario M, Díaz D, Francés R, Monserrat J, Pastor O, Aguado-Fraile E, Such J. Interaction between intestinal dendritic cells and bacteria translocated from the gut in rats with cirrhosis. Hepatology. 2012;56:1861-1869. [PubMed] [DOI] |
| 13. | Bures J, Cyrany J, Kohoutova D, Förstl M, Rejchrt S, Kvetina J, Vorisek V, Kopacova M. Small intestinal bacterial overgrowth syndrome. World J Gastroenterol. 2010;16:2978-2990. [PubMed] [DOI] |
| 14. | Pande C, Kumar A, Sarin SK. Small-intestinal bacterial overgrowth in cirrhosis is related to the severity of liver disease. Aliment Pharmacol Ther. 2009;29:1273-1281. [PubMed] [DOI] |
| 15. | Eksteen B, Mora JR, Haughton EL, Henderson NC, Lee-Turner L, Villablanca EJ, Curbishley SM, Aspinall AI, von Andrian UH, Adams DH. Gut homing receptors on CD8 T cells are retinoic acid dependent and not maintained by liver dendritic or stellate cells. Gastroenterology. 2009;137:320-329. [PubMed] [DOI] |
| 16. | Sánchez E, Casafont F, Guerra A, de Benito I, Pons-Romero F. Role of intestinal bacterial overgrowth and intestinal motility in bacterial translocation in experimental cirrhosis. Rev Esp Enferm Dig. 2005;97:805-814. [PubMed] [DOI] |
| 17. | Bauer TM, Steinbrückner B, Brinkmann FE, Ditzen AK, Schwacha H, Aponte JJ, Pelz K, Kist M, Blum HE. Small intestinal bacterial overgrowth in patients with cirrhosis: prevalence and relation with spontaneous bacterial peritonitis. Am J Gastroenterol. 2001;96:2962-2967. [PubMed] [DOI] |
| 19. | Hilly O, Rath-Wolfson L, Koren R, Mizrachi A, Hamzany Y, Bachar G, Shpitzer T. CD1a-positive dendritic cell density predicts disease-free survival in papillary thyroid carcinoma. Pathol Res Pract. 2015;211:652-656. [PubMed] [DOI] |
| 20. | Cella M, Jarrossay D, Facchetti F, Alebardi O, Nakajima H, Lanzavecchia A, Colonna M. Plasmacytoid monocytes migrate to inflamed lymph nodes and produce large amounts of type I interferon. Nat Med. 1999;5:919-923. [PubMed] [DOI] |
| 21. | Duan XZ, Zhuang H, Wang M, Li HW, Liu JC, Wang FS. Decreased numbers and impaired function of circulating dendritic cell subsets in patients with chronic hepatitis B infection (R2). J Gastroenterol Hepatol. 2005;20:234-242. [PubMed] [DOI] |