修回日期: 2016-07-13
接受日期: 2016-07-19
在线出版日期: 2016-10-08
构建并鉴定DAB2IP启动子荧光素酶报告基因载体pGL3-Basic-DAB2IP-luc, 观察Snail在胃癌细胞中对DAB2IP表达调控.
利用PCR法克隆出DAB2IP启动子序列(1000 bp), 构建pGL3-Basic-DAB2IP-luc载体并酶切并测序鉴定. 检测转染pEGFP-C1-Snail载体对pGL3-Basic-DAB2IP-luc双荧光素酶活性及对DAB2IP的表达水平的影响.
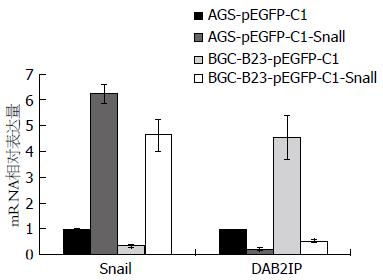
荧光素酶报告系统结果显示Snail+pGL3-Basic-DAB2IP-luc组荧光活性明显低于pGL3-Basic-DAB2IP-luc组和空白组(P<0.01; P<0.01), 此外, pGL3-Basic-DAB2IP-luc组比空白组的荧光活性更低(P<0.01; P<0.01). 荧光定量PCR和Western blot结果显示, 转染pEGFP-C1-Snail下调DAB2IP的mRNA和蛋白水平.
转录因子Snail抑制DAB2IP的转录和表达. 具有生物活性的pGL3-Basic-DAB2IP-luc的构建成功为研究DAB2IP在胃癌中转录调控机制提供了重要的研究工具.
核心提要: DAB2IP是多个信号通路的重要分子开关, 参与细胞内信号调控. 通过构建DAB2IP启动子载体, 在胃癌细胞中验证转录因子Snail对DAB2IP的转录活性和表达水平的影响.
引文著录: 王舰梅, 周铁军, 张熙曦, 鲁梦婕, 刘勇. DAB2IP启动子荧光素酶报告基因载体的构建及其应用. 世界华人消化杂志 2016; 24(28): 3985-3990
Revised: July 13, 2016
Accepted: July 19, 2016
Published online: October 8, 2016
To construct and identify pGL3-Basic-DAB2IP-luc vector, a luciferase reporter gene vector containing DAB2IP promoter, and explore the regulatory effect of Snail on the activity of this promoter in gastric cancer cells.
The fragment of DAB2IP gene promoter (1000 bp) was amplified by PCR and then cloned into pGL3-Basic-luc vector to obtain pGL3-Basic-DAB2IP-luc vector, which was identified by restriction enzyme digestion, sequencing and biological activity detection. The activity of pGL3-Basic-DAB2IP-luc and the expression of DAB2IP were detected after transfection with pEGFP-C1-Snail in gastric cancer cells.
Luciferase reporter system showed that the luciferase activity was significantly lower in the Snail + pGL3-Basic-DAB2IP-luc group compared to the pGL3-Basic-DAB2IP-luc group and blank group (P < 0.01 for both). In addition, the luciferase activity was significantly lower in the pGL3-Basic-DAB2IP-luc group than in the blank group (P < 0.01). Real-time PCR and Western blot results showed that mRNA and protein expression of DAB2IP was decreased in gastric cancer cells after transfection with pEGFP-C1-Snail.
The transcription factor Snail inhibits the transcription and expression of DAB2IP. The vector pGL3-Basic-DAB2IP-luc has been constructed successfully and its biological activity has been identified, which provides an important tool for further study of the role of DAB2IP in transcriptional regulation in gastric cancer.
- Citation: Wang JM, Zhou TJ, Zhang XX, Lu MJ, Liu Y. Construction of a luciferase reporter gene vector containing DAB2IP promoter. Shijie Huaren Xiaohua Zazhi 2016; 24(28): 3985-3990
- URL: https://www.wjgnet.com/1009-3079/full/v24/i28/3985.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i28.3985
人DOC-2/DAB2相互作用蛋白基因(DAB2IP)是最近发现的RasGAP家族的一个新成员, 该家族成员通过其共有的RasGAP结构域在Ras通路发挥信号转导作用[1,2]. DAB2IP通过其不同的结构域参与多个信号通路调控有效抑制肿瘤的发生和发展[3,4]. 在多种恶性肿瘤中, DAB2IP广泛参与调节肿瘤细胞的增殖、凋亡、侵袭和转移过程, 并能通过影响肿瘤干细胞的自我更新抑制肿瘤的发展[4-7]. 近年来, 转录因子参与调控下游靶基因, 影响肿瘤的发生和发展备受关注[8,9]. 目前, 研究[10,11]发现DAB2IP上游调控受表观遗传学影响, 而有关转录因子参与DAB2IP表达调控的机制还不明确. 为了进一步探讨DAB2IP在肿瘤调控中的作用, 明确转录因子对DAB2IP转录和表达的影响, 本实验首先构建了DAB2IP启动子载体, 软件预测并筛选与DAB2IP启动子潜在的转录因子, 最后在胃癌细胞中验证转录因子Snail对DAB2IP的转录活性和表达水平的影响. 成功构建DAB2IP启动子载体为DAB2IP的转录调控研究提供了实验工具, 进一步阐明了DAB2IP在胃癌发生和发展中的分子机制, 为DAB2IP成为抗肿瘤药物的新靶点提供理论支持.
人胚肾上皮细胞株HEK293A细胞及AGS、BGC823细胞为病理科自存; 双荧光素酶报告系统检测试剂盒购自Promega公司; DNA提取试剂盒、DNA Ladder Marker、PrimeSTAR HS DNA-Polymerse、T4 DNA Ligase、各内切酶、TaKaRa TaqTM购自TaKaRa公司. 质粒提取试剂盒、DNA凝胶回收试剂盒购于DONGSHENG BIOTECH公司. 荧光报告系统检测仪(GloMaxTM 20/20)为Promega产品, 型号为E5331. 双荧光报告载体、pEGFP-C1-Snail实验室自存.
1.2.1 DNA提取: 取人血液并分离其中白细胞, 用4 ℃冷冻PBS轻柔冲洗1遍, 然后用0.25%的胰酶裂解, 收集于离心管中, 用4 ℃冷冻PBS冲洗1遍, 2000 g/min离心5 min, 弃上清, 用200 μL冷冻PBS重悬细胞, 按照基因组DNA提取试剂盒说明提取人基因组DNA.
1.2.2 DAB2IP启动子序列扩增: 在Ensembl数据库中, 在线获得DAB2IP起始密码子所在序列上游1 kb作为DAB2IP的启动子序列, 根据该序列和载体pGL3-Basic酶切位点设计引物. 上游引物(含有酶切位点Kpn Ⅰ): 5'-AAAAGGTACCAGGACAATCCGGATCATGTCA-3', 下游引物(含有酶切位点Hind Ⅲ): 5'-AAAAAAGCTTCCTCCTTTTGTATTCCATCTG-3'. 取上述人基因组DNA为模板根据PCR说明书进行扩增, PCR产物进行DNA定量, -20 ℃保存备用.
1.2.3 DAB2IP启动序列荧光素酶报告基因表达载体构建: 取上述PCR扩增的DAB2IP启动序列和质粒小提的pGL3-Basic载体用Kpn Ⅰ和Hind Ⅲ分别双酶切, 利用凝胶回收试剂盒回收并纯化酶切产物. 将上述制备纯化的DAB2IP启动序列与线性化双黏性末端的pGL3-Basic载体片段以5:1摩尔比的比例用T4 DNA连接酶于16 ℃循环水浴连接反应过夜, 连接产物于60 ℃灭活10 min后转化至感受态大肠埃希菌DH5α, 经氨苄霉素抗性筛选, 挑取阳性克隆提取重组质粒, 细菌小摇、质粒小提, 该产物进行双酶切鉴定.
1.2.4 荧光素酶活性检测: 荧光素酶活性检测将96孔板转染了荧光素酶报告基因的细胞培养上清吸弃, 每孔加裂解液75 μL, 裂解15 min后, 转移至96孔板白板中, 将96孔板置于荧光检测仪中读板, 检测结果分析: 萤火虫荧光素酶F与海肾荧光素酶R发光值的比值(F/R)即为荧光素酶的相对活性. 活性倍数 = (F/R)样品/(F/R)对照, 保存所读取的数据, 做柱状图并进行统计学分析.
1.2.5 荧光定量PCR: DAB2IP引物: sense: 5'-CTTGACCATGAACGCGCAGT-3', anti-sense: 5'-ATACTCTCTTTCAGCTGGGTCAGG-3'. Snail引物: sense: 5'-GACCACTATGCCGCGCTCTT-3'; anti-sense: 5'-TCGCTGTAGTTAGGCTTCCGATT-3'; 反应条件: 95 ℃预变性2 min, 95 ℃变性30 s, 60 ℃ 退火34 s, 72 ℃延伸34 s, 40个循环; 计算方法: 以Folds = 2-ΔΔCt表示实验组与对照组目的基因表达的倍比关系, 公式如下: ΔΔCt = [Ct(目的基因) - Ct(GAPDH)]实验组-[Ct(目的基因)-Ct(GAPDH)]对照组.
1.2.6 Western blot检测: 将状态良好的细胞用冷PBS洗2次, 加入细胞裂解液反复混匀, 冰上放置20 min. 收集细胞裂解液于EP管, 12000 g离心20 min, 上清收集于-80 ℃保存. 检测时, 取蛋白溶液冰上融解后, 检测浓度, 以每孔10 μg蛋白上样量, 电压80-100 V进行10%SDS-PAGE电泳分离, 再以100 V, 90 min的条件电转到PVDF膜上, 5%脱脂奶粉封闭1 h后, 检测抗体Snail和DAB2IP以1:200比例与封闭液混合, 加入膜, 4 ℃孵育过夜, PBST洗涤3次后, 加入HPR标记的羊抗兔IgG二抗(1:10 000)室温摇床振荡1 h. PBST洗涤3次, 加入ECL发光液曝光.
统计学处理 数据分析均使用SPSS13.0软件包进行统计处理, 所有数值均以3次独立实验的mean±SD表示. 两组间的比较采用双尾不配对学生t检验, 多组间的均数比较采用单因素方差分析. P<0.05为差异有统计学意义.
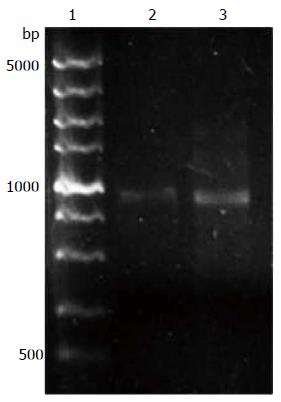
以此查找获得DAB2IP启动子序列设计引物, 并以人血液提取DNA为模板进行PCR扩增, 扩增产物进行凝胶电泳. 电泳结果显示: 在Marker DL5000的1000 bp左右有1条特异的条带, 这与我们预扩增的DAB2IP启动子1000 bp大小一致, 从而证明DAB2IP启动子已经扩增成功(图1).
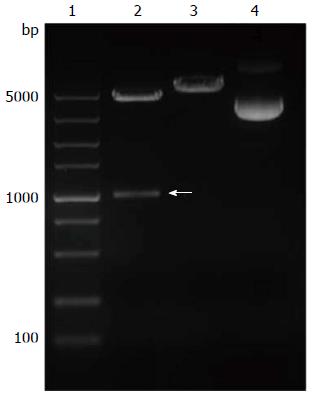
载体pGL3-Basic和上述DAB2IP启动子PCR产物分别进行Kpn Ⅰ和Hind Ⅲ双酶切, 纯化后进行T4酶连接. 连接产物经过细菌转化、克隆筛选、细菌小摇后质粒小提. 小提产物进行酶切, 酶切结果显示, 在单酶切泳道5000 bp以上可见1条带, 在双酶切泳道1000 bp和5000 bp附近分别见到1条带, 这与我们的载体和启动子片段大小一致. 为进一步鉴定质粒序列, 部分质粒进行测序, 测序结果经BLAST比对, 序列完全正确测序, 从而证明pGL3-Basic-DAB2IP-luc构建成功(图2).
利用Mapper2、Consite、TRED 3个常用软件预测DAB2IP上游转录因子, 选取最高评分并综合分析可能与DAB2IP启动子结合的潜在的转录因子, 综合考虑选择3个软件均评分较高的转录因子Snail作为DAB2IP的转录因子. 预测软件预测位置如表1所示.
| 预测软件 | 预测位置 |
| Consite | 151-156 bp CACCTG |
| 321-326 bp CAGGTG | |
| TRED | 151-156 bp CACCTG |
| 321-326 bp CAGGTG | |
| Mapper2 | 321-326 bp CAGGTG |
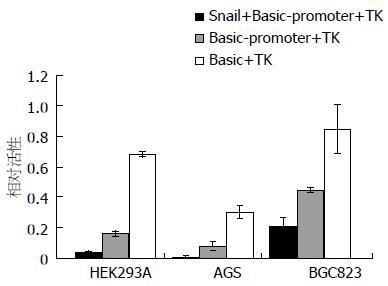
将pGL3-Basic-DAB2IP-luc和pEGFP-C1-Snail载体共同转染至AGS、BGC823及HEK293A细胞后, 荧光素酶报告系统结果显示其荧光活性明显低于单独转染pGL3-Basic-DAB2IP-luc组和空白组(P<0.001; P<0.001), 此外单独转染pGL3-Basic-DAB2IP-luc组比空白组的荧光活性更弱(P<0.001; P<0.001), 表明转录因子Snail能抑制DAB2IP启动子的转录活性(图3).
细胞信号转导是指位于细胞膜或细胞内的受体受细胞外信号分子的刺激, 通过一系列相关信号转导蛋白的酶促反应, 将生物学信息传递到核内, 诱导相应的基因表达, 引起相关生物学效应的过程. 信号转导通路的异常活化与恶性肿瘤的发生、发展关系密切[12,13]. 转录因子介导的信号转导通路的异常与肿瘤的发生、演进及预后密切相关. 胃癌的发生和发展是多基因、多步骤的复杂过程, 其中胃癌细胞中基因的转录调控异常在其中发挥着重要的作用[14].
人DAB2IP是最近发现的RasGAP家族的一个新成员[15]. DAB2IP位于9q33.1-q33.3染色体, 包含4个结构域分别为C2结构域、RasGAP结构域、DUF结构域、PH结构域, 其中RasGAP结构域为RasGAP家族的保守结构域[16]. DAB2IP是多个信号通路的重要分子开关, 参与细胞内信号调控[17,18]. 例如, 文献报道, EZH2表观沉默DAB2IP基因的表达, DAB2IP沉默能有效的活化Ras和核因子-κB(nuclear factor-κB, NF-κB)信号通路, Ras通路促进前列腺癌原发性肿瘤生长, 而NF-κB通路则促进其上皮间质转化(epithelial to mesenchymal transition, EMT)的发生和转移[18]. DAB2IP通过其Ras-GAP结构域, 抑制Ras-Raf-MEK细胞存活信号通路, 抑制前列腺癌细胞生长[3]; Xie等[16]发现DAB2IP的表达缺失导致EMT的发生, 促进前列腺癌细胞的转移. DAB2IP调控GSK-3β-β-catenin信号通路, 通过其C2功能区与PP2A形成复合物促使GSK-3β活化, 造成β-catenin的降解, 进而导致EMT的发生.
DAB2IP肿瘤相关机制研究主要集中在前列腺, 而在胃癌中DAB2IP转录相关研究较少. 为进一步明确DAB2IP在胃癌中的转录调控机制, 本实验首先构建并鉴定了DAB2IP启动子荧光素酶报告基因载体, 通过软件预测可能调控DAB2IP的转录因子, 通过综合分析最终确定Snail与DAB2IP启动子潜在结合可能性最大. 锌指转录因子Snail属于转录抑制因子Snail超家族, 该家族成员具有相似的结构, 由1个含有4-6个锌指结构域的高度保守的羧基末端和1个高度可变的氨基末端构成, 各成员间结构上的不同主要表现在中间P-S富集区域. 在肿瘤的生长、转移和EMT过程, 转录因子Snail都发挥重要的转录调控作用[19]. 在胃癌中, Snail对细胞间钙黏附蛋白E-cadherin的转录抑制是胃癌细胞发生EMT的重要步骤[20]. 本实验中双荧光素酶实验充分证实了Snail对DAB2IP的转录调控的可靠性, 通过荧光定量PCR和Western blot检测发现Snail抑制DAB2IP的mRNA和蛋白表达. 由此我们可以认为: 首先, pGL3-Basic-DAB2IP-luc的构建成功为DAB2IP转录相关研究提供了重要的实验工具; 其次, 证实Snail参与调控DAB2IP的转录表达, 为DAB2IP参与调控胃癌的发生和发展分子机制提供了新的理论依据和实验思路.
胃癌是最常见的恶性肿瘤之一, 其发病趋势呈逐年上升和年轻化趋势. 本研究通过构建DAB2IP启动子载体, 探讨转录因子对DAB2IP的转录调控作用, 为DAB2IP参与胃癌的发生和发展的研究提供的实验基础和理论依据.
刘江文, 主任医师, 石河子市人民医院暨石河子大学医学院第三附属医院普外科; 芦永福, 副教授, 副主任医师, 青海大学附属医院消化科
近年来抑癌基因DAB2IP参与肿瘤的发生发展的研究成为国内外研究热点, 但对转录因子调控DAB2IP表达影响胃癌的演进报道较少. 本文通过构建DAB2IP启动子载体, 探讨在胃癌细胞中转录因子调控DAB2IP表达的分子机制.
前期学者研究已发现DAB2IP在多种恶性肿瘤中发挥抑癌作用, DAB2IP作为分子开关通过调控多个信号通路影响肿瘤细胞的增殖、周期、凋亡、迁移和转移. 此外, DAB2IP在肿瘤组织中低表达提示患者预后不良. 作者前期研究发现DAB2IP在结直肠癌中通过表观调控影响肿瘤细胞的转移. 本研究为进一步研究DAB2IP在肿瘤中发挥的作用提供了新方法和新思路.
本研究在转录因子对DAB2IP的启动子转录调控方面进行了初步探讨, 成功构建了DAB2IP启动子载体, 并首次预测并验证了Snail与DAB2IP启动子存在潜在结合, 并从mRNA和蛋白水平检测Snail对DAB2IP的表达调控影响.
首先, pGL3-Basic-DAB2IP-luc的构建成功为DAB2IP转录相关研究提供了重要的实验工具; 其次, 证实Snail参与调控DAB2IP的转录表达, 为DAB2IP参与调控胃癌的发生和发展分子机制提供了新的理论依据和实验思路.
本文实验证据充足, 科学结论较明确, 为参与调控胃癌的发生和发展分子机制提供了新的理论依据和实验思路, 具有一定的学术价值.
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 四川省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C
D级 (一般): 0
E级 (差): 0
编辑: 郭鹏 电编:胡珊
| 1. | Zhang H, Zhang R, Luo Y, D'Alessio A, Pober JS, Min W. AIP1/DAB2IP, a novel member of the Ras-GAP family, transduces TRAF2-induced ASK1-JNK activation. J Biol Chem. 2004;279:44955-44965. [PubMed] [DOI] |
| 2. | Maertens O, Cichowski K. An expanding role for RAS GTPase activating proteins (RAS GAPs) in cancer. Adv Biol Regul. 2014;55:1-14. [PubMed] [DOI] |
| 3. | Xie D, Gore C, Zhou J, Pong RC, Zhang H, Yu L, Vessella RL, Min W, Hsieh JT. DAB2IP coordinates both PI3K-Akt and ASK1 pathways for cell survival and apoptosis. Proc Natl Acad Sci USA. 2009;106:19878-19883. [PubMed] [DOI] |
| 4. | Liu L, Xu C, Hsieh JT, Gong J, Xie D. DAB2IP in cancer. Oncotarget. 2016;7:3766-3776. [PubMed] [DOI] |
| 5. | Yun EJ, Baek ST, Xie D, Tseng SF, Dobin T, Hernandez E, Zhou J, Zhang L, Yang J, Sun H. DAB2IP regulates cancer stem cell phenotypes through modulating stem cell factor receptor and ZEB1. Oncogene. 2015;34:2741-2752. [PubMed] [DOI] |
| 6. | Wu K, Liu J, Tseng SF, Gore C, Ning Z, Sharifi N, Fazli L, Gleave M, Kapur P, Xiao G. The role of DAB2IP in androgen receptor activation during prostate cancer progression. Oncogene. 2014;33:1954-1963. [PubMed] [DOI] |
| 7. | Wu K, Xie D, Zou Y, Zhang T, Pong RC, Xiao G, Fazli L, Gleave M, He D, Boothman DA. The mechanism of DAB2IP in chemoresistance of prostate cancer cells. Clin Cancer Res. 2013;19:4740-4749. [PubMed] [DOI] |
| 8. | de Herreros AG, Peiró S, Nassour M, Savagner P. Snail family regulation and epithelial mesenchymal transitions in breast cancer progression. J Mammary Gland Biol Neoplasia. 2010;15:135-147. [PubMed] [DOI] |
| 9. | Lin Y, Dong C, Zhou BP. Epigenetic regulation of EMT: the Snail story. Curr Pharm Des. 2014;20:1698-1705. [PubMed] |
| 10. | Smits M, van Rijn S, Hulleman E, Biesmans D, van Vuurden DG, Kool M, Haberler C, Aronica E, Vandertop WP, Noske DP. EZH2-regulated DAB2IP is a medulloblastoma tumor suppressor and a positive marker for survival. Clin Cancer Res. 2012;18:4048-4058. [PubMed] [DOI] |
| 11. | Dote H, Toyooka S, Tsukuda K, Yano M, Ota T, Murakami M, Naito M, Toyota M, Gazdar AF, Shimizu N. Aberrant promoter methylation in human DAB2 interactive protein (hDAB2IP) gene in gastrointestinal tumour. Br J Cancer. 2005;92:1117-1125. [PubMed] [DOI] |
| 12. | Heldin CH, Lu B, Evans R, Gutkind JS. Signals and Receptors. Cold Spring Harb Perspect Biol. 2016;8:a005900. [PubMed] [DOI] |
| 13. | Rosselin G. [Cell surface receptors in digestive epithelial cells]. Ann Endocrinol (Paris). 1989;50:447-463. [PubMed] |
| 14. | Thiel A, Ristimäki A. Gastric cancer: basic aspects. Helicobacter. 2012;17 Suppl 1:26-29. [PubMed] [DOI] |
| 15. | Qiao S, Kim SH, Heck D, Goldowitz D, LeDoux MS, Homayouni R. Dab2IP GTPase activating protein regulates dendrite development and synapse number in cerebellum. PLoS One. 2013;8:e53635. [PubMed] [DOI] |
| 16. | Xie D, Gore C, Liu J, Pong RC, Mason R, Hao G, Long M, Kabbani W, Yu L, Zhang H. Role of DAB2IP in modulating epithelial-to-mesenchymal transition and prostate cancer metastasis. Proc Natl Acad Sci USA. 2010;107:2485-2490. [PubMed] [DOI] |
| 17. | Li X, Dai X, Wan L, Inuzuka H, Sun L, North BJ. Smurf1 regulation of DAB2IP controls cell proliferation and migration. Oncotarget. 2016;7:26057-26069. [PubMed] [DOI] |
| 18. | Min J, Zaslavsky A, Fedele G, McLaughlin SK, Reczek EE, De Raedt T, Guney I, Strochlic DE, Macconaill LE, Beroukhim R. An oncogene-tumor suppressor cascade drives metastatic prostate cancer by coordinately activating Ras and nuclear factor-kappaB. Nat Med. 2010;16:286-294. [PubMed] [DOI] |
| 19. | Kao YC, Wu LW, Shi CS, Chu CH, Huang CW, Kuo CP, Sheu HM, Shi GY, Wu HL. Downregulation of thrombomodulin, a novel target of Snail, induces tumorigenesis through epithelial-mesenchymal transition. Mol Cell Biol. 2010;30:4767-4785. [PubMed] [DOI] |
| 20. | Becker KF, Rosivatz E, Blechschmidt K, Kremmer E, Sarbia M, Höfler H. Analysis of the E-cadherin repressor Snail in primary human cancers. Cells Tissues Organs. 2007;185:204-212. [PubMed] [DOI] |