修回日期: 2016-05-02
接受日期: 2016-05-09
在线出版日期: 2016-08-28
左、右半结肠癌具有明显的异质性, 除了流行病学、组织病理类型、临床表现上的差异, 其在自然预后、治疗预后和复发后的生存上均存在差异, 且与分期相关, 这些预后差异亦提示了左、右半结肠癌不同的基因背景与分子生物学特征. 本文就左、右半结肠癌在临床预后及分子生物学特征方面的差异作一综述, 对不同期别的左、右半结肠癌分别论述了肿瘤位置于预后的影响, 同时对一些具有相对明确预后意义的分子与通路进行了总结论述, 初步探究临床与分子差异的联系. 综合考虑位置对结肠癌预后的影响及左、右半结肠癌预后分子的差异, 将有助于更精确地判断结肠癌患者的预后.
核心提要: 综合考虑位置对结肠癌预后的影响及左、右半结肠癌预后分子的差异, 有助于更精确地判断患者的预后, 更有效地筛选化疗、靶向或免疫治疗的获益人群, 制定更为个体化的治疗方案.
引文著录: 杨琦, 孔祥兴, 丁克峰. 左、右半结肠癌的预后及分子生物学特征差异. 世界华人消化杂志 2016; 24(24): 3556-3563
Revised: May 2, 2016
Accepted: May 9, 2016
Published online: August 28, 2016
Apart from differences in epidemiologic, pathologic and symptomatic features, the natural prognosis, therapeutic prognosis, as well as survival after relapse also show great differences between left- and right-sided colon cancer. Those differences in prognosis are noticed to be dependent on tumor stage and also thought to be due to the variant genetic background and molecular biological features. In this review, we summarize the differences in prognosis and molecular biological features between left- and right-sided colon cancer, and discuss the possible connections between clinical and molecular differences. Taking into account the impact that location and differentially expressed molecules may have on prognosis, clinicians could have a more accurate estimate on the prognosis of colon cancer patients.
- Citation: Yang Q, Kong XX, Ding KF. Differences in prognosis and molecular biological features between left- and right-sided colon cancer. Shijie Huaren Xiaohua Zazhi 2016; 24(24): 3556-3563
- URL: https://www.wjgnet.com/1009-3079/full/v24/i24/3556.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i24.3556
随着人群生活习惯的改变和肠镜筛查的普及, 结直肠癌已跃居为发病率全球第3[1]、全国第4的高发肿瘤. 就结肠而言, 通常根据不同的胚胎起源, 将其以脾曲为界分为近端的右半结肠, 包括盲肠、升结肠及右2/3的横结肠; 以及远端的左半结肠, 包括左1/3的横结肠、降结肠及乙状结肠. 研究[2-5]发现左、右半结肠(癌)在胚胎来源、解剖生理、病理类型以及性别、年龄等人口学特征上均存在差异.
右半结肠来源于中原肠, 与空回肠同源, 由肠系膜上动脉供血, 功能以水、钠吸收为主, 腔内胆盐浓度较左半结肠高; 而左半结肠来源于后原肠, 与膀胱尿道同源, 由肠系膜下动脉供血, 水钠吸收功能弱, 腔内胆盐浓度低. 在流行病学上, 左半结肠癌的发病率逐渐下降, 而右半结肠癌的发病率逐年升高[6]. 据美国国立癌症研究所SEER数据库统计, 右半结肠癌的发病率以0.68%的年均增长率在1976-2005的30年间发病率共增长了25.26%[7]. 临床上, 右半结肠癌好发于老年女性, 症状隐匿, 以贫血等全身症状为主, 诊断偏晚, 大体多呈浸润型或溃疡型, 黏液成分较多, 分化偏低, 淋巴结与腹膜转移较远处转移多; 左半结肠癌多见大便性状、习惯改变及腹痛梗阻症状, 诊断偏早期, 大体以肿块型为主, 腺癌比例高, 分化程度相对高, 肝肺转移为多. 而这些临床特征的差异是否能转化为有意义的预后差异及差异的根本原因尚无定论. 1990年Bufill[2]首次从胚胎起源与基因背景的角度论述了左、右半结肠癌的差异, 而近年来分子生物学技术及高通量测序技术则进一步推动了对左、右半结肠癌差异本质的研究.
本文旨在对左、右半结肠癌在临床预后及分子生物学特征方面进行综述, 借以初步探究两者的预后差异及机制, 从而有助于临床医师决定是否将位置差异作为结肠癌预后判断及治疗决策的考虑因素, 同时为结肠癌预后相关的研究提供一点思路.
上世纪80年代的研究认为左、右半结肠癌的总体生存无明显差异[8]. 1987年的数据显示, 左半结肠癌和右半结肠癌整体的5年生存率相近(68% vs 71%). 而90年代起则有文章指出两者总体生存存在差异, 分别为59.7%和56.3%(P<0.01)[9]. 到2000年, 差异则扩大到71%和67%(P<0.01)[10]. Pappas等[11]指出结肠癌患者的中位生存时间是83 mo, 其中右半结肠癌为78 mo, 左半结肠癌为89 mo. Yahagi等[12]的荟萃分析亦显示右半结肠癌较左半结肠癌总体生存预后差, 但在癌症特异生存上并未观察到显著差异.
目前认为, 左、右半结肠癌生存差异增大的趋势可能与综合治疗手段的发展及不同位置结肠癌对治疗, 尤其是化疗的敏感性相关. 另外, 分期是影响结肠癌预后的重要因素之一, 而右半结肠癌中晚期的比例高于左半, 期别构成比的差异很可能掩盖了两者在不同期别上的预后区别. 近来, 有较多研究对不同期别的左、右半结肠癌做了针对性的比较, 下文将对此进行论述.
早期和局部进展期的结肠癌, 以手术根治为主要治疗手段. Weiss等[3]分析了美国SEER数据库中1992-2005年Ⅰ-Ⅲ期共53801例根治术后的结肠癌患者, 结果显示所有Ⅰ-Ⅲ期的结肠癌患者的5年死亡率无明显左、右半差异, 而亚组分析显示: Ⅰ期患者根治术后预后相当, 而Ⅱ期患者中右半结肠癌5年死亡率较低, 而在Ⅲ期患者中则相反, 右半结肠癌5年死亡率高于左半结肠癌. 德国总结了17000例结肠癌随访数据, 得到了类似结果: 5年的无病生存率所有期别左右半无明显差异, Ⅰ期和Ⅲ期右半结肠癌患者的5年生存率不及左半结肠癌, 而Ⅱ 期右半结肠癌显示出了一定的生存优势(74% vs 72%).
左、右半结肠癌在不同期别的化疗预后亦有所区别. Elsaleh等[13]报道, Ⅲ期结肠癌患者中, 右半结肠癌接受氟尿嘧啶+亚叶酸钙化疗的化疗获益更高. Missiaglia等[14]研究了3045例接受FOLFIRI方案化疗的Ⅱ、Ⅲ期结肠癌患者, 发现Ⅲ期患者左右半生存获益相当, 而Ⅱ期患者中右半结肠癌则显示出更好的生存获益. Sinicrope等[15]在N0147试验中发现, 接受FOLFOX化疗的Ⅲ期结肠癌患者中左半结肠癌患者拥有更长的无病生存期, 亚组分析发现错配修复基因正常的患者中左半结肠癌无病生存期更长, 而错配修复基因缺陷的患者中则是右半结肠癌的生存更优.
对于晚期结肠癌, 右半结肠癌的自然预后及姑息化疗预后均不如左半结肠癌, 但对转移灶可切除的患者, 根治术后两者的预后相当. 在2014年ASCO上, 澳大利亚的一项研究报道左、右半晚期结直肠癌的总生存分别为9.8 mo和19.2 mo. 化疗联合转移灶切除的右半结肠癌总生存较短, 仅行姑息性化疗的患者右半总生存期为10.3 mo, 也明显短于左半结肠癌; 而在168例行肝转移灶切除联合必要时化疗的患者中, 5年生存率左右半无明显区别. 2015年Price等[16]的研究得到了与此相近的结果. 因此, 手术可切除的晚期左、右半结肠癌预后相当, 而以化疗为主要治疗手段时出现生存差异, 这提示肿瘤位置对晚期结肠癌的预后影响主要与左右半结肠的化疗敏感性相关.
Modest等[17]研究了晚期左、右半结肠癌对FOLFIRI和mIROX两种姑息性化疗方案的反应率. 结果显示FOLFIRI方案对左半结肠癌进展的延缓更起作用, 无进展生存期左、右半分别为8.7 mo和6.0 mo, 中位总生存期分别为25.0 mo和12.5 mo; 而对于mIROX方案, 左右半获益相当.
靶向治疗中左半结肠癌亦可获得更大的生存收益. Boisen等[18]发现, Ⅳ期结肠癌应用卡培他滨和贝伐珠单抗联合治疗后, 左半结肠癌的预后明显好于右半结肠癌, 总生存期分别为23.5 mo和13.0 mo; 而单用卡培他滨治疗的Ⅳ期肠癌, 位置和预后无明显相关性. 德国一项研究[19]也发现, 西妥昔单抗联合化疗治疗转移性结肠癌, 左半结肠癌有更好的PFS和中位OS, PFS左、右半分别为7.7 mo和5.2 mo, 中位OS分别为23.6 mo和14.8 mo. 进一步研究发现, 这种预后差异受KRAS基因状态影响: 在接受联合化疗的KRAS基因突变的患者中, 左、右半结肠癌生存获益无明显差异, 而在KRAS基因野生型患者中左半结肠癌患者有更好的生存获益.
左、右半结肠癌在术后复发率、复发时间、复发后生存时间及复发后的靶向药物治疗预后上均存在差异. Park等[20]回顾性分析了韩国国立癌症中心2001-2009年的1632例非转移性结肠腺癌发现: 根治术后5年的总复发率为5.7%, 其中右半结肠癌为8.5%, 而左半结肠癌为4.1%, 且复发时间右半结肠癌亦显著短于左半. 2013年ASCO上Missiaglia报道Ⅲ期结肠癌中左、右半的无复发生存时间无明显差异, 但在复发后生存上右半结肠癌表现出明显劣势, 且在接受西妥昔单抗治疗的KRAS基因野生型患者中, 左半结肠癌患者具有高于右半结肠癌2倍的治疗反应率和更长的无进展生存期. 该结果同年在Brulé等[21]对CO.17试验的报告中得到了验证, 即KRAS基因野生型的复发性转移性结肠癌应用西妥昔单抗治疗后的无进展生存期与结肠内肿瘤位置相关, 左半结肠癌患者的预后较好.
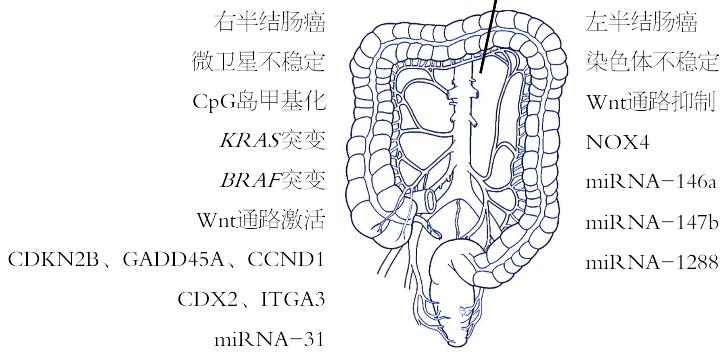
随着高通量测序技术的发展和各种在线基因数据库的不断完善, 对比左、右半结肠正常组织和肿瘤组织基因表达差异的研究日渐增多. Slattery等[22]分析了175例结肠癌患者正常组织与肿瘤组织配对标本的RNA数据, 发现左、右半肿瘤组织差异表达的基因多达320个, 其中包括p53、KRAS、CIMP、MMR等相关基因. 下文将对众多差异表达分子中的几个具有相对明确预后意义的分子与通路分别综述, 讨论左、右半结肠癌不同的分子生物学特征对预后的影响(图1).
染色体不稳定(chromosome instability, CIN), 即染色体结构或数目的异常, 以非整倍体或染色体杂合性缺失为特征, 可导致诸如RAS等原癌基因的激活和APC、p53等抑癌基因的失活, 这些突变基因的累积推动了Fearon等[23]所描述的典型的腺瘤-腺癌的发展. 作为结肠癌发生的首要机制, CIN见于约80%的患者, 且在左、右半结肠癌中分别占75%和30%. 因此, CIN在左半结肠癌中相对更多见, 并在其发生发展过程中发挥了更重要的作用.
CIN被认为是结肠癌预后不良的独立因素[12,24,25], 可引起p53等抑癌基因的失活, 后者是目前研究最多的抑癌基因. 秦环龙等[26]分析了包括Dukes A-D 4期共185例结肠癌患者, 发现大肠癌组织中有较高的p53表达率, 其表达程度与肿瘤部位无关, 而与分化程度、浆膜浸润情况及分期和淋巴结转移密切相关. 国外的研究[27,28]则认为p53的突变更多见于左半结肠癌, 特别是在Ⅱ、Ⅲ期结肠癌中差异明显, 在T3 N0的结肠癌亚组中[28], Gervaz等[28]发现60%的左半结肠癌过表达突变型p53, 而右半结肠癌仅16%; 突变型p53低表达和过表达的患者5年生存率分别为78%和63%, 提示p53基因突变的患者死亡风险增高, 特别是左半结肠癌患者. Russo等[27]在3583例结直肠癌患者中发现右半结肠癌患者p53基因突变率为34%, 而在左半结肠和直肠癌患者中, 该比例高达45%, 研究亦同时指p53基因的突变与患者的不良预后相关.
微卫星不稳定性(microsatellite Instability, MSI), 即因DNA甲基化或基因突变导致的错配修复基因缺失(mismatch repair deficiency, dMMR)而造成的微卫星重复序列长度的变异. MSI可见于15%-20%的结直肠癌, 包括Lynch综合征和散发性MSI结直肠癌, 前者主要因胚系突变所致, 而后者多为错配修复基因MLH1的启动子甲基化失活. MSI在结直肠癌的发生率随分期逐步下降[29]: Ⅱ期中占15%-20%左右, Ⅲ期中<15%, Ⅳ期则更少. 在2012年ESMO大会报告的一项纳入来自4个临床试验的3063例晚期结直肠癌患者的荟萃分析中, dMMR的发生率仅为5.0%.
许多研究[5,28-31]均提示MSI与右半结肠癌相关性更大. 通过对245例Ⅱ/Ⅲ期结直肠癌患者的分析, Shin等[30]发现存在MSI表型的结肠癌多为右半结肠癌. 有研究在更大样本量的Ⅱ/Ⅲ期结直肠癌患者中发现右半结肠癌中dMMR基因型所占比例明显较左半结肠癌中dMMR比例高(27% vs 9%). 对PETACC3试验中的结肠癌患者按照解剖位置评估分子特征, 结果也表明右半结肠癌有更多的MSI、过度突变、BRAF基因突变、锯齿状特征以及肿瘤浸润性淋巴细胞浸润明显等, 而左半结肠癌更多的表现为CIN、HER1/2扩增、EGFR信号活化和大量非BRAF样基因突变, 且结果显示自升结肠至直肠, MSI-H比例逐渐下降.
MSI被证实为准确评估预后的独立因子之一[32], 其常见病理特征为肿瘤周围淋巴细胞浸润[33], 反映了活跃的黏膜免疫反应和免疫相关的良好预后[34,35], 这可部分解释Ⅱ期右半结肠癌患者的生存获益来自于其MSI, 且与黏膜免疫反应相关.
CpG岛甲基化(CpG island hypermethylation phenotype, CIMP)基因型表现为CpG岛启动子中的胞嘧啶被过度甲基化, 从而导致了抑癌基因沉默和肿瘤发生. CIMP常发生于右半结肠的散发无蒂锯齿状腺癌, 这部分可见MLH1基因的过度甲基化; 或是发生于左半结肠和直肠的传统的锯齿状腺癌, 这部分可见MGMT甲基化. 在结肠癌中, CIMP有15%左右的发生率, 且更多见于右半结肠癌中[36]. CIMP与结肠癌不良预后相关. Barault等[37]发现微卫星稳定基因型伴CIMP阳性的患者的5年生存率较阴性患者差. Juo等[38]的荟萃分析也显示, CIMP是结直肠癌预后不良的独立危险因素, 亦有研究[29,30]报道CIMP在右半结肠癌中与BRAF基因突变和MSI相关.
EGFR-RAS-RAF-MAPK信号通路一直是结直肠癌基础研究中的热点与重点, 该通路中表皮生长因子受体及其下游分子调控着细胞增殖和生长, 同时驱动了多种恶性肿瘤的发生发展, 其中K-RAS和BRAF在结肠癌中具有相对较明确的预后意义, 并受结肠内肿瘤的位置影响.
2.4.1 K-RAS: RAS(包括K-RAS、N-RAS、H-RAS)是EGFR下游的关键效应分子, 在多数结肠癌中被突变激活或过表达. 散发性结直肠癌中K-RAS突变的发生率在23.5%-42.5%间, 其中右半结肠癌中发生率明显高于左半(57.3% vs 40.4%)[39]. 进一步研究发现, K-RAS的第12和13位密码子在右半结肠癌中的突变率分别为34%和12%, 远高于左半结肠癌的28%和6%. K-RAS突变与患者不良预后有关, 因K-RAS突变的患者不能从西妥昔单抗的治疗中获益[40]. Lu等[41]在接受一线靶向三联方案化疗的转移性结直肠癌亚洲人群中发现, 应用西妥昔单抗组左半结肠癌较右半在客观缓解率(70.1% vs 33.3%, P = 0.024)、无进展生存(15.0 mo vs 5.3 mo, P<0.001)和总生存(35.8 mo vs 14.4 mo, P = 0.031)上具有较为明显的优势. Blons等[42]发现第13位密码子突变对患者生存的影响与肿瘤位置相关, 在接受FOLFOX±cetuximab辅助化疗的Ⅲ期结肠癌患者中, 右半结肠癌患者的K-RAS突变位点不影响TTR和DFS, 而左半结肠癌患者的TTR和DFS则均受突变位点影响: K-RAS第12位密码子突变的患者复发风险显著增加, 而第13位密码子突变则不增加复发风险.
2.4.2 BRAF: BRAF是RAS-RAF-MAPK信号通路中另一重要分子, 文献报道[43,44]结肠癌中BRAF突变的发生率为2.5%-20.0%. 有趣的是Yamauchi等[45]发现BRAF的突变率与肿瘤位置呈线性相关, 随着肿瘤位置从升结肠到直肠, BRAF的突变率从40%逐渐降至不到2.3%. 另有研究[46]显示右半结肠癌中BRAF突变率为18.4%-22.4%, 而左半结肠癌和直肠癌中仅1.3%-7.8%, 且BRAF突变型和野生型中右半结肠癌分别占95%和48%, 故可认为BRAF突变与右半结肠癌相关. Eklöf等[47]的荟萃分析结果提示BRAF突变与不良预后相关. 亦有研究[48]认为BRAF突变是腹膜转移和远处淋巴结转移的危险因素, 这可部分解释右半结肠癌腹膜转移和淋巴结转移多见的临床病理特征及Ⅲ、Ⅳ期右半结肠癌较差的预后.
此外, BRAF突变与MSI也密切相关[38], 微卫星稳定的患者中BRAF突变率为5%, 而MSI患者中则为51.8%, 且MSI表型在BRAF突变和野生型患者中分别占76%和12%. 总之, BRAF突变多发生在右半, 预后较差, 且多伴有MSI.
左、右半结肠癌在术后复发率、复发时间、复发后生存时间及复发后的靶向药物治疗预后上的差异提示不同部位的结肠癌复发途径可能存在差异. Bauer等[49]应用NCBI上的基因微阵列数据(GSE14333), 对比了102例右半结肠癌和95例左半结肠癌复发切除标本, 聚类分析后发现两者的复发相关通路和分子存在差异: 右半结肠癌中CDKN2B、GADD45A、CCND1等细胞周期调控相关基因表达增加, Wnt信号通路激活; 而左半结肠癌中则是促进基质扩张的基因表达增高, 激活Wnt通路的肿瘤抑制基因表达降低, Wnt信号通路受到抑制.
复发相关的单基因预后预测分子NOX4、CDX2和ITGA3在不同部位的结肠癌中存在表达差异且和预后相关[49,50]. 研究发现NOX4的高表达与左半结肠癌5年无复发生存率降低相关; 而对于右半结肠, CDX2的高表达提示5年无复发生存率降低. 有趣的是, 这两种分子在对侧结肠上均不表现出这样的意义. 另一研究[50]则发现NOX4和ITGA3分别与左半和右半结肠癌复发相关.
MicroRNA为一群作用于转录后调控的非编码小分子RNA, 其中有原癌基因也有抑癌基因, 在结肠癌中表达差异大, 且受肿瘤位置影响. Nosho等[51]分析了29例结肠癌组织中的760个MicroRNA后, 发现miRNA-31在右半结肠癌中表达更高, 与KRAS和BRAF突变相关, 且这部分患者癌症特异性死亡率更高, 与右半结肠癌预后差的特点相符. Omrane等[52]分析了25例结肠癌样本发现miRNA-146a和miRNA-147b在左半结肠癌中的表达率更高, 提示这两种MicroRNA可作为左半结肠癌的标志分子. 另有一项122例结直肠癌患者的队列研究[53]发现, 尽管miRNA-1288在76%的患者中低表达甚至缺失, 其在左半和直肠癌中的表达率还是高于右半.
左、右半结肠癌在自然预后、治疗预后和复发相关预后上均存在差异, 且呈期别依赖. 总体而言: Ⅰ期患者两者生存差异不明显, 而Ⅱ期右半结肠癌患者具有生存优势, Ⅲ、Ⅳ期右半结肠癌患者预后较差; 结肠内肿瘤位置对根治术预后无明显影响, 而对化疗预后影响较大, 左半结肠癌整体的生存获益或许主要来自于其对化疗和靶向治疗的较好反应. 而这些预后差异提示了左右半结肠癌不同的基因背景, 关于预后相关分子的研究部分解释了临床预后差异的原因, 但还远远不够, 还有待更深入、更全面的基因表达差异的临床预后转化性研究.
作为一种具有明显异质性的疾病, 目前不同位置的结肠癌在分期和治疗上尚未区别对待. 相信随着更多左、右半结肠癌预后相关的分子生物学差异被揭示, 我们能够综合不同位置及预后分子的差异, 更精确地判断患者的预后, 更有效地筛选化疗、靶向或免疫治疗的获益人群, 从而来制定更为个体化的治疗方案.
左、右半结肠具有明显的异质性, 在胚胎起源、解剖生理, 癌症的发病率、性别、年龄等人口学特征及组织病理类型上均存在差异, 但目前对于两者的分期与治疗尚未区别对待, 原因在于两者的预后差异及分子生物学差异的临床意义仍存在争议.
蔡建春, 教授, 主任医师, 厦门大学附属中山医院胃肠外科; 周建奖, 教授, 贵阳医学院分子生物学重点实验室
左、右半结肠癌的发病机制、进展与复发、转移途径的差异及其对两者预后与治疗决策的影响是该领域亟待研究的问题.
本文系统阐述了左、右半结肠癌在临床预后及分子生物学特征方面的差异, 初步探究了临床与分子差异的联系, 有助于临床医师决定是否将位置差异作为结肠癌预后判断及治疗决策的考虑因素, 同时为结肠癌预后相关的基础研究提供一些思路.
认识结肠内不同肿瘤位置对结肠癌预后的影响以及左、右半结肠癌预后分子的差异, 有助于更精确地判断患者的预后, 更有效地筛选化疗、靶向或免疫治疗的获益人群, 从而来制定更为个体化的治疗方案.
本文利用分子生物学技术和高通量测序技术等学科进展, 对于左半、右半结肠癌相关的分子与通路进行总结, 并综述二者在临床预后和分子生物学特征方面的差异, 为临床医师以及科研工作者提供了一个新的思路, 对于临床科研的转化性研究有较大意义.
手稿来源: 邀请约稿
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告分类
A级 (优秀): A, A
B级 (非常好): 0
C级 (良好): 0
D级 (一般): 0
E级 (差): 0
编辑: 于明茜 电编:胡珊
| 1. | Siegel R, Desantis C, Jemal A. Colorectal cancer statistics, 2014. CA Cancer J Clin. 2014;64:104-117. [PubMed] [DOI] |
| 2. | Bufill JA. Colorectal cancer: evidence for distinct genetic categories based on proximal or distal tumor location. Ann Intern Med. 1990;113:779-788. [PubMed] |
| 3. | Weiss JM, Pfau PR, O'Connor ES, King J, LoConte N, Kennedy G, Smith MA. Mortality by stage for right- versus left-sided colon cancer: analysis of surveillance, epidemiology, and end results--Medicare data. J Clin Oncol. 2011;29:4401-4409. [PubMed] [DOI] |
| 4. | Pritchard CC, Grady WM. Colorectal cancer molecular biology moves into clinical practice. Gut. 2011;60:116-129. [PubMed] [DOI] |
| 5. | Markowitz SD, Bertagnolli MM. Molecular origins of cancer: Molecular basis of colorectal cancer. N Engl J Med. 2009;361:2449-2460. [PubMed] [DOI] |
| 6. | Beart RW, Melton LJ, Maruta M, Dockerty MB, Frydenberg HB, O'Fallon WM. Trends in right and left-sided colon cancer. Dis Colon Rectum. 1983;26:393-398. [PubMed] |
| 7. | Cheng L, Eng C, Nieman LZ, Kapadia AS, Du XL. Trends in colorectal cancer incidence by anatomic site and disease stage in the United States from 1976 to 2005. Am J Clin Oncol. 2011;34:573-580. [PubMed] [DOI] |
| 8. | Wiggers T, Arends JW, Volovics A. Regression analysis of prognostic factors in colorectal cancer after curative resections. Dis Colon Rectum. 1988;31:33-41. [PubMed] |
| 9. | Meguid RA, Slidell MB, Wolfgang CL, Chang DC, Ahuja N. Is there a difference in survival between right- versus left-sided colon cancers? Ann Surg Oncol. 2008;15:2388-2394. [PubMed] [DOI] |
| 10. | Benedix F, Kube R, Meyer F, Schmidt U, Gastinger I, Lippert H. Comparison of 17,641 patients with right- and left-sided colon cancer: differences in epidemiology, perioperative course, histology, and survival. Dis Colon Rectum. 2010;53:57-64. [PubMed] [DOI] |
| 11. | Pappas AV, Lagoudianakis EE, Dallianoudis IG, Kotzadimitriou KT, Koronakis NE, Chrysikos ID, Koukoutsi ID, Markogiannakis HE, Antonakis PT, Manouras AJ. Differences in colorectal cancer patterns between right and left sided colorectal cancer lesions. J BUON. 2010;15:509-513. [PubMed] |
| 12. | Yahagi M, Okabayashi K, Hasegawa H, Tsuruta M, Kitagawa Y. The Worse Prognosis of Right-Sided Compared with Left-Sided Colon Cancers: a Systematic Review and Meta-analysis. J Gastrointest Surg. 2016;20:648-655. [PubMed] [DOI] |
| 13. | Elsaleh H, Joseph D, Grieu F, Zeps N, Spry N, Iacopetta B. Association of tumour site and sex with survival benefit from adjuvant chemotherapy in colorectal cancer. Lancet. 2000;355:1745-1750. [PubMed] [DOI] |
| 14. | Missiaglia E, Jacobs B, D'Ario G, Di Narzo AF, Soneson C, Budinska E, Popovici V, Vecchione L, Gerster S, Yan P. Distal and proximal colon cancers differ in terms of molecular, pathological, and clinical features. Ann Oncol. 2014;25:1995-2001. [PubMed] [DOI] |
| 15. | Sinicrope FA, Mahoney MR, Smyrk TC, Thibodeau SN, Warren RS, Bertagnolli MM, Nelson GD, Goldberg RM, Sargent DJ, Alberts SR. Prognostic impact of deficient DNA mismatch repair in patients with stage III colon cancer from a randomized trial of FOLFOX-based adjuvant chemotherapy. J Clin Oncol. 2013;31:3664-3672. [PubMed] [DOI] |
| 16. | Price TJ, Beeke C, Ullah S, Padbury R, Maddern G, Roder D, Townsend AR, Moore J, Roy A, Tomita Y. Does the primary site of colorectal cancer impact outcomes for patients with metastatic disease? Cancer. 2015;121:830-835. [PubMed] [DOI] |
| 17. | Modest DP, Schulz C, von Weikersthal LF, Quietzsch D, von Einem JC, Schalhorn A, Vehling-Kaiser U, Laubender RP, Giessen C, Stintzing S. Outcome of patients with metastatic colorectal cancer depends on the primary tumor site (midgut vs. hindgut): analysis of the FIRE1-trial (FuFIRI or mIROX as first-line treatment). Anticancer Drugs. 2014;25:212-218. [PubMed] [DOI] |
| 18. | Boisen MK, Johansen JS, Dehlendorff C, Larsen JS, Osterlind K, Hansen J, Nielsen SE, Pfeiffer P, Tarpgaard LS, Holländer NH. Primary tumor location and bevacizumab effectiveness in patients with metastatic colorectal cancer. Ann Oncol. 2013;24:2554-2559. [PubMed] [DOI] |
| 19. | von Einem JC, Heinemann V, von Weikersthal LF, Vehling-Kaiser U, Stauch M, Hass HG, Decker T, Klein S, Held S, Jung A. Left-sided primary tumors are associated with favorable prognosis in patients with KRAS codon 12/13 wild-type metastatic colorectal cancer treated with cetuximab plus chemotherapy: an analysis of the AIO KRK-0104 trial. J Cancer Res Clin Oncol. 2014;140:1607-1614. [PubMed] [DOI] |
| 20. | Park JH, Kim MJ, Park SC, Kim MJ, Hong CW, Sohn DK, Han KS, Oh JH. Difference in Time to Locoregional Recurrence Between Patients With Right-Sided and Left-Sided Colon Cancers. Dis Colon Rectum. 2015;58:831-837. [PubMed] [DOI] |
| 21. | Brulé SY, Jonker DJ, Karapetis CS, O'Callaghan CJ, Moore MJ, Wong R, Tebbutt NC, Underhill C, Yip D, Zalcberg JR. Location of colon cancer (right-sided versus left-sided) as a prognostic factor and a predictor of benefit from cetuximab in NCIC CO.17. Eur J Cancer. 2015;51:1405-1414. [PubMed] [DOI] |
| 22. | Slattery ML, Pellatt DF, Mullany LE, Wolff RK, Herrick JS. Gene expression in colon cancer: A focus on tumor site and molecular phenotype. Genes Chromosomes Cancer. 2015;54:527-541. [PubMed] [DOI] |
| 23. | Fearon ER, Vogelstein B. A genetic model for colorectal tumorigenesis. Cell. 1990;61:759-767. [PubMed] [DOI] |
| 24. | Gonzalez EC, Roetzheim RG, Ferrante JM, Campbell R. Predictors of proximal vs. distal colorectal cancers. Dis Colon Rectum. 2001;44:251-258. [PubMed] [DOI] |
| 25. | Gao P, Song YX, Xu YY, Sun Z, Sun JX, Xu HM, Wang ZN. Does the prognosis of colorectal mucinous carcinoma depend upon the primary tumour site? Results from two independent databases. Histopathology. 2013;63:603-615. [PubMed] [DOI] |
| 27. | Russo A, Bazan V, Iacopetta B, Kerr D, Soussi T, Gebbia N. The TP53 colorectal cancer international collaborative study on the prognostic and predictive significance of p53 mutation: influence of tumor site, type of mutation, and adjuvant treatment. J Clin Oncol. 2005;23:7518-7528. [PubMed] [DOI] |
| 28. | Gervaz P, Cerottini JP, Bouzourene H, Hahnloser D, Doan CL, Benhattar J, Chaubert P, Secic M, Gillet M, Carethers JM. Comparison of microsatellite instability and chromosomal instability in predicting survival of patients with T3N0 colorectal cancer. Surgery. 2002;131:190-197. [PubMed] [DOI] |
| 29. | Jernvall P, Mäkinen MJ, Karttunen TJ, Mäkelä J, Vihko P. Microsatellite instability: impact on cancer progression in proximal and distal colorectal cancers. Eur J Cancer. 1999;35:197-201. [PubMed] [DOI] |
| 30. | Shin US, Cho SS, Moon SM, Park SH, Jee SH, Jung EJ, Hwang DY. Is microsatellite instability really a good prognostic factor of colorectal cancer? Ann Coloproctol. 2014;30:28-34. [PubMed] [DOI] |
| 31. | Corso G, Pascale V, Flauti G, Ferrara F, Marrelli D, Roviello F. Oncogenic mutations and microsatellite instability phenotype predict specific anatomical subsite in colorectal cancer patients. Eur J Hum Genet. 2013;21:1383-1388. [PubMed] [DOI] |
| 32. | Popat S, Hubner R, Houlston RS. Systematic review of microsatellite instability and colorectal cancer prognosis. J Clin Oncol. 2005;23:609-618. [PubMed] [DOI] |
| 33. | Greenson JK, Huang SC, Herron C, Moreno V, Bonner JD, Tomsho LP, Ben-Izhak O, Cohen HI, Trougouboff P, Bejhar J. Pathologic predictors of microsatellite instability in colorectal cancer. Am J Surg Pathol. 2009;33:126-133. [PubMed] [DOI] |
| 34. | Kloor M, Michel S, von Knebel Doeberitz M. Immune evasion of microsatellite unstable colorectal cancers. Int J Cancer. 2010;127:1001-1010. [PubMed] [DOI] |
| 35. | Naito Y, Saito K, Shiiba K, Ohuchi A, Saigenji K, Nagura H, Ohtani H. CD8+ T cells infiltrated within cancer cell nests as a prognostic factor in human colorectal cancer. Cancer Res. 1998;58:3491-3494. [PubMed] |
| 36. | Iacopetta B, Heyworth J, Girschik J, Grieu F, Clayforth C, Fritschi L. The MTHFR C677T and DeltaDNMT3B C-149T polymorphisms confer different risks for right- and left-sided colorectal cancer. Int J Cancer. 2009;125:84-90. [PubMed] [DOI] |
| 37. | Barault L, Charon-Barra C, Jooste V, de la Vega MF, Martin L, Roignot P, Rat P, Bouvier AM, Laurent-Puig P, Faivre J. Hypermethylator phenotype in sporadic colon cancer: study on a population-based series of 582 cases. Cancer Res. 2008;68:8541-8546. [PubMed] [DOI] |
| 38. | Juo YY, Johnston FM, Zhang DY, Juo HH, Wang H, Pappou EP, Yu T, Easwaran H, Baylin S, van Engeland M. Prognostic value of CpG island methylator phenotype among colorectal cancer patients: a systematic review and meta-analysis. Ann Oncol. 2014;25:2314-2327. [PubMed] [DOI] |
| 39. | Tong JH, Lung RW, Sin FM, Law PP, Kang W, Chan AW, Ma BB, Mak TW, Ng SS, To KF. Characterization of rare transforming KRAS mutations in sporadic colorectal cancer. Cancer Biol Ther. 2014;15:768-776. [PubMed] [DOI] |
| 40. | Ogura T, Kakuta M, Yatsuoka T, Nishimura Y, Sakamoto H, Yamaguchi K, Tanabe M, Tanaka Y, Akagi K. Clinicopathological characteristics and prognostic impact of colorectal cancers with NRAS mutations. Oncol Rep. 2014;32:50-56. [PubMed] [DOI] |
| 41. | Lu HJ, Lin JK, Chen WS, Jiang JK, Yang SH, Lan YT, Lin CC, Chang SC, Teng HW. Primary tumor location is an important predictive factor for wild-type KRAS metastatic colon cancer treated with cetuximab as front-line bio-therapy. Asia Pac J Clin Oncol. 2016; Mar 3. [Epub ahead of print]. [PubMed] [DOI] |
| 42. | Blons H, Emile JF, Le Malicot K, Julié C, Zaanan A, Tabernero J, Mini E, Folprecht G, Van Laethem JL, Thaler J. Prognostic value of KRAS mutations in stage III colon cancer: post hoc analysis of the PETACC8 phase III trial dataset. Ann Oncol. 2014;25:2378-2385. [PubMed] [DOI] |
| 43. | Chen D, Huang JF, Liu K, Zhang LQ, Yang Z, Chuai ZR, Wang YX, Shi DC, Huang Q, Fu WL. BRAFV600E mutation and its association with clinicopathological features of colorectal cancer: a systematic review and meta-analysis. PLoS One. 2014;9:e90607. [PubMed] [DOI] |
| 44. | Yaeger R, Cercek A, Chou JF, Sylvester BE, Kemeny NE, Hechtman JF, Ladanyi M, Rosen N, Weiser MR, Capanu M. BRAF mutation predicts for poor outcomes after metastasectomy in patients with metastatic colorectal cancer. Cancer. 2014;120:2316-2324. [PubMed] [DOI] |
| 45. | Yamauchi M, Morikawa T, Kuchiba A, Imamura Y, Qian ZR, Nishihara R, Liao X, Waldron L, Hoshida Y, Huttenhower C. Assessment of colorectal cancer molecular features along bowel subsites challenges the conception of distinct dichotomy of proximal versus distal colorectum. Gut. 2012;61:847-854. [PubMed] [DOI] |
| 46. | Smith CG, Fisher D, Claes B, Maughan TS, Idziaszczyk S, Peuteman G, Harris R, James MD, Meade A, Jasani B. Somatic profiling of the epidermal growth factor receptor pathway in tumors from patients with advanced colorectal cancer treated with chemotherapy ± cetuximab. Clin Cancer Res. 2013;19:4104-4113. [PubMed] [DOI] |
| 47. | Eklöf V, Wikberg ML, Edin S, Dahlin AM, Jonsson BA, Öberg Å, Rutegård J, Palmqvist R. The prognostic role of KRAS, BRAF, PIK3CA and PTEN in colorectal cancer. Br J Cancer. 2013;108:2153-2163. [PubMed] [DOI] |
| 48. | Tran B, Kopetz S, Tie J, Gibbs P, Jiang ZQ, Lieu CH, Agarwal A, Maru DM, Sieber O, Desai J. Impact of BRAF mutation and microsatellite instability on the pattern of metastatic spread and prognosis in metastatic colorectal cancer. Cancer. 2011;117:4623-4632. [PubMed] [DOI] |
| 49. | Bauer KM, Hummon AB, Buechler S. Right-side and left-side colon cancer follow different pathways to relapse. Mol Carcinog. 2012;51:411-421. [PubMed] [DOI] |
| 50. | Bauer KM, Watts TN, Buechler S, Hummon AB. Proteomic and functional investigation of the colon cancer relapse-associated genes NOX4 and ITGA3. J Proteome Res. 2014;13:4910-4918. [PubMed] [DOI] |
| 51. | Nosho K, Igarashi H, Nojima M, Ito M, Maruyama R, Yoshii S, Naito T, Sukawa Y, Mikami M, Sumioka W. Association of microRNA-31 with BRAF mutation, colorectal cancer survival and serrated pathway. Carcinogenesis. 2014;35:776-783. [PubMed] [DOI] |
| 52. | Omrane I, Kourda N, Stambouli N, Privat M, Medimegh I, Arfaoui A, Uhrhammer N, Bougatef K, Baroudi O, Bouzaienne H. MicroRNAs 146a and 147b biomarkers for colorectal tumor's localization. Biomed Res Int. 2014;2014:584852. [PubMed] [DOI] |
| 53. | Gopalan V, Pillai S, Ebrahimi F, Salajegheh A, Lam TC, Le TK, Langsford N, Ho YH, Smith RA, Lam AK. Regulation of microRNA-1288 in colorectal cancer: altered expression and its clinicopathological significance. Mol Carcinog. 2014;53 Suppl 1:E36-E44. [PubMed] [DOI] |