修回日期: 2016-07-03
接受日期: 2016-07-19
在线出版日期: 2016-08-18
目的: 探讨高迁移率族蛋白B1(high mobility group protein B1, HMGB1)和Toll样受体4(Toll-like receptor 4, TLR4)在人食管鳞状细胞癌(食管鳞癌)组织中的表达及其临床意义.
方法: 选择72例食管鳞癌标本, 15例癌旁正常组织标本, 采用EnVision免疫组织化学染色法检测HMGB1和TLR4在食管鳞癌组织及癌旁正常组织中的表达, 并应用统计学方法对其表达与临床病理因素进行分析.
结果: 食管鳞癌组织中HMGB1、TLR4的表达显著高于正常组织(P<0.05), 且与淋巴结转移及TNM分期相关(P<0.05), 与肿瘤大小、分化程度等无相关性. 食管麟癌组织HMGB1和TLR4的表达呈显著正相关(r = 0.377, P<0.01).
结论: 食管鳞癌组织中HMGB1、TLR4的表达显著高于癌旁正常组织, 且其表达与淋巴结转移及TNM分期相关, 联合检测二者可能有助于评估食管鳞癌的恶性程度. 因此, HMGB1/TLR信号通路有可能作为反映食管癌预后的重要生物学指标及抗食管癌的重要靶点.
核心提示: 高迁移率族蛋白B1(high mobility group protein B1, HMGB1)和Toll样受体4(Toll-like receptor 4, TLR4)在多种肿瘤的发生、发展过程中起重要作用. 通过对食管鳞癌组织中HMGB1、TLR4表达的检测及其与病理因素关系的分析, 推测HMGB1/TLR信号通路有可能作为反映食管癌预后的重要生物学指标及抗食管癌的重要靶点.
引文著录: 梁旭阳, 李祎, 马艳芹, 张志梅, 贺艳琳. HMGB1和TLR4在食管鳞癌组织中的表达及临床意义. 世界华人消化杂志 2016; 24(23): 3495-3501
Revised: July 3, 2016
Accepted: July 19, 2016
Published online: August 18, 2016
AIM: To detect the expression of high mobility group protein B1 (HMGB1) and Toll-like receptor 4 (TLR4) in human esophageal squamous cell carcinoma and analyze their clinical significance.
METHODS: The expression of HMGB1 and TLR4 was detected by EnVision immunohisto-
chemical staining method in 72 esophageal squamous carcinoma specimens and 15 matched normal tissue specimens. Statistical methods were used to analyze the relationship between the expression of HMGB1 and TLR4 and clinical and pathological parameters.
RESULTS: The expression of HMGB1 and TLR4 in esophageal squamous carcinoma tissues was significantly higher than that in matched normal tissues (P < 0.05). HMGB1 and TLR4 expression was positively associated with lymphatic metastasis and TNM stage (P < 0.05), but negatively correlated with tumor size and degree of differentiation. The expression of HMGB1 and TLR4 had a significant positive correlation (r = 0.377, P < 0.01).
CONCLUSION: The expression of HMGB1 and TLR4 in esophageal squamous carcinoma tissues is associated with lymphatic metastasis and TNM stage, and the joint detection of HMGB1 and TLR4 expression may help evaluate the degree of malignancy of esophageal squamous carcinoma. HMGB1/TLR may be used as important biological indicators reflecting the prognosis of esophageal cancer and important targets for therapy of esophageal cancer.
- Citation: Liang XY, Li Y, Ma YQ, Zhang ZM, He YL. Clinical significance of expression of high mobility group protein B1 and Toll-like receptor 4 in esophageal squamous cell carcinoma. Shijie Huaren Xiaohua Zazhi 2016; 24(23): 3495-3501
- URL: https://www.wjgnet.com/1009-3079/full/v24/i23/3495.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i23.3495
食管癌是消化系最常见的恶性肿瘤之一, 其中食管鳞状细胞癌是食管癌最常见的病理类型, 其恶性程度高, 易发生转移, 预后较差, 在所有肿瘤中发病率居第5位, 死亡率居第4位[1]. 食管癌早期诊断率低, 临床确诊时大都为中晚期, 部分甚至已发生转移, 治疗效果差. 高迁移率族蛋白(high mobility group protein, HMG)是一类与染色体结合的非组蛋白, 广泛参与调节DNA复制、转录、重组和修复等多种重要核内生物学功能. 近来研究发现其与多种肿瘤的生长、浸润、转移有关, 然而其在肿瘤发生发展中的具体机制尚不清楚. HMGB1能与多种Toll-样受体(Toll-like receptor, TLR)相互作用, 主要有TLR2、TLR4和TLR9. HMGB1与TLR结合后, 主要通过髓样分化因子(myeloid differentiation factors 88, MyD88)依赖信号通路转导, 激活核因子-κB(nuclear factor-κB, NF-κB)活性, 引起肿瘤坏死因子-α(tumor necrosis factor α, TNF-α)、白介素(interleukin, IL)-1、IL-6、IL-8等促炎细胞因子的基因表达上调并大量释放[2,3]. 有研究[4-6]证实TLR表达的上调与胃癌、肺癌、卵巢癌等发生、发展有密切关系, 且TLR4是目前发现与肿瘤发病关系最密切的TLR家族成员之一. 本研究通过免疫组织化学法检测HMGB1和TLR4在食管鳞癌组织及癌旁正常组织中的表达情况, 探讨二者在食管鳞癌发展过程中的关联性及其与临床病理参数的关系.
收集连云港市第一人民医院病理科2011-01/2014-09具有完整临床资料食管鳞癌存档石蜡标本72例(A组). 癌旁正常黏膜组织(癌缘外6 cm, 并3/4病理证实无肿瘤细胞)15例(B组)进行对照. 所有病例均3/4病理确诊为单一鳞状细胞癌, 患者术前未3/4放疗、化疗. 患者男62例, 女10例, 年龄43-74岁, 平均62岁; 其中高分化鳞癌14例, 高中及中分化鳞癌共48例, 中低及低分化鳞癌共10例; 侵犯深度为黏膜及黏膜下层12例, 肌层14例, 外膜及邻近结构46例, 伴有淋巴结转移26例, 无淋巴结转移46例. 根据美国癌症联合委员会(American joint committee on cancer, AJCC)和国际抗癌联盟(International Union Against Cancer, IUCC)2009年制订的第7版食管癌TNM分期和分段标准, 临床分期Ⅰ期8例、Ⅱa期21例、Ⅱb期24例、Ⅲa期11例、Ⅲb期3例、Ⅲc期4例、Ⅳ期1例. 羊抗人HMGB1单克隆抗体、羊抗人TLR4单克隆抗体均购自美国Abcam公司; EnVision免疫组织化学试剂盒购自北京中杉生物技术有限公司.
1.2.1 免疫组织化学EnVision二步法检测HMGB1、TLR4的表达: 制作4 μm厚连续石蜡切片, 70 ℃烤箱3 min, 常规脱蜡与水化, 高温高压法抗原热修复(修复液柠檬酸缓冲0.01 mol/L、pH 6.0), 自然冷却至室温; 3%H2O2孵育10 min, 滴加一抗(HMGB1稀释比1:300、TLR4稀释比1:200), 4 ℃冰箱过夜, 滴加二抗室温孵育15 min, DAB显色, 苏木素复染, 分化脱水, 透明, 中性树胶封片. 用已知阳性切片做阳性对照, PBS代替一抗作阴性对照.
1.2.2 结果判定: 所有免疫组织化学染色结果均有两位病理科医生在双盲条件下完成, 并根据食管鳞癌细胞(HMGB1定位于细胞质或细胞核, TLR4定位于细胞膜和细胞质)出现淡黄色至棕褐色颗粒, 定位明确, 染色明显, 高倍镜下随机选择5个视野(每个视野观察细胞不少于200个), 根据阳性细胞百分比及染色强度进行判定. 阳性细胞≤10.0%为0分, 10.0%-25.0%为1分, 26.0%-50.0%为2分, 51.0%-75.0%为3分, ≥76.0%为4分. 无色为0分, 淡黄色为1分, 棕黄色为2分, 棕褐色为3分. 取上述两项评分的乘积作为总积分, 总积分≥5为阳性表达.
统计学处理 采用SPSS22.0软件进行统计学分析, 计数资料用百分比表示, 采用χ2检验; 计量资料采用单因素方差分析, 相关性采用Spearman等级相关分析. 以α = 0.05作为检验水准. P<0.05为差异有统计学意义.
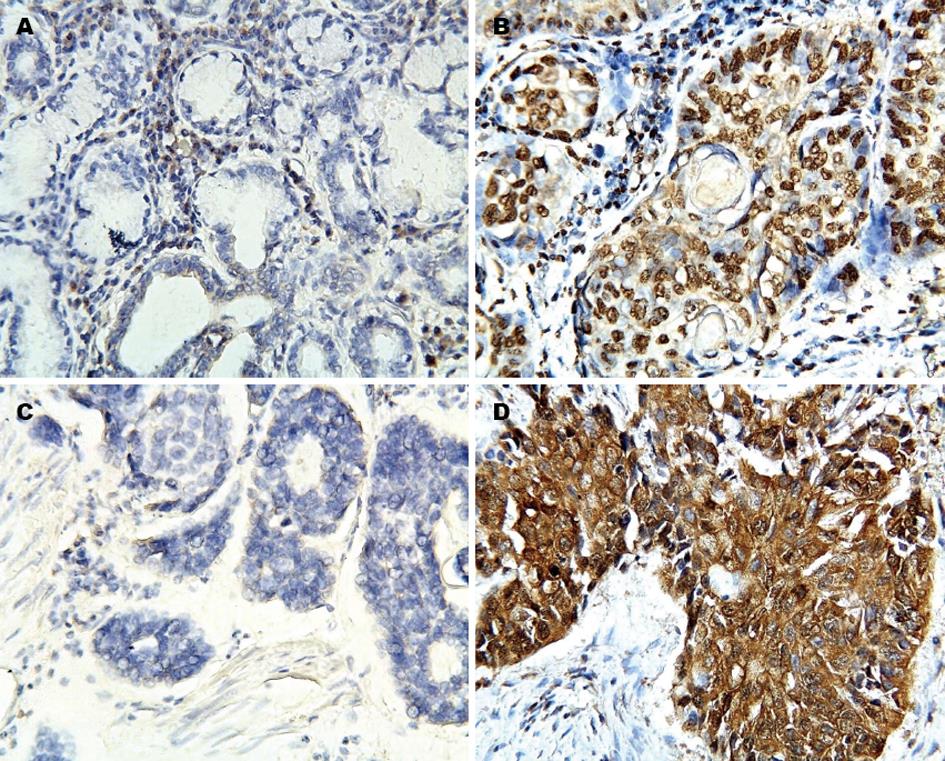
HMGB1主要表达于食管鳞癌细胞和部分间质细胞核和细胞质中, 阳性染色呈淡黄色至棕黄色. 食管鳞癌癌旁正常组织中很少见阳性染色, 说明HMGB1在食管鳞癌组织中有过度表达(图1A, B). HMGB1蛋白在食管鳞癌和癌旁正常组织中的阳性表达率为68.1% vs 20.0%, 差异有统计学意义(P<0.01).
TLR4主要表达于食管鳞癌细胞浆和/或细胞膜, 阳性染色呈棕黄色至棕褐色, 食管鳞癌癌旁正常组织中很少见阳性染色, 说明TLR4在食管鳞癌组织中有过度表达(图1C, D). 本实验结果显示TLR4蛋白在食管鳞癌和癌旁正常组织中的阳性表达率为66.7% vs 26.7%, 有统计学差异(P<0.05).
在72例食管鳞癌组织中, HMGB1的表达与年龄、性别、肿瘤大小以及肿瘤分化程度无关, 随着淋巴结转移及TNM分期的增加而逐渐升高, 差异有统计学意义. 同样可见TLR4的表达与患者年龄、性别以及肿瘤大小、分化程度亦无关, 与淋巴结转移和TNM分期呈正相关, 且差异明显(表1).
| 临床病理特征 | HMGB1 | P值 | TLR4 | P值 | ||
| 阴性 | 阳性 | 阴性 | 阳性 | |||
| 年龄(岁) | 0.079 | 1.000 | ||||
| ≤62 | 9 | 30 | 13 | 26 | ||
| >62 | 14 | 19 | 11 | 22 | ||
| 性别 | 0.092 | 0.904 | ||||
| 男 | 17 | 45 | 20 | 42 | ||
| 女 | 6 | 4 | 4 | 6 | ||
| 分化程度 | 0.612 | 0.185 | ||||
| 高/高中/中 | 21 | 41 | 23 | 39 | ||
| 中低/低 | 2 | 8 | 1 | 9 | ||
| 浸润深度 | 0.156 | 0.083 | ||||
| T1-2 | 11 | 15 | 12 | 14 | ||
| T3-4 | 12 | 34 | 12 | 34 | ||
| 淋巴结转移 | 0.011 | 0.010 | ||||
| N0 | 20 | 26 | 22 | 24 | ||
| N1-4 | 3 | 23 | 2 | 24 | ||
| 远处转移 | 0.831 | 0.800 | ||||
| M0 | 23 | 47 | 24 | 46 | ||
| M1 | 0 | 2 | 0 | 2 | ||
| TNM分期 | 0.009 | 0.030 | ||||
| Ⅰ/Ⅱ | 22 | 31 | 22 | 31 | ||
| Ⅲ/Ⅳ | 1 | 18 | 2 | 17 | ||
在食管鳞癌组织中HMGB1和TLR4蛋白表达的阳性率分别为68.1%(49/72)和66.7%(48/72), 两者同阳性率为52.8%, 同阴性率为18.1%, 两者异常表达率为29.2%. 通过关联性分析发现, HMGB1和TLR4在食管鳞癌组织表达呈正相关, 其相关性有统计学意义(r = 0.377, P<0.01).
炎症通常是宿主抵御微生物病原体入侵、组织破坏和抗肿瘤的一种防护措施. 然而近年来研究显示慢性炎症会增加肿瘤进展的风险[7], 慢性反流性食管炎则是食管癌发展的高危因素[8].
诸多研究表明, 发生恶性肿瘤时, 由于肿瘤细胞基因表达和肿瘤组织微环境(如缺氧、营养缺乏等)的改变, 肿瘤细胞、炎性细胞等HMGB1通常表达增强和释放增多, 另外肿瘤坏死细胞也释放部分HMGB1[9], 对肿瘤部位局部炎症反应和肿瘤生长速率可能起调节作用. 研究表明HMGB1在多种肿瘤的发生、发展过程中起重要作用, 如肝细胞癌[10-14]、胰腺癌[15-17]、肾透明细胞癌[18]、前列腺癌[19]、结直肠癌[20-22]、胃癌[23-25]等. 本研究结果显示, HMGB1在食管鳞癌组织中阳性表达率为68.06%(49例), 显著高于癌旁正常组织中阳性表达率20.00%(3例), 差异有统计学意义, 提示HMGB1的表达与食管鳞癌的发生具有相关性. 在食管鳞癌组织中, HMGB1的表达与年龄、性别以及肿瘤大小、分化程度无关, 而与淋巴结有否转移及TNM分期有关, 表明HMGB1与食管鳞癌的侵袭和转移能力密切相关.
TLR是最近发现的一种模式识别受体, 其中TLR2、TLR4、TLR9等已被研究证实. TLR的生物学功能中最突出的就是促进细胞因子的合成和释放, 引发炎症反应[26]. 近年来研究[27,28]表明由自身免疫疾病或者病原微生物感染引起的许多慢性炎症是相应恶性肿瘤的癌前病变, 这些病原微生物包括幽门螺杆菌、人乳头瘤病毒、乙型肝炎病毒、丙型肝炎病毒、EB病毒等, 他们感染机体促进消化系统肿瘤、宫颈癌、肝癌、造血系统肿瘤的发生发展. 热休克蛋白(heat shock protein, HSP)是一类重要的内源性的TLR配体, 肿瘤细胞释放的HSP60、HSP70、HSP90能够激活肿瘤相关的巨噬细胞的TLR4, 诱导促炎性细胞因子的分泌, 从而促进肿瘤的生长[29]. TLR2和TLR4的持续激活被认为是慢性炎症持续存在进而发展为恶性肿瘤的重要因素[30]. 亦有研究[31]表明TLR2、TLR3、TLR4和TLR9信号能够上调miR-155的表达, TLR2、TLR4和TLR5信号能够上调肿瘤细胞miR-146的表达, 促进炎性的肿瘤微环境的形成与肿瘤的发展. 肿瘤表面的TLR激活后还可以损伤免疫细胞的抗肿瘤作用, 从而改变炎症反应原本的防御性作用, 促进肿瘤的增殖和侵袭[32]. TLR存在不同基因的多态性, 已3/4发现的TLR多态性有几百种, 但其中绝大部分功能未知. 近期研究[33]表明, TLR4的遗传多态性Asp299Gly和Thr399Ile是多种癌症高发的显著性标志. TLR4的多态性显著提高了包括结肠直肠癌、胃癌、肝癌和乳腺癌的发生率[34]. 本研究显示, 食管鳞癌组织中TLR4表达显著高于癌旁正常对照组, 差异有统计学意义(P<0.05). 与HMGB1在食管鳞癌组织中表达相似, 随着肿瘤淋巴结发生转移及TNM分期增加, TLR4表达有增高趋势, 提示TLR4高表达者, 食管鳞状细胞癌的侵袭性和转移性增高.
HMGB1主要受体是晚期糖基化终末产物受体(receptor for advanced glycation end-products, RAGE)和TLR. HMGB1能与多种TLR相互作用, 主要有TLR2、TLR4和TLR9. HMGB1与TLR结合后, 主要通过MyD88依赖信号通路转导, 激活NF-κB活性, 引起TNF-α、IL-1、IL-6、IL-8等促炎细胞因子的基因表达上调并大量释放[2,3]. 本研究中HMGB1表达与TLR4表达具有相关性, 从一定程度上说明HMGB1-TLR4信号通路在食管癌的转移与侵袭过程中发挥重要作用, 其具体机制有待进一步深入研究.
总之, HMGB1与TLR4在食管癌发生发展中起重要作用, 与食管癌转移侵袭相关. 因此联合检测二者在食管癌组织中的表达, 可能有助于阐明食管癌发生发展机制, 作为判断预后的指标之一, 为食管癌的治疗寻找新的靶点.
感谢连云港市第一人民医院病理科刘毅与齐冬雪给予本实验的大力支持.
食管癌恶性程度高, 早期诊断率低,易发生转移, 治疗效果差, 预后较差. 加强其发病机制的研究有助于早期诊断与及时治疗. 高迁移率族蛋白B1(high mobility group protein B1, HMGB1)和Toll样受体4(Toll-like receptor 4, TLR4)参与调控多种肿瘤发生、发展的多项生物学功能, 但具体机制尚不完全清楚.
常丽丽, 主任医师, 石家庄市第一医院消化内科; 刘鹏飞, 主任医师, 东南大学医学院附属江阴医院消化内科
HMGB1是一种与染色体结合的非组蛋白, 研究表明其在多种肿瘤的发生、发展过程中起重要作用. HMGB1能与多种TLR相互作用, 其中TLR4能显著提高包括结直肠癌、胃癌等的发生率. 目前联合检测二者在食管鳞癌中表达的相关报道甚少.
Bauer等报道了TLR4的持续激活被认为是慢性炎症持续存在进而发展为恶性肿瘤的重要因素. Santini等的研究表明TLR4信号能够上调肿瘤细胞miR-155、miR-146的表达, 促进炎性的肿瘤微环境的形成与肿瘤的发展.
本研究选择人食管鳞癌标本, 采用EnVision免疫组织化学染色法检测HMGB1和TLR4在食管鳞癌组织及癌旁正常组织中的表达, 并探讨其表达与临床病理因素之间的关系.
本研究为评估食管鳞癌的恶性程度及预后寻找了新的指标, 并可能为食管癌治疗提供新靶点.
本研究发现食管鳞癌组织中HMGB1、TLR4的表达显著高于癌旁正常组织, 且其表达与淋巴结转移及TNM分期相关, 推测HMGB1/TLR信号通路有可能作为反映食管癌预后的重要生物学指标及抗食管癌的重要靶点. 该研究有较高学术价值和意义.
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 江苏省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): 0
D级 (一般): 0
E级 (差): 0
编辑: 郭鹏 电编:闫晋利
| 1. | 赫 捷, 陈 万青. 中国肿瘤登记年报. 第2012版. 北京: 军事医学科学出版社 2012; 12. |
| 2. | Kang JW, Koh EJ, Lee SM. Melatonin protects liver against ischemia and reperfusion injury through inhibition of toll-like receptor signaling pathway. J Pineal Res. 2011;50:403-411. [PubMed] [DOI] |
| 3. | Wang S, Schmaderer C, Kiss E, Schmidt C, Bonrouhi M, Porubsky S, Gretz N, Schaefer L, Kirschning CJ, Popovic ZV. Recipient Toll-like receptors contribute to chronic graft dysfunction by both MyD88- and TRIF-dependent signaling. Dis Model Mech. 2010;3:92-103. [PubMed] [DOI] |
| 4. | Schmausser B, Andrulis M, Endrich S, Müller-Hermelink HK, Eck M. Toll-like receptors TLR4, TLR5 and TLR9 on gastric carcinoma cells: an implication for interaction with Helicobacter pylori. Int J Med Microbiol. 2005;295:179-185. [PubMed] [DOI] |
| 5. | Droemann D, Albrecht D, Gerdes J, Ulmer AJ, Branscheid D, Vollmer E, Dalhoff K, Zabel P, Goldmann T. Human lung cancer cells express functionally active Toll-like receptor 9. Respir Res. 2005;6:1. [PubMed] [DOI] |
| 6. | Kelly MG, Alvero AB, Chen R, Silasi DA, Abrahams VM, Chan S, Visintin I, Rutherford T, Mor G. TLR-4 signaling promotes tumor growth and paclitaxel chemoresistance in ovarian cancer. Cancer Res. 2006;66:3859-3868. [PubMed] [DOI] |
| 7. | Mantovani A, Allavena P, Sica A, Balkwill F. Cancer-related inflammation. Nature. 2008;454:436-444. [PubMed] [DOI] |
| 8. | van der Woude CJ, Kleibeuker JH, Jansen PL, Moshage H. Chronic inflammation, apoptosis and (pre-)malignant lesions in the gastro-intestinal tract. Apoptosis. 2004;9:123-130. [PubMed] [DOI] |
| 9. | Tang D, Kang R, Zeh HJ, Lotze MT. High-mobility group box 1 and cancer. Biochim Biophys Acta. 2010;1799:131-140. [PubMed] [DOI] |
| 10. | Cheng P, Dai W, Wang F, Lu J, Shen M, Chen K, Li J, Zhang Y, Wang C, Yang J. Ethyl pyruvate inhibits proliferation and induces apoptosis of hepatocellular carcinoma via regulation of the HMGB1-RAGE and AKT pathways. Biochem Biophys Res Commun. 2014;443:1162-1168. [PubMed] [DOI] |
| 11. | Dong YD, Cui L, Peng CH, Cheng DF, Han BS, Huang F. Expression and clinical significance of HMGB1 in human liver cancer: Knockdown inhibits tumor growth and metastasis in vitro and in vivo. Oncol Rep. 2013;29:87-94. [PubMed] [DOI] |
| 12. | Yan W, Chang Y, Liang X, Cardinal JS, Huang H, Thorne SH, Monga SP, Geller DA, Lotze MT, Tsung A. High-mobility group box 1 activates caspase-1 and promotes hepatocellular carcinoma invasiveness and metastases. Hepatology. 2012;55:1863-1875. [PubMed] [DOI] |
| 13. | Liu F, Zhang Y, Peng Z, Gao H, Xu L, Chen M. High expression of high mobility group box 1 (hmgb1) predicts poor prognosis for hepatocellular carcinoma after curative hepatectomy. J Transl Med. 2012;10:135. [PubMed] [DOI] |
| 14. | Cheng BQ, Jia CQ, Liu CT, Lu XF, Zhong N, Zhang ZL, Fan W, Li YQ. Serum high mobility group box chromosomal protein 1 is associated with clinicopathologic features in patients with hepatocellular carcinoma. Dig Liver Dis. 2008;40:446-452. [PubMed] [DOI] |
| 15. | Wittwer C, Boeck S, Heinemann V, Haas M, Stieber P, Nagel D, Holdenrieder S. Circulating nucleosomes and immunogenic cell death markers HMGB1, sRAGE and DNAse in patients with advanced pancreatic cancer undergoing chemotherapy. Int J Cancer. 2013;133:2619-2630. [PubMed] [DOI] |
| 16. | Kang R, Tang D. Autophagy in pancreatic cancer pathogenesis and treatment. Am J Cancer Res. 2012;2:383-396. [PubMed] |
| 17. | Chung HW, Lim JB, Jang S, Lee KJ, Park KH, Song SY. Serum high mobility group box-1 is a powerful diagnostic and prognostic biomarker for pancreatic ductal adenocarcinoma. Cancer Sci. 2012;103:1714-1721. [PubMed] [DOI] |
| 18. | Takeuchi T, Sakazume K, Tonooka A, Zaitsu M, Takeshima Y, Mikami K, Uekusa T. Cytosolic HMGB1 expression in human renal clear cell cancer indicates higher pathological T classifications and tumor grades. Urol J. 2013;10:960-965. [PubMed] |
| 19. | Gnanasekar M, Kalyanasundaram R, Zheng G, Chen A, Bosland MC, Kajdacsy-Balla A. HMGB1: A Promising Therapeutic Target for Prostate Cancer. Prostate Cancer. 2013;2013:157103. [PubMed] [DOI] |
| 20. | Yao X, Zhao G, Yang H, Hong X, Bie L, Liu G. Overexpression of high-mobility group box 1 correlates with tumor progression and poor prognosis in human colorectal carcinoma. J Cancer Res Clin Oncol. 2010;136:677-684. [PubMed] [DOI] |
| 21. | Lee H, Park M, Shin N, Kim G, Kim YG, Shin JS, Kim H. High mobility group box-1 is phosphorylated by protein kinase C zeta and secreted in colon cancer cells. Biochem Biophys Res Commun. 2012;424:321-326. [PubMed] [DOI] |
| 22. | Lee H, Song M, Shin N, Shin CH, Min BS, Kim HS, Yoo JS, Kim H. Diagnostic significance of serum HMGB1 in colorectal carcinomas. PLoS One. 2012;7:e34318. [PubMed] [DOI] |
| 23. | Akaike H, Kono K, Sugai H, Takahashi A, Mimura K, Kawaguchi Y, Fujii H. Expression of high mobility group box chromosomal protein-1 (HMGB-1) in gastric cancer. Anticancer Res. 2007;27:449-457. [PubMed] |
| 24. | Bao G, Qiao Q, Zhao H, He X. Prognostic value of HMGB1 overexpression in resectable gastric adenocarcinomas. World J Surg Oncol. 2010;8:52. [PubMed] [DOI] |
| 25. | Chung HW, Lee SG, Kim H, Hong DJ, Chung JB, Stroncek D, Lim JB. Serum high mobility group box-1 (HMGB1) is closely associated with the clinical and pathologic features of gastric cancer. J Transl Med. 2009;7:38. [PubMed] [DOI] |
| 26. | Akira S, Uematsu S, Takeuchi O. Pathogen recognition and innate immunity. Cell. 2006;124:783-801. [PubMed] [DOI] |
| 27. | Rakoff-Nahoum S, Medzhitov R. Toll-like receptors and cancer. Nat Rev Cancer. 2009;9:57-63. [PubMed] [DOI] |
| 28. | Kuper H, Adami HO, Trichopoulos D. Infections as a major preventable cause of human cancer. J Intern Med. 2000;248:171-183. [PubMed] |
| 29. | Lee CH, Wu CL, Shiau AL. Toll-like receptor 4 signaling promotes tumor growth. J Immunother. 2010;33:73-82. [PubMed] [DOI] |
| 30. | Bauer AK, Dixon D, DeGraff LM, Cho HY, Walker CR, Malkinson AM, Kleeberger SR. Toll-like receptor 4 in butylated hydroxytoluene-induced mouse pulmonary inflammation and tumorigenesis. J Natl Cancer Inst. 2005;97:1778-1781. [PubMed] [DOI] |
| 31. | Nahid MA, Satoh M, Chan EK. MicroRNA in TLR signaling and endotoxin tolerance. Cell Mol Immunol. 2011;8:388-403. [PubMed] [DOI] |
| 32. | Albini A, Sporn MB. The tumour microenvironment as a target for chemoprevention. Nat Rev Cancer. 2007;7:139-147. [PubMed] [DOI] |
| 33. | Santini D, Angeletti S, Ruzzo A, Dicuonzo G, Galluzzo S, Vincenzi B, Calvieri A, Pizzagalli F, Graziano N, Ferraro E. Toll-like receptor 4 Asp299Gly and Thr399Ile polymorphisms in gastric cancer of intestinal and diffuse histotypes. Clin Exp Immunol. 2008;154:360-364. [PubMed] [DOI] |
| 34. | Pimentel-Nunes P, Teixeira AL, Pereira C, Gomes M, Brandão C, Rodrigues C, Gonçalves N, Boal-Carvalho I, Roncon-Albuquerque R, Moreira-Dias L. Functional polymorphisms of Toll-like receptors 2 and 4 alter the risk for colorectal carcinoma in Europeans. Dig Liver Dis. 2013;45:63-69. [PubMed] [DOI] |