修回日期: 2016-07-11
接受日期: 2016-07-19
在线出版日期: 2016-08-08
目的: 探讨大肠息肉切除术后复发的相关高危因素.
方法: 回顾性分析2012-01/2015-12于上海市普陀区中心医院行2次以上大肠息肉切除术的患者, 探讨大肠息肉内镜下治疗后复发的相关高危因素.
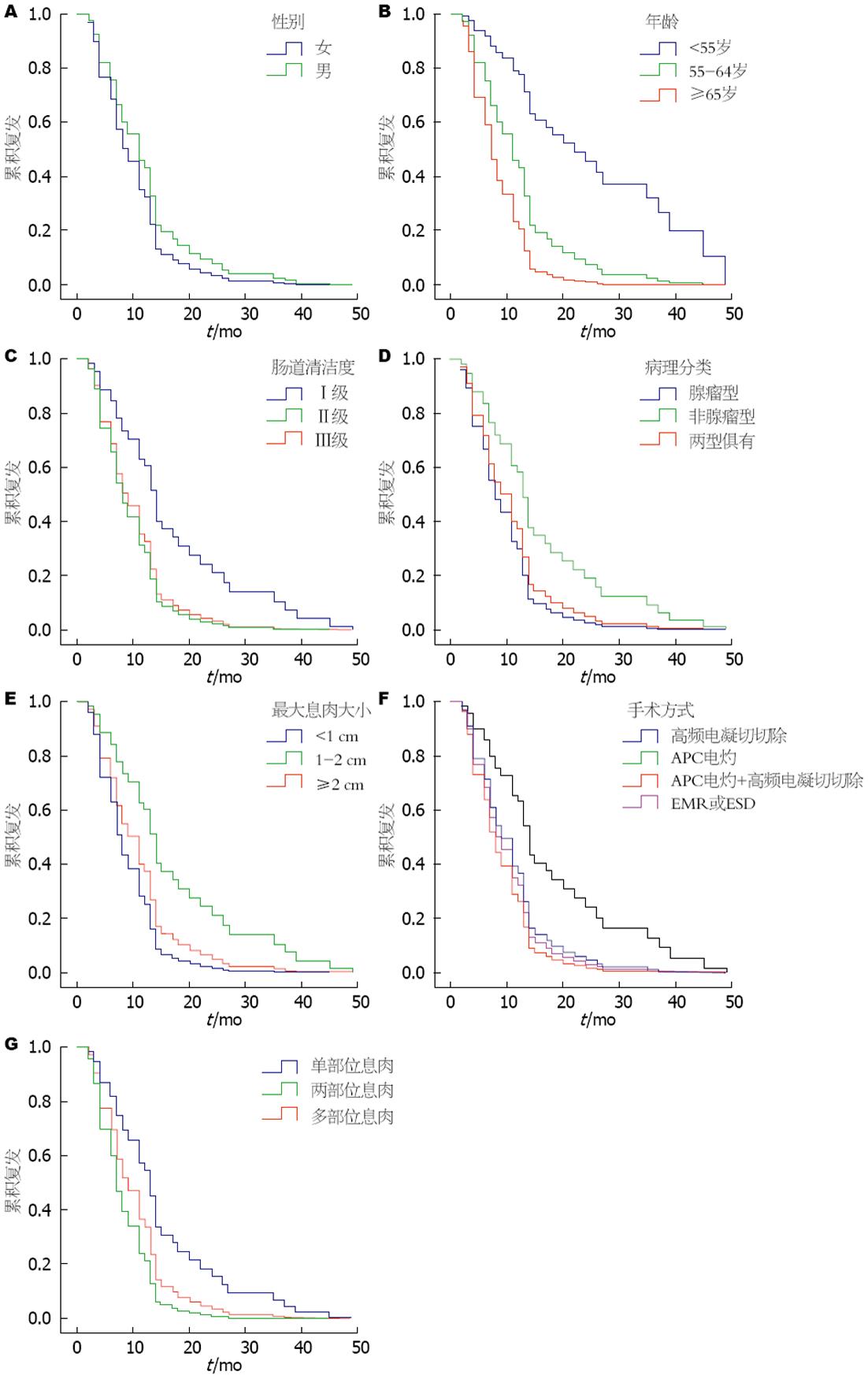
结果: 2012-01/2015-12上海市普陀区中心医院行2次以上内镜下大肠息肉切除术的患者总共54例. 在单因素分析中, 男性大肠息肉患者术后复发率高于女性; 随着年龄的增长, 大肠息肉的复发率也逐渐增高; 肠道清洁度越高, 越不易复发; 腺瘤性较非腺瘤性息肉更易复发; <1 cm的息肉最易复发, 1-2 cm的息肉最不易复发; 氩离子凝固术(argon plasma coagulabor, APC)电灼术后的大肠息肉最不易复发, APC电灼+高频电凝切除术后的大肠息肉最易复发; 多发息肉较单发息肉更易复发. 在多因素分析中仅有年龄是大肠息肉术后复发的独立危险因素.
结论: 年龄、性别、息肉个数、息肉病理类型、肠道清洁度均是大肠息肉切除术后复发的高危因素, 而肠道准备不充分、息肉较小则会增加漏诊率, 大肠息肉手术方式由于样本量较小则不能完全阐明其是否为大肠息肉切除术后复发的高危因素.
核心提示: 大肠息肉目前最常见的治疗方式就是内镜下治疗, 但是其术后复发率较高. 本文回顾性分析2012-01/2015-12于上海市普陀区中心医院行2次以上大肠息肉切除术患者的临床资料, 探讨大肠息肉内镜下治疗后复发的相关高危因素, 以期对大肠息肉患者的随访观察提供依据, 为消化及内镜医生的临床工作提供指导.
引文著录: 蒋元烨, 田继云, 曹勤. 大肠息肉切除术后复发的相关高危因素. 世界华人消化杂志 2016; 24(22): 3433-3438
Revised: July 11, 2016
Accepted: July 19, 2016
Published online: August 8, 2016
AIM: To investigate the high risk factors for recurrence after resection of colorectal polyps.
METHODS: A retrospective analysis was performed of patients who underwent endoscopic resection of colorectal polyps more than twice from January 2012 to December 2015 at Shanghai Putuo District Central Hospital to identify the high risk factors for recurrence.
RESULTS: A total of 54 patients was included. Univariate analysis showed that male gender, old age, low intestinal cleaning degree, adenomatous polyps, polyps < 1 cm, APC electric cauterization combined with high frequency electrocoagulation, and multiple polyps were risk factors for postoperative recurrence of colorectal polyps. Multivariate analysis showed that only age was an independent risk factor for postoperative recurrence of colorectal polyps.
CONCLUSION: Age, gender, polyp number, polyp pathology, and intestinal cleanliness are risk factors for postoperative recurrence of colorectal polyps. Insufficient bowel preparation and smaller polyps will increase the rate of missed diagnosis and increase the risk of postoperative recurrence.
- Citation: Jiang YY, Tian JY, Cao Q. High risk factors for recurrence after resection of colorectal polyps. Shijie Huaren Xiaohua Zazhi 2016; 24(22): 3433-3438
- URL: https://www.wjgnet.com/1009-3079/full/v24/i22/3433.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i22.3433
大肠息肉是指从大肠黏膜表面突起到肠腔的隆起状赘生物, 是结肠发病率最高的良性肿瘤. 大肠息肉最普遍的治疗方式即内镜下息肉摘除术, 随着镜下治疗技术的不断发展, 内镜下治疗结肠息肉的方法也越来越多, 氩离子凝固术(argon plasma coagulabor, APC)、内镜下黏膜剥离术(endoscopic submucosal dissection, ESD)、内镜下黏膜切除术(endoscopic mucosal resection, EMR)等技术的应用, 使得大肠息肉及部分早期病变在内镜下可得到根除, 避免了外科手术, 具有创伤小、安全可靠的特点. 但切除后的息肉复发率较高, 且仍具有恶变的危险. 目前国内外对大肠息肉复发的定义存在一定争议, 现在临床上所指的复发多系大肠息肉患者行内镜下切除或治疗后并明确上一次息肉切除术时已经将所有息肉切除, 其后再次行肠镜检查发现大肠息肉. 国外研究报道, 直肠腺瘤摘除后3-5年内的复发率在20%-50%[1,2]. 国内有研究[3]报道, 1年内累计复发率为38.1%, 2年内累计复发率为78.2%. 结肠息肉术后1年、3年具有恶变倾向的息肉发病率为2.5%、31.0%[4], Rosa等[5]研究发现首次内镜下腺瘤切除术后第8年腺瘤复发率达到高峰, 而继续随访发现此后复发率逐年降低. 国内关于腺瘤性息肉复发的大规模研究较少, 国内一项多中心研究[6]发现, 腺瘤切除后复发高峰主要集中在第1年, 第1年的随访特别重要, 这与国外的研究结果有差异.
随着大肠息肉术后复发患者的发病率不断增加, 了解其复发的高危因素, 对于防治大肠息肉复发具有重要意义. 以往研究发现大肠息肉复发相关因素复杂, 且目前国内外对大肠息肉复发相关高危因素并没有统一认识, 本研究回顾性分析了上海中医药大学附属普陀医院2012-01/2015-12 4年期间共计54例大肠息肉内镜下切除术后复发患者的临床资料, 以进一步了解大肠息肉术后复发相关高危因素, 现报道如下.
2012-01/2015-12于上海中医药大学附属普陀医院住院部行2次以上大肠息肉内镜下切除术的所有患者共计54例. 病例诊断标准: 大肠息肉患者行内镜下切除或治疗后并明确上一次息肉切除术时已经将所有息肉切除, 其后再次行肠镜检查发现大肠息肉者. 病例纳入标准: (1)术前肠镜明确诊断为大肠息肉并行内镜下切除或治疗, 术前患者肠道准备充分, 由经验丰富的副高以上职称的内镜医生仔细操作, 确保无遗漏; (2)每次肠镜检查均为全结肠检查且临床资料完整; (3)初次行大肠息肉切除或治疗后复查肠镜再次发现大肠息肉者. 病例剔除标准: (1)病史资料不全者; (2)合并血液系统疾病、恶性肿瘤等疾病者; (3)年龄<18岁; (4)家族性息肉病; (5)炎症性肠病如溃疡性结肠炎(ulcerative colortis, UC)、克罗恩病(Crohn's disease, CD); (6)初次行大肠息肉切除或治疗后未再复查肠镜者. 本研究符合医学伦理学标准, 并经医院伦理委员会批准, 所有治疗和检查均获得过患者或家属的知情同意.
结肠镜为OLMPUS CF-H260AI系列, 高频电切器为ERBE系列. 首次常规行全结肠镜检查时, 若发现息肉则需明确息肉所在部位、数目及基底部特征, 测量息肉最大直径, 钳取息肉组织行病理检查明确息肉性质, 待性质明确后需再次行肠镜完成高频电凝切除术. 切除的息肉组织需再次送病理确认诊断, 当2次病理结果有差别时, 以切除后的组织结果为准. 大部分有蒂腺瘤可一次完整切除, 亚蒂、无蒂或直径较大的腺瘤则需多次分块切除, 电切术后确保切除完全, 切缘无残留.
统计学处理 采用统计学软件SPSS19.0行统计分析, 对检测人群各项参数指标进行描述分析, 进行正态检验及方差齐性检验, 非正态分布变量取自然对数正态化后进行分析; 计量资料符合正态分布的用mean±SD表示, 正态数据组间比较采用独立样本t检验; 单因素和多因素分析采用COX比例分析复发模型; 统计结果以P<0.05表示差异具有统计学意义.
其中性别: 男性31例(57.41%), 女23例(42.59%), 患者平均年龄62.39岁(47-76岁);平均间隔时间: 12.63 mo; 手术史: 有胆囊切除手术史4例, 结肠癌手术史2例; 合并症: 合并有高血压病24例、2型糖尿病8例、幽门螺旋杆菌(Helicobacter pylori, H. pylori)感染5例, 其他疾病32例; 肠道清洁度: Ⅰ级23例, Ⅱ级66例, Ⅲ级22例; 息肉形态: 亚蒂息肉9例, 长蒂息肉5例, 其他均为广基息肉; 息肉病理: 管状腺瘤33例, 管状绒毛状腺瘤32例, 低级别上皮内瘤变39例, 不典型增生轻度4例, 不典型增生中度4例, 炎性增生16例, 息肉样增生22例, 高级别内皮瘤变1例. 手术方式: 摘除6例, APC治疗16例, 电凝切除术7例, APC+电凝切除术13例, EMR+ESD2例; 息肉大小: <1 cm息肉140个, 1-2 cm息肉14个, >2 cm息肉2个; 住院次数: 2次入院患者42例, 3次入院患者9例, 4次入院患者2例, 5次入院患者1例. 单发息肉10例, 多发息肉44例.
从表1我们可以得出结论, 在大肠息肉切除术后复发相关高危因素的多因素分析中, 只有年龄是独立危险因素P<0.01, 差异具有统计学意义.
| 属性 | RR值 | 95%CI | P值 |
| 性别 | 1.341 | 0.597-3.013 | 0.477 |
| 年龄<55岁 | 0.162 | 0.046-0.568 | 0.005 |
| 年龄55-64岁 | 0.536 | 0.239-1.201 | 0.130 |
| 肠道清洁度Ⅰ级1 | 0.448 | 0.128-1.571 | 0.210 |
| 肠道清洁度Ⅱ级1 | 1.117 | 0.399-3.129 | 0.833 |
| 高频电凝切除2 | 0.885 | 0.138-5.674 | 0.898 |
| APC电灼2 | 0.406 | 0.061-2.684 | 0.349 |
| APC电灼+高频电凝切除2 | 1.178 | 0.167-8.321 | 0.870 |
| 息肉个数 | 0.986 | 0.833-1.167 | 0.868 |
| 息肉(<1 cm)3 | 1.391 | 0.302-6.405 | 0.672 |
| 息肉(1-2 cm)3 | 0.510 | 0.119-2.186 | 0.364 |
| 腺瘤4 | 1.218 | 0.410-3.148 | 0.684 |
| 非腺瘤4 | 0.545 | 0.162-1.831 | 0.326 |
| 单部位息肉5 | 0.554 | 0.146-2.108 | 0.386 |
| 两部位息肉5 | 1.424 | 0.392-5.182 | 0.591 |
从图1A我们可以得出结论, 男性大肠息肉患者术后复发率高于女性, 这与文献报道是符合的. 随着年龄的增长, 大肠息肉的复发率也逐渐增高, 这与文献报道也是符合的(图1B). 肠道清洁度越高, 越不易复发, 这可能与大肠息肉诊治疗过程中存在一定程度的漏诊率相关, 近几年大量的国外文献报道结肠镜检查时漏诊的息肉约为12%-47%[7,8]. 肠道准备越不充分, 所谓的再发则越有可能是上次手术时的漏诊(图1C). 腺瘤性较非腺瘤性息肉更易复发, 这与文献报道也是符合的(图1D). <1 cm的息肉最易复发, 1-2 cm的息肉最不易复发, 这可能也与大肠息肉诊过程中存在一定程度的漏诊率相关, van Rijn等[9]通过6项研究共465例患者的Meta分析发现息肉的总体漏诊率为22%, 对于直径≥10 mm的腺瘤性息肉, 漏诊率约为2.1%, 5-10 mm的腺瘤漏诊率可达到13%, 当腺瘤的直径≤5 mm时, 漏诊的息肉可达到26%(图1E). APC电灼术后的大肠息肉最不易复发, APC电灼+高频电凝切除术后的大肠息肉最易复发. 这可能与EMR或ESD样本量较少, 只有2例有关. 所以并不能完全阐明手术方式是否为大肠息肉切除术后复发的高危因素(图1F). 单发息肉最不易复发, 同时有多个息肉者较易复发, 这与文献报道也是符合的(图1G).
大肠息肉尤其是大肠腺瘤性息肉是目前结直肠癌(colorectal cancer, CRC)公认的癌前病变. 其发展过程大致经过增生性腺瘤-管状腺瘤-绒毛状腺瘤-早期癌-浸润癌这一途径. 80%的大肠癌被认为由腺瘤样息肉衍变而来, 内镜检查及早发现腺瘤并给予相应处理可切断由腺瘤向癌发展的序贯过程, 可使大肠癌发生的风险降低76%-90%[10,11]. 本文回顾性分析了2012-01/2015-12 4年期间上海中医药大学附属普陀医院消化内科住院患者中共有54例大肠息肉切除术后再次复发的患者, 从以上数据中我们可以得出年龄、性别、息肉个数、息肉病理类型、肠道清洁度均是大肠息肉切除术后复发的高危因素, 这些都是与既往的文献报道相符合. 而肠道准备不充分、息肉较小则会增加漏诊率, 因此, 充分的肠道准备可通过降低漏诊率而降低息肉恶化风险. 由于样本量较少, 所以并不能完全阐明手术方式是否为大肠息肉切除术后复发的高危因素. 另有Huang等[12]研究发现阿托伐他汀通过甲羟戊酸和异戊二烯化通路能诱导体外细胞凋亡. 阿托伐他汀虽然不能有效的防止小鼠模型息肉形成, 但能有效地减缓裸鼠模型肿瘤的生长, 降低的肿瘤的生长可以说明增加的细胞凋亡. 部分研究发现结直肠腺瘤患者的肠道黏膜处于持续性慢性炎症状态, 故非甾体类抗炎药的应用可能在预防患者术后复发中发挥一定的作用[13], 而本研究中患者资料中并未详细统计分析是否有服用阿司匹林、阿托伐他汀等特殊药物及其他保健品史, 因此无法做出相关分析. 既往有许多研究将胆囊疾病史尤其是有胆囊切除史作为大肠息肉发生的危险因素, 国外曾有学者对胆系疾病与大肠息肉进行荟萃分析报道[14], 42543例结肠腺瘤患者中, 28281例患者中有胆系疾病或曾行胆囊切除术, 而在本研究中, 有胆囊切除手术史者仅4例, 样本量太少, 故未进行单独分析. 目前也有研究认为H. pylori感染与大肠息肉的发生具有相关性, Selgrad等[15]研究发现, 大肠息肉患病率在H. pylori感染组占63.4%, 而且H. pylori感染多发生在增生性息肉和低级别上皮内瘤变腺瘤患者中, H. pylori是大肠肿瘤发展的危险因素[15,16], 而在本研究中, 合并H. pylori感染者仅5例, 样本量太少, 故也未进行单独分析. 因此, 多中心大样本量的临床资料的统计, 对于我们进一步明确国人大肠息肉切除术后复发的高危因素, 从而可以更好的开展针对性的治疗预防随访策略具有重要意义.
大肠息肉, 尤其是大肠腺瘤性息肉被认为是结直肠癌的癌前病变. 随着内镜治疗技术的不断发展, 内镜下治疗结肠息肉的方法越来越多, 但大肠息肉术后复发的发病率也在不断增加, 且目前国内外对大肠息肉复发相关高危因素并没有统一认识, 了解其复发相关高危因素, 对于防治大肠息肉复发具有重要意义.
陈光, 教授, 吉林大学第一医院消化器官外科; 邱成志, 教授, 主任医师, 福建医科大学附属第二医院普外科
目前国内外对大肠息肉复发相关高危因素并没有统一认识, 也尚无统一的息肉术后随访策略, 如何才能确定更加符合国内人群的随访指南, 制定个体化随访策略及方案, 是国内学者需要面对的一项重大任务.
大肠息肉的复发过程复杂, 受到多种因素的影响, 目前关于复发的原因及机制尚不十分明确, 据文献报道, 大肠息肉复发可能与地理位置、生活习惯、饮食因素、性别、年龄、吸烟、饮酒、幽门螺旋杆菌(Helicobacter pylori, H. pylori)感染、遗传因素等有关.
大肠息肉切除术后复发率较高, 且仍具有恶变的危险. 本文对大肠息肉切除术后复发相关高危因素进行了回顾性分析, 对临床工作具有一定的指导意义.
复发性大肠息肉: 目前国内外对大肠息肉复发的定义存在一定争议, 现在临床上所指的复发多系大肠息肉患者行内镜下切除或治疗后并明确上一次息肉切除术时已经将所有息肉切除, 其后再次行肠镜检查发现大肠息肉.
本文资料详实, 论述充分, 可读性较好, 有一定的临床使用价值.
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 上海市
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): 0
D级 (一般): 0
E级 (差): 0
编辑: 于明茜 电编:闫晋利
| 1. | Massari LP, Kastelan M, Gruber F. Epidermal malignant tumors: pathogenesis, influence of UV light and apoptosis. Coll Antropol. 2007;31 Suppl 1:83-85. [PubMed] |
| 2. | Martínez ME, Baron JA, Lieberman DA, Schatzkin A, Lanza E, Winawer SJ, Zauber AG, Jiang R, Ahnen DJ, Bond JH. A pooled analysis of advanced colorectal neoplasia diagnoses after colonoscopic polypectomy. Gastroenterology. 2009;136:832-841. [PubMed] [DOI] |
| 4. | Kim JB, Han DS, Lee HL, Kim JP, Jeon YC, Sohn JH, Hahm JS. [The recurrence rate of colon polyp after polypectomy and the interval of surveillance colonoscopy: predictors of early development of advanced polyp]. Korean J Gastroenterol. 2004;44:77-83. [PubMed] |
| 5. | Rosa I, Fidalgo P, Soares J, Vinga S, Oliveira C, Silva JP, Ferro SM, Chaves P, Oliveira AG, Leitão CN. Adenoma incidence decreases under the effect of polypectomy. World J Gastroenterol. 2012;18:1243-1248. [PubMed] [DOI] |
| 6. | Gao QY, Chen HM, Sheng JQ, Zheng P, Yu CG, Jiang B, Fang JY. The first year follow-up after colorectal adenoma polypectomy is important: a multiple-center study in symptomatic hospital-based individuals in China. Front Med China. 2010;4:436-442. [PubMed] [DOI] |
| 7. | Heresbach D, Barrioz T, Lapalus MG, Coumaros D, Bauret P, Potier P, Sautereau D, Boustière C, Grimaud JC, Barthélémy C. Miss rate for colorectal neoplastic polyps: a prospective multicenter study of back-to-back video colonoscopies. Endoscopy. 2008;40:284-290. [PubMed] [DOI] |
| 8. | Kaltenbach T, Friedland S, Soetikno R. A randomised tandem colonoscopy trial of narrow band imaging versus white light examination to compare neoplasia miss rates. Gut. 2008;57:1406-1412. [PubMed] [DOI] |
| 9. | van Rijn JC, Reitsma JB, Stoker J, Bossuyt PM, van Deventer SJ, Dekker E. Polyp miss rate determined by tandem colonoscopy: a systematic review. Am J Gastroenterol. 2006;101:343-350. [PubMed] [DOI] |
| 10. | Winawer SJ, St John DJ, Bond JH, Rozen P, Burt RW, Waye JD, Kronborg O, O'Brien MJ, Bishop DT, Kurtz RC. Prevention of colorectal cancer: guidelines based on new data. WHO Collaborating Center for the Prevention of Colorectal Cancer. Bull World Health Organ. 1995;73:7-10. [PubMed] |
| 11. | Cappell MS. Reducing the incidence and mortality of colon cancer: mass screening and colonoscopic polypectomy. Gastroenterol Clin North Am. 2008;37:129-160, vii-viii. [PubMed] [DOI] |
| 12. | Huang EH, Johnson LA, Eaton K, Hynes MJ, Carpentino JE, Higgins PD. Atorvastatin induces apoptosis in vitro and slows growth of tumor xenografts but not polyp formation in MIN mice. Dig Dis Sci. 2010;55:3086-3094. [PubMed] [DOI] |
| 14. | Chiong C, Cox MR, Eslick GD. Gallstones are associated with colonic adenoma: a meta-analysis. World J Surg. 2012;36:2202-2209. [PubMed] [DOI] |
| 15. | Selgrad M, Bornschein J, Kandulski A, Hille C, Weigt J, Roessner A, Wex T, Malfertheiner P. Helicobacter pylori but not gastrin is associated with the development of colonic neoplasms. Int J Cancer. 2014;135:1127-1131. [PubMed] [DOI] |
| 16. | Sonnenberg A, Genta RM. Helicobacter pylori is a risk factor for colonic neoplasms. Am J Gastroenterol. 2013;108:208-215. [PubMed] [DOI] |