修回日期: 2016-07-11
接受日期: 2016-07-19
在线出版日期: 2016-08-08
目的: 本文在于探讨五味子通过促进内源性干细胞增殖治疗肝硬化的机制.
方法: 通过CCl4复制大鼠肝硬化模型成功后, 将大鼠随机分成实验组(小剂量组A1、中剂量组A2和大剂量组A3)、空白组C及模型组M, 小剂量组给予五味子1.0 mg/200 g, 中剂量组给予1.5 mg/200 g, 大剂量给予2.0 mg/200 g. 观察五味子对肝硬化大鼠肝脏组织病理学、肝功[谷草转氨酶(aspartate transaminase, AST)、谷丙转氨酶(alanine transaminase, ALT)和白蛋白(albnmin, ALB)]、肝纤维化的影响以及通过免疫荧光法和免疫组织化学法观察五味子对Brdu标记的内源性干细胞的增殖情况及CK-18、ALB及甲胎蛋白(α-fetoprotein, AFP)三种蛋白的表达情况.
结果: 通过病理切片HE染色及Masson染色, 治疗组的肝硬化大鼠肝细胞变性坏死及肝纤维化程度有一定的改善, 各治疗组的肝纤维化评分各异(P<0.05), 与模型组相比, 中剂量组的肝纤维化评分改善最明显(P<0.01), 在免疫组织化学中, 发现各治疗组ALB、CK-18及AFP的蛋白表达不同(P<0.05), 用Brdu标记肝脏处于分裂间期的干细胞, 通过"区域共存"观察到各治疗组干细胞的增殖和分裂, 并用免疫荧光法半定量统计发现, 各治疗组中ALB、CK-18及AFP的蛋白表达不同(P<0.01), 中剂量组表达最显著(P<0.01), 在从眼球采血评估肝硬化大鼠肝功能中, 各治疗组的肝功能均有一定程度的改善(P<0.05), 与对照组相比, 中剂量组的AST、ALT明显下降, ALB明显改善(P<0.01).
结论: 五味子对损伤的肝脏细胞有保护作用, 并能延缓肝硬化的进展, 机制有可能与五味子通过促进内源性干细胞增殖防治肝硬化有关.
核心提示: 本实验主要说明五味子对CCl4损伤的肝脏细胞有修复作用, 并能改善肝硬化的进展, 并通过免疫组织化学和免疫荧光法, 用Brdu进行标记, 证明机制可能与五味子能通过促进内源干细胞增殖以此防治肝硬化有关.
引文著录: 阮梦婷, 金世柱, 刘自帅, 张菲菲, 张春伟, 韩明子. 五味子通过促进内源性干细胞增殖对肝硬化治疗的作用. 世界华人消化杂志 2016; 24(22): 3373-3380
Revised: July 11, 2016
Accepted: July 19, 2016
Published online: August 8, 2016
AIM: To investigate the mechanism for Wuweizi to treat liver cirrhosis.
METHODS: A rat model of liver cirrhosis was developed with CCl4. Rats were randomly divided into five groups: three treatment groups [small dose Wuweizi group (A1), middle dose group (A2) and high dose group (A3)], a blank group (C) and a model group (M). Except group C, liver cirrhosis was induced in all other groups. Groups A1, A2 and A3 were given 1.0, 1.5 and 2.0 mg/200 g Wuweizi, respectively. After treatment, histopathology, liver function [aspartate transaminase (AST), alanine transaminase (ALT) and albumin (ALB)], hepatic fibrosis, stem cell proliferation, and the expression ofCK-18, ALB and α-fetoprotein (AFP) were assessed.
RESULTS: In the treatment groups, there was an improvement in the degree of hepatic fibrosis and the condition of liver cell degeneration and necrosis, as revealed by HE staining and Masson staining, and the liver fibrosis scores were different among each treatment group (P < 0.05). Compared with group M, the liver fibrosis score of group A2 was improved most obviously (P < 0.01). Immunohistochemistry analysis showed that the expression of CK-18, ALB and AFP was different between each treatment group (P < 0.05). By labeling liver tissue stem cells with BrdU, the proliferation and division of stem cells were observed through the method of "regional coexistence". Immunofluorescence analysis revealed that the expression of CK-18, ALB and AFP were different among each treatment group (P < 0.01), with group A2 having the most prominent expression (P < 0.01). Liver function was improved differently in each treatment group (P < 0.05). Compared with group M, AST and ALT were decreased most significantly and ALB increased most obviously in group A2 (P < 0.01).
CONCLUSION: Wuweizi has a protective effect on injured liver cells. Wuweizi could delay the process of liver cirrhosis via mechanisms possibly related to promoting the proliferation of endogenous stem cells.
- Citation: Ruan MT, Jin SZ, Liu ZS, Zhang FF, Zhang CW, Han MZ. Wuweizi protects against liver cirrhosis by promoting endogenous stem cell proliferation. Shijie Huaren Xiaohua Zazhi 2016; 24(22): 3373-3380
- URL: https://www.wjgnet.com/1009-3079/full/v24/i22/3373.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i22.3373
肝硬化是慢性肝病缓慢进展的最后阶段, 目前肝硬化的病理机制并不明确, 在我国肝硬化最常见的病因为病毒性肝炎, 其次为酒精性肝炎. 病理组织变化主要为干细胞坏死、再生结节、肝脏纤维组织增生以及假小叶的形成[1], 目前肝硬化尚无根治办法, 治疗方案多为保肝、防治并发症等支持对症治疗. 而五味子有保肝、抗炎、抗氧化等作用, 临床将其应用于各种病因引起的肝硬化的治疗, 为了更好的探究五味子治疗肝硬化的作用机制, 我们通过CCl4诱导的大鼠肝硬化模型, 探讨五味子通过促进内源性干细胞增殖改善肝硬化进展的机制.
实验动物为SD♂大鼠58只, 8 wk大小, 体质量200 g±20 g, 由哈尔滨医科大学附属第二医院实验动物中心提供. 其中8只用于验证肝硬化模型的制作成功与否, 分为2组(模型组和空白组), 每组4只. 50只大鼠随机分成5组, 分为实验组(小剂量组A1、中剂量组A2和大剂量组A3)、空白组C及模型组M. 药物为北五味子(多糖、三萜和木脂素), 目前认为五味子各个成分中, 木脂素为保肝、抗炎的主要有效成分[2,3], 药物制备[4]: 购买河北承德产北五味子, 加10倍与药材量的850 mL/L乙醇进行提取, 共提取2次, 每次1 h进行过滤, 减压回收乙醇, 浓缩成生药, 但药物未经过鉴定成分、量及浓度, CCl4(西陇化工股份有限公司), 纯橄榄油(国药集团化学试剂有限公司). 主要实验仪器有激光共聚焦显微镜、光学显微镜、石蜡自动包埋脱水机、连续切片机、电子称等.
1.2.1 肝硬化模型制作及处理: 44只SD大鼠用CCl4腹腔注射制作肝硬化模型. 将50%的CCl4溶解于纯橄榄油中, 5 mL/kg体质量每隔3 d进行腹腔注射, 连续12 wk. 取4只CCl4处理过的SD大鼠, 用麻醉药物(戊巴比妥50 mg/kg)腹腔注射处死, 并取其肝脏组织进行切片处理后(HE及Masson染色)在镜下观察进行验证. 余下的40只SD大鼠随机分为4组, 分别为模型组、小剂量组、中剂量组和大剂量组, 还有10只未用CCl4处理的大鼠设为空白组. 每组10只. 小剂量组给予1.0 mg/200 g, 中剂量组给予1.5 mg/200 g, 大剂量给予2.0 mg/200 g. 分别连续灌胃治疗4 wk, 在治疗期间观察大鼠的状态(包括大鼠的生命体征、活动度、意识状态及全身情况等), 在第4周末分别取大鼠眼球血评估大鼠肝功以及通过HE染色和Masson染色进行肝纤维化评分[5,6], 并在治疗结束前4 d, 腹腔注射5-溴脱氧尿嘧啶核苷(5-bromodeoxyuridine, Brdu)以此标记增殖的细胞, 在第28天取其肝脏组织切片处理后, 用免疫荧光法及免疫组织化学法观察增殖的干细胞以评估五味子治疗肝硬化的成效.
1.2.2 肝功能检测: 在灌肠治疗第4周末, 分别取大鼠眼球血对各剂量组治疗后的肝功能进行比较.
1.2.3 HE染色、Masson染色及肝纤维化评分: HE染色是在治疗第4周末, 取各组大鼠肝脏切片, 将石蜡打蜡的肝组织切片进行处理脱蜡脱水后, 用苏木素染色5 min冲洗, 再用伊红染色3 min后冲洗, 并用中性树脂裱上; Masson染色用于显示组织中纤维, 在治疗第4周末, 取大鼠肝脏切片, 石蜡切片脱蜡至水, 用蒸馏水冲洗, 用Regaud苏木精染液染核10 min, 蒸馏水冲洗后用Masson丽春红酸性复红液10 min, 并用2%的冰醋酸水溶液浸洗后, 用1%的磷钼酸水溶液分化5 min, 直接用苯胺蓝染色5 min, 再以0.2%冰醋酸水溶液洗涤, 最后用950 mL/L乙醇, 无水乙醇, 中性树脂封固. 处理完切片后, 将切片置于光学显微镜下进行观察和对肝脏组织进行肝纤维化评分.
1.2.4 免疫荧光法: 将肝组织切片脱蜡, 在0.3%的多聚甲醛中保存30 min, 消除部分内源性过氧化物酶, 用PBS冲洗3次, 每次5 min, 用pH 6.0的修复液(柠檬酸缓冲液)高压修复抗原, 用微波蒸汽处理2 min, 在98 ℃的水浴中25 min后室温下冷却25 min. 再用PBS冲洗3遍, 每遍5 min. 切片和CK-18、ALB以及AFP一抗在4 ℃条件下过夜, 用PBS冲洗3次, 每次5 min, 加入二抗在室温下避光孵育1 h, PBS冲洗后用甘油封片. 计算阳性细胞的百分比.
1.2.5 免疫组织化学检测: 石蜡切片脱蜡后PBS浸泡5 min, 消除内源性过氧化物酶的活性, 进行抗原修复, 10%的山羊血清室温下封闭10 min, 倾去血清, 加入一抗(CK-18、ALB、AFP), 4 ℃下过夜, PBS冲洗3次, 每次3 min, 滴加适当比例稀释的链霉素抗生物素蛋白溶液37 ℃下孵化30 min, 用PBS冲洗3次, 每次3 min, 并用DAB显色剂显色, 自来水充分冲洗后复染, 脱水并密封切片. 计算染色强度和阳性细胞的百分比, 以及半定量计算每个正方形网格内的标记数目.
统计学处理 实验结果用统计学SPSS19.0软件进行处理分析, 各种数据用mean±SE表示, 两均数比较采用t检验, 样本均数之间采用单因素方差分析, P<0.05为差异有统计学意义.
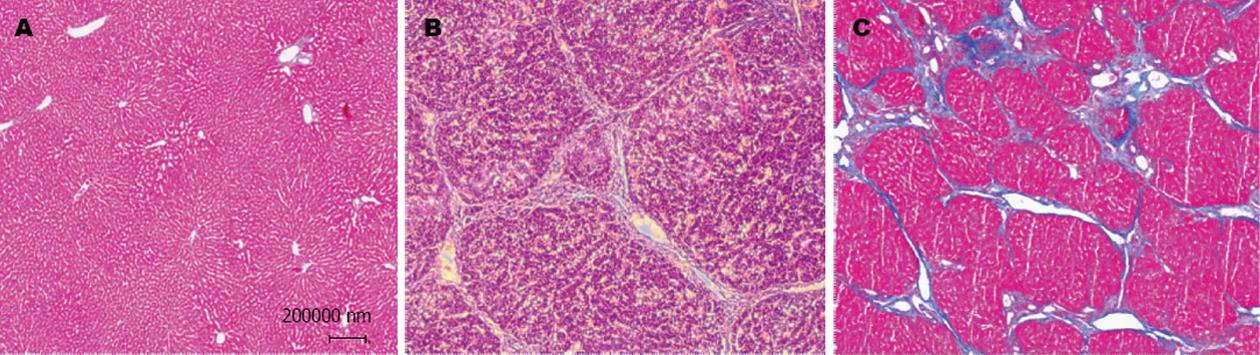
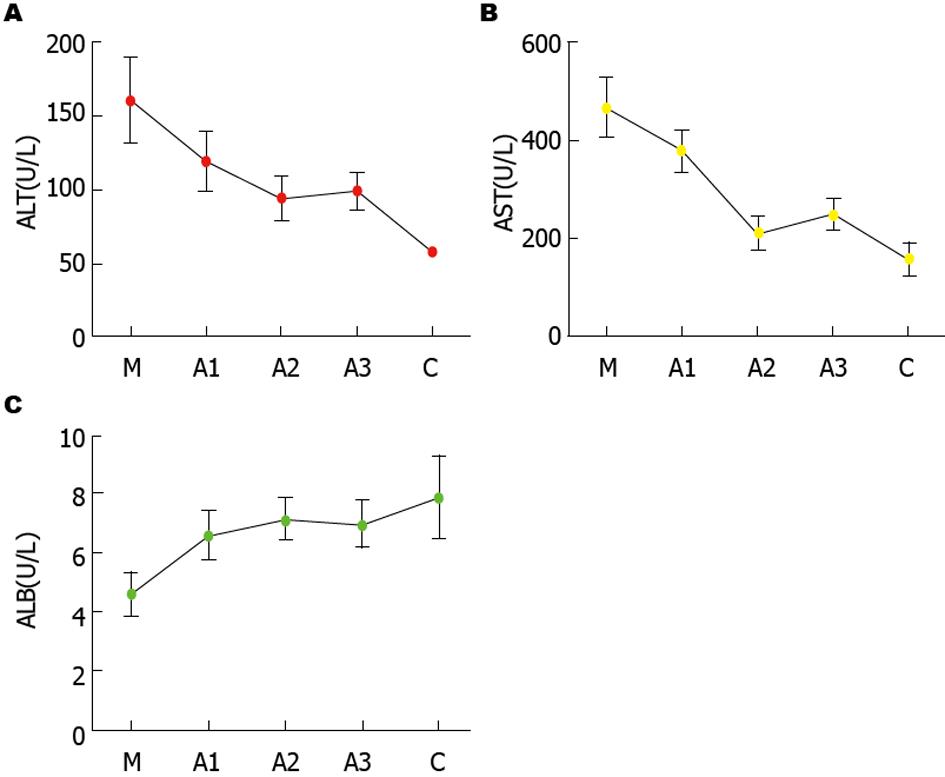
在造模过程中, 观察到模型组大鼠一般状态明显差于空白组, 模型组大鼠毛发枯燥, 食欲不振, 且在第4周开始体重明显下降, 在模型组有一只大鼠状态萎靡, 出现肠胀气, 在第12周末处死4只大鼠, 肉眼观察发现大鼠肝脏变形, 表面凹凸不平, 有一些大小不等的结节. 病理切片(HE及Masson染色)可见广泛肝细胞变性坏死, 有不规则的再生结节(结节状肝细胞团), 可见到假小叶形成, 表明大鼠肝硬化模型造模成功, 且通过眼球采血评估大鼠肝功能变化(主要指标有ALT、AST和ALB), 再次验证造模成功, 与空白组相比, 造模组ALT(167.80 U/L±4.19 U/L vs 42.83 U/L±2.25 U/L; P<0.01)和AST明显升高 (464.60 U/L±8.21 U/L vs 141.80 U/L±6.15 U/L; P<0.01), ALB明显降低(4.00 U/L±0.25 U/L vs 7.35 U/L±0.46 U/L; P<0.01), 如图1所示.
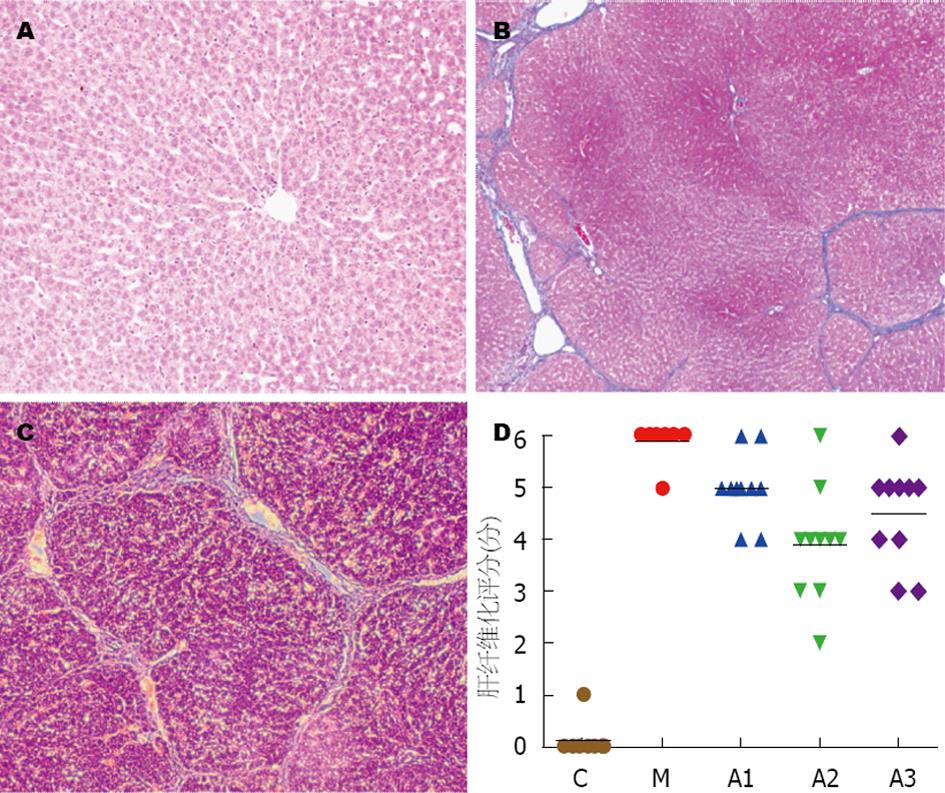
通过HE和Masson染色, 并用光学显微镜观察, 对各组大鼠肝脏切片进行肝纤维化评分(Ishak)肝脏纤维化评分可分为0-6分, 0分为无纤维化, 1-2分为汇管区纤维化, 3-4分为汇管区纤维化并伴有汇管-汇管桥接纤维化和汇管-中央桥接纤维化, 5分为偶有结节, 6分可能或肯定为肝硬化, 如图2, C组为0分, M组基本为6分, 只有一只大鼠未能确定为肝硬化, A1、A2、A3与M组相比肝硬化程度均有一定的改善, A2组最为明显(P<0.01), 肝纤维化评分在4分左右.
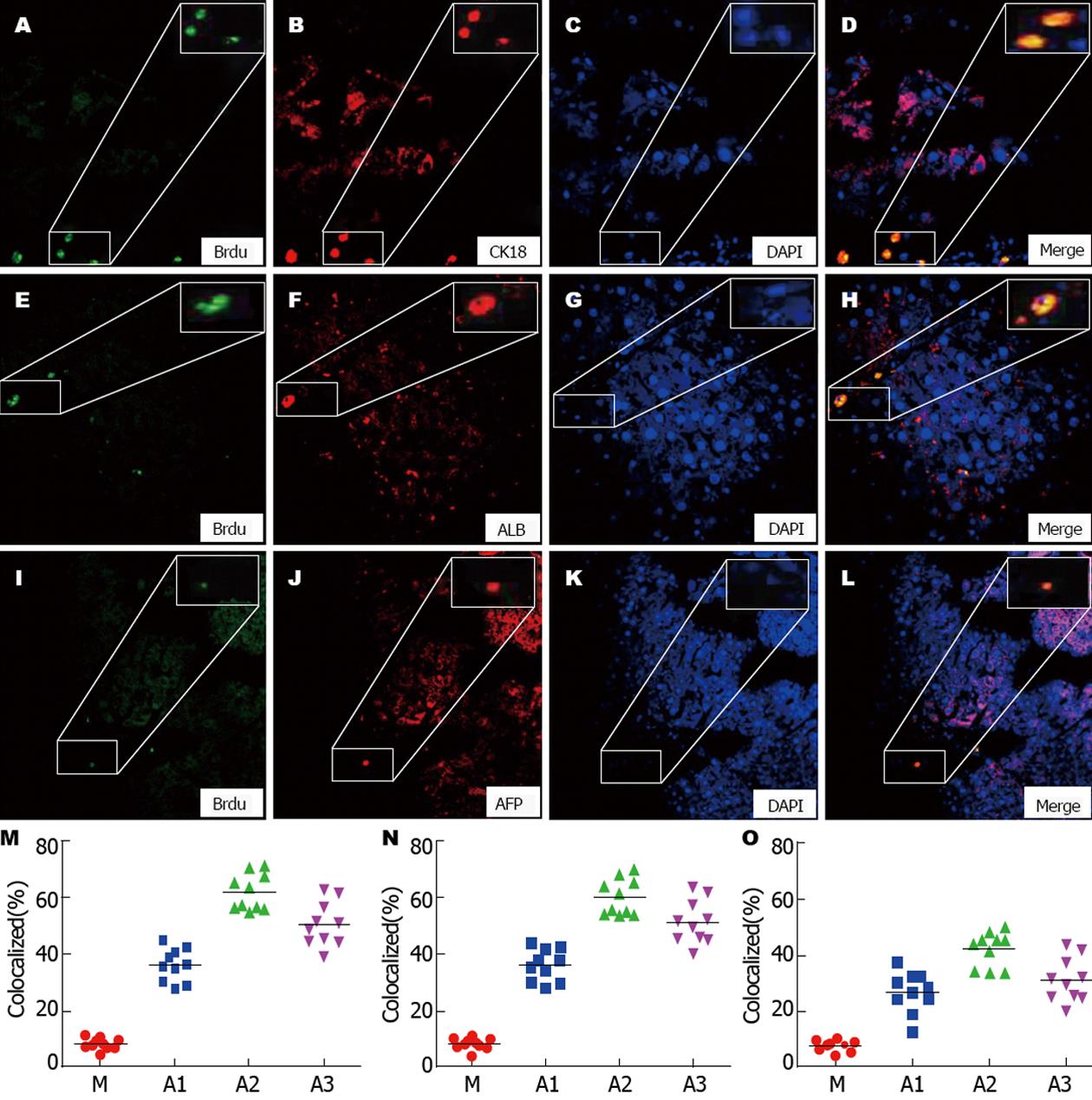
Brdu为胸腺嘧啶的衍生物, 可以在DNA合成期代替胸腺嘧啶, 用其抗体将其染色后判断细胞的增殖情况. 在此实验中, 我们用Brdu标记内源性干细胞, 并选取CK18、ALB及AFP三种蛋白标记肝细胞蛋白的表达, 通过"区域共存"将内源性干细胞增殖定量化, 便于观察及比较. 在治疗后第4周末, M、A1、A2、A3均能检测到Brdu标记的内源性干细胞, 与M组相比, A1、A2、A3组中有较多的染绿细胞, 其中以A2中剂量组最多, 三种蛋白CK18、ALB、AFP在A2组中均有表达(P<0.05), AFP表达量较少, 但三者的表达趋势一致(图3).
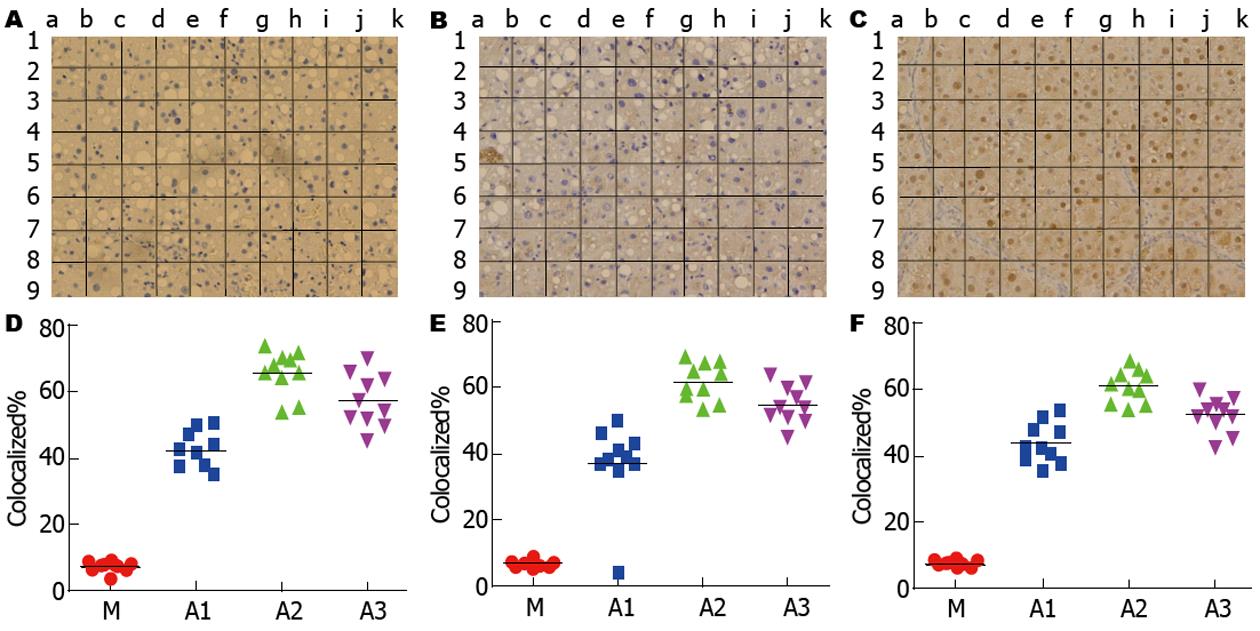
通过免疫组织化学法检测肝组织蛋白的表达, 从实验中, M、A1、A2、A3均有CK18、ALB和AFP的表达, CK18在包膜、包浆及靠近汇管区有表达, 且呈弱阳性(A), ALB在实质细胞中表达(B), AFP在肝硬化肝脏组织中也会有少量的表达(C). 用网格法将染色强度结合阳性细胞百分率进行染色结果半定量分析, 从D、E、F中, 我们看到A1、A2、A3组中蛋白表达均有差异(P<0.05), 治疗组CK18、ALB、AFP表达均高于M组, 且以A2组表达最为显著(图4).
治疗第4周末, 从各组大鼠眼球取血检测肝功能, 各组肝功能(ALT、AST和ALB)结果如图5所示, 与M组相比, A1、A2、A3组肝功指标AST、ALT明显下降(A, B), ALB明显升高(C); 且A2组各项指标较A1、A3组改善明显(P<0.05), 也同时验证了五味子剂量的"屋顶学说", 随着剂量的增加, 治疗效果改善不明显.
肝纤维化是一种肝硬化过程中的病理变化, 各种因素(如病毒、酒精、药物、免疫反应等)作用于肝脏后, 肝细胞变性坏死后长期刺激周边细胞, 从而导致肝组织结构破坏, 若不及时进行控制, 最终将会进展至肝硬化[7]. 在一定条件下, 肝纤维化是可逆的[8], 但是肝硬化是不可恢复的[9], 肝硬化的病因有很多, 在我国最常见的病因还是病毒性肝炎[10], 随着酒精的大量应用, 酒精性肝硬化的发病率也逐年增长[11]. 除了肝脏移植, 我们只能通过一些药物治疗延缓肝硬化的进展. CCl4是较常用的, 较可靠的制作肝硬化模型的药物, 他的作用机制主要通过细胞色素P450分解CCl4, 从而产生CCl4自由基团导致细胞膜氧化后选择性破坏中央区的肝细胞[12]. 该模型常用于药物治疗肝硬化的研究中[13]. 肝硬化在美国和欧洲[14]的发病率排名第九, 且每年有超过35000例死亡[15]. 肝硬化的并发症主要有腹水、肝性脑病[16]、静脉曲张出血、肾功能不全[17]、肝癌等, 而营养不良以及肌萎缩在临床上最常见, 其预后也较差[18].
目前肝硬化的治疗方式主要是对症、支持以及相关并发症的治疗, 尚无根治手段[19,20], 而肝脏移植在时间选择、患者选择、肝脏来源等各个方面也存在较多的条件与禁忌症[21]. 且肝硬化的发生机制复杂, 单一环节干预很难取得理想的疗效, 在此背景下国内外学者将眼光转向了中药[22]. 五味子是一种多年生落叶藤本, 在中国药典中主要分为两种, 其味酸, 甘. 性温. 具有广泛的药理作用, 他的活性成分有多糖、三萜和木脂素, 基础实验中较多提取成乙素、丙素等, 其具有抗炎、保肝、抗氧化、抗肿瘤等作用[2,23-25].也有研究表明五味子成分乙素具有通过其抗氧化途径改善艾尔兹海默病(Alzheimer's disease, AD)的记忆障碍[26]以及镇静、抗衰老的作用[27], 同时五味子也用于糖尿病的治疗, 尚有研究证实五味子可以通过调控GLUT-4从而减轻和预防胰岛素抵抗状态[28]; 另有研究[29]证明, 五味子中的木脂素成分可以有效减轻CCl4对肝脏的作用, 如减轻脂肪变性等, 并且使肝脏下调成脂基因从而减少甘油三酯等的积累等[30].
在此实验中, 我们发现在五味子的治疗干预下, 与对照组相比, 在病理切片中, 通过HE染色和Masson染色, 治疗组的肝细胞变性坏死及炎性细胞浸润数量有所减少, 部分肝组织结构紊乱有一定的改善, 尤其是中剂量组比较明显. 在肝功和肝纤维化程度评价中, 治疗组的肝功治疗ALT、AST明显下降, 同时ALB明显增加, 这表明在五味子的治疗后, 肝硬化大鼠的肝功得到了一定的改善, 从肝纤维化评分中, 治疗组的肝纤维化程度有了一定的改善. 与此同时, 我们用Brdu标记处于分裂间期的细胞, 通过免疫荧光法观察ALT、AFP和ALB蛋白的表达, 从而预估内源性干细胞的增殖情况, 我们发现治疗组中增殖干细胞明显多于对照组, 并且可以分化为肝组织的标志物, 且五味子的疗效不随着剂量增加而加强, 在此实验中, 中剂量的治疗效果最佳. 由此我们可以推测, 五味子对损伤的肝脏细胞有保护作用, 并能改善肝硬化的进展, 这有可能与五味子通过促进内源性干细胞增殖防治肝硬化有关.
肝硬化是全球发病率较高的疾病, 在我国仍以病毒性肝炎为肝硬化首要发病原因, 而肝硬化尚无根治手段, 只能通过支持、对症、治疗并发症等手段, 近几年, 国内外专家将治疗方向转移至中药治疗, 目的在于通过中药的一些药理机制改善和防治肝硬化, 取得较好的治疗效果.
孔德润, 教授, 安徽医科大学第一附属医院消化科; 姜春萌, 教授, 大连医科大学附属第二医院消化科
用5-溴脱氧尿嘧啶核苷(5-bromodeoxyuridine, Brdu)标记处于分裂间期的干细胞, 从而直接观察到五味子对肝硬化的修复作用, 并表明五味子参与促进内源性干细胞增殖这一机制.
五味子是一种临床应用较久, 有具有抗炎、保肝、抗氧化、抗肿瘤等作用, 既往有文献证明五味子可通过减轻CCl4对肝脏的作用, 并使肝脏下调成脂基因从而减少甘油三酯等的积累防治肝硬化等, 但尚无研究证实五味子可通过促进内源性干细胞增殖防治肝硬化.
本文以五味子通过促进内源性干细胞的增殖这一机制为切入口, 用Brdu标记处于分裂间期的干细胞, 通过免疫组织化学和免疫荧光等证明五味子对受损肝组织的修复作用以及对肝硬化进展的延缓作用.
本文主要探讨中药五味子对肝硬化的防治效果, 以此提示中国医药对于某些疾病的疗效, 同时也为肝硬化的治疗和预防提供了一种新的可能.
5-溴脱氧尿嘧啶核苷(Brdu): 可代替胸腺嘧啶在DNA合成期(S期), 活体注射或细胞培养加入, 而后利用抗Brdu单克隆抗体, ICC染色, 显示增殖细胞. 同时结合其他细胞标志物, 双重染色, 可判断增殖细胞的种类, 增殖速度, 对研究细胞动力学有重要意义.
本文探索中药治疗肝硬化或纤维化的可能性, 试图从干细胞层面解释其原因, 思路清晰, 设计合理, 实验严谨, 结果可信.
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 黑龙江省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): 0
D级 (一般): 0
E级 (差): 0
编辑: 郭鹏 电编:闫晋利
| 1. | Sharma S, Khalili K, Nguyen GC. Non-invasive diagnosis of advanced fibrosis and cirrhosis. World J Gastroenterol. 2014;20:16820-16830. [PubMed] [DOI] |
| 4. | 赵 辉平, 李 峰, 王 胜春, 胡 咏武. 柴胡、丹参和五味子配伍对CCl4所致肝硬化大鼠的作用及其机制. 胃肠病学和肝病学杂志. 2005;14:610-614. |
| 5. | Kim SU, Jung KS, Lee S, Park JY, Kim do Y, Ahn SH, Choi GH, Kim KS, Choi JS, Han KH. Histological subclassification of cirrhosis can predict recurrence after curative resection of hepatocellular carcinoma. Liver Int. 2014;34:1008-1017. [PubMed] [DOI] |
| 6. | Kim MY, Cho MY, Baik SK, Park HJ, Jeon HK, Im CK, Won CS, Kim JW, Kim HS, Kwon SO. Histological subclassification of cirrhosis using the Laennec fibrosis scoring system correlates with clinical stage and grade of portal hypertension. J Hepatol. 2011;55:1004-1009. [PubMed] [DOI] |
| 8. | Ohkoshi S, Hirono H, Watanabe K, Hasegawa K, Kamimura K, Yano M. Natural regression of fibrosis in chronic hepatitis B. World J Gastroenterol. 2016;22:5459-5466. [PubMed] [DOI] |
| 9. | Iwai M, Sato K, Omori N, Nagano I, Manabe Y, Shoji M, Abe K. Three steps of neural stem cells development in gerbil dentate gyrus after transient ischemia. J Cereb Blood Flow Metab. 2002;22:411-419. [PubMed] [DOI] |
| 10. | Alavian SM, Imanieh MH, Imanieh MH. Predictive Factors in the Incidence of Cirrhosis in Chronic Hepatitis B Virus Infections. Hepat Mon. 2016;16:e34790. [PubMed] [DOI] |
| 11. | He L, Deng T, Luo H. Aldehyde Dehydrogenase 2 (ALDH2) Polymorphism and the Risk of Alcoholic Liver Cirrhosis among East Asians: A Meta-Analysis. Yonsei Med J. 2016;57:879-884. [PubMed] [DOI] |
| 13. | Yu Q, Shao R, Qian HS, George SE, Rockey DC. Gene transfer of the neuronal NO synthase isoform to cirrhotic rat liver ameliorates portal hypertension. J Clin Invest. 2000;105:741-748. [PubMed] [DOI] |
| 14. | Nilsson E, Anderson H, Sargenti K, Lindgren S, Prytz H. Incidence, clinical presentation and mortality of liver cirrhosis in Southern Sweden: a 10-year population-based study. Aliment Pharmacol Ther. 2016;43:1330-1339. [PubMed] [DOI] |
| 15. | Stankovic Z. Four-dimensional flow magnetic resonance imaging in cirrhosis. World J Gastroenterol. 2016;22:89-102. [PubMed] [DOI] |
| 16. | Hytiroglou P, Snover DC, Alves V, Balabaud C, Bhathal PS, Bioulac-Sage P, Crawford JM, Dhillon AP, Ferrell L, Guido M. Beyond "cirrhosis": a proposal from the International Liver Pathology Study Group. Am J Clin Pathol. 2012;137:5-9. [PubMed] [DOI] |
| 18. | Thandassery RB, Montano-Loza AJ. Role of Nutrition and Muscle in Cirrhosis. Curr Treat Options Gastroenterol. 2016;14:257-273. [PubMed] [DOI] |
| 21. | Del Bello A, Congy-Jolivet N, Danjoux M, Muscari F, Kamar N. Donor-specific antibodies and liver transplantation. Hum Immunol. 2016; Feb 23. [Epub ahead of print]. [PubMed] [DOI] |
| 24. | Tian DD, Wang W, Wang HN, Sze SC, Zhang ZJ. Pharmacokinetic Evaluation of Clozapine in Concomitant Use of Radix Rehmanniae, Fructus Schisandrae, Radix Bupleuri, or Fructus Gardeniae in Rats. Molecules. 2016;21:pii E696. [PubMed] [DOI] |
| 26. | Hu D, Cao Y, He R, Han N, Liu Z, Miao L, Yin J. Schizandrin, an antioxidant lignan from Schisandra chinensis, ameliorates Aβ1-42-induced memory impairment in mice. Oxid Med Cell Longev. 2012;2012:721721. [PubMed] [DOI] |
| 27. | Liu Y, Wang L, Sha D, Zheng S, He J. [Thin layer chromatographic studies on radix Ginseng, fructus Schisandrae and radix Salviae miltiorrhizae in yixinfumai granules]. Zhongguo Zhongyao Zazhi. 1992;17:217-219, 255. [PubMed] |
| 28. | Jin D, Zhao T, Feng WW, Mao GH, Zou Y, Wang W, Li Q, Chen Y, Wang XT, Yang LQ. Schisandra polysaccharide increased glucose consumption by up-regulating the expression of GLUT-4. Int J Biol Macromol. 2016;87:555-562. [PubMed] [DOI] |
| 29. | Pan SY, Yu Q, Zhang Y, Wang XY, Sun N, Yu ZL, Ko KM. Dietary Fructus Schisandrae extracts and fenofibrate regulate the serum/hepatic lipid-profile in normal and hypercholesterolemic mice, with attention to hepatotoxicity. Lipids Health Dis. 2012;11:120. [PubMed] [DOI] |
| 30. | Jang MK, Nam JS, Kim JH, Yun YR, Han CW, Kim BJ, Jeong HS, Ha KT, Jung MH. Schisandra chinensis extract ameliorates nonalcoholic fatty liver via inhibition of endoplasmic reticulum stress. J Ethnopharmacol. 2016;185:96-104. [PubMed] [DOI] |