修回日期: 2015-11-30
接受日期: 2015-12-08
在线出版日期: 2016-01-18
近年来, 胃息肉的发病率有不断增高的趋势, 关于长期应用质子泵抑制剂与胃息肉的相关性的报道尚少, 且报道不一. 本文报道了辽宁省大连市友谊医院发现的4例长期口服质子泵抑制剂致胃息肉的病例, 探讨了质子泵抑制剂长期应用可能的不良反应, 并指出长期应用质子泵抑制剂可能是胃息肉发生的原因之一.
核心提示: 关于长期应用质子泵抑制剂(proton-pump inhibitors, PPIs)是否与胃息肉的发生存在相关性, 目前报道不多, 且报道不一. 本文报道了4例长期口服PPIs致胃息肉的病例, 探讨了长期应用PPIs的不良反应, 并指出长期应用质子泵抑制剂可能是胃息肉发生的原因之一.
引文著录: 李正阳, 樊晓明, 张娜, 孙咏红. 长期应用质子泵抑制剂致胃息肉4例并文献复习. 世界华人消化杂志 2016; 24(2): 322-327
Revised: November 30, 2015
Accepted: December 8, 2015
Published online: January 18, 2016
The incidence of gastric polyps is increasing. It is still unclear whether use of prolonged proton pump inhibitors (PPIs) is associated with the development of gastric polyps. Here we report 4 cases of gastric polyps induced by the long-term use of PPIs. We also discuss the side effects of prolonged use of PPIs and suggest that the long-term use of PPIs may be a cause of gastric polyps.
- Citation: Li ZY, Fan XM, Zhang N, Sun YH. Gastric polyps following prolonged proton-pump inhibitor therapy: Report of 4 cases and a literature review. Shijie Huaren Xiaohua Zazhi 2016; 24(2): 322-327
- URL: https://www.wjgnet.com/1009-3079/full/v24/i2/322.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i2.322
胃息肉是指胃黏膜及黏膜下层局限性增生性并向管腔内隆起的病变, 为临床常见病、多发病. 胃息肉包括胃底腺息肉(fundic gland polyps, FGPs)、增生性息肉、炎性息肉和错构性息肉[1,2]. FGPs是最常见的胃良性息肉之一, 通常长在胃底或者胃体. 其发病机制尚不十分清楚, 长期应用质子泵抑制剂(proton-pump inhibitors, PPIs)是否与胃息肉的发生存在相关性, 目前报道不多, 且报道不一. 现就辽宁省大连市友谊医院发现的4例长期口服PPIs致胃息肉的病例, 报告如下.
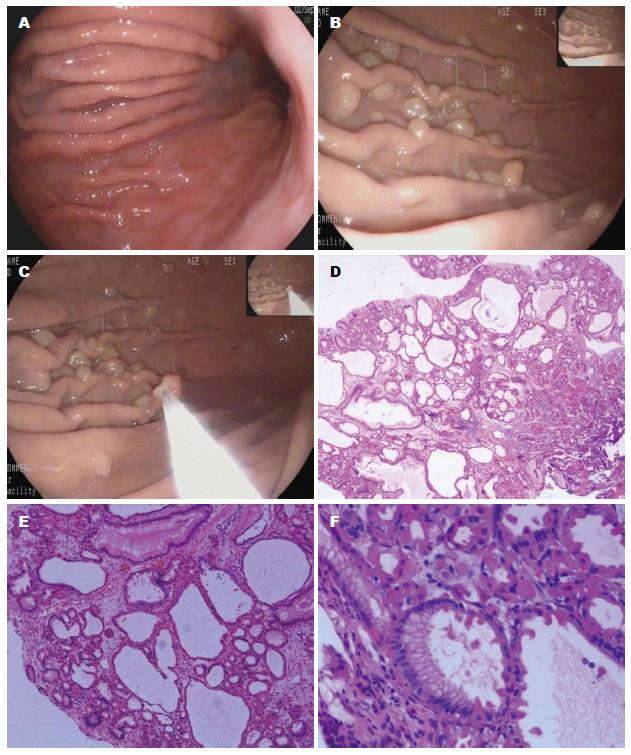
病例1: 女性, 51岁, 平素体健, 既往无长期口服阿司匹林病史, 无长期口服非甾体抗炎药(nonsteroidal antiinflammatory drugs, NASIDs)病史. 无家族性腺瘤性息肉病病史. 患者因反复的烧心、反流症状, 于辽宁省大连市友谊医院行胃镜检查, 提示慢性胃炎, 14C呼气试验结果提示幽门螺杆菌(Helicobacter pylori, H. pylori)阳性. 诊断为反流性食管炎. 患者因烧心、反流症状需口服PPIs, 服药后临床症状消失, 但停药后症状反复, 故选择雷贝拉唑20 mg/d口服控制症状. 12 mo后复查胃镜, 提示胃体及胃底多发息肉, 予内镜下胃息肉电切术, 术后病理提示FGPs. 因患者临床症状反复发作, 无法停用雷贝拉唑. 2年内2次复查胃镜, 仍提示存在胃息肉, 2次予内镜下胃息肉电切术. 术后病理均提示FGPs(图1).
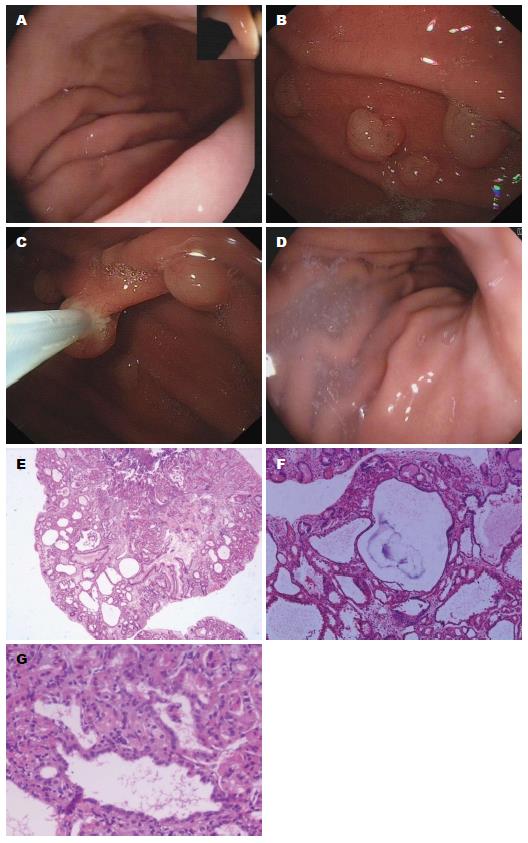
病例2: 女性, 62岁, 既往有高血压3级、很高危病史10年, 服用硝苯地平片控制血压, 血压控制基本达标. 无长期口服阿司匹林及NASIDs病史. 患者因烧心症状行胃镜检查, 结果提示慢性胃炎, 14C呼气试验结果提示H. pylori阴性. 予兰索拉唑30 mg/d口服控制烧心症状. 13 mo后复查胃镜, 提示胃体及胃底多发息肉, 予内镜下胃息肉电切术, 术后病理提示FGPs, 因患者停用兰索拉唑后临床症状反复发作, 随给予法莫替丁及达喜控制症状, 1年后复查胃镜, 未见胃息肉. 2年后再次随诊胃镜, 未见胃息肉(图2).
病例3: 女性, 73岁, 患者平素体健. 既往无长期口服阿司匹林病史, 无长期口服NASIDs病史. 患者因反复烧心、反流症状, 于辽宁省大连市友谊医院行胃镜检查, 结果提示反流性食管炎(LA-B), 14C呼气试验结果提示H. pylori阴性, 予埃索美拉唑20 mg/d口服控制症状. 12 mo后复查胃镜, 提示胃体及胃底多发息肉, 予内镜下胃息肉电切术, 术后病理提示FGPs, 因患者临床症状反复发作, 无法停用埃索美拉唑. 患者规律随诊2年, 每半年左右复查胃镜, 均提示存在胃底腺息肉, 多次予内镜下胃息肉电切术.
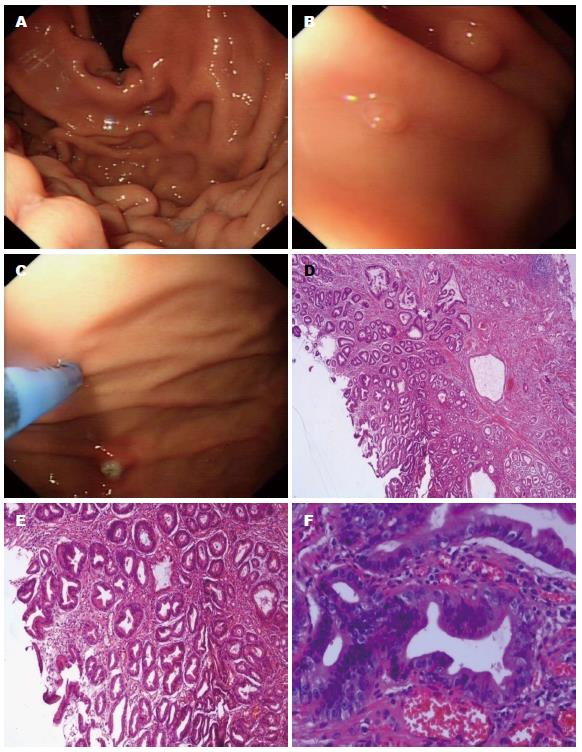
病例4: 男性, 65岁, 患者平素体健, 无长期口服阿司匹林及NASIDs病史. 无家族性腺瘤性息肉病病史. 因反复的反流、烧心症状行胃镜检查, 提示慢性胃炎, 14C呼气试验结果提示H. pylori阴性. 予雷贝拉唑20 mg/d口服控制症状, 18 mo后复查胃镜, 提示胃体多发息肉, 予内镜下胃息肉电切术, 术后病理提示胃增生性息肉. 后该患者失访(图3).
该4例患者无家族性腺瘤性息肉病病史, 既往均无长期口服阿司匹林及NASIDs病史, 服用PPIs前胃镜检查未见胃息肉, 仅为慢性胃炎或反流性食管炎, 长期服用PPIs(12-18 mo)后复查胃镜均可见胃息肉形成, 2例分布于胃体及胃底, 另两例分布于胃底和胃体, 且1例患者停用PPIs后胃息肉未再复发. 由此推测, 长期口服PPIs可能与胃息肉的发生存在一定的相关性.
近年来, 胃肠道息肉的发病率在不断增加, 内镜的广泛使用有助于息肉的发现[3]. FGPs作为最常见的胃良性息肉之一, 其病因及发病机制尚不明确. 在过去的一二十年里, PPIs得到了广泛的应用, PPIs应用的不良反应包括可逆的高胃泌素血症, 胃黏膜ECL细胞轻度增生, 加快H. pylori感染的胃体萎缩性胃炎的进展[3]. 有研究显示, FGPs的发生与长期使用PPIs相关, 然而, 研究结果并不一致.
Fujimoto等[4]随访了服用PPIs长达26 mo的192例患者, 发现26例(13.6%)的患者出现了FGPs. 他们认为PPIs应用时间是FGPs发病的独立危险因素, 应用PPIs疗程>48 mo导致FGPs的发病率明显增高, 而提高PPIs剂量对FGPs的发病率并无严重影响. Jalving等[5]的报道指出, 长期应用PPIs导致FGPs的发生率高达非长期应用PPIs者的4倍.
来自我国中山大学第五附属医院的Huang等[2]收集了内镜中心2011-2013的数据, 共纳入10904名接受胃镜检查者, 研究者对性别、年龄、H. pylori的感染状态及PPIs长期服用(使用PPIs 1年以上)进行多元回归分析, 发现长期使用PPIs和患者年龄与FGPs的发生相关.
然而2001年来自德国的Vieth等[6]研究了2251例服用PPIs>4 wk的患者, 得出的结论是PPIs的服用与FGPs的发病无明显相关性, PPIs的使用并不是FGPs发病的危险因素. García-Alonso等[7]在2011年的文献报道与其结果吻合.
我们报告的4例患者在应用PPIs前胃镜检查均未见胃息肉, 而在长时间(12-18 mo)应用PPIs后均见胃息肉形成, 3例患者为FGPs, 1例患者为胃增生性息肉, 且1例患者停用PPIs后FGPs未再发生. 因此, 考虑患者FGPs的形成和PPIs长时间应用可能存在一定的相关性.
目前, 研究者将使用PPIs药物1年以上定义为PPIs长期使用[2-4]. Fujimoto等[4]认为PPIs应用时间是FGPs发病的独立危险因素, 而Vieth等[6]及García-Alonso等[7]之所以得出PPIs的服用与FGPs发病无相关性的原因, 考虑与PPIs使用时间过短(>4 wk)可能存在一定的关系.
以上研究报道中的学者均认为, 在FGPs发病的危险因素中, H. pylori感染阳性患者FGPs发病率低于H. pylori阴性患者, 提示H. pylori对FGPs的发生具有保护作用. 长期使用PPIs的患者中, H. pylori感染可抑制FGPs的发生, 根除H. pylori则会诱导FGPs的发生[2-4]. 我们报道的4例患者中3例FGPs患者H. pylori均为阴性, 与文献报道结果一致.
Fujimoto等[4]的研究指出, 胃增生性息肉的发病与胃泌素水平的升高可能存在一定的相关性, PPIs长时间使用亦导致胃增生性息肉发病率的增高, 这一结果提示胃增生性息肉与长期应用PPIs导致的高胃泌素血症有关, 可能是由于高胃泌素血症的"营养"作用, 使局部腺体上皮过度增生, 导致息肉形成.
研究[8-10]发现, 长期接受PPIs治疗的患者胃黏膜中存在壁细胞凸起, 壁细胞凸起的发生是长期使用PPIs后导致的胃酸减少、胃泌素过高所致, PPIs对胃黏膜分泌小管泌酸的直接抑制作用, 可能也是壁细胞凸起的原因之一. 由于壁细胞凸起阻塞了腺体的峡部, 使腺体的外分泌受阻, 腺体扩张形成黏膜内囊肿, 囊肿进一步扩大, 进展为胃增生性息肉. 大量研究证实, 长期使用PPIs会使患者胃黏膜发生壁细胞凸起-黏膜内囊肿-胃增生性息肉的顺序进展[11,12].
由于PPIs强大的抑酸作用, 使得其成为治疗许多消化系统疾病的一线药物. 从1998年首次使用PPIs到现在, PPIs在胃食管反流病和消化性溃疡的疗效已在世界范围内得到广泛认可, 我国对PPIs的应用正在逐步增加, 有些地方甚至到了滥用的地步. 随着临床的广泛应用, 新的不良反应相继被发现, 其确切机制尚不明确, 有待进一步探讨及研究. 本文报道的病例提示临床医师, 应用PPIs时要严格掌握该药的适应证、治疗疗程, 避免无指征长期应用, 若确需要长期抑酸治疗, 可以适当换用H2-R阻滞剂, 间断交替进行, 或采用小剂量按需用药的方法, 并密切观察用药反应, 发现问题及早处理, 预防严重不良反应的发生.
胃息肉是指胃黏膜及黏膜下层局限性增生性并向管腔内隆起的病变, 为临床常见病、多发病. 长期应用质子泵抑制剂(proton-pump inhibitors, PPIs)与胃息肉发生的相关性的报道不多.
管小青, 教授, 主任医师, 南京鼓楼医院集团宿迁市人民医院(徐州医科大学附属宿迁医院)普通外科; 刘飞德, 副主任医师, 中国人民解放军总医院第一附属医院普通外科; 李幼生, 教授, 中国人民解放军南京军区南京总医院普通外科研究所
目前PPIs的应用逐步增加, 随着临床的广泛应用, 新的不良反应相继被发现. 关于长期应用PPIs是否与胃息肉的发生存在相关性的报告尚少, 且报道不一. 提高对长期应用PPIs的不良反应的认识, 指导临床合理用药, 是亟待解决的问题.
本文对长期应用PPIs导致胃息肉这一现象进行观察并分析总结, 得出长期应用与胃息肉的发生有相关性的结论, 相关文献报道不多. 结合目前PPIs的广泛应用情况, 建议对某些需要长期应用PPIs的患者用药时要适当进行调整, 有一定的新意, 对临床工作有一定的指导意义.
应用PPIs时要严格掌握适应证、治疗疗程, 避免无指征长期应用, 若确需要长期抑酸治疗, 可以适当换用H2-R阻滞剂, 间断交替进行, 或采用小剂量按需用药的方法, 并密切观察用药反应, 发现问题及早处理, 预防严重不良反应的发生.
胃息肉: 指胃黏膜及黏膜下层局限性增生性并向管腔内隆起的病变, 为临床常见病、多发病; 质子泵抑制剂(PPIs): 临床上常用的抑制胃酸分泌的药物, 是治疗许多消化系统疾病的一线药物.
本文对长期应用PPIs导致胃息肉这一现象进行观察并分析总结, 得出长期应用与胃息肉的发生有相关性的结论, 国内国际相关的文献报道不多. 作者结合国内目前PPIs的广泛应用部分甚至滥用的情况, 建议在对某些需要长期应用PPIs的患者用药时要适当进行调整, 有一定的新意, 对临床工作有一定的指导意义.
编辑: 于明茜 电编:闫晋利
| 1. | 朱 元民, 李 菁, 刘 玉兰. 胃息肉发病机制相关因素研究. 胃肠病学和肝病学杂志. 2007;20:522-524. |
| 2. | Huang CZ, Lai RX, Mai L, Zhou HL, Chen HJ, Guo HX. Relative risk factors associated with the development of fundic gland polyps. Eur J Gastroenterol Hepatol. 2014;26:1217-1221. [PubMed] [DOI] |
| 3. | Thomson AB, Sauve MD, Kassam N, Kamitakahara H. Safety of the long-term use of proton pump inhibitors. World J Gastroenterol. 2010;16:2323-2330. [PubMed] [DOI] |
| 4. | Fujimoto K, Hongo M. Safety and efficacy of long-term maintenance therapy with oral dose of rabeprazole 10 mg once daily in Japanese patients with reflux esophagitis. Intern Med. 2011;50:179-188. [PubMed] [DOI] |
| 5. | Jalving M, Koornstra JJ, Wesseling J, Boezen HM, DE Jong S, Kleibeuker JH. Increased risk of fundic gland polyps during long-term proton pump inhibitor therapy. Aliment Pharmacol Ther. 2006;24:1341-1348. [PubMed] [DOI] |
| 6. | Vieth M, Stolte M. Fundic gland polyps are not induced by proton pump inhibitor therapy. Am J Clin Pathol. 2001;116:716-720. [PubMed] [DOI] |
| 7. | García-Alonso FJ, Martín-Mateos RM, González Martín JA, Foruny JR, Vázquez-Sequeiros E, Boixeda de Miquel D. Gastric polyps: analysis of endoscopic and histological features in our center. Rev Esp Enferm Dig. 2011;103:416-420. [PubMed] [DOI] |
| 8. | Jianu CS, Fossmark R, Viset T, Qvigstad G, Sørdal O, Mårvik R, Waldum HL. Gastric carcinoids after long-term use of a proton pump inhibitor. Aliment Pharmacol Ther. 2012;36:644-649. [PubMed] [DOI] |
| 9. | Kojima Y, Takeuchi T, Ota K, Harada S, Edogawa S, Narabayashi K, Nouda S, Okada T, Kakimoto K, Kuramoto T. Effect of long-term proton pump inhibitor therapy and healing effect of irsogladine on nonsteroidal anti-inflammatory drug-induced small-intestinal lesions in healthy volunteers. J Clin Biochem Nutr. 2015;57:60-65. [PubMed] [DOI] |
| 10. | Song H, Zhu J, Lu D. Long-term proton pump inhibitor (PPI) use and the development of gastric pre-malignant lesions. Cochrane Database Syst Rev. 2014;12:CD010623. [PubMed] [DOI] |
| 11. | Hongo M, Fujimoto K. Incidence and risk factor of fundic gland polyp and hyperplastic polyp in long-term proton pump inhibitor therapy: a prospective study in Japan. J Gastroenterol. 2010;45:618-624. [PubMed] [DOI] |
| 12. | Sheen E, Triadafilopoulos G. Adverse effects of long-term proton pump inhibitor therapy. Dig Dis Sci. 2011;56:931-950. [PubMed] [DOI] |