修回日期: 2016-06-04
接受日期: 2016-06-21
在线出版日期: 2016-07-08
目的: 通过高通量测序方法研究植物发酵液(plant fermented extract, PFE)对肠易激综合征(irritable bowel syndrome, IBS)患者肠道菌群的影响.
方法: 分别收集PFE作用0 d和30 d的人体粪便样本, 采用Illumima系统MiSeq平台对PFE作用前后的样本进行16S rRNA测序, 分析肠道菌群的结构和丰度.
结果: PFE作用后, IBS患者的肠道菌群多样性无显著变化. 在门水平上, 硬壁菌门(Firmicutes)丰度显著降低(P<0.01), 拟杆菌门(Bacteroidete)和变形菌门(Proteobacterias)的丰度以及Bacteroidetes/Firmicutes的比值增加. 在最佳分类水平(科水平)上, PFE作用后的粪便肠道菌群中检测到弯曲菌科(Campylobacteraceae)、蟑螂杆状体科(Cryomorphaceae)、丹毒丝菌科(Erysipelotrichaceae)和纤维杆菌科(Fibrobacteraceae), 且丰度变化具有显著差异(P<0.05).
结论: PFE能够改善IBS患者肠道菌群丰度, 调节肠道菌群, 可能在IBS疾病的诊断和治疗中具有重要作用.
核心提示: 肠易激综合征(irritable bowel syndrome, IBS)是一种常见的消化道疾病, 常伴随肠道菌群紊乱, 植物发酵液能够降低菌群中Firmicutes丰度, 增加Bacteroidetes与Firmicutes比值, 改善IBS患者肠道菌群.
引文著录: 杨莉丽, 吴彬彬, 梁岩. 植物发酵液对肠易激综合征患者肠道菌群的调节. 世界华人消化杂志 2016; 24(19): 2982-2987
Revised: June 4, 2016
Accepted: June 21, 2016
Published online: July 8, 2016
AIM: To investigate the effect of plant fermentation extracts (PFE) on intestinal microbiota in patients with irritable bowel syndrome (IBS), using high-throughput sequencing.
METHODS: The feces were collected from IBS patients before (day 0) and 30 days (day 30) after consumption of PFE, respectively. The community structure and abundance of the intestinal microbiota were examined via analyzing 16S rRNA high throughput sequencing using an Illumima System.
RESULTS: The overall diversity of the intestinal microbiota had no significant change on day 30. At the phylum level, the abundance of Firmicutes was significantly decreased (P < 0.05), while that of Bacteroidetes was significantly increased (P < 0.05). The ratio of Bacteroidetes/Firmicutes was greatly elevated. At the family level, Campylobacteraceae, Cryomorphaceae, Erysipelotrichaceae and Fibrobacteraceae were detected after the PFE consumption, and their abundance all significantly increased (P < 0.05).
CONCLUSION: PFE improves the abundance of intestinal microbiota in IBS patients, which may be utilized as a type of dietary intervention of IBS.
- Citation: Yang LL, Wu BB, Liang Y. Effects of plant fermentation extract on intestinal microbiota in patients with irritable bowel syndrome. Shijie Huaren Xiaohua Zazhi 2016; 24(19): 2982-2987
- URL: https://www.wjgnet.com/1009-3079/full/v24/i19/2982.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i19.2982
肠易激综合征(irritable bowel syndrome, IBS)是一种以腹痛或者腹部不适伴排便习惯或大便性状改变为特征, 症状持续或间隙发作, 经相关检查无器质性改变证据的综合征[1-4]. 他是临床上最常见的功能性胃肠病之一. 近年来, IBS的发病率在我国具有明显增加的趋势, 在一些医院, 因IBS而就诊的患者达到消化内科就诊人数的30%-40%. 虽然IBS不会严重威胁生命健康, 但他严重影响了人们的正常工作和生活.
目前, IBS疾病的发病机制仍不清楚[5], 随着科技的发展, 有学者发现肠道菌群失调可能是IBS发病的重要机制. 有研究报道IBS患者肠道内细菌与正常人相比具有较大差异[6,7]. 肠道菌群失调能够破坏肠道黏膜屏蔽, 引起细胞因子高表达[8,9], 导致低度肠炎, 这与IBS的临床症状吻合, 因此通过调节肠道菌群可能是治疗IBS的一个突破口. 最近, 研究发现植物发酵液(plant fermented extract, PFE)在抗氧化, 提高免疫力及调理肠道方面具有良好的作用, 这表明PFE可能在调节IBS患者肠道菌群、辅助治疗IBS方面具有潜在作用[10]. 因此, 本项目拟通过高通量测序方法分析PFE对IBS患者肠道菌群的影响, 研究PFE对IBS的作用, 为IBS的临床诊断和治疗奠定基础.
在北京大学深圳医院共招募IBS受试者5例, 排除对PFE类产品有过敏反应的志愿者及近3 mo内服用过抗生素类药物和对胃肠道有影响药物的受试者. 受试者每天饮用3次PFE, 每次20 mL, 连续作用30 d. PFE(古元真牌发酵型果蔬汁饮料)由中科台富科技有限公司提供, 基因组DNA提取试剂盒购自天根生化科技有限公司, 高压灭菌锅购自日本三洋公司, 台式离心机、微量核酸蛋白检测仪购自美国Biorad公司.
1.2.1 肠道菌群宏基因组DNA的提取: 使用无菌的50 mL离心管收集粪便样本, 使用肠道菌群细菌基因组提取试剂盒提取制备细菌全基因组DNA, 提取方法严格按照试剂盒操作说明书进行.
1.2.2 16S rDNA的扩增与测序: 采用分光光度计对提取的全基因组DNA进行质检, 对质检合格的细菌进行16S rDNA的V4可变区进行扩增(通用引物为: 正向5'-AYTGGGYDTAAAGNG-3', 反向5'-TACNVGGGTATCTAATCC-3'), PCR体系为25 µL, 扩增条件为: 94 ℃变性, 30 s; 50 ℃退火, 30 s; 72 ℃延伸, 30 s. PCR产物经均一化处理后建库, 使用Illumima系统MiSeq平台进行测序. 对测序结果主要进行以下处理: (1)对序列进行连接, 获得最终序列; (2)进行OUT生产和注释; (3)进行生物多样性分析等.
统计学处理 使用SPSS16.0软件对生物多样性进行t检验, 使用mothur软件中metastats命令进行组间显著性差异分析, P<0.05为差异有统计学意义.
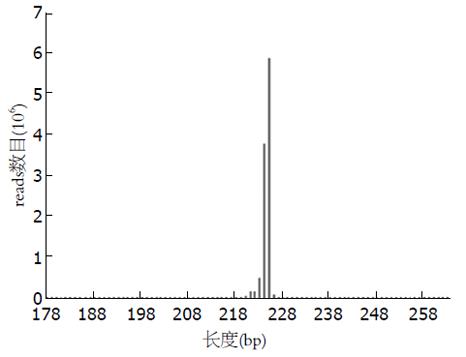
根据测序数据分析可知, PFE作用前后两组样本的测序长度主要分布在218-228 bp范围内, 且绝大多数为224 bp(35.4%)和225 bp(54.5%), 这与细菌16S rDNA V4片段长度相符(图1).
对测序后的序列进行分析, 作用前和作用后的有效序列分别为55564±9892和48332±6763, 优化后分别得到55743±9888和48484±6784条优质序列. 在相似度为0.97条件下, 应用生物信息学软件进行序列分析, 共获得47646个OTU, 其中纲水平47607个, 目水平47408个, 科水平47028个, 属水平46166个, 种水平44953个. 经绘制稀释曲线, 大部分测序的样品接近平台期. 对样品的测序覆盖度进行分析, 发现两组样品的覆盖率均为96.5%, 说明测序的16S rRNA序列能够很好的代表待测粪便样本的绝大多数细菌.
分析两组测序样品肠道菌群的多样性指数, 发现PFE作用前的香农指数和辛普森指数分别为5.500±0.160和0.019±0.003, 作用后的香农指数和辛普森指数分别为5.200±0.320和0.030±0.008. 此外, 作用前的丰富度指数为6100±182, 作用后的丰富度指数为5518±741, PFE对肠道菌群多样性无显著影响(P>0.05).
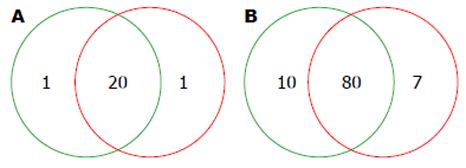
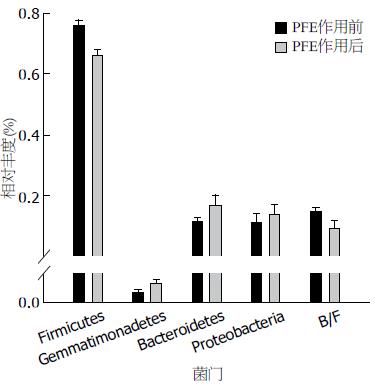
通过对测序序列进行整理, 并与16S rDNA数据库进行比对, 对所有样品的微生物进行分析后, 共发现有22个菌门, PFE处理前后样本中共有的门有20个, 对照组特有菌门1个(Deferribactere), 处理组特有菌门1个(Nitrospirae)(图2A). 进一步分析发现样品中细菌绝大多数由硬壁菌门(Firmicutes), 变形菌门(Proteobacteria)和拟杆菌门(Bacteroidetes)组成, 对照组和处理组中Firmicutes序列分别为39850条和30357条, 占总菌的比例为76%和0.66%, Proteobacteria序列分别为5807条和6492条, 占总菌的比例为11%和14%. Bacteroidetes序列分别为6203条和7451条, 占总菌的比例为12%和17%. 统计分析发现与对照组相比, 处理组的Firmicutes丰度显著下降(P<0.01), Bacteroidete和Proteobacterias的丰度增加(P>0.05), Bacteroidetes/Firmicutes的比值也增加(P>0.05). 此外, Gemmatimonadetes的丰度虽然较低(P<0.01), 但其丰度变化具有显著变化(P<0.05)(图3).
对肠道菌群在最佳分类水平科水平进一步深入分析, 能更清晰的反应PFE作用前后肠道菌群的变化趋势. 高通量测序数据分析发现两组肠道菌群主要的科均为Alcaligenaceae、Lachnospiraceae、Rikenellaceae和Ruminococcaceae, 处理前后分别占总数的8.1%、42.4%、7.0%、25.1%和11.0%、38.2%、11.1%、16.8%. 两组肠道菌群中共有97个科, 其中共有的科有80个, 对照组特有的科有10个, 处理组特有的科有7个(图2B). 统计分析发现PFE作用后有7个科的丰度发生显著变化, 其中弯曲菌科(Campylobacteraceae)、蟑螂杆状体科(Cryomorphaceae)、丹毒丝菌科(Erysipelotrichaceae)和纤维杆菌科(Fibrobacteraceae)为PFE处理后出现的科, 丰度变化具有统计学意义(表1).
| 科水平 | 对照组 | 处理组 | P值 |
| Burkholderiaceae | 0.01±0.01 | 0.20±0.20 | 0.00 |
| Campylobacteraceae | 0.00±0.00 | 0.09±0.09 | 0.00 |
| Cryomorphaceae | 0.00±0.00 | 0.06±0.05 | 0.00 |
| Erysipelotrichaceae | 0.00±0.00 | 0.04±0.02 | 0.02 |
| Fibrobacteraceae | 0.00±0.00 | 0.07±0.07 | 0.00 |
| Gemmatimonadaceae | 0.10±0.02 | 0.20±0.03 | 0.03 |
| Planctomycetaceae | 0.01±0.01 | 0.14±0.14 | 0.00 |
IBS是一种长期的胃肠道功能紊乱疾病, 其发病机制目前尚不十分清楚, 多数学者认为主要有以下几种: 胃肠蠕动改变, 肠道高敏感性, 肠道菌群作用, 肠道上皮细胞和免疫作用, 脑肠轴异常或心理因素引起[11]. 近几年来, 越来越多的研究报道肠道菌群与IBS疾病具有密切关系, 肠道菌群失调可能是IBS发病的重要机制[12-14]. Tana等[15]以RT-PCR和细菌培养检测粪便细菌组成, 以液色谱法检测粪便中的有机酸水平, 发现IBS患者的韦荣球菌、乳酸杆菌数量以及乙酸、丙酸、总有机酸水平均较正常对照组显著升高. Noor等[16]通过使用PCR-DGGE技术研究了IBS和对照组之间肠道菌群的区别, 发现IBS组和对照组的肠道菌群在种类和生物变异度上具有显著差异, 这些研究结果提示IBS患者的肠道菌群出现一定程度的紊乱. 针对这一IBS疾病的特点, 已有学者试图采用口服补充益生菌或益生元的方法治疗IBS[17,18]. 然而, 由于不同研究者使用的益生元或益生菌不同, 研究方式也不同(单种法或复合法)[19], 导致实验结果存在一定的差异和不稳定性. 而PFE的发现和使用为IBS的治疗提供了新的途径. PFE一般是指由几十种水果蔬菜经益生菌天然发酵而来的液体, 是一种植物"酵素". 其含有丰富的维生素和植物化学成分, 在台湾地区被作用多年, 对人体无不良反应. 近几年研究发现, PFE不仅具有抗氧化和抗炎症作用[20], 还具有润肠通便的作用[21].
本研究在已有研究的基础上, 通过高通量测定PFE作用前后IBS患者的肠道菌群结构和丰度, 分析了PFE在调节IBS肠道菌种的作用. 发现PFE作用后, IBS患者肠道菌群多样性无显著变化. 深入分析发现粪便肠道菌群主要由Firmicutes、Proteobacterias和Bacteroidetes构成. 在IBS患者中, Firmicutes的丰度一般高于对照组[22], 而Bacteroidetes与Firmicutes的比值则相对较低. Bacteroidetes与Firmicutes比值是肠道是否健康的重要指标. Rajilić-Stojanović等[8]发现IBS患者肠道内Bacteroidetes与Firmicutes的比值低于对照组, Abbasian等[23]报道IBS患者粪便中Bacteroidetes与Firmicutes的比值仅是对照组的三分之一, 本研究发现PFE作用后IBS患者肠道菌群中Firmicutes的丰度减少, Bacteroidetes与Firmicutes的比值增加, 提示PFE对IBS患者的肠道菌群具有积极的调节作用.
此外, 我们还在科水平对肠道菌进行了深入的研究, 分析发现肠道菌的主要科Lachnospiraceae和Ruminococcaceae在干涉后有所减少, 而其他主要的科如Alcaligenaceae和Rikenellaceae等则有所增加. 另外, 我们在PFE作用后的粪便中检测到Campylobacteraceae、Cryomorphaceae、Erysipelotrichaceae和Fibrobacteraceae 4个科, 且其丰度变化具有统计学意义. Campylobacteraceae属于变形菌门, 在人体肠道内的丰富与饮食和营养等因素具有一定关系[17,18,23,24], Cryomorphaceae属于拟杆菌门, 与高脂饮食和锻炼等有关[19]. Erysipelotrichaceae不仅与饮食有关[25], 还与IBS有关. 有研究报道IBS患者肠道内Erysipelotrichaceae明显减少, 说明Erysipelotrichaceae与IBS具有一定相关性[20]. Fibrobacteraceae常在牛、羊等食草性动物的消化道中检出[21,22,26,27], 与内脏高敏感性有关[28].
IBS是一种胃肠道功能紊乱性疾病, 与膳食、内脏高敏感性和脑肠轴异常等有关[29-30]. 本研究发现PFE能够调节IBS患者的肠道菌群, 降低Firmicutes丰度, 提高Bacteroidetes与Firmicutes比值. 此外, 在PFE作用后的IBS患者粪便中检测到的Campylobacteraceae、Cryomorphaceae、Erysipelotrichaceae和Fibrobacteraceae 4个科, 与膳食、内脏高敏感性等因素有关, 提示这4个科可能在IBS的诊断和治疗中具有积极作用.
研究发现肠易激综合征(irritable bowel syndrome, IBS)与肠道菌群失衡密切相关, 改善IBS患者肠道菌群有利于减缓IBS症状. 植物发酵液(plant fermented extract, PFE)具有调理肠道作用, 其是否能够调节IBS肠道菌群、改善IBS症状有待进一步研究.
李树德, 副教授, 昆明医科大学基础医学院生物化学与分子生物学系
IBS的病因和发病机制尚不十分明确, 寻找肠道菌群标志物是诊断和治疗IBS疾病的一个突破口.
有研究报道PFE具有润肠通便作用, 本课题组前期研究发现PFE能提高免疫力, 增强抗氧化作用.
本文通过高通量测序分析发现PFE能够改善IBS患者的肠道菌群, 可以降低IBS患者肠道菌群Firmicutes的丰度, 增加Bacteroidete和Proteobacterias的丰度.
本文揭示了PFE改善IBS患者肠道菌群作用, 发现弯曲菌科、蟑螂杆状体科、丹毒丝菌科和纤维杆菌科可能在IBS的诊断和治疗中具有潜在作用.
16S rRNA是核糖体RNA的一个亚基, 在结构与功能上高度保守, 可通过测序技术获得其序列, 常用于菌种鉴定和系统发生学研究.
本文通过高通量测序方法分析PFE对IBS患者肠道菌群的影响, 研究PFE对IBS的作用, 为IBS的临床诊断和治疗奠定基础, 论文具有较好的创新性和应用前景.
编辑: 郭鹏 电编:都珍珍
| 1. | Drossman DA. The functional gastrointestinal disorders and the Rome III process. Gastroenterology. 2006;130:1377-1390. [PubMed] [DOI] |
| 3. | Chang L, Heitkemper MM, Wiley JW, Camilleri M. 2015 James W. Freston Single Topic Conference: A Renaissance in the Understanding and Management of Irritable Bowel Syndrome. Clin Gastroenterol Hepatol. 2016; May 27. [Epub ahead of print]. [PubMed] [DOI] |
| 4. | Enck P, Aziz Q, Barbara G, Farmer AD, Fukudo S, Mayer EA, Niesler B, Quigley EM, Rajilić-Stojanović M, Schemann M. Irritable bowel syndrome. Nat Rev Dis Primers. 2016;2:16014. [PubMed] [DOI] |
| 6. | Casén C, Vebø HC, Sekelja M, Hegge FT, Karlsson MK, Ciemniejewska E, Dzankovic S, Frøyland C, Nestestog R, Engstrand L. Deviations in human gut microbiota: a novel diagnostic test for determining dysbiosis in patients with IBS or IBD. Aliment Pharmacol Ther. 2015;42:71-83. [PubMed] [DOI] |
| 7. | Rigsbee L, Agans R, Shankar V, Kenche H, Khamis HJ, Michail S, Paliy O. Quantitative profiling of gut microbiota of children with diarrhea-predominant irritable bowel syndrome. Am J Gastroenterol. 2012;107:1740-1751. [PubMed] [DOI] |
| 8. | Rajilić-Stojanović M, Biagi E, Heilig HG, Kajander K, Kekkonen RA, Tims S, de Vos WM. Global and deep molecular analysis of microbiota signatures in fecal samples from patients with irritable bowel syndrome. Gastroenterology. 2011;141:1792-1801. [PubMed] [DOI] |
| 9. | Saulnier DM, Riehle K, Mistretta TA, Diaz MA, Mandal D, Raza S, Weidler EM, Qin X, Coarfa C, Milosavljevic A. Gastrointestinal microbiome signatures of pediatric patients with irritable bowel syndrome. Gastroenterology. 2011;141:1782-1791. [PubMed] [DOI] |
| 10. | Moussa L, Bézirard V, Salvador-Cartier C, Bacquié V, Houdeau E, Théodorou V. A new soy germ fermented ingredient displays estrogenic and protease inhibitor activities able to prevent irritable bowel syndrome-like symptoms in stressed female rats. Clin Nutr. 2013;32:51-58. [PubMed] [DOI] |
| 11. | Gao J. Correlation between anxiety-depression status and cytokines in diarrhea-predominant irritable bowel syndrome. Exp Ther Med. 2013;6:93-96. [PubMed] [DOI] |
| 12. | Park JM, Choi MG, Cho YK, Lee IS, Kim JI, Kim SW, Chung IS. Functional Gastrointestinal Disorders Diagnosed by Rome III Questionnaire in Korea. J Neurogastroenterol Motil. 2011;17:279-286. [PubMed] [DOI] |
| 13. | Quigley EM. Do Patients with Functional Gastrointestinal Disorders have an Altered Gut Flora? Therap Adv Gastroenterol. 2009;2:23-30. [PubMed] [DOI] |
| 14. | Ghoshal UC, Shukla R, Ghoshal U, Gwee KA, Ng SC, Quigley EM. The gut microbiota and irritable bowel syndrome: friend or foe? Int J Inflam. 2012;2012:151085. [PubMed] [DOI] |
| 15. | Tana C, Umesaki Y, Imaoka A, Handa T, Kanazawa M, Fukudo S. Altered profiles of intestinal microbiota and organic acids may be the origin of symptoms in irritable bowel syndrome. Neurogastroenterol Motil. 2010;22:512-59, 512-59. [PubMed] [DOI] |
| 16. | Noor SO, Ridgway K, Scovell L, Kemsley EK, Lund EK, Jamieson C, Johnson IT, Narbad A. Ulcerative colitis and irritable bowel patients exhibit distinct abnormalities of the gut microbiota. BMC Gastroenterol. 2010;10:134. [PubMed] [DOI] |
| 17. | Roberts LM, McCahon D, Holder R, Wilson S, Hobbs FD. A randomised controlled trial of a probiotic 'functional food' in the management of irritable bowel syndrome. BMC Gastroenterol. 2013;13:45. [PubMed] [DOI] |
| 18. | Ortiz-Lucas M, Tobías A, Saz P, Sebastián JJ. Effect of probiotic species on irritable bowel syndrome symptoms: A bring up to date meta-analysis. Rev Esp Enferm Dig. 2013;105:19-36. [PubMed] [DOI] |
| 19. | Dai C, Zheng CQ, Jiang M, Ma XY, Jiang LJ. Probiotics and irritable bowel syndrome. World J Gastroenterol. 2013;19:5973-5980. [PubMed] [DOI] |
| 20. | 陈 宏运, 崔 红燕, 吴 彬彬, 刘 春花, 罗 茜, 徐 芳芳, 潘 永龙, 杨 莉丽, 梁 岩. 植物发酵液对D-半乳糖致衰老模型小鼠的抗氧化活性研究. 现代食品科技. 2015;8:7-17. |
| 22. | Chung CS, Chang PF, Liao CH, Lee TH, Chen Y, Lee YC, Wu MS, Wang HP, Ni YH. Differences of microbiota in small bowel and faeces between irritable bowel syndrome patients and healthy subjects. Scand J Gastroenterol. 2016;51:410-419. [PubMed] [DOI] |
| 23. | Abbasian F, Saberbaghi T. Metagenomic study of human gastrointestinal tracts in health and diseases. Journal of Gastroenterology and Hepatology Research. 2013;2:885-896. [DOI] |
| 24. | Gupta SS, Mohammed MH, Ghosh TS, Kanungo S, Nair GB, Mande SS. Metagenome of the gut of a malnourished child. Gut Pathog. 2011;3:7. [PubMed] [DOI] |
| 26. | Thoetkiattikul H, Mhuantong W, Laothanachareon T, Tangphatsornruang S, Pattarajinda V, Eurwilaichitr L, Champreda V. Comparative analysis of microbial profiles in cow rumen fed with different dietary fiber by tagged 16S rRNA gene pyrosequencing. Curr Microbiol. 2013;67:130-137. [PubMed] [DOI] |
| 27. | Singh KM, Jisha TK, Reddy B, Parmar N, Patel A, Patel AK, Joshi CG. Microbial profiles of liquid and solid fraction associated biomaterial in buffalo rumen fed green and dry roughage diets by tagged 16S rRNA gene pyrosequencing. Mol Biol Rep. 2015;42:95-103. [PubMed] [DOI] |
| 28. | Zhou XY, Li M, Li X, Long X, Zuo XL, Hou XH, Cong YZ, Li YQ. Visceral hypersensitive rats share common dysbiosis features with irritable bowel syndrome patients. World J Gastroenterol. 2016;22:5211-5227. [PubMed] [DOI] |
| 29. | Barshop K, Staller K. New Pathways, New Targets: Visceral Hypersensitivity Pathogenesis in Irritable Bowel Syndrome. Clin Transl Gastroenterol. 2016;7:e146. [PubMed] [DOI] |