修回日期: 2016-05-18
接受日期: 2016-05-23
在线出版日期: 2016-06-18
目的: 观察血清甲胎蛋白(α-fetoprotein, AFP)阳性晚期胃癌患者的临床特征及预后.
方法: 回顾收集江苏省宜兴市人民医院收治的46例血清AFP阳性晚期胃癌患者作为研究组, 并选取同期收治的85例血清AFP阴性晚期胃癌患者作为对照组, 分析两组患者的病例资料、化疗方案等, 随访两组患者生存时间.
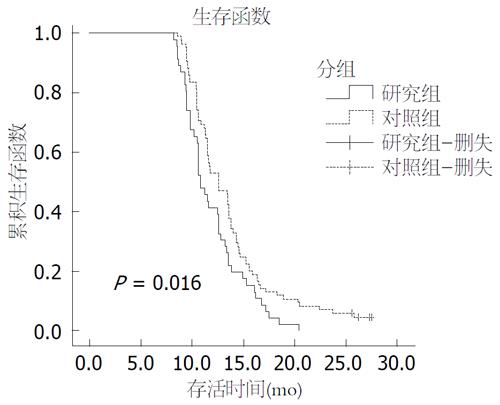
结果: 与对照组比较, 研究组肿瘤恶性程度明显增高(P = 0.014), 术后病理分期明显偏晚(P = 0.045), 肝转移发生率明显增高(P = 0.001). 研究组中位无进展生存时间(progress-free survival, PFS)明显短于对照组(4.5 mo vs 6.4 mo, P<0.01), 研究组的1年生存率略低于对照组(41.3% vs 52.9%, P = 0.203), 无统计学意义, Kaplan-Meier生存曲线提示研究组中位生存时间较对照组明显缩短(10.8 mo vs 12.6 mo, P = 0.016), 差异有统计学意义.
结论: 血清AFP阳性晚期胃癌是一种特殊的肿瘤类型, 恶性程度高, 容易引起肝转移, 化疗效果差, 预后差. 血清AFP水平异常升高可作为判断胃癌预后差的敏感指标.
核心提示: 本研究回顾分析了血清甲胎蛋白(α-fetoprotein, AFP)阳性晚期胃癌患者的临床特征及预后, 研究结果显示, 血清AFP阳性晚期胃癌是一种罕见的胃恶性肿瘤, 具有与普通胃癌明显不同的生物学特点, 预后较差, 容易引起肝转移, 对化疗相对敏感.
引文著录: 张云雷, 姚强, 邓建良, 周炎, 汤月华, 金俊. 血清甲胎蛋白阳性晚期胃癌的临床特征及预后. 世界华人消化杂志 2016; 24(17): 2708-2712
Revised: May 18, 2016
Accepted: May 23, 2016
Published online: June 18, 2016
AIM: To investigate the clinical features and prognosis of serum α-fetoprotein (AFP) positive advanced gastric cancer.
METHODS: Forty-six cases of serum AFP positive advanced gastric cancer (study group), and 85 cases of advanced gastric cancer with normal serum AFP were enrolled (control group). Clinical data and survival were compared between the two groups.
RESULTS: Compared with the control group, the study group had a significantly increased degree of malignancy (P = 0.014), later postoperative pathological stages (P = 0.045), and higher incidence of hepatic metastases (P = 0.001). Median progress-free survival (PFS) in the study group was significantly shorter than that of the control group (4.5 mo vs 6.4 mo, P < 0.01). The 1-year survival rate in the study group was slightly lower than that in the control group (41.3% vs 52.9%, P = 0.203), and there was no significant difference. Kaplan-Meier survival curve analysis demonstrated that the median survival time in the study group was significantly shorter than that in the control group (10.8 mo vs 12.6 mo, P = 0.016).
CONCLUSION: Serum AFP positive advanced gastric cancer is a specific type of tumor, which has high malignancy, tends to develop liver metastasis, has no remarkable response to chemotherapy and has a poor prognosis. Abnormal increase of serum AFP is a sensitive indicator for poor prognosis.
- Citation: Zhang YL, Yao Q, Deng JL, Zhou Y, Tang YH, Jin J. Clinical features and prognosis of serum α-fetoprotein positive advanced gastric cancer. Shijie Huaren Xiaohua Zazhi 2016; 24(17): 2708-2712
- URL: https://www.wjgnet.com/1009-3079/full/v24/i17/2708.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i17.2708
甲胎蛋白(α-fetoprotein, AFP)属于胚胎性血清蛋白, 主要由卵黄囊上皮和胚胎肝脏产生, 是诊断肝细胞性肝癌及生殖系统恶性肿瘤的特异性标志物. 血清AFP升高也见于来源于内胚层器官的其他恶性肿瘤中, 如胃癌、胰腺癌、胆囊癌等[1]. 近年来随着对其作用机制和功能的深入研究, 发现多种与AFP相关且可用于肿瘤诊断的物质, 如AFP异质体, AFP-mRNA等[2]. 本研究回顾分析了江苏省宜兴市人民医院收治的血清AFP升高的晚期胃癌病例46例, 并选取同期收治的85例血清AFP阴性晚期胃癌患者作为对照, 对其临床资料、诊治情况及预后进行分析, 现汇报如下.
回顾分析2009-01/2013-12在江苏省宜兴市人民医院就诊的131例晚期胃癌病例, 中位年龄58.7岁, 患者既往均有胃癌手术史, 术后病理均提示胃腺癌, 随后的CT检查明确有远处转移灶, 且病灶可测量评价, 既往6 mo内无化疗史, 无其他严重内科疾病, Karnofsky(KPS)评分≥70分, 详细基线资料如表1.
| 临床特征 | n | 研究组 | 对照组 | P值 |
| 性别 | 0.933 | |||
| 男 | 69 | 24(34.8) | 45(65.2) | |
| 女 | 62 | 22(35.5) | 40(64.5) | |
| 年龄 (岁) | 0.964 | |||
| ≥59 | 63 | 22(34.9) | 41(65.1) | |
| <59 | 68 | 24(35.3) | 44(64.7) | |
| 原发部位 | 0.628 | |||
| 胃窦 | 62 | 20(32.3) | 42(67.7) | |
| 胃底、贲门 | 46 | 16(34.8) | 30(65.2) | |
| 胃体 | 23 | 10(43.5) | 13(56.5) | |
| 病理分化程度 | 0.014 | |||
| 高、中分化 | 53 | 12(22.6) | 41(77.4) | |
| 低分化、印戒细胞 | 78 | 34(43.6) | 44(56.4) | |
| 术后TNM分期 | 0.045 | |||
| Ⅰ-Ⅱ期 | 40 | 9(22.5) | 31(77.5) | |
| Ⅲ期 | 91 | 37(40.7) | 54(59.3) | |
| 既往化疗史 | 0.668 | |||
| 有 | 88 | 32(36.4) | 56(63.6) | |
| 无 | 43 | 14(32.6) | 29(67.4) | |
| 转移部位 | 0.001 | |||
| 肝脏 | 80 | 37(43.3) | 43(56.7) | |
| 其他转移 | 51 | 9(17.6) | 42(82.4) | |
| 化疗方案 | 0.155 | |||
| 两药联合 | 68 | 20(29.4) | 48(70.6) | |
| 三药联合 | 63 | 26(41.3) | 37(58.7) | |
| KPS评分(分) | 0.637 | |||
| 70 | 38 | 12(31.6) | 26(68.4) | |
| 80 | 75 | 26(34.7) | 49(65.3) | |
| 90-100 | 18 | 8(44.4) | 10(55.6) |
1.2.1 AFP检测: 采用电化学发光法检测血清AFP水平, 电化学发光仪购自美国Roche公司. 血清AFP≤7 IU/mL定义为阴性, 血清AFP≥14 IU/mL定义为阳性.
1.2.2 治疗: 所有患者均为发现胃癌转移后的一线化疗, 两药方案: 卡培他滨或5-氟尿嘧啶联合草酸铂或者紫杉类; 三药方案: 卡培他滨或5-氟尿嘧啶联合草酸铂、紫杉类, 视患者情况3-4 wk为一疗程. 化疗药物剂量一般按标准剂量给予, 视患者耐受性及年龄可予以适当减量, 均至少进行4周期以上化疗. 化疗过程中常规予以护胃、止吐等预防不良反应, 每次化疗前查血常规、肝肾功能、肿瘤指标, 化疗结束后1 wk内复查血常规, 定期复查CT评价疗效.
1.2.3 随访: 所有病例均得到随访, 患者死亡均因肿瘤或者肿瘤引起相关并发症引起, 随访截止日为2015-12-31.
统计学处理 使用SPSS18.0软件包进行数据处理, 计数资料采用mean±SD表示, 计数资料两两比较采用Fisher确切概率计算法, 生存分析采用Kaplan-Meier法, Log-rank检验比较生存率, 检验水准α = 0.05, 双侧P<0.05为差异有统计学意义.
研究组与对照组比较, 低分化腺癌明显增多, 术后病理分期为Ⅲ期患者明显增多, 肝转移发生率明显升高, 均有统计学意义(表1).
研究组46例, 中位PFS为4.5 mo, 1年内死亡27例, 1年生存率41.3%, 截止最后随访时间死亡46例, 存活0例, 中位生存时间10.8 mo; 对照组85例, PFS为6.4 mo, 1年内死亡40例, 1年生存率52.9%, 截止最后随访时间死亡81例, 存活4例, 中位生存时间12.6 mo. 两组中位PFS比较有统计学意义(P<0.01), 两组1年生存率比较无统计学意义(P = 0.203), Kaplan-Meier生存曲线显示两组总生存时间比较有统计学意义(P = 0.016)(图1).
AFP阳性胃癌发生率约占胃癌的3%-15%[3,4]. 这种胃癌类型具有独特的血清学、病理形态学、免疫组织化学和生物学行为特征, 大多数患者在血清和肿瘤组织中可检测出AFP增高[5]. 一旦发现胃癌患者血清AFP异常升高, 即使未发现明确转移灶, 也应进行积极干预. 解春生等[6]动态观察CA199, CA50及AFP, 癌胚抗原(carcino-embryonic antigen, CEA)可作为消化系恶性肿瘤早期诊断、观察疗效、监测复发或转移及判断预后的一项重要指标. 目前对于胃癌患者出现AFP异常升高的原因至今仍存在争议. 有研究者认为因胃与肝脏组织在胚胎期起源类似, 导致在肿瘤形成过程中部分胃癌组织出现肝细胞样分化, 使得产生AFP潜能充分表达, 导致胃癌患者血清中产生大量AFP[7]. 这使得有些胃癌患者在手术前AFP异常升高, 在手术根治性切除胃癌组织后, 血清AFP可迅速下降甚至达到正常这一现象得以解释. AFP阳性胃癌容易发生肝脏转移, 研究显示血清AFP阳性胃癌的淋巴结转移率、临床分期和肝脏转移率均高于血清AFP阴性组[8,9], 这与我们研究结果相类似. Tatli等[10]研究显示AFP较CEA在AFP阳性胃癌的诊断及随访中起着更为重要的作用, 可作为一个独立的预测胃癌预后差的因子.
本研究显示, 研究组与对照组比较低分化腺癌及印戒细胞癌明显增多, 术后Ⅲ期患者明显增多, 肝转移发生率明显增高. 各项数据均提示, 血清AFP阳性晚期胃癌侵袭性更强, 恶性程度更高[4]. 故我们在临床上遇到血清AFP异常升高的患者, 除了首先考虑原发性肝癌或者生殖系统肿瘤时, 也因想到消化系恶性肿瘤特别时胃癌的筛查及鉴别.
胃癌对化疗一般具有较高的敏感性, 但AFP阳性晚期胃癌患者PFS较AFP阴性晚期胃癌明显缩短, 提示此类胃癌组织具有与AFP阴性胃癌明显的异质性, 对化疗耐受, 其原因目前尚不明确. Lu等[11]对产AFP胃癌细胞AGS进行了实验研究, 结果显示: 用siRNA干涉AFP表达后, 细胞的侵袭性和转移性均明显降低, 其可能机制为提高了细胞的凋亡敏感性. Liu等[12]对产AFP胃癌进行研究, 结果显示: P21蛋白表达是产AFP胃癌的独立预后因子. 多数报道均提示产AFP胃癌预后较差[9,13], 仅有个别病案报道产AFP胃癌肝转移患者经过多种治疗手段后获得了30 mo的总生存, 其治疗包括手术、化疗, 介入治疗和索拉菲尼分子靶向治疗等多种治疗手段[14]. 索拉菲尼为主要治疗晚期肾细胞癌和晚期原发性肝细胞癌的多激酶抑制剂, 病案报道中对产AFP晚期胃癌有一定效果, 这为我们治疗提供以一定借鉴.
本研究结果显示, AFP阳性晚期胃癌的1年生存率为41.3%, 中位生存时间为10.8 mo, AFP阴性晚期胃癌的1年生存率为52.9%, 中位生存时间为12.6 mo, AFP阳性晚期胃癌较AFP阴性晚期胃癌1年生存率未有明显差异, 但中位生存时间研究组较对照组降低了1.8 mo, 具有统计学差异, Lew等[15]研究显示, AFP阳性胃癌生存时间更短, 结果与之相符.
血清AFP阳性胃癌容易引起肝脏转移, 本研究数据中血清AFP阳性晚期胃癌共46例, 其中发生肝转移病例37例, 发生率为80.4%, 原发性肝癌对化疗效果差, 因原发性肝癌主要由肝动脉供血, 经肝动脉肝癌化疗栓塞术可有效阻断肿瘤供血引起肿瘤坏死、缩小. 对于此类胃癌是否具有与原发性肝癌相类似的组织细胞学特征, 对于明确的胃癌肝转移病灶, 采用经肝动脉化疗栓塞术是否可以取得与原发性肝癌相类似的效果, 需要我们进一步研究.
总之, 此回顾性研究提示血清AFP阳性晚期胃癌是一种特殊类型的胃癌, 此类胃癌恶性程度高, 预后差, 对化疗不敏感, 故对于胃癌患者临床上应常规行血清AFP检查, 以期早期发现这一特殊类型的胃癌, 从而进行更具有针对性的治疗, 延长患者的生存期.
甲胎蛋白(α-fetoprotein, AFP)是诊断原发性肝癌及生殖系统恶性肿瘤的特异性标志物, 近年来发现许多胃癌患者血清中AFP也出现了异常升高, 且这部分胃癌患者预后多较差.
陈光, 教授, 吉林大学第一医院消化器官外科
血清AFP阳性胃癌预后多较差, 目前研究多停留在对这一现象的观察、统计及分析, 仍然没有针对血清AFP阳性胃癌的诊治规范或指南, 主要原因为对此类胃癌缺乏深层次的如基因水平的研究.
Tatli等研究显示AFP较癌胚抗原在AFP阳性胃癌的诊断及随访中起着更为重要的作用, 可作为一个独立的预测胃癌预后差的因子. Liu等对产AFP胃癌进行研究, 结果显示, P21蛋白表达是产AFP胃癌的独立预后因子.
本文比较了血清AFP阳性晚期胃癌与血清AFP阴性晚期胃癌的临床特征及预后, 认为血清AFP阳性晚期胃癌具有明显的临床特征, 预后较差.
血清AFP阳性晚期胃癌预后较差, 对化疗相对不敏感, 临床上针对此类患者应区别对待, 制定个体化治疗方案.
无进展生存时间: 为患者从确诊胃癌转移开始计算至发现疾病进展的时间. 1年生存率为患者从发现胃癌转移开始计算的1年时间内患者仍存活的比率; 总生存时间: 为患者从确诊胃癌转移开始计算至患者死亡或者随访截止的时间.
作者采用回顾性的病历对照研究, 阐述了血清AFP阳性晚期胃癌临床特征及预后. 产AFP胃癌临床研究多年, 现在已经深入到基因研究, 希望后续研究可以开展基因测序.
编辑: 郭鹏 电编:都珍珍
| 1. | El-Bahrawy M. Alpha-fetoprotein-producing non-germ cell tumours of the female genital tract. Eur J Cancer. 2010;46:1317-1322. [PubMed] [DOI] |
| 3. | Kono K, Amemiya H, Sekikawa T, Iizuka H, Takahashi A, Fujii H, Matsumoto Y. Clinicopathologic features of gastric cancers producing alpha-fetoprotein. Dig Surg. 2002;19:359-365; discussion 365. [PubMed] |
| 4. | Li XD, Wu CP, Ji M, Wu J, Lu B, Shi HB, Jiang JT. Characteristic analysis of α-fetoprotein-producing gastric carcinoma in China. World J Surg Oncol. 2013;11:246. [PubMed] [DOI] |
| 7. | Ishikura H, Kirimoto K, Shamoto M, Miyamoto Y, Yamagiwa H, Itoh T, Aizawa M. Hepatoid adenocarcinomas of the stomach. An analysis of seven cases. Cancer. 1986;58:119-126. [PubMed] |
| 8. | Chen Y, Qu H, Jian M, Sun G, He Q. High level of serum AFP is an independent negative prognostic factor in gastric cancer. Int J Biol Markers. 2015;30:e387-e393. [PubMed] [DOI] |
| 9. | Wang D, Li C, Xu Y, Xing Y, Qu L, Guo Y, Zhang Y, Sun X, Suo J. Clinicopathological characteristics and prognosis of alpha-fetoprotein positive gastric cancer in Chinese patients. Int J Clin Exp Pathol. 2015;8:6345-6355. [PubMed] |
| 10. | Tatli AM, Urakci Z, Kalender ME, Arslan H, Tastekin D, Kaplan MA. Alpha-fetoprotein (AFP) elevation gastric adenocarcinoma and importance of AFP change in tumor response evaluation. Asian Pac J Cancer Prev. 2015;16:2003-2007. [PubMed] |
| 11. | Lu S, Ma Y, Sun T, Ren R, Zhang X, Ma W. Expression of α-fetoprotein in gastric cancer AGS cells contributes to invasion and metastasis by influencing anoikis sensitivity. Oncol Rep. 2016;35:2984-2990. [PubMed] [DOI] |
| 12. | Liu X, Yu H, Cai H, Wang Y. Expression of CD24, p21, p53, and c-myc in alpha-fetoprotein-producing gastric cancer: Correlation with clinicopathologic characteristics and survival. J Surg Oncol. 2014;109:859-864. [PubMed] [DOI] |
| 13. | Wen S, Liu Z, Hu X. [Clinical features and prognostic analysis of α-fetoprotein positive gastric cancer]. Zhonghua Weichang Waike Zazhi. 2016;19:67-70. [PubMed] |
| 14. | Fang YU, Wang L, Yang N, Gong X, Zhang YU, Qin S. Successful multimodal therapy for an α-fetoprotein-producing gastric cancer patient with simultaneous liver metastases. Oncol Lett. 2015;10:3021-3025. [PubMed] [DOI] |
| 15. | Lew DH, Jung WT, Kim HJ, Min HJ, Ha CY, Kim HJ, Kim TH, Ko GH. [Clinicopathological characteristics and prognosis of alpha-fetoprotein producing gastric cancer]. Korean J Gastroenterol. 2013;62:327-335. [PubMed] |