修回日期: 2016-05-18
接受日期: 2016-05-23
在线出版日期: 2016-06-18
目的: 观察融合蛋白胞质转导肽(cytoplasmic transduction peptide, CTP)-HBcAg18-27-Tapasin通过介导JAK/STAT通路诱导近交系C57BL/6小鼠HBV特异性细胞毒性T淋巴细胞(cytotoxic T lymphocyte, CTL)反应.
方法: C57BL/6小鼠随机分为4组: CTP-HBcAg18-27-Tapasin实验组、CTP-HBcAg18-27-Tapasin+AG490对照组、AG490对照组、PBS空白组. 融合蛋白经肌肉注射免疫小鼠, 腹腔注射AG490阻断JAK/STAT通路, CCK-8比色法检测T淋巴细胞增殖活性; 流式细胞术检测T淋巴细胞内的的细胞因子; ELISA检测T淋巴细胞分泌细胞因子, Real-time PCR检测JAK/STAT通路信号分子表达水平.
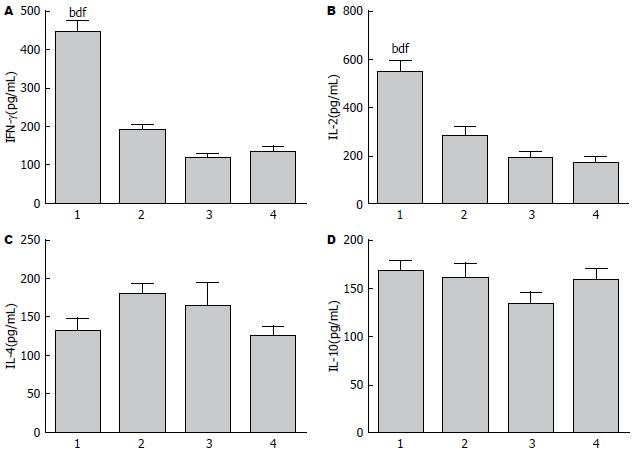
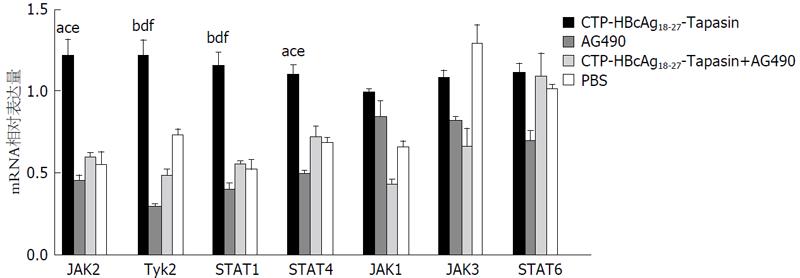
结果: CTP-HBcAg18-27-Tapasin组相比CTP-HBcAg18-27-Tapasin+AG490组CD8+IFN-γ+ T双阳性细胞百分比显著增加(P<0.01), 淋巴细胞增殖活性差异具有显著性(P<0.01), Th1型细胞因子分泌水平显著增加(P<0.01), 其他各组之间没有显著性差异, JAK/STAT信号通路信号中Jak2, STAT4 mRNA 分子表达水平CTP-HBcAg18-27-Tapasin组相比其他对照组表达水平差异具有显著性(P<0.05), CTP-HBcAg18-27-Tapasin组Tyk2、STAT1 mRNA的分子表达水平相比其他对照组表达水平具有显著性差异(P<0.01).
结论: 本研究表明CTP-HBcAg18-27-Tapasin通过JAK/STAT信号通路促进Th1型细胞因子的分泌而促进特异性CTL反应.
核心提示: 本研究证实融合蛋白胞质转导肽-HBcAg18-27-Tapasin通过JAK/STAT信号通路促进Th1型细胞因子分泌(干扰素-γ和白介素-2)诱导增强C57BL/6小鼠乙型肝炎病毒特异性细胞毒性T淋巴细胞反应.
引文著录: 吴姗姗, 唐余燕, 王洁玲, 陈小华, 张毅, 汤正好, 臧国庆, 余永胜. CTP-HBcAg18-27-Tapasin诱导C57BL/6小鼠HBV特异性CTL反应的机制. 世界华人消化杂志 2016; 24(17): 2688-2695
Revised: May 18, 2016
Accepted: May 23, 2016
Published online: June 18, 2016
AIM: To observe whether the fusion protein cytoplasmic transduction peptide (CTP) -HBcAg18-27-Tapasin can induce HBV-specific cytotoxic T lymphocyte (CTL) response in C57BL/6 mice via the JAK / STAT pathway.
METHODS: C57BL/6 mice were randomly divided into four groups: CTP-HBcAg18-27-Tapasin alone group, CTP-HBcAg18-27-Tapasin + AG490 group, AG490 alone group, and PBS group. Mice were immunized with the fusion protein through intramuscular injection, and AG490 was administered through intraperitoneal injection. The proliferation of T lymphocytes was observed using CCK-8 assay. The levels of the cytokines secreted by T lymphocytes were detected by ELISA, and the levels of intracellular cytokines of proliferative T lymphocytes were detected by flow cytometry. Expression levels of molecules of the JAK/STAT signal pathway were detected by real-time PCR.
RESULTS: The percentage of CD8+IFN-γ+ T cells, T lymphocytes proliferative activity and the levels of Th1 cytokines in the CTP-HBcAg18-27-Tapasin alone group were significantly increased compared with the CTP-HBcAg18-27-Tapasin + AG490 group (P < 0.01), although there was no statistical significance between the other groups. The expression levels of Jak2 and STAT4 were significantly higher in the CTP-HBcAg18-27-Tapasin alone group than the rest groups (P < 0.05), and the expression levels of Tyk2 and STAT1 were also dramatically increased in the CTP-HBcAg18-27-Tapasin alone group compared to other groups (P < 0.01).
CONCLUSION: CTP-HBcAg18-27-Tapasin fusion protein increases HBV-specific CTL response via the JAK/STAT signal pathway in C57BL/6 mice.
- Citation: Wu SS, Tang YY, Wang JL, Chen XH, Zhang Y, Tang ZH, Zang GQ, Yu YS. Mechanism for cytoplasmic transduction peptide-HBcAg18-27-Tapasin to induce HBV specific CTL response in C57BL/6 mice. Shijie Huaren Xiaohua Zazhi 2016; 24(17): 2688-2695
- URL: https://www.wjgnet.com/1009-3079/full/v24/i17/2688.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i17.2688
乙型肝炎病毒(hepatitis B virus, HBV)感染的慢性化是持续病毒复制和不充分的免疫应答之间相互作用的结果, 在病毒感染初期CD4+ T细胞致敏能力下降, 以致不能引起强烈的CD8+ T细胞反应, 从而体内适应性免疫下降导致病毒的持续感染, 在慢性乙型肝炎(chronic hepatitis B, CHB)感染者中HBV特异性毒性T淋巴细胞(cytotoxic T lymphocyte, CTL)很难检测到, 因此认为CHB患者持续病毒感染的原因是CTL反应减弱[1,2]. 胞质转导肽(cytoplasmic transduction peptide, CTP)在体内可携带生物活性大分子(蛋白、多肽、核酸等)转运到细胞并定位于胞质[3,4]. 清除HBV需要针对不同表位的多克隆CTL反应, HBcAg18-27是具有HLA-A2限制性特异性CTL表位肽, 针对该表位肽的特异性CTL在控制HBV感染中尤为重要[5]. Tapasin是抗原递呈相关转运蛋白(transporter associated with antigen processing, TAP)三分子复合物的一个亚单位, 与主要组织相容性复合体(major histocompatibility complex, MHC)-I类分子一样, 是免疫球蛋白超家族中的一分子, 与MHC/多肽的装配密切相关[6,7]. JAK/STAT信号通路介导多种细胞因子和干扰素的信号传导, 调节各种细胞过程, 如细胞增殖、分化、迁移和存活[8]. JAK分子有4种(JAK1、JAK2、JAK4、Tyk2), STAT家族有7种(STAT1、STAT2、STAT3、STAT4、STAT5a、STAT5b、STAT6). 他们与特定细胞因子受体结合并激活不同的JAK/STAT分子可引起特定的细胞反应[9,10]. 有研究[11,12]证明, Th2细胞的功能依赖于STAT6, STAT4是Th1型细胞因子的关键信号, 在STAT4缺陷的小鼠观察到完全消失的免疫反应, 干扰素-γ(interferon γ, IFN-γ)分泌下降. 进一步观察表明, 从小鼠中分离STAT4缺陷的CD4+ T细胞转染人类STAT4基因后CD4+ T细胞可导致朝向Th1型细胞分化. 此发现表明, STAT4是在Th1细胞中起重要作用. 本试验选用定位性好转运率高的新型胞质转导肽CTP(GGRRARRRRRR)、HLA-A2限制性CTL表位肽HBcAg18-27(FLPSDFFPSV)及分子伴侣Tapasin构建融合蛋白CTP-HBcAg18-27-Tapasin, 肌肉免疫C57BL/6小鼠, AG490作为JAK/STAT信号通路的特异性抑制剂, 我们通过对JAK/STAT信号通路特异性阻断, 探讨研究JAK/STAT信号通路在诱导CTL反应中的作用, 为CHB的免疫治疗提供理论基础.
6-8周龄雌性无特定病原体(specific pathogen free, SPF)级C57BL/6健康小鼠, 体质量22-26 g, 由上海生命科学研究院斯莱克实验动物有限公司提供, 按照实验动物饲养标准饲养1 wk后进行实验. 融合蛋白CTP-HBcAg18-27-Tapasin, 由课题组构建并保存[13]. 小鼠淋巴细胞分离液购自北京达科为生物技术有限公司; T细胞尼龙毛柱购自Wako公司; ELISA试剂盒购自R&D公司[IFN-γ, 白介素(interleukin, IL)-2, IL-4, IL-10]; 异硫氰酸荧光素(FITC)标志的小鼠单克隆抗体CD8α及藻红蛋白(PE)标志的小鼠单克隆抗体IFN-γ均购自eBioscience公司; 佛波酯、莫能霉素、离子霉素及刀豆素(concanavalin A, ConA)均购自Sigma公司; 细胞固定剂和破膜剂购自Invitrogen公司; CCK-8试剂盒购自日本同仁化学研究所; RT-PCR试剂盒、dNTP、Taq酶、DNA marker均购自TAKARA公司.
1.2.1 实验动物免疫: 实验小鼠随机分为4组, 每组10只C57BL/6小鼠, 分别是CTP-HBcAg18-27-Tapasin实验组, CTP-HBcAg18-27-Tapasin+AG490对照组, AG490对照组及PBS空白组, 融合蛋白免疫小鼠的剂量为50 μg/只, 每只小鼠给予100 μL总剂量肌肉注射, 间隔1 wk共免疫3次, AG490阻断剂5 mg/kg腹腔注射, 每日一次(不间断), 融合蛋白最后一次免疫7 d后处死小鼠取脾脏备用.
1.2.2 脾淋巴细胞的分离与制备: 将小鼠断颈处死, 放在750 mL/L乙醇中浸泡5 min, 无菌取脾脏, 置于200目的筛网上, 以5 mL注射器针芯仔细研磨, 并加入预热的RPMI 1640培养液冲洗, 将细胞悬液慢慢加到事先预热的2倍体积的淋巴细胞分离液中, 再以2200 r/min离心20 min后, 吸取淋巴细胞层, 用PBS洗涤2遍后重悬得到混合淋巴细胞悬液.
1.2.3 尼龙毛法制备T淋巴细胞: 先加入3-4倍柱体的无血培养基平衡, 之后加入相同体积的含有血清的培养基平衡(上述培养基都要37 ℃预热), 随后关闭弹簧夹; 加入以上制备的混合淋巴细胞悬液, 打开弹簧夹, 再加入1 mL含有血清的培养基, 随后关闭弹簧夹; 覆盖铝², 垂直固定, 置于培养箱内37 ℃孵育1 h; 从培养箱中拿出柱子, 750 mL/L乙醇消毒后打开弹簧夹控制流速在3-4 mL/min, 用预温至37 ℃的培养液20 mL含血清的培养基洗柱,收集细胞悬液约1个柱子的体积.
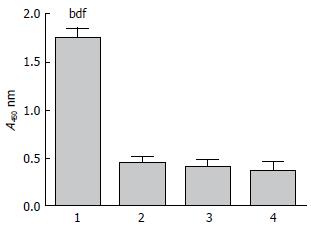
1.2.4 T淋巴细胞增殖反应: 采用CCK-8比色法检测, 将分离得到的T淋巴细胞调整至1×106/mL, 加入100 μL细胞悬液于96孔平底培养板, 并设空白对照, 每组各3个复孔. 根据说明书, 每孔加入100 μL 10 μg/mL的ConA溶液, 终体积为200 μL, 置于37 ℃, 50 mL/L CO2的培养箱中培养44 h后, 每孔加入20 μL CCK-8试剂, 孵育4 h, 将96孔板置于平板摇床上混匀消除各孔内气泡后用酶标仪测A450值, 取3孔的平均值作为结果.
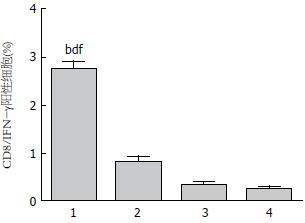
1.2.5 T细胞内细胞因子检测: 采用流式细胞仪检测, 将分离得到的T淋巴细胞以RPMI 1640调整至1×106/mL, 25 g/mL佛波酯、1 g/mL离子霉素和1.7 g/mL莫能霉素加入培养液中37 ℃、50 mL/L CO2孵育6 h; PBS洗涤2次后收集细胞, 加入PE-CD8a抗体避光孵育15 min; PBS洗涤2次, 100 μL固定剂作用15 min, PBS洗涤后加入100 μL破膜剂作用5 min, 直接加FITC-IFN-γ抗体, 室温避光孵育30 min; PBS洗涤2次后用500 μL PBS重悬, 流式细胞仪对细胞荧光强度进行检测分析.
1.2.6 T淋巴细胞培养上清液中细胞因子检测: 采用酶联免疫吸附法(ELISA)检测, 将上述制备的T淋巴细胞用RPMI 1640调整细胞密度为1×107/mL, 37 ℃、50 mL/L CO2条件下培养4 d 后收集上清液; 将标准品和样本各50 μL依次加入孔中, 每孔分别加入50 μL酶联亲和物, 37 ℃温育60 min 后弃孔内液体; 用稀释的洗涤液反复冲洗5 次后加入显色液, 室温下避光反应15 min, 每孔加入终止液50 μL, 酶标仪在450 nm测定吸光度(A)值. 通过标准曲线计算出IL-2、IL-4、IL-10和IFN-γ的水平.
1.2.7 JAK/STAT通路信号分子表达水平检测: 上述制备的T淋巴细胞RPMI 1640调整至1×106/mL, 37 ℃、50 mL/L CO2条件下培养. RNA抽提试剂盒分别提取其总RNA, 以逆转录试剂盒合成cDNA. 引物由上海生工生物工程技术服务有限公司合成(表1), PCR条件如下: 热循环参数: 94 ℃预变性2 min; 94 ℃变性45 s, 54 ℃退火1 min, 72 ℃延伸45 s; 33个循环; 最后72 ℃延伸10 min每次在延伸阶段读取吸光值该目标量的计算由下面的等式: 以2-△△Ct值表示, 每个样品的3个平行反应和进行内部控制.
| 基因名称 | 上游 | 下游 |
| Jak1 | 5'-CAGATGCCCACCATTACC-3' | 5'-CCCTCTTCACTCCCTTCC-3' |
| Jak2 | 5'-GGCAGCAGCAGAACCTAC-3' | 5'-GTCTAACACCGCCATCCC-3' |
| Jak3 | 5'-CCCATCCGCTGAGTTCCT-3' | 5'-GGCTGCTATCCGGGTCTT-3' |
| Tyk2 | 5'-TTCCGTAGCAACCGTCTC-3' | 5'-CATCAAGCATCCTGTGGG-3' |
| STAT1 | 5'-CTATGAGCCCGACCCTAT-3' | 5'-TTGAACTTCCGAAATCCT-3' |
| STAT4 | 5'-CCTGCTGTTGGTTGGTGT-3' | 5'-CTTGAGGCTTTCCTGTGC-3' |
| STAT6 | 5'-TCCTGGTCACAGTTCAATAA-3' | 5'-CGATCTCAGAGTCGCTAAA-3' |
| GAPDH | 5'-AGAAGGCTGGGGCTCATTTG-3' | 5'-AGGGGCCATCCACAGTCTTC-3' |
统计学处理 采用SPSS17.0统计软件建立数据库并进行统计学分析. 数据用mean±SD表示, 两均数比较采用t检验, 多样本均数比较采用单因素方差分析(one-way ANOVA), 组间两两比较采用LSD法, 以P<0.05为差异具有统计学意义.
C57BL/6小鼠经不同处理后, 诱导T淋巴细胞分泌细胞因子(IL-2、IL-4、IL-10和IFN-γ). 经ELISA法检测结果显示实验组融合蛋白分泌IL-2和IFN-γ水平显著高于其他对照组(P<0.05, 图1), 而IL-4和IL-10分泌水平各组间没有明显差异(P>0.05, 图1). 结果显示融合蛋白CTP-HBcAg18-27-Tapasin可以明显增加T淋巴细胞Th1型细胞因子IL-2(F = 25.13, P = 0.0002)和IFN-γ(F = 71.77, P<0.01)的分泌, IL-4和IL-10的分泌水平没有显著性差异(P>0.05).
各组T淋巴细胞经ConA刺激后, 采用CCK-8比色法检测, CTP-HBcAg18-27-Tapasin组淋巴细胞增殖活性显著高于CTP-HBcAg18-27-Tapasin+AG490组, AG490组和PBS组(F = 69.14, P<0.01)(图2).
为了解不同组免疫C57BL/6小鼠后对T细胞因子分泌IFN-γ的影响, 采用流式细胞仪对细胞进行CD8α和IFN-γ双标检测各组T淋巴细胞分泌IFN-γ水平, 结果显示CTP-HBcAg18-27-Tapasin组相比CTP-HBcAg18-27-Tapasin+AG490、AG490、PBS组能够显著增加CD8+IFN-γ双阳性细胞百分比(F = 132, P<0.01)(图3).
为了探讨实验组融合蛋白免疫小鼠增高T淋巴细胞分泌Th1细胞因子与JAK/STAT信号通路信号分子表达水平的关系, 我们通过Real-time PCR法检测JAK/STAT信号通路信号分子mRNA的表达. 结果显示, 与CTP HBcAg18 27-Tapasin+AG490组、AG490组及空白组相比CTP-HBcAg18-27-Tapasin组中Jak2, Tyk2, STAT1, STAT4 mRNA的表达水平明显上调(P<0.05)(图4).
引起人肝脏慢性感染的肝炎病毒中, HBV引起的慢性感染是最常见的. 据世界卫生组织估计, 每年有超过500万例新增急性HBV感染, 全球约有2.48亿慢性HBV携带者其中1/3的患者发生严重的HBV相关并发症.免疫激活在HBV清除中起重要作用[14,15]. 越来越多的证据表明, 宿主的免疫反应是决定HBV感染结局的重要因素, 急性感染者通常对病毒产生强烈的, 多克隆的, 特异性CTL反应和多克隆T辅助(Th)细胞反应, 而在慢性感染患者的这些反应明显减弱[1,16-18].
CTP在体内可携带生物活性大分子(蛋白、多肽、核酸等)转运到细胞并定位于胞质[3,4], Tapasin作为PLC的核心组成部分, 稳定MHC-I分子并催化低亲和力对高亲和力, 促进免疫肽交流. 清除HBV需要针对不同表位的多克隆CTL反应, 其中我国人口中常见的抗原表位肽是人类白细胞抗原HLA-A2限制性[19,20]. HBcAg18-27是具有HLA-A2限制性特异性CTL表位肽, 针对该表位肽的特异性CTL在控制HBV感染中尤为重要[5,21,22]. Tapasin是TAP三分子复合物的一个亚单位, 与MHC-I类分子一样, 是免疫球蛋白超家族中的一分子, 与MHC/多肽的装配密切相关[6,7].
我们在前期的研究中, 已经成功构建CTP-HBcAg18-27-Tapasin融合基因质粒, 融合蛋白表达纯化后证明在体内可转运到DC细胞并定位于胞质, 并在体外实验中发现可引起特异性CTL反应[23,24], CTP-HBcAg18-27-Tapasin+AG490组诱导的Th1类细胞因子明显下降. 我们进一步检测各组处理后CD8+IFN-γ阳性细胞数量百分比, 结果显示融合蛋白实验组CD8+IFN-γ阳性细胞数量百分比明显高于CTP-HBcAg18-27-Tapasin+AG490组及空白对照组. 以上结果提示CTP-HBcAg18-27-Tapasin融合蛋白能有效刺激小鼠T淋巴细胞分泌Th1型细胞因子并诱导Th1/Th2平衡向Th1方向极化, 增强Th1/Th2细胞免疫比例. 本实验中我们用CCK8试剂盒检测T淋巴细胞增殖能力, 结果显示CTP-HBcAg18-27-Tapasin组在ConA作用下的增殖能力明显高于对照组和空白组, 提示实验组融合蛋白能有效刺激T淋巴细胞的增殖.
JAK/STAT信号通路首先在哺乳动物细胞因子诱导的信号传导途径中发现, 现在已证明在多种生物学过程包括造血发育和分化、胚胎发育、组织内环境稳定以及先天免疫和适应性免疫中发挥作用[25,26]. 细胞因子信号转导是通过JAK/STAT信号通路介导某些特定靶基因的表达[27]. 而且JAK/STAT信号通路与多种细胞因子的合成有关, 他们需要与受体相关激酶结合才能引起磷酸化级联反应. 作为非受体酪氨酸激酶, JAKs与跨膜受体胞质内的部分结合, 当配位体结合和细胞因子受体二聚化时, 相关的JAK分子变得活跃并发送信号至相应的STATs, 然后STAT转位至细胞核, 激活转录因子调节基因转录JAK/STAT信号通路介导免疫细胞的分化, 因此阻断此通路会导致信号通路的失调[28]. 一些研究证实CHB患者对于抗病毒治疗的完全反应与优势Th1反应引起的CTL反应有关, 表明Th1免疫的激活可能在HBV的清除中发挥作用, 因此CTL活化需要Th1免疫激活.
Th1细胞产生1型细胞因子包括IL-2、IFN-γ以及TNF-α/b, 诱导细胞介导对胞内抗原的免疫(例如病毒). 相反Th2细胞产生高水平的针对体液免疫的2型细胞因子(包括IL-4、IL-5、IL-6、IL-10和IL-13). JAK分子有4种(JAK1、JAK2、JAK4、Tyk2), STAT家族有7种(STAT1、STAT2、STAT3、STAT4、STAT5a、STAT5b、STAT6)他们与特定细胞因子受体结合并激活不同的JAK/STAT分子可引起特定的细胞反应[8,9], 有研究证明, Th2细胞的功能依赖于STAT6而STAT4是Th1型细胞因子的关键信号, 在STAT4缺陷的小鼠观察到完全消失的免疫反应, IFN-γ分泌下降. 一些研究证实在CHB患者中产生完全抗病毒治疗的患者与主导Th1免疫应答增强CTL反应有关, 表明Th1型免疫可能在HBV的治疗中发挥重要作用[29]. 研究证实CTP-HBcAg18-27-Tapasin能够增强Th1型细胞因子的分泌, JAK/STAT信号通路参与多种生物学过程[30], 此基础上我们进一步探讨CTP-HBcAg18-27-Tapasin通过JAK/STAT通路增强HBV特异性CTL反应. 本研究中, 我们融合蛋白免疫C57BL/6健康小鼠, 使用JAK/STAT信号通路的特异性抑制剂AG490阻断JAK/STAT信号通路, 采用ELISA法检测T淋巴细胞上清液中细胞因子的分泌水平, CTP-HBcAg18-27-Tapasin实验组分泌的Th1类细胞因子(IL-2和IFN-γ)明显高于其他对照组, Th2类细胞因子(IL-4和IL-10)各组间没有明显差异. 流式细胞仪检测CTP-HBcAg18-27-Tapasin实验组的CD8+IFN-γ+ T细胞百分比明显比CTP-HBcAg18-27-Tapasin+AG490组高(P<0.01), 通过对比各组细胞JAK/STAT信号分子mRNA相对表达量, JAK2、Tyk2、STAT1和STAT4表达量增加, 表明CTP-HBcAg18-27-Tapasin经JAK/STAT通路中JAK2、Tyk2、STAT1和STAT4分子引起特异性CTL反应与他们促进Th1类细胞因子表达有关.
本实验证实CTP-HBcAg18-27-Tapasin通过JAK/STAT信号通路促进Th1类细胞分子的表达, 从而增强特异性CTL反应, 进一步探讨其中的分子机制能够为抗HBV的免疫治疗提供新的思路.
全球约有2.48亿慢性乙型肝炎病毒(hepatitis B virus, HBV)携带者其中1/3的患者发生严重的HBV相关并发症, 急性感染者体内可以检测到多克隆的细胞毒性T淋巴细胞(cytotoxic T lymphocyte, CTL)反应, 慢性乙型肝炎(chronic hepatitis B, CHB)患者中很难检测到特异性CTL反应, CHB患者持续病毒感染的原因可能是CTL反应减弱.
程书权, 教授, 主任医师, 研究生导师, 桂林医学院第三附属医院(桂林市传染病医院, 桂林市第三人民医院)肝病科
JAK/STAT信号通路首先在哺乳动物细胞因子诱导的信号传导途径中发现, 参与多种生物学过程, 包括在固有免疫和适应性免疫中发挥作用.
既往文献证明, Th2细胞的功能依赖于STAT6, STAT4是Th1型细胞因子的关键信号, 在STAT4缺陷的小鼠观察到完全消失的免疫反应, 干扰素-γ(interferon-γ, IFN-γ)分泌下降. 从小鼠中分离STAT4缺陷的CD4+ T细胞转染人类STAT4基因后CD4+ T细胞可导致朝向Th1型细胞分化.
本文以Th1型细胞因子分泌量、CD8+IFN-γ+双阳性T细胞百分比以及JAK/STAT信号通路中的分子表达水平的为切入点, 研究CTP-HBcAg18-27-Tapasin通过JAK/STAT信号通路诱导C57BL/6小鼠HBV特异性CTL反应.
JAK/STAT信号通路: 是与细胞生长、增殖和分化关系十分密切的一条信号通路, 作为非受体酪氨酸激酶, JAKs与跨膜受体胞质内的部分结合, 相关的JAK分子变得活跃并发送信号至相应的STATs, 然后STAT转位至细胞核实现信号转导.
本研究内容较新颖, 有一定借鉴价值, 具有较好的科研性和理论价值.
编辑: 郭鹏 电编:都珍珍
| 1. | Jung MC, Pape GR. Immunology of hepatitis B infection. Lancet Infect Dis. 2002;2:43-50. [PubMed] |
| 2. | Chisari FV, Ferrari C. Hepatitis B virus immunopathogenesis. Annu Rev Immunol. 1995;13:29-60. [PubMed] [DOI] |
| 3. | Chen X, Lai J, Pan Q, Tang Z, Yu Y, Zang G. The delivery of HBcAg via Tat-PTD enhances specific immune response and inhibits Hepatitis B virus replication in transgenic mice. Vaccine. 2010;28:3913-3919. [PubMed] [DOI] |
| 4. | Han SS, Lee J, Jung Y, Kang MH, Hong JH, Cha MS, Park YJ, Lee E, Yoon CH, Bae YS. Development of oral CTL vaccine using a CTP-integrated Sabin 1 poliovirus-based vector system. Vaccine. 2015;33:4827-4836. [PubMed] [DOI] |
| 5. | Liu HG, Chen WW, Fan ZP, Yang HY, Shi M, Zhang Z, Luan SS, Zhang H, Lu P, Tien P. The high prevalence of the I27 mutant HBcAg18-27 epitope in Chinese HBV-infected patients and its cross-reactivity with the V27 prototype epitope. Clin Immunol. 2007;125:337-345. [PubMed] [DOI] |
| 6. | Apcher S, Prado Martins R, Fåhraeus R. The source of MHC class I presented peptides and its implications. Curr Opin Immunol. 2016;40:117-122. [PubMed] [DOI] |
| 7. | Abualrous ET, Fritzsche S, Hein Z, Al-Balushi MS, Reinink P, Boyle LH, Wellbrock U, Antoniou AN, Springer S. F pocket flexibility influences the tapasin dependence of two differentially disease-associated MHC Class I proteins. Eur J Immunol. 2015;45:1248-1257. [PubMed] [DOI] |
| 8. | Khanna P, Chua PJ, Bay BH, Baeg GH. The JAK/STAT signaling cascade in gastric carcinoma (Review). Int J Oncol. 2015;47:1617-1626. [PubMed] [DOI] |
| 9. | Villarino AV, Kanno Y, Ferdinand JR, O'Shea JJ. Mechanisms of Jak/STAT signaling in immunity and disease. J Immunol. 2015;194:21-27. [PubMed] [DOI] |
| 10. | Shuai K, Liu B. Regulation of JAK-STAT signalling in the immune system. Nat Rev Immunol. 2003;3:900-911. [PubMed] [DOI] |
| 11. | Chitnis T, Salama AD, Grusby MJ, Sayegh MH, Khoury SJ. Defining Th1 and Th2 immune responses in a reciprocal cytokine environment in vivo. J Immunol. 2004;172:4260-4265. [PubMed] |
| 12. | Chang HC, Zhang S, Kaplan MH. Neonatal tolerance in the absence of Stat4- and Stat6- dependent Th cell differentiation. J Immunol. 2002;169:4124-4128. [PubMed] |
| 13. | 刘 红红, 陈 小华, 周 丽芹, 刘 雪妮, 余 永胜, 臧 国庆, 汤 正好. CTP-HBcAg18-27-Tapasin融合表达载体的构建及其表达和纯化. 胃肠病学和肝病学杂志. 2013;22:684-687. |
| 14. | Golsaz-Shirazi F, Shokri F. Hepatitis B immunopathogenesis and immunotherapy. Immunotherapy. 2016;8:461-477. [PubMed] [DOI] |
| 15. | Levrero M, Zucman-Rossi J. Mechanisms of HBV-induced hepatocellular carcinoma. J Hepatol. 2016;64:S84-S101. [PubMed] [DOI] |
| 16. | Kakimi K, Isogawa M, Chung J, Sette A, Chisari FV. Immunogenicity and tolerogenicity of hepatitis B virus structural and nonstructural proteins: implications for immunotherapy of persistent viral infections. J Virol. 2002;76:8609-8620. [PubMed] |
| 17. | Rehermann B. Immune responses in hepatitis B virus infection. Semin Liver Dis. 2003;23:21-38. [PubMed] [DOI] |
| 18. | Boni C, Fisicaro P, Valdatta C, Amadei B, Di Vincenzo P, Giuberti T, Laccabue D, Zerbini A, Cavalli A, Missale G. Characterization of hepatitis B virus (HBV)-specific T-cell dysfunction in chronic HBV infection. J Virol. 2007;81:4215-4225. [PubMed] [DOI] |
| 19. | Sun L, Zhang Y, Zhao B, Deng M, Liu J, Li X, Hou J, Gui M, Zhang S, Li X. A new unconventional HLA-A2-restricted epitope from HBV core protein elicits antiviral cytotoxic T lymphocytes. Protein Cell. 2014;5:317-327. [PubMed] [DOI] |
| 20. | Paul RG, Roodman ST, Campbell CR, Bodicky CJ, Perrillo RP. HLA class I antigen expression as a measure of response to antiviral therapy of chronic hepatitis B. Hepatology. 1991;13:820-825. [PubMed] |
| 21. | Shimada N, Yamamoto K, Kuroda MJ, Terada R, Hakoda T, Shimomura H, Hata H, Nakayama E, Shiratori Y. HBcAg-specific CD8 T cells play an important role in virus suppression, and acute flare-up is associated with the expansion of activated memory T cells. J Clin Immunol. 2003;23:223-232. [PubMed] |
| 22. | Shimizu Y. T cell immunopathogenesis and immunotherapeutic strategies for chronic hepatitis B virus infection. World J Gastroenterol. 2012;18:2443-2451. [PubMed] [DOI] |
| 23. | 唐 余燕, 陈 小华, 周 丽芹, 卓 萌, 臧 国庆, 汤 正好, 余 永胜. 胞质转导肽-HBcAg18-27-Tapasin诱导特异性细胞毒性T淋巴细胞抑制转基因小鼠HBV复制. 中华肝脏病杂志. 2014;22:24-29. |
| 24. | Chen X, Tang Y, Zhang Y, Zhuo M, Tang Z, Yu Y, Zang G. Tapasin modification on the intracellular epitope HBcAg18-27 enhances HBV-specific CTL immune response and inhibits hepatitis B virus replication in vivo. Lab Invest. 2014;94:478-490. [PubMed] [DOI] |
| 25. | Kiu H, Nicholson SE. Biology and significance of the JAK/STAT signalling pathways. Growth Factors. 2012;30:88-106. [PubMed] [DOI] |
| 27. | Gyurkovska V, Ivanovska N. Tyrosine kinase inhibitor tyrphostin AG490 reduces liver injury in LPS-induced shock. Eur J Pharmacol. 2015;751:118-126. [PubMed] [DOI] |
| 28. | Arbouzova NI, Zeidler MP. JAK/STAT signalling in Drosophila: insights into conserved regulatory and cellular functions. Development. 2006;133:2605-2616. [PubMed] [DOI] |
| 29. | Tsai SL, Sheen IS, Chien RN, Chu CM, Huang HC, Chuang YL, Lee TH, Liao SK, Lin CL, Kuo GC. Activation of Th1 immunity is a common immune mechanism for the successful treatment of hepatitis B and C: tetramer assay and therapeutic implications. J Biomed Sci. 2003;10:120-135. [PubMed] [DOI] |
| 30. | Thomas SJ, Snowden JA, Zeidler MP, Danson SJ. The role of JAK/STAT signalling in the pathogenesis, prognosis and treatment of solid tumours. Br J Cancer. 2015;113:365-371. [PubMed] [DOI] |