修回日期: 2016-05-05
接受日期: 2016-05-09
在线出版日期: 2016-06-08
目的: 研究茵陈蒿汤血清对梗阻性黄疸大鼠肝细胞中肌醇酶1α(inositol-requiring enzyme-1-α, IRE1α)蛋白表达的影响.
方法: 通过结扎SD大鼠胆总管建立梗阻性黄疸模型, 分离梗阻性黄疸大鼠原代肝细胞进行体外培养. 通过喂食SD大鼠茵陈蒿汤制备相应的含药血清. 处理组(B组)以含药血清培养基培养大鼠原代肝细胞, 对照组(A组)以不含药的常规培养基培养大鼠原代肝细胞. 分别测定细胞中IRE1α蛋白表达情况及培养液中谷丙转氨酶(alanine transaminase, ALT)、谷草转氨酶(aspartate transaminase, AST)含量.
结果: 通过比较对照组(A组)各时间点与处理组(B组)的蛋白和转氨酶含量, B组在IRE1α蛋白表达(IRE1α表达量: 6 h 1.85±0.04 vs 1.58±0.04, 24 h 1.95±0.02 vs 1.60±0.03, 48 h 2.22±0.13 vs 1.99±0.10, P<0.05)及ALT、AST测定值均降低(AST测定值: 6 h 17.23 U/L±3.01 U/L vs 13.13 U/L±2.41 U/L, 24 h 19.33 U/L±3.01 U/L vs 15.67 U/L±2.36 U/L, 48 h 24.40 U/L±3.93 U/L vs 19.18 U/L±1.65 U/L, P<0.05; ALT测定值: 6 h 17.23 U/L±3.01 U/L vs 13.13 U/L±2.41 U/L, 24 h 19.33 U/L±3.01 U/L vs 15.67 U/L±2.36 U/L, 48 h 24.40 U/L±3.93 U/L vs 19.18 U/L±1.65 U/L, P<0.05), 差异有统计学意义.
结论: 血清药理学研究方法可以用于茵陈蒿汤的药效评价, 经IRE1α介导的内质网应激(endoplasmic reticulum stress, ERS)可能是茵陈蒿汤对梗阻性黄疸大鼠肝细胞保护作用的一条重要通路.
核心提示: 梗阻性黄疸是目前肝胆外科常见病, 而茵陈蒿汤是中医治疗黄疸的主要方剂, 本文通过血清药理学研究方法, 探明经肌醇酶1α介导的内质网应激可能是茵陈蒿汤对梗阻性黄疸大鼠肝细胞保护作用的一条重要通路.
引文著录: 宋仕军, 李忠廉, 张西波. 茵陈蒿汤对梗阻性黄疸大鼠肝细胞中IRE1α蛋白表达的影响. 世界华人消化杂志 2016; 24(16): 2520-2524
Revised: May 5, 2016
Accepted: May 9, 2016
Published online: June 8, 2016
AIM: To investigate the effect of medicated serum of Yinchenhao decoction on inositol-requiring enzyme-1-α (IRE1α) protein expression in hepatocytes of rats with obstructive jaundice.
METHODS: Common bile duct ligation was used to generate an SD rat model of obstructive jaundice. Primary hepatocytes were isolated from the rat models. Gavage administration with Yinchenhao decoction was applied to prepare serum containing the corresponding drug. Yinchenhao decoction serum was added into the medium for primary hepatocyte culture in the administrated group (Group B), while the medium containing no drug was used in the sham group (Group A). The expression of IRE1αprotein in cells as well as alanine transaminase (ALT) and aspartate transaminase (AST) in culture fluid was detected.
RESULTS: The levels of IRE1α expression, AST and ALT in group B were significantly lower than those in group A at all time points (expression of IRE1α: 6 h 1.85 ± 0.04 vs 1.58 ± 0.04, 24 h 1.95 ± 0.02 vs 1.60 ± 0.03, 48 h 2.22 ± 0.13 vs 1.99 ± 0.10, P < 0.05; AST: 6 h 17.23 U/L ± 3.01 U/L vs 13.13 U/L ± 2.41 U/L, 24 h 19.33 U/L ± 3.01 U/L vs 15.67 U/L ± 2.36 U/L, 48 h 24.40 U/L ± 3.93 U/L vs 19.18 U/L ± 1.65 U/L, P < 0.05; ALT: 6 h 17.23 U/L ± 3.01 U/L vs 13.13 U/L ± 2.41 U/L, 24 h 19.33 U/L ± 3.01 U/L vs 15.67 U/L ± 2.36 U/L, 48 h 24.40 U/L ± 3.93 U/L vs 19.18 U/L ± 1.65 U/L, P < 0.05).
CONCLUSION: Serum pharmacology test can be used for pharmacodynamic evaluation of Yinchenhao decoction. The endoplasmic reticulum stress mediated by IRE1α might be an important pathway by which Yinchenhao decoction exerts a protective effect on hepatocytes of rats with obstructive jaundice.
- Citation: Song SJ, Li ZL, Zhang XB. Effect of Yinchenhao decoction on expression of IRE1α protein in liver cells of rats with obstructive jaundice. Shijie Huaren Xiaohua Zazhi 2016; 24(16): 2520-2524
- URL: https://www.wjgnet.com/1009-3079/full/v24/i16/2520.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i16.2520
梗阻性黄疸(obstructive jaundice, OJ)是指由于各种不同的原因导致肝内外胆道机械性梗阻, 使得胆汁完全或者部分不能排入十二指肠而引发的黄疸, 他能够导致全身各个器官损害, 其中以肝脏损伤为代表[1,2]. 而内质网应激(endoplasmic reticulum stress, ERS)是肝损伤的重要途径, ERS过程中有三种主要的跨膜蛋白:肌醇酶1(inositol requiring enzyme 1, IRE1)、活化转录因子6(the activating transcription factor 6, ATF6)、蛋白激酶R样内质网激酶(protein kinase R-like ER kinase, PERK). 其中IRE1的表达水平间接反应了ERS及细胞凋亡的严重程度[3,4]. 茵陈蒿汤是由茵陈、生大黄、栀子组成的经典名方, 其功效为清热除湿、利胆退黄[5], 仍是目前临床上中医治疗湿热所致阳黄的第一要方. "血清药理学研究"是指采取口服途径给药, 并在给药一定时间后采集并分离动物血清, 经适当处理后进行体外实验的一种新方法[6], 该方法作为一种新的中药研究思路, 近年来备受推崇. 本实验通过喂食SD大鼠茵陈蒿汤提取含药血清, 体外刺激梗阻性黄疸大鼠原代肝细胞, 观察IRE1蛋白表达变化, 探明其对于梗阻性黄疸的治疗机制.
SD大鼠20只, 体质量270-300 g, 由天津市中西医结合急腹症研究所动物研究中心提供. 胶原酶Ⅳ(美国Sigma公司); DMEM培养基(500 mL)、胎牛血清(500 mL)与 EDTA-胰蛋白酶(500 mL)(美国Gibco公司); PBS溶液(500 mL, 美国Cellgro公司); 青链霉素混合液(100 mL, 美国Hyclone公司). IRE1α Antibody(Santa Cruz公司); 灌注液A: Hank's液500 mL, 含2 mmol/L EGTA和0.1%葡萄糖溶液; 灌注液B: Hank's液200 mL, 含0.3 g/L Ⅳ型胶原蛋白酶和5 mmol/L CaCl2. PVDF膜(孔径为0.22 μm)(美国Millipore公司); 高速离心机(Avanti J-30I型)(美国BECKMAN公司); 生物安全柜(MSC-ADVANTAGE)与CO2恒温培养箱(311型) (美国Thermo公司); 电泳仪(北京百晶生物技术有限公司); 倒置光学显微镜(DM14000B型)(德国Leica公司). 全自动生化仪(奥林巴斯AU2700).
1.2.1 茵陈蒿汤的配制: 依据《金匮要略·黄疸病脉证并治第十五》中的记载, 本实验的茵陈蒿汤的成分为: 茵陈蒿100 g, 栀子70 g, 生大黄40 g, 共计210 g. 药品从天津市中西医结合医院草药房购买. 煎药方法: 预先冷水浸泡30 min后煎煮, 先后45 min煎煮1次, 30 min煎煮1次, 取2次煎煮后的药液浓缩至200 mL, 每毫升含生药量约1.0 g, 置4 ℃冰箱里保存备用.
1.2.2 大鼠梗阻性黄疸模型的建立及含药血清的制备: 梗阻性黄疸模型建立: 大鼠腹腔注射20%乌拉坦(1 mL/kg)麻醉; 大鼠头部以下浸泡酒精消毒, 固定于超净台内的手术板上, 剔除腹部毛发, 下腹端切口剖开整个腹腔, 暴露出肝脏; 充分显露肝门及胰腺, 游离胆总管, 于胆总管中上1/3处双重结扎胆总管, 然后间断全层缝合关腹. 术后大鼠毛色、尾巴、耳朵、爪子、尿液逐渐变黄, 提示梗阻性黄疸模型建立成功. 含药血清的制备: 按动物体表面积比率换算等效剂量法计算给予茵陈蒿汤的剂量, 为1 mL/100 g体质量. 在梗阻性黄疸造模手术当日开始给予大鼠茵陈蒿汤灌胃, 每天1次, 第7天经腹主动脉取血, 离心后血清经0.22 μm微孔滤膜过滤, 置4 ℃冰箱里保存备用.
1.2.3 梗阻性黄疸大鼠原代肝细胞分离及培养: 采用简化改良后的"原位在体两步灌流法"[7]分离出大鼠肝细胞, 简要步骤如下: 梗阻性黄疸大鼠术后第7天, 从原手术切口入腹, 具体麻醉及手术入腹方法如1.2.2, 暴露肝脏后, 从大鼠肝门静脉插入灌注针, 输入材料中所述的灌注液A流速6 mL/min以除去肝脏中的血液, 待肝脏肿胀膨大后, 切断下腔静脉及肝静脉, 排出血液; 灌注约10 min后见下腔静脉流出的灌流液无血液, 改用含Ⅳ型胶原蛋白酶的灌注液B流速10 mL/min灌注约15 min, 肝质变软且按压后凹陷不易恢复; 取下肝叶剪碎肝组织并加入胶原酶溶液继续消化20 min, 终止消化后过100目筛梯度离心分离去除红细胞得到肝细胞混悬液, 反复用PBS溶液洗涤纯化后用台盼蓝染色测定细胞总数及存活率. 活细胞率≥90%用于实验. 将浓度为每毫升1×106个肝细胞, 以1×105个/cm2接种于24孔培养板中, 于CO2培养箱(50 mL/L CO2)、37 ℃培养.
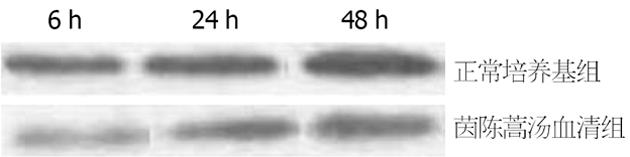
1.2.4 细胞分组及给药: 将培养的肝细胞分为两组: 正常培养基组(A组)和加入茵陈蒿汤血清组(B组), 其中A组培养基为: DMEM高糖培养基+10%胎牛血清 +1%青链霉素混悬液; B组培养基为: DMEM高糖培养基+10%胎牛血清+10%喂食茵陈蒿汤大鼠血清+1%青链霉素混悬液. 每组18孔, 分别于6、24、48 h取各孔的培养液分别留存用于测定ALT、AST, 细胞用于测定IRE1α蛋白含量.
1.2.5 培养液中ALT、AST的测定: 收集得各孔细胞培养液经3000 r/min离心10 min, 取上层液使用全自动生化仪测定各组血清谷丙转氨酶(alanine transaminase, ALT)、谷草转氨酶(aspartate transaminase, AST)的值.
1.2.6 Western blot法测定肝细胞中IRE1α蛋白含量: 取出培养液后, 在各孔中加入裂解液, 提取细胞总蛋白, 根据蛋白定量结果, 加入相应体积的总蛋白样品与5×蛋白质凝胶电泳上样缓冲液, 轻轻混合, 95 ℃变性10 min, 立即插入冰中待用. 将样品轻轻加至凝胶孔中, 电泳仪设置成稳压状态, 接通电源, 将电压调至80 V恒压使样品通过浓缩胶与分离胶(电压约8 V/cm). 电泳使染料至分离胶适当位置, 结束电泳. 采用美国UVP分析仪器, 对胶片进行扫描, 然后括住每一个条带, 系统自动生成灰度值, 即为结果.
统计学处理 应用SPSS22.0统计学软件分析数据结果, 计量资料以mean±SD表示, 统计方法采用单因素方差分析, P<0.05为差异具有统计学意义.
与A组相比, B组各个时间点的AST及ALT含量均明显降低, 差异有统计学意义(P<0.05)(表1).
梗阻性黄疸是临床上常见的病理状态, 多因胆道炎症、结石、肿瘤等因素导致, 可以引发机体各系统器官的损害及病理生理改变[8]. 他可造成肝脏以及全身多器官、多系统发生一系列病理和生理改变, 其中最主要是肝脏损伤, 也就是其他并发症的重要诱因. 随着梗阻时间延长, 肝脏最终萎缩、肝细胞最终消亡. 细胞死亡有两种不同途径: 一种为细胞坏死; 另一种为细胞凋亡[9]. 其诱发肝细胞凋亡的机制有[10]: (1)死亡受体途径; (2)线粒体途径; (3)ERS凋亡途径. 其中ERS凋亡途径是目前发现的一种新的凋亡途径. ERS凋亡途径包括3种通路[11]: (1)IRE1α-JNK的激活通路; (2)PERK/elF-2α-CHOP基因的激活转录; (3)内质网特有的Caspase12的激活.
IRE1是一种重要的内质网跨膜蛋白, 参与了ERS的三个阶段, 包括适应、警戒、凋亡[12]. 目前已知IRE1有两种蛋白亚型, 即IRE1α和IRE1β, 他们由不同的基因编码而成. 而肝细胞中只有IRE1α表达[13]. IRE1α是内质网膜上的一种Ⅰ型跨膜蛋白, 参与了未折叠蛋白反应(unfolded protein response, UPR)号传导通路. IRE1α是一种核糖核酸酶, 主要有三个不同的功能区, 分别是激酶域、RNase域和氨基末端域. 其中氨基末端域位于内质网腔, 而激酶域和RNase域位于胞质侧[14]. 当肝细胞内质网腔内有未折叠蛋白蓄积时, 能够激活氨基末端域, 并跨过内质网转导信号, 使位于胞质侧的蛋白激酶域激活, 导致自身氧化磷酸化发生, 形成p-IRE1a, 同时进一步激活RNase域(XBP5), 使得IRE1α与伴侣蛋白解离而活化, 从而发挥IRE1α的核酸内切酶活力, 进而剪接XBP-1的前体mRNA分子中的26 bp的内含子, 剪接后的XBP-1(s) mRNA发生翻译框移, 编码产生具有转录活性的XBP-1s, 进而启动并增强了与蛋白折叠及降解有关的基因JNK的表达[15].
茵陈蒿汤最早见于汉代张仲景伤寒论中, 是目前治疗梗阻性黄疸的经典方剂[16], 由茵陈、大黄、栀子组成, 其以茵陈最善清利湿热为主药, 结合清利三焦之栀子和荡泄阳明之大黄, 三药联合, 使湿热蕴结之邪排出体外, 有清热利湿退黄之功效[17]. 现代医学研究证实, 茵陈蒿具有显著的利胆作用, 茵陈还具有解毒抗氧化的作用, 茵陈中的茵陈色原酮能抑制转化生长因子和脑源性神经营养因子活性, 从而使葡萄糖醛酸不被分解, 加强肝脏解毒作用栀子具有明显的促进胆囊收缩的作用, 还可使结扎胆总管动物的Y、Z蛋白升高, 且能增加肝脏二磷酸尿昔葡萄糖脱氢酶活性, 从而明显降低血清中胆红素含量大黄具有保肝利胆退黄调节免疫和抗病毒抗脂质过氧化和抗肝纤维化等作用[18].
本研究表明, 与正常培养基组(A组)相比, 加入茵陈蒿汤血清培养基(B组)中ALT、AST含量明显降低, 提示茵陈蒿汤含药血清对梗阻性黄疸原代肝细胞功能恢复有确切效果, 其IRE1α的表达水平明显降低, 提示茵陈蒿汤对梗阻性黄疸肝细胞保护机制与IRE1α-JNK介导的ERS相关, 可能是通过抑制IRE1α的活化, 减少JNK基因表达, 降低ERS的程度而减少肝细胞凋亡, 这为临床上应用茵陈蒿汤辨证治疗梗阻性黄疸提供了又一佐证.
茵陈蒿汤由茵陈、大黄、栀子组成, 最早记载于汉代张仲景《伤寒论》, 其治疗梗阻性黄疸的具体作用机制是目前研究热点, 本文通过血清药理学方法探究茵陈蒿汤在抗肝细胞凋亡中的机制.
钦丹萍, 教授, 浙江中医药大学附属第一医院消化内科
氧化应激是导致肝损伤的重要机制, 多种自由基和抗氧化系统参与构成了一个较为复杂的网络反应体系, 各种不同的组分在整个氧化应激体系中的地位及其相关关系成为研究热点, 如何应用中药对抗氧化应激保护肝细胞是研究的重点.
许波等研究表明茵陈蒿汤含药血清中的药源性成分主要为来源于大黄的蒽醌类成分、来源于栀子的环烯醚萜类成分和西红花酸类成分及以上成分的代谢产物, 这些药源性成分可能构成了该方保肝作用的药效物质基础.
本文通过分离梗阻性黄疸大鼠肝细胞离体培养, 并应用茵陈蒿汤含药血清为刺激因素, 既完全保留了茵陈蒿汤在体内所有可能的作用因子, 又避免了体内其他因素对肝细胞的干扰, 故研究结果对临床参考价值大.
本文通过血清药理学研究方法, 证实了经IRE1α介导的内质网应激是茵陈蒿汤对梗阻性黄疸大鼠肝细胞保护作用的一条重要通路. 为茵陈蒿汤辨证治疗梗阻性黄疸提供理论基础.
未折叠蛋白反应(UPR): 指只有合适的组装蛋白质才能从内质网进入细胞表面. 细胞会根据需要来调节内质网内部蛋白质组装能力, 从而确保蛋白质折叠的精确性. 肝细胞凋亡时内质网内未折叠蛋白蓄积激活并增强内质网的组装折叠能力的反应.
本文研究方向、结论合理, 研究方法创新性好, 对茵陈蒿汤中药药理学方法评价具有一定的参考意义, 有一定的可读性和科学性.
编辑: 郭鹏 电编:闫晋利
| 1. | Sun C, Yan G, Li Z, Tzeng CM. A meta-analysis of the effect of preoperative biliary stenting on patients with obstructive jaundice. Medicine (Baltimore). 2014;93:e189. [PubMed] [DOI] |
| 2. | Distler M, Kersting S, Rückert F, Dobrowolski F, Miehlke S, Grützmann R, Saeger HD. Palliative treatment of obstructive jaundice in patients with carcinoma of the pancreatic head or distal biliary tree. Endoscopic stent placement vs. hepaticojejunostomy. JOP. 2010;11:568-574. [PubMed] |
| 3. | Gupta A, Hossain MM, Read DE, Hetz C, Samali A, Gupta S. PERK regulated miR-424(322)-503 cluster fine-tunes activation of IRE1 and ATF6 during Unfolded Protein Response. Sci Rep. 2015;5:18304. [PubMed] [DOI] |
| 4. | Han D, Lerner AG, Vande Walle L, Upton JP, Xu W, Hagen A, Backes BJ, Oakes SA, Papa FR. IRE1alpha kinase activation modes control alternate endoribonuclease outputs to determine divergent cell fates. Cell. 2009;138:562-575. [PubMed] [DOI] |
| 7. | Wang KP, Zeng F, Liu JY, Guo D, Zhang Y. Inhibitory effect of polysaccharides isolated from Angelica sinensis on hepcidin expression. J Ethnopharmacol. 2011;134:944-948. [PubMed] [DOI] |
| 9. | Wang K. Molecular mechanisms of liver injury: apoptosis or necrosis. Exp Toxicol Pathol. 2014;66:351-356. [PubMed] [DOI] |
| 10. | Mariño G, Niso-Santano M, Baehrecke EH, Kroemer G. Self-consumption: the interplay of autophagy and apoptosis. Nat Rev Mol Cell Biol. 2014;15:81-94. [PubMed] |
| 11. | Cao Y, Hao Y, Li H, Liu Q, Gao F, Liu W, Duan H. Role of endoplasmic reticulum stress in apoptosis of differentiated mouse podocytes induced by high glucose. Int J Mol Med. 2014;33:809-816. [PubMed] [DOI] |
| 12. | Logue SE, Cleary P, Saveljeva S, Samali A. New directions in ER stress-induced cell death. Apoptosis. 2013;18:537-546. [PubMed] [DOI] |
| 13. | Martino MB, Jones L, Brighton B, Ehre C, Abdulah L, Davis CW, Ron D, O'Neal WK, Ribeiro CM. The ER stress transducer IRE1β is required for airway epithelial mucin production. Mucosal Immunol. 2013;6:639-654. [PubMed] [DOI] |
| 14. | Sano R, Reed JC. ER stress-induced cell death mechanisms. Biochim Biophys Acta. 2013;1833:3460-3470. [PubMed] [DOI] |
| 15. | Phillips MJ, Voeltz GK. Structure and function of ER membrane contact sites with other organelles. Nat Rev Mol Cell Biol. 2016;17:69-82. [PubMed] [DOI] |
| 17. | Chen Z, Ma X, Zhao Y, Wang J, Zhang Y, Li J, Wang R, Zhu Y, Wang L, Xiao X. Yinchenhao decoction in the treatment of cholestasis: A systematic review and meta-analysis. J Ethnopharmacol. 2015;168:208-216. [PubMed] [DOI] |