修回日期: 2016-04-21
接受日期: 2016-04-25
在线出版日期: 2016-06-08
目的: 本研究通过检测人类胃癌组织及相应的癌旁组织中Ⅱ型多磷酸肌醇4-磷酸酶(inositol polyphosphate-4-phosphatase type Ⅱ, INPP4B)的mRNA及蛋白表达情况, 分析其与胃癌临床病理特征的关系, 探讨其在胃癌发生发展中的意义.
方法: 采用实时荧光定量PCR法(quantitative real-time PCR, qRT-PCR)及免疫组织化学SP法检测50例胃癌患者的癌组织及相应的癌旁组织(距癌组织边缘>5 cm)中INPP4B mRNA及蛋白表达情况. 并分析INPP4B表达与胃癌临床病理特征的关系.
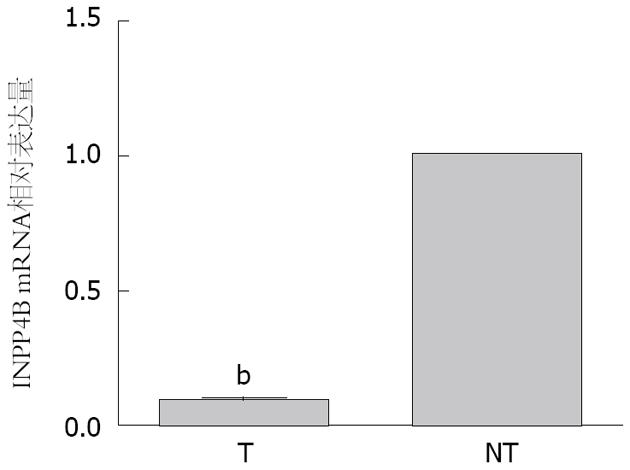
结果: qRT-PCR结果显示, 胃癌组织中INPP4B mRNA表达均明显低于相应的癌旁组织(P<0.01). 免疫组织化学结果显示胃癌组织中INPP4B蛋白的表达阳性率明显低于相应癌旁组织的阳性率(28.0% vs 82.0%, P<0.01). INPP4B mRNA及蛋白表达与胃癌的分化程度、淋巴结转移及TNM分期密切相关(P<0.01), 而与患者的性别、年龄、肿瘤直径无关(P>0.05).
结论: INPP4B mRNA及蛋白均在胃癌组织中表达下调, 与胃癌的分化程度、淋巴结转移及TNM分期密切相关; INPP4B可能在胃癌中起着抑癌基因的作用, 其研究可能为胃癌的治疗提供新的方向.
核心提示: 为了延长胃癌患者的生存时间, 提高胃癌患者的生存质量, 胃癌分子靶向治疗药物的研发越来越成为医学研究的热点. 本文研究发现Ⅱ型多磷酸肌醇4-磷酸酶在胃癌组织中表达下调, 提示其可能在胃癌的发生、发展过程中起到抑制作用, 该发现可能为胃癌的靶向治疗提供新的方向.
引文著录: 胡勤龙, 王红兵, 杨明. INPP4B基因在胃癌组织中的表达及意义. 世界华人消化杂志 2016; 24(16): 2478-2484
Revised: April 21, 2016
Accepted: April 25, 2016
Published online: June 8, 2016
AIM: To investigate the expression of inositol polyphosphate-4-phosphatase, type II (INPP4B) in gastric cancer, and to analyze its relationship with clinical and pathological characteristics.
METHODS: The expression of INPP4B mRNA and protein in 50 gastric cancer tissues and matched tumor-adjacent normal tissues was detected by quantitative real-time PCR (qRT-PCR) and immunohistochemistry (IHC), respectively. The relationship between INPP4B expression and clinical and pathological characteristics was then analyzed.
RESULTS: INPP4B mRNA expression was significantly lower in gastric cancer tissue than in adjacent normal tissues (P < 0.01). The expression of INPP4B protein in gastric cancer tissues was also significantly lower compared with adjacent normal tissues (28.0% vs 82.0%, P < 0.01). The expression of INPP4B mRNA and protein was significantly related to tumor differentiation, lymph node metastasis and TNM stage in GC (P < 0.05), but not to gender, age or tumor size (P > 0.05).
CONCLUSION: Both INPP4B protein and mRNA are down-regulated in gastric cancer, and its expression significantly correlates with tumor differentiation, lymph node metastasis and TNM stage. INPP4B may be a tumor suppressor gene for gastric cancer.
- Citation: Hu QL, Wang HB, Yang M. Significance of expression of INPP4B in gastric cancer. Shijie Huaren Xiaohua Zazhi 2016; 24(16): 2478-2484
- URL: https://www.wjgnet.com/1009-3079/full/v24/i16/2478.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i16.2478
国际癌症研究机构2012年的统计数据表明, 胃癌是世界上5种最常见的恶性肿瘤之一, 并且每年因胃癌死亡的人数在恶性肿瘤中位于第3位[1]. 目前手术切除仍是胃癌首选的治疗手段, 对于复发或者不适合手术的患者, 化疗或放疗是主要的治疗方式, 尽管近年来胃癌的死亡率有所下降, 但总体疗效未得到明显改善, 因此寻求新的治疗手段有着重大的意义[2]. 胃癌的发生、发展是一个多方面, 多因素相互作用的长期过程, 涉及癌基因的激活、抑癌基因的突变失活、多种传导通路失调等多方面[3-5], 因此针对胃癌发生、发展机制的研究, 无疑会对胃癌治疗提供新的思路. Ⅱ型多磷酸肌醇4-磷酸酶(inositol polyphosphate 4-phosphatase type Ⅱ, INPP4B)作为一种新发现潜在的抑癌基因[6], 通过抑制AKT激酶, 阻断PI3K/AKT信号传导通路, 减弱肿瘤细胞的生长、增殖能力, 诱发肿瘤凋亡[7,8]. 研究[9-13]发现其在前列腺癌、乳腺癌、卵巢癌、黑色素瘤、白血病等恶性肿瘤肿瘤中表达减少. 但目前国内外关于INPP4B在胃癌组织中表达的情况尚无相关性报道. 本研究采用实时荧光定量PCR法(quantitative real-time PCR, qRT-PCR)及免疫组织化学SP法的对50例胃癌患者癌组织及癌旁组织中的INPP4B核酸及蛋白进行检测, 分析其表达情况, 并探讨其与胃癌临床病理特征的相关性及临床意义.
本研究用新鲜组织标本取自徐州医学院附属医院胃肠外科及肿瘤外科2015-08/2015-11的50例胃癌手术标本, 50例胃癌患者术前均未接受任何抗肿瘤治疗, 且临床病理资料均完整. 50例标本均为腺癌, 术后均经病理证实. 其中男性36例, 女性14例, 年龄45-81岁, 中位年龄63岁. 标本中肿瘤直径<5 cm 31例, ≥5 cm 19例; 低分化腺癌29例, 中分化腺癌17例, 高分化腺癌4例; 无淋巴结转移21例, 有淋巴结转移29例; TNM分期(UICC, 2010): Ⅰ期12例、Ⅱ期10例、Ⅲ期28例. 所有组织标本均于样本离体后立即取材, 每份标本分别取癌组织和癌旁组织, 癌旁组织取自距癌组织边缘5 cm以上的正常胃黏膜组织. 标本分两部分处理, 一份3/440 g/L甲醛溶液固定后石蜡包埋, 切成4 μm厚的连续石蜡切片备用; 另一份用液氮速冻后-80 ℃冰箱保存用于提取组织总RNA. INPP4B兔抗人多克隆抗体(购自美国CST公司), 免疫组织化学试剂盒(SP法, 购自北京中杉金桥生物技术有限公司), 浓缩型DAB试剂盒(购自北京中杉金桥生物技术有限公司), RNA提取试剂(TRIzol)(购自美国invitrogen公司), qRT-PCR试剂盒(日本TAKARA公司).
1.2.1 RNA提取及qRT-PCR法: 实验步骤如下: 按照TRIzol试剂说明书操作提取组织总RNA, 紫外分光光度计检测其浓度及A260/280比值. 取总RNA 2 μg, 按照PrimeScriptTM RT Master Mix(TAKARA公司)逆转录试剂盒说明书合成cDNA, 然后通过美国ABI公司的7500型RT-PCR仪进行荧光定量PCR, INPP4B引物序列为: 上游引物5'-GAAGAGTGGGACAGGGTGTG-3', 下游引物5'-GGGTGAGAGGGAATGGCATC-3'; β-actin作为内参对照, β-actin引物序列为: 上游引物5'-AGCGAGCATCCCCCAAAGTT-3', 下游引物5'-GGGCACGAAGGCTCATCATT-3'. PCR反应体系为10 μL, 反应条件: 95 ℃ 30 s, 95 ℃ 5 s, 60 ℃ 34 s, 以上40个循环. 癌组织组及癌旁组均设3个复孔. 采用相对定量的方法, 取2-△△Ct值进行比较.
1.2.2 免疫组织化学SP法: 实验步骤如下: (1)将组织石蜡包块按4 μm厚度切片, 置于65 ℃烤箱3 h; (2)二甲苯脱蜡、梯度乙醇水化; (3)柠檬酸盐缓冲液中抗原修复, PBS冲洗3次; (4)3%H2O2室温孵育10 min, PBS冲洗3次; (5)滴加50 μL试剂A(山羊血清工作液), 室温封闭45 min后甩干; (6)滴加约50 μL稀释一抗(比例为1:400), 4 ℃冰箱孵育过夜; (7)次日去除一抗, 复温45 min, 滴加二抗, 室温孵育30 min, PBS冲洗3次; (8)DAB显色, 显微镜下观察染色程度, 染色充分后, 立即水洗终止; (9)苏木素复染3 min; 逐级乙醇脱水、二甲苯透明、中性树胶封片.用已知阳性切片作为阳性对照, 以PBS缓冲液替代一抗作为阴性对照. 免疫组织化学结果判断: INPP4B免疫组织化学以细胞质内出现棕黄色颗粒或棕褐色颗粒为阳性结果. 根据染色细胞百分比及染色强度进行评判及分析: 阳性染色细胞数的百分比计分: >75%为4分, 51%-75%为3分, 6%-25%为1分, <5%为0分. 染色强度计分: 棕褐色为3分, 棕黄色为2分, 浅棕黄色为1分, 无着色为0分. 两项结果乘积为最后评价结果: 0-1分为阴性(-), 2-4分为弱阳性(1+), 5-8分为中等阳性(2+), 9-12分为强阳性(3+). 在统计分析中将 (-/1+)定为阴性表达, 将(2+/3+)定为阳性表达.
统计学处理 运用SPSS16.0软件进行统计学分析. 数据采用以mean±SD表示, 计量资料的差异性采用t检验或ANVOA检验; 计数资料的差异性采用Pearson χ2检验法. P<0.05为差异有统计学意义.
qRT-PCR结果显示: 50例胃癌患者癌组织及癌旁组织中均有INPP4B mRNA表达. 定义癌旁组织中INPP4B mRNA相对表达量为1, 胃癌组织中INPP4B mRNA表达量约为癌旁组织的0.0943倍±0.0449倍, 明显低于癌旁组织, 有统计学意义(P<0.01)(图1).
胃癌组织中, INPP4B mRNA表达与肿瘤分化程度、淋巴结转移及TNM分期明显相关, 差异显著, 有统计学意义(P<0.01), 而与患者的性别、年龄、肿瘤直径等无关, 差异无统计学意义(P>0.05)(表1).
| 临床病理特征 | n | INPP4B mRNA相对表达量 | P值 |
| 性别 | 0.270 | ||
| 男 | 36 | 0.0899±0.0451 | |
| 女 | 14 | 0.1056±0.0437 | |
| 年龄(岁) | 0.631 | ||
| ≤63 | 25 | 0.0918±0.0415 | |
| >63 | 25 | 0.0968±0.0488 | |
| 肿瘤直径(cm) | 0.813 | ||
| <5 | 31 | 0.0955±0.0450 | |
| ≥5 | 19 | 0.0924±0.0459 | |
| 组织分化程度 | <0.01 | ||
| 低分化 | 29 | 0.0764±0.0371 | |
| 中或高分化 | 21 | 0.1190±0.0436 | |
| 淋巴结转移 | <0.01 | ||
| 无 | 21 | 0.1277±0.0397 | |
| 有 | 29 | 0.0701 ±0.0310 | |
| TNM分期 | <0.01 | ||
| Ⅰ期 | 12 | 0.1577±0.0179 | |
| Ⅱ期 | 10 | 0.1094±0.0116 | |
| Ⅲ期 | 28 | 0.0618±0.0228 |
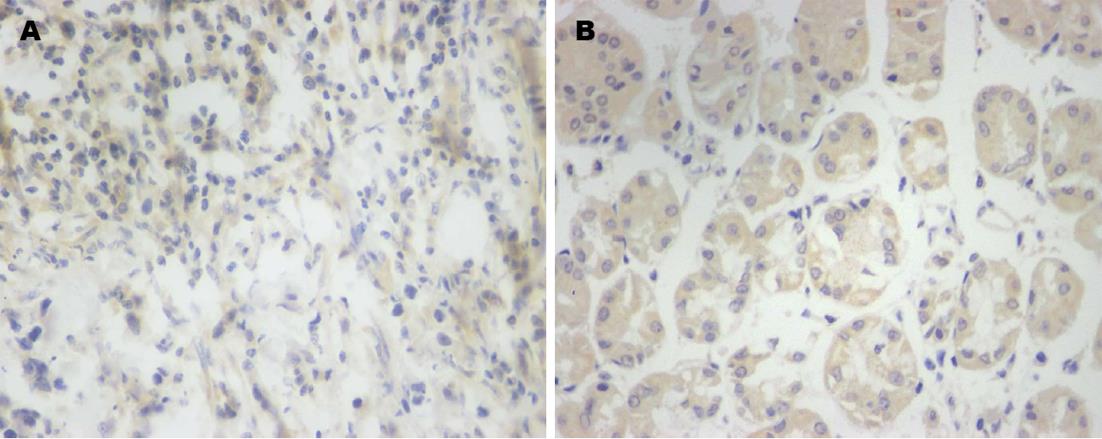
免疫组织化学结果显示: 50例胃癌患者癌组织及癌旁组织中INPP4B蛋白有着不同程度的表达, 在癌旁组织中INPP4B多呈现出高表达, 表现为细胞质内均匀分布的棕褐色颗粒, 而癌组织多呈现低表达或阴性表达(图2). 癌旁组织阳性表达率为82.0%(41/50), 癌组织阳性表达率为28.0%(14/50), 癌旁组织中INPP4B蛋白阳性表达率显著高于癌组织, 两者差异有统计学意义(χ2 = 29.455, P<0.01)(表2).
| 临床病理特征 | n | INPP4B蛋白表达n(%) | P值 | |
| 阳性表达 | 阴性表达 | |||
| 部位 | <0.01 | |||
| 胃癌组织 | 50 | 14(28) | 36(72) | |
| 癌旁组织 | 50 | 41(82) | 9(18) | |
| 性别 | 0.449 | |||
| 男 | 36 | 9(25.0) | 27(75.0) | |
| 女 | 14 | 5(35.7) | 9(64.3) | |
| 年龄(岁) | 0.529 | |||
| ≤63 | 25 | 8(32.0) | 17(68.0) | |
| >63 | 25 | 6(24.0) | 19(76.0) | |
| 肿瘤直径(cm) | 0.836 | |||
| <5 | 31 | 9(29.0) | 22(71.0) | |
| ≥5 | 19 | 5(26.3) | 14(73.7) | |
| 组织分化程度 | <0.01 | |||
| 未或低分化 | 29 | 4(13.8) | 25(86.2) | |
| 中或高分化 | 21 | 10(47.6) | 11(52.4) | |
| TNM分期 | 0.015 | |||
| Ⅰ/Ⅱ期 | 22 | 10(45.5) | 12(54.5) | |
| Ⅲ期 | 28 | 4(14.3) | 24(85.7) | |
| 淋巴结转移 | <0.01 | |||
| 无 | 21 | 12(57.1) | 9(49.2) | |
| 有 | 29 | 2(6.9) | 27(93.1) | |
胃癌组织中, INPP4B蛋白表达与肿瘤分化程度、淋巴结转移及TNM分期明显相关, 差异有统计学意义(P<0.05), 而与患者的性别、年龄、肿瘤直径等无关, 差异无统计学意义(P>0.05)(表2).
胃癌是一种多因素相互作用引起的疾病, 其发病的主要危险因素包括吸烟、过度饮酒、饮食、地域、遗传、感染幽门螺杆菌等, 但也不仅仅局限于此[14], 目前胃癌的治疗, 包括手术治疗, 放化疗, 分子靶向治疗等[15], 通过合理的治疗, 目前我国胃癌患者生存期得到了延长, 并且生活质量也有所改善. 但由于胃癌具有高度的侵袭性及转移性, 超过50%的患者初诊时已进入进展期, 使得术后患者的复发率居高不下[16]. 侵袭和转移是胃癌等恶性肿瘤最重要的生物学行为, 也是胃癌患者术后复发和死亡的最主要原因[17,18].
目前胃癌发生、发展的机制尚未完全明确, 但涉及一系列传导通路失调, 有报道表明PI3K/AKT/mTOR信号传导通路异常激活在胃癌的发生、发展过程中起着重要作用, 并且与预后密切相关[2,19]. PI3K/AKT通路参与调控许多重要的生物过程, 比如细胞的生长、增殖、凋亡及迁移, 其调节异常与肿瘤的血管生成、恶性增殖及侵袭转移密切相关[6,20,21]. 因此寻求途径调节PI3K/AKT信号通路, 可能为胃癌治疗提供新的思路. 近期, Gewinner等[22]发现INPP4B在抑制PI3K/AKT信号通路中起着重要作用. INPP4B定位于人染色体4q31.21, 其分子量约110 kDa, 主要高表达于骨骼肌、心脏、脑、肝脏和胰腺等组织, 除此之外还存在于乳腺及前列腺上皮细胞中. INPP4B结构包括N末端C2脂质结合域, NHR 2及C-末端磷酸酶结构域[23-25]. INPP4B可促使PI(3,4)P2的D4位磷酸基团去磷酸化, 使其降解为3磷酸磷脂酰肌醇[PI(3)P], 从而抑制AKT活化, 阻断PI3K/AKT信号通路传导, 进而抑制肿瘤进一步发展[26,27]. Ross等[28]对132例急性淋巴细胞白血病(ALL)患儿的白血病细胞的基因分析, 发现与其他的所有亚型相比, INPP4B在BCR-ABL融合基因阳性的急性淋巴细胞白血病中的表达增加了12.4倍. Perez-Lorenzo等[29]通过对59例黑色素痣、67例原发黑色素瘤及56例转移性黑色素瘤的患者研究发现INPP4B在原发黑色素瘤或转移性黑色素瘤中的表达明显低于黑色素痣. 在小鼠的种瘤试验中, 利用小干扰RNA敲除INPP4B后, 黑色素瘤的成瘤能力及细胞的增殖能力均有提升. Hodgson等[26]利用免疫组织化学技术检测发现相对于正常前列腺上皮组织INPP4B蛋白在前列腺癌组织中表达下调, 并且INPP4B表达减少会增加前列腺癌生化指标复发的风险. INPP4B在人类的一些乳腺癌中出现杂合性缺失, Fedele等[30]发现INPP4B只有在非增殖状态下的雌激素受体(estrogen receptor, ER)阳性的正常人类乳腺癌细胞株中表达, 并且敲除INPP4B后, 乳腺癌细胞的增殖、侵袭能力增强. 相反, 在ER阴性的乳腺癌细胞中重构INPP4B表达后, 乳腺癌细胞的生长能力减弱. 这些研究表明INPP4B的表达在多种恶性肿瘤的发生、发展起着负调控作用. 本研究通过qRT-PCR分别检测50例胃癌患者癌组织及其相应癌旁组织中INPP4B mRNA表达情况, 我们发现胃癌组织中INPP4B mRNA的表达量明显低于癌旁组织, 差异有统计学意义(P<0.01); 同时我们采用免疫组织化学法对50例胃癌患者癌组织及其相应癌旁组织中INPP4B蛋白表达情况进行检测, 证实胃癌组织中INPP4B蛋白的表达水平同样明显减低(P<0.01). 并且通过与胃癌相关病理特征的统计分析, 我们发现INPP4B mRNA及蛋白的表达与胃癌的肿瘤分化程度有关, 分化程度越高, INPP4B mRNA及蛋白的表达量越高, 提示INPP4B的表达可能影响胃癌的分化过程. 我们还发现有淋巴结转移的患者胃癌组织中INPP4B mRNA及蛋白表达明显低于无淋巴结转移的患者, Ⅲ、IV期的INPP4B mRNA及蛋白阳性表达亦明显低于Ⅰ、Ⅱ期, 提示INPP4B与胃癌的侵袭、转移密切相关.
总之, INPP4B mRNA及蛋白在胃癌组织中表达量均减少, 并且INPP4B在胃癌的发生、发展、侵袭、转移中起着负调控作用, 提示我们INPP4B可能是胃癌的一种抑制基因, 可作为胃癌治疗的新靶点, 为我们研究胃癌的治疗提供新的方向.
感谢杜贝贝女士对此研究提供的帮助.
II型多磷酸肌醇4-磷酸酶(inositol polyphosphate 4-phosphatase type II, INPP4B)作为一种新发现潜在的抑癌基因, 通过阻断PI3K/AKT信号传导通路, 减弱肿瘤细胞的生长、增殖能力, 从而诱发肿瘤凋亡. 本文研究INPP4B在胃癌组织中的表达情况, 有助于大家进一步了解胃癌的发生、发展机制, 并为胃癌的治疗提供新的方向.
关泉林, 教授, 兰州大学第一医院肿瘤外科; 卢宁, 副主任医师, 兰州军区乌鲁木齐总医院肿瘤科
目前研究发现INPP4B在多种恶性肿瘤中的发生、发展过程中起到负调控作用, 并与预后密切相关. 但目前关于INPP4B在胃癌中的表达尚无相关性报道.
目前国内外研究人员发现INPP4B在前列腺癌、乳腺癌、卵巢癌、黑色素瘤、白血病等恶性肿瘤中表达下调, 并且发现INPP4B的表达与肿瘤侵袭、转移以及肿瘤患者的预后有关.
本文研究发现, INPP4B在胃癌组织中表达下调, 且与胃癌分化程度、TNM分期及淋巴结转移密切相关, 提示INPP4B在胃癌的发生发展过程中起负调控作用, INPP4B可能是胃癌的一种抑制基因, 有望成为胃癌治疗的一个新靶点.
本文研究初步探讨了INPP4B在胃癌中的表达情况, 并通过与胃癌的临床病理特征的相关性分析, 发现INPP4B的表达与胃癌分化程度、TNM分期及淋巴结转移密切相关, 为进一步研究以INPP4B为靶点的胃癌靶向治疗提供理论依据.
本文可能为胃癌的治疗打下一定的基础. 内容客观, 分析方法成熟, 观点真实, 具有一定的科学意义.
编辑: 于明茜 电编:闫晋利
| 1. | Yuan DD, Zhu ZX, Zhang X, Liu J. Targeted therapy for gastric cancer: Current status and future directions (Review). Oncol Rep. 2016;35:1245-1254. [PubMed] [DOI] |
| 2. | Liu Y, Chen S, Xue R, Zhao J, Di M. Mefloquine effectively targets gastric cancer cells through phosphatase-dependent inhibition of PI3K/Akt/mTOR signaling pathway. Biochem Biophys Res Commun. 2016;470:350-355. [PubMed] [DOI] |
| 3. | Grabsch HI, Tan P. Gastric cancer pathology and underlying molecular mechanisms. Dig Surg. 2013;30:150-158. [PubMed] [DOI] |
| 4. | Zagouri F, Papadimitriou CA, Dimopoulos MA, Pectasides D. Molecularly targeted therapies in unresectable-metastatic gastric cancer: a systematic review. Cancer Treat Rev. 2011;37:599-610. [PubMed] [DOI] |
| 5. | Sasaki T, Kuniyasu H. Significance of AKT in gastric cancer (Review). Int J Oncol. 2014;45:2187-2192. [PubMed] [DOI] |
| 6. | Yuen JW, Chung GT, Lun SW, Cheung CC, To KF, Lo KW. Epigenetic inactivation of inositol polyphosphate 4-phosphatase B (INPP4B), a regulator of PI3K/AKT signaling pathway in EBV-associated nasopharyngeal carcinoma. PLoS One. 2014;9:e105163. [PubMed] [DOI] |
| 7. | Hakim S, Bertucci MC, Conduit SE, Vuong DL, Mitchell CA. Inositol polyphosphate phosphatases in human disease. Curr Top Microbiol Immunol. 2012;362:247-314. [PubMed] [DOI] |
| 8. | Zhang Q, Claret FX. Phosphatases: the new brakes for cancer development? Enzyme Res. 2012;2012:659649. [PubMed] [DOI] |
| 9. | Chi MN, Guo ST, Wilmott JS, Guo XY, Yan XG, Wang CY, Liu XY, Jin L, Tseng HY, Liu T. INPP4B is upregulated and functions as an oncogenic driver through SGK3 in a subset of melanomas. Oncotarget. 2015;6:39891-39907. [PubMed] [DOI] |
| 10. | Salmena L, Shaw P, Fans I, McLaughlin B, Risch H, Mitchell C, Sun P, Narod SA, Kotsopoulos J. Prognostic value of INPP4B protein immunohistochemistry in ovarian cancer. Eur J Gynaecol Oncol. 2015;36:260-267. [PubMed] |
| 11. | Kofuji S, Kimura H, Nakanishi H, Nanjo H, Takasuga S, Liu H, Eguchi S, Nakamura R, Itoh R, Ueno N. INPP4B Is a PtdIns(3,4,5)P3 Phosphatase That Can Act as a Tumor Suppressor. Cancer Discov. 2015;5:730-739. [PubMed] [DOI] |
| 12. | Hodgson MC, Deryugina EI, Suarez E, Lopez SM, Lin D, Xue H, Gorlov IP, Wang Y, Agoulnik IU. INPP4B suppresses prostate cancer cell invasion. Cell Commun Signal. 2014;12:61. [PubMed] [DOI] |
| 13. | Gasser JA, Inuzuka H, Lau AW, Wei W, Beroukhim R, Toker A. SGK3 mediates INPP4B-dependent PI3K signaling in breast cancer. Mol Cell. 2014;56:595-607. [PubMed] [DOI] |
| 14. | Hu J, La Vecchia C, Negri E, de Groh M, Morrison H, Mery L. Macronutrient intake and stomach cancer. Cancer Causes Control. 2015;26:839-847. [PubMed] [DOI] |
| 15. | Xu W, Yang Z, Lu N. Molecular targeted therapy for the treatment of gastric cancer. J Exp Clin Cancer Res. 2016;35:1. [PubMed] [DOI] |
| 16. | Montagnani F, Turrisi G, Marinozzi C, Aliberti C, Fiorentini G. Effectiveness and safety of oxaliplatin compared to cisplatin for advanced, unresectable gastric cancer: a systematic review and meta-analysis. Gastric Cancer. 2011;14:50-55. [PubMed] [DOI] |
| 17. | Zhao X, Dou W, He L, Liang S, Tie J, Liu C, Li T, Lu Y, Mo P, Shi Y. MicroRNA-7 functions as an anti-metastatic microRNA in gastric cancer by targeting insulin-like growth factor-1 receptor. Oncogene. 2013;32:1363-1372. [PubMed] [DOI] |
| 19. | Ying J, Xu Q, Liu B, Zhang G, Chen L, Pan H. The expression of the PI3K/AKT/mTOR pathway in gastric cancer and its role in gastric cancer prognosis. Onco Targets Ther. 2015;8:2427-2433. [PubMed] [DOI] |
| 20. | Chew CL, Chen M, Pandolfi PP. Endosome and INPP4B. Oncotarget. 2016;7:5-6. [PubMed] [DOI] |
| 21. | Bertucci MC, Mitchell CA. Phosphoinositide 3-kinase and INPP4B in human breast cancer. Ann N Y Acad Sci. 2013;1280:1-5. [PubMed] [DOI] |
| 22. | Gewinner C, Wang ZC, Richardson A, Teruya-Feldstein J, Etemadmoghadam D, Bowtell D, Barretina J, Lin WM, Rameh L, Salmena L. Evidence that inositol polyphosphate 4-phosphatase type II is a tumor suppressor that inhibits PI3K signaling. Cancer Cell. 2009;16:115-125. [PubMed] [DOI] |
| 23. | Liu Y, Cheney MD, Gaudet JJ, Chruszcz M, Lukasik SM, Sugiyama D, Lary J, Cole J, Dauter Z, Minor W. The tetramer structure of the Nervy homology two domain, NHR2, is critical for AML1/ETO's activity. Cancer Cell. 2006;9:249-260. [PubMed] [DOI] |
| 24. | Lopez SM, Hodgson MC, Packianathan C, Bingol-Ozakpinar O, Uras F, Rosen BP, Agoulnik IU. Determinants of the tumor suppressor INPP4B protein and lipid phosphatase activities. Biochem Biophys Res Commun. 2013;440:277-282. [PubMed] [DOI] |
| 25. | Ferron M, Vacher J. Characterization of the murine Inpp4b gene and identification of a novel isoform. Gene. 2006;376:152-161. [PubMed] [DOI] |
| 26. | Hodgson MC, Shao LJ, Frolov A, Li R, Peterson LE, Ayala G, Ittmann MM, Weigel NL, Agoulnik IU. Decreased expression and androgen regulation of the tumor suppressor gene INPP4B in prostate cancer. Cancer Res. 2011;71:572-582. [PubMed] [DOI] |
| 27. | Agoulnik IU, Hodgson MC, Bowden WA, Ittmann MM. INPP4B: the new kid on the PI3K block. Oncotarget. 2011;2:321-328. [PubMed] [DOI] |
| 28. | Ross ME, Zhou X, Song G, Shurtleff SA, Girtman K, Williams WK, Liu HC, Mahfouz R, Raimondi SC, Lenny N. Classification of pediatric acute lymphoblastic leukemia by gene expression profiling. Blood. 2003;102:2951-2959. [PubMed] [DOI] |
| 29. | Perez-Lorenzo R, Gill KZ, Shen CH, Zhao FX, Zheng B, Schulze HJ, Silvers DN, Brunner G, Horst BA. A tumor suppressor function for the lipid phosphatase INPP4B in melanocytic neoplasms. J Invest Dermatol. 2014;134:1359-1368. [PubMed] [DOI] |
| 30. | Fedele CG, Ooms LM, Ho M, Vieusseux J, O'Toole SA, Millar EK, Lopez-Knowles E, Sriratana A, Gurung R, Baglietto L. Inositol polyphosphate 4-phosphatase II regulates PI3K/Akt signaling and is lost in human basal-like breast cancers. Proc Natl Acad Sci USA. 2010;107:22231-22236. [PubMed] [DOI] |