修回日期: 2016-05-06
接受日期: 2016-05-09
在线出版日期: 2016-06-08
目的: 观察内质网应激凋亡通路中关键信号分子Caspase12活性变化, 探讨其在肝纤维化大鼠肝细胞凋亡中的可能作用.
方法: 将Wistar大鼠随机分为正常4 wk组、正常8 wk组、肝纤维化4 wk组和肝纤维化8 wk组. 皮下注射40%CCl4花生油溶液诱导肝纤维化形成, 剂量0.3 mL/100 g体质量, 2次/wk. 肝组织中GRP78、GRP94及Caspase12基因水平的表达通过实时荧光定量PCR技术测定; GRP78、GRP94、Procaspase12及活性Caspase12蛋白的表达采用蛋白质免疫印迹法检测; 肝细胞凋亡通过TUNEL法测定.
结果: 肝纤维化4 wk组大鼠肝组织中GRP78、GRP94及Caspase12 mRNA表达显著高于正常4 wk组大鼠; 肝纤维化8 wk时, 肝组织中GRP78、GRP94、Caspase12 mRNA的表达较正常8 wk组显著增加. 通过Western blot对各指标蛋白水平的检测发现, 肝纤维化4 wk时大鼠肝脏中GRP78、GRP94、Procaspase12及活性Caspase12蛋白的表达较正常4 wk组大鼠显著增加; 肝纤维化8 wk时, 肝脏中GRP78、GRP94、Procaspase12、活性Caspase12蛋白的表达仍保持在高水平, 但与肝纤维化4 wk时比较无显著差异. 细胞凋亡检测发现, 与正常组大鼠比较, 肝纤维化4 wk及8 wk组大鼠肝细胞凋亡均明显升高.
结论: 内质网应激凋亡通路中关键信号分子Caspase12活化可能介导了肝纤维化大鼠肝细胞凋亡的发生.
核心提示: 内质网应激诱导的凋亡是近年来新发现的一种细胞凋亡途径. 本文通过观察内质网应激凋亡通路中关键信号分子Caspase12的活性变化, 证实CCl4诱导的肝纤维化过程中可通过激活Caspase12诱导细胞凋亡的发生, 从而促进肝细胞损伤及肝纤维化的发生.
引文著录: 谢汝佳, 韩冰, 杨婷, 杨勤. 内质网应激凋亡通路中Caspase12激活介导的肝纤维化大鼠肝细胞凋亡. 世界华人消化杂志 2016; 24(16): 2470-2477
Revised: May 6, 2016
Accepted: May 9, 2016
Published online: June 8, 2016
AIM: To observe the change of activity of Caspase12, a key signaling molecule in endoplasmic reticulum stress related apoptosis pathway, and to explore its role in the apoptosis of hepatocytes in rats with hepatic fibrosis.
METHODS: Wistar rats were randomly divided into a 4 wk control group, an 8 wk control group, a 4 wk hepatic fibrosis group and an 8 wk hepatic fibrosis group. Rats of hepatic fibrosis groups received subcutaneous injections of 40% CCl4 twice a week at doses of 0.3 mL/100 g. Expression of GRP78, GRP94 and Caspase12 genes in hepatic tissue was detected by RT-PCR. The expression of GRP78, GRP94, procaspase12 and activated Caspase12 proteins was determined by Western blot. The apoptosis of hepatocytes was evaluated by TUNEL assay.
RESULTS: Expression of GRP78, GRP94 and Caspase12 mRNAs in the 4 wk hepatic fibrosis group was significantly higher than that in the 4 wk control group. In the 8 wk hepatic fibrosis group, expression of GRP78, GRP94 and Caspase12 mRNAs was also elevated obviously. Western blot analysis revealed that expression of GRP78, GRP94, procaspase12 and activated Caspase12 proteins was increased obviously in the liver in the 4 wk hepatic group. Compared with the 8 wk control group, expression of GRP78, GRP94, procaspase12 and activated Caspase12 proteins was elevated obviously in the 8 wk hepatic group. The apoptosis of hepatocytes in the 4 wk and 8 wk hepatic fibrosis groups was significantly higher than that in the control groups.
CONCLUSION: Activation of Caspase12, a key signaling molecule in endoplasmic reticulum stress related apoptosis pathway, may mediate the apoptosis of hepatocytes in rats with hepatic fibrosis.
- Citation: Xie RJ, Han B, Yang T, Yang Q. Activation of Caspase12, a key molecule in endoplasmic reticulum stress related apoptosis pathway, induces apoptosis of hepatocytes in rats with hepatic fibrosis. Shijie Huaren Xiaohua Zazhi 2016; 24(16): 2470-2477
- URL: https://www.wjgnet.com/1009-3079/full/v24/i16/2470.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i16.2470
肝细胞是肝脏内唯一的实质细胞, 近年来关于肝细胞凋亡增加在肝纤维化发病机制中的作用受到了国内外研究人员的广泛关注[1,2]. 大量研究[3,4]证实肝细胞凋亡过度是肝纤维化、肝硬化等病变形成的机制之一. 因此, 深入阐明肝纤维化时肝细胞凋亡的分子机制对肝纤维化及肝硬化的防治具有十分重要的意义. 目前已知肝细胞凋亡可由死亡受体途径、线粒体依赖的凋亡途径及内质网应激(endoplasmic reticulum stress, ERS)等信号通路介导, 特别是ERS诱导的细胞凋亡是近年来发现的一种新的细胞凋亡途径[5-7], 而关于ERS介导肝细胞凋亡的具体分子机制目前仍不十分清楚. 本研究旨在通过观察大鼠肝纤维化形成过程中ERS凋亡通路中关键信号分子Caspase12的活性变化, 探讨其对肝细胞凋亡的影响.
清洁级♂Wistar大鼠由贵州医科大学实验动物中心提供[许可证号: SCXK-(黔)2002-0001]; Caspase12多克隆抗体购自英国Abcam公司; GRP78及GRP94多克隆抗体由美国Santa cruz公司提供; Bradford蛋白定量试剂盒购自北京鼎国昌盛生物技术有限公司; 原位末端标记法(TUNEL)检测试剂盒由武汉博士德公司提供; 增强化学发光试剂盒和PVDF膜购自美国Millipore公司; 吐温20、甘氨酸、三羟甲基氨基甲烷、过硫酸铵、十二烷基硫酸钠由美国Genview公司提供; 丙烯酰胺及甲叉双丙烯酰胺购自美国Amresco公司; TRIzol由美国Invitrogen公司提供; SYBR Green购自大连宝生物工程有限公司; PCR逆转录试剂盒由加拿大Fermentas公司提供; GRP78、GRP94、Caspase12及内参引物购自上海捷瑞生物工程有限公司, 引物序列如表1.
| 引物名称 | 引物序列 | |
| Caspase12 | 上游引物 | 5'-GAAGGAATCTGTGGGGTGAA-3' |
| 下游引物 | 5'-TCCCTTTGCTTGTGGGATACC-3' | |
| GRP78 | 上游引物 | 5'-TGGAATCTTCACCTCAGAGTG-3' |
| 下游引物 | 5'-ATATCCAAGGTGAACACACAC-3' | |
| GRP94 | 上游引物 | 5'-ACTGTTGAGGAGCCCATGGAGG-3' |
| 下游引物 | 5'-GCTGAAGAGTCTCGCGGGAAAC-3' | |
| β-actin | 上游引物 | 5'-GAGAGGGAAATCGTGCGTGAC-3' |
| 下游引物 | 5'-CATCTGCTGGAAGGTGGACA-3' |
1.2.1 肝纤维化大鼠模型复制: 选取体质量150-160 g的♂Wistar大鼠32只, 按照随机数字表法分成正常4 wk、正常8 wk、肝纤维化4 wk和肝纤维化8 wk组, 每组各8只大鼠. 参照本课题组前期的实验方法复制肝纤维化模型, 具体方法如下: 肝纤维化4 wk及8 wk组大鼠通过皮下注射40%CCl4花生油溶液(剂量0.3 mL/100 g)诱导肝纤维化形成, 2次/wk, 分别注射4 wk和8 wk; 正常4 wk及8 wk组大鼠则通过皮下注射花生油(剂量0.3 mL/100 g), 2次/wk, 注射时间同样为4 wk和8 wk. 于实验第4周末和第8周末采用乙醚麻醉后处死实验大鼠[8].
1.2.2 病理学检查: 取大鼠肝右叶组织浸泡于40 g/L中性甲醛溶液中固定48 h, 随后将肝组织进行石蜡包埋切片并进行Masson染色, 通过光学显微镜观察肝组织病理形态学改变.
1.2.3 GRP78、GRP94及Caspase12 mRNA检测: 取100 mg肝组织, 加入1.0 mL TRIzol提取肝组织总RNA. 采用Fermentas逆转录试剂盒将提取的肝组织总RNA逆转录合成cDNA, 反应体系配制及反应条件严格按照试剂盒说明书进行操作. 随后用逆转录合成的cDNA为模板进行实时荧光定量PCR检测, 在冰上配制PCR反应体系(25 μL), PCR反应条件如下: 95 ℃ 30 s, 95 ℃ 5 s, 60 ℃ 30 s, 第2、3步重复40个循环. 以β-actin为内参, 用2-△△Ct法[9]计算各组大鼠肝组织中GRP78、GRP94及Caspase12 mRNA的相对表达量.
1.2.4 GRP78、GRP94及Caspase12蛋白表达检测: 取200 mg肝组织, 加入1.0 mL细胞裂解液于冰上充分匀浆后, 将匀浆液置于离心机中进行离心(12000 r/min, 4 ℃, 15 min). 离心结束后将上清液分装于0.5 mL Epp管中, 置于-80 ℃低温冰箱保存, 并采用Bradford蛋白定量试剂盒对上清液中的蛋白进行定量. 通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离蛋白质, 随后将聚丙烯酰胺凝胶中的蛋白质转移至PVDF膜上. PVDF膜在封闭缓冲液中封闭1 h, 随后与一抗稀释液(Caspase12稀释倍数为1:1000, GRP78、GRP94稀释倍数为1:500)4 ℃振摇孵育过夜. 次日早上将PVDF膜取出, 用洗膜缓冲液冲洗掉膜上多余的一抗, 随后将PVDF膜与二抗稀释液(1:2000)在室温下孵育1 h. 用洗膜缓冲液冲洗掉膜上多余的二抗, 然后将ECL化学发光试剂均匀的滴加在PVDF膜上进行化学发光.
1.2.5 肝细胞凋亡检测: 采用TUNEL法检测肝细胞凋亡, 具体方法如下: 肝组织石蜡切片经脱腊水化后用蛋白酶K 37 ℃消化10 min; 滴加标记液37 ℃孵育2 h, 随后封闭液室温封闭30 min; 封闭完后生物素化抗地高辛抗体37 ℃孵育30 min; 滴加荧光素+过氧化物酶标记的链酶亲和素37 ℃孵育30 min, 随后用0.01 mol/L Tris缓冲盐溶液洗片4次, 每次5 min. 在荧光显微镜下进行观察, 每张切片随机抽取5个高倍镜下视野, 以细胞核出现绿色荧光的细胞作为凋亡细胞, 并计算凋亡指数. 凋亡指数 = (凋亡细胞数/细胞总数)×100%.
统计学处理 计量资料采用mean±SD表示, 使用SPSS14.0进行组间方差分析, 两两比较采用LSD法, P<0.05表示差异有统计学意义.
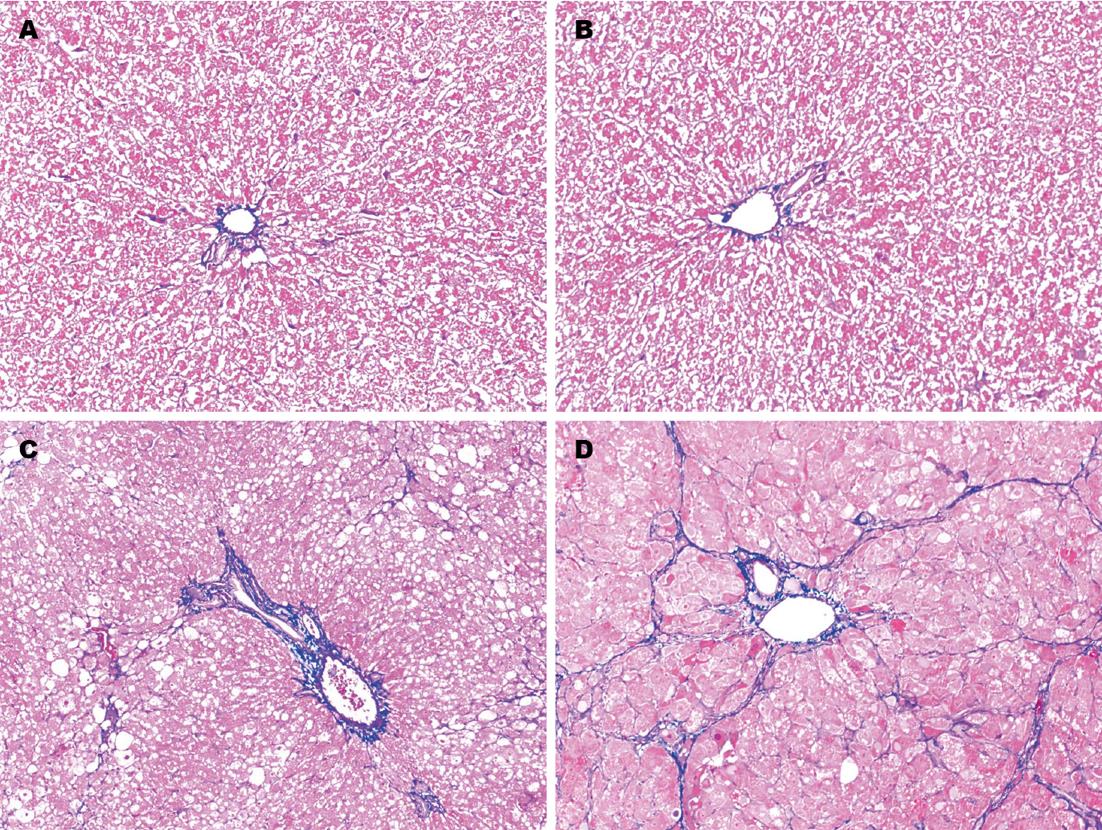
大鼠肝脏病理学改变如图1所示: 正常4、8 wk组大鼠肝小叶结构正常, 除汇管区有少量被染成蓝色的胶原纤维外, 其他部位未见胶原纤维增生; 肝纤维化4 wk组大鼠肝组织内可见部分呈空泡样变的肝细胞, 肝组织内胶原纤维含量较正常4 wk组显著增多; 肝纤维化8 wk时, 大鼠肝细胞脂肪样变进一步加重, 肝组织内可见大量被染成蓝色的胶原纤维, 胶原纤维包绕、分割肝组织, 导致肝小叶结构遭到破坏, 可见假小叶形成, 纤维化程度较正常8 wk组显著加重.
与正常4 wk组比较, 肝纤维化4 wk组大鼠肝脏中GRP78、GRP94及Caspase12 mRNA水平均显著升高, 差异具有显著性(P<0.01); 肝纤维化8 wk时, 大鼠肝脏中GRP78、GRP94及Caspase12 mRNA水平与正常8 wk组相比均明显增高(P<0.01或P<0.05), 但与肝纤维化4 wk组比较无显著差异(表2).
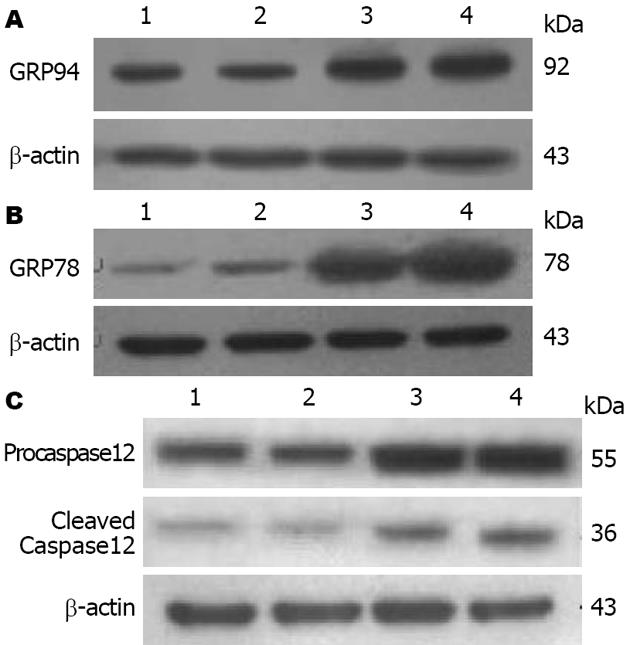
大鼠肝脏中GRP78、GRP94、Procaspase12及活性Caspase12蛋白水平如表3和图2所示: 与正常4 wk组比较, 肝纤维化4 wk组大鼠肝脏中GRP78, GRP94, Procaspase12及活性Caspase12水平显著升高(P<0.01或P<0.05); 肝纤维化8 wk时大鼠肝脏中GRP78、GRP94、Procaspase12及活性Caspase12的表达仍保持在高水平, 与正常8 wk组相比差异具有显著性(P<0.01或P<0.05), 但与肝纤维化4 wk组比较差异不具有显著性.
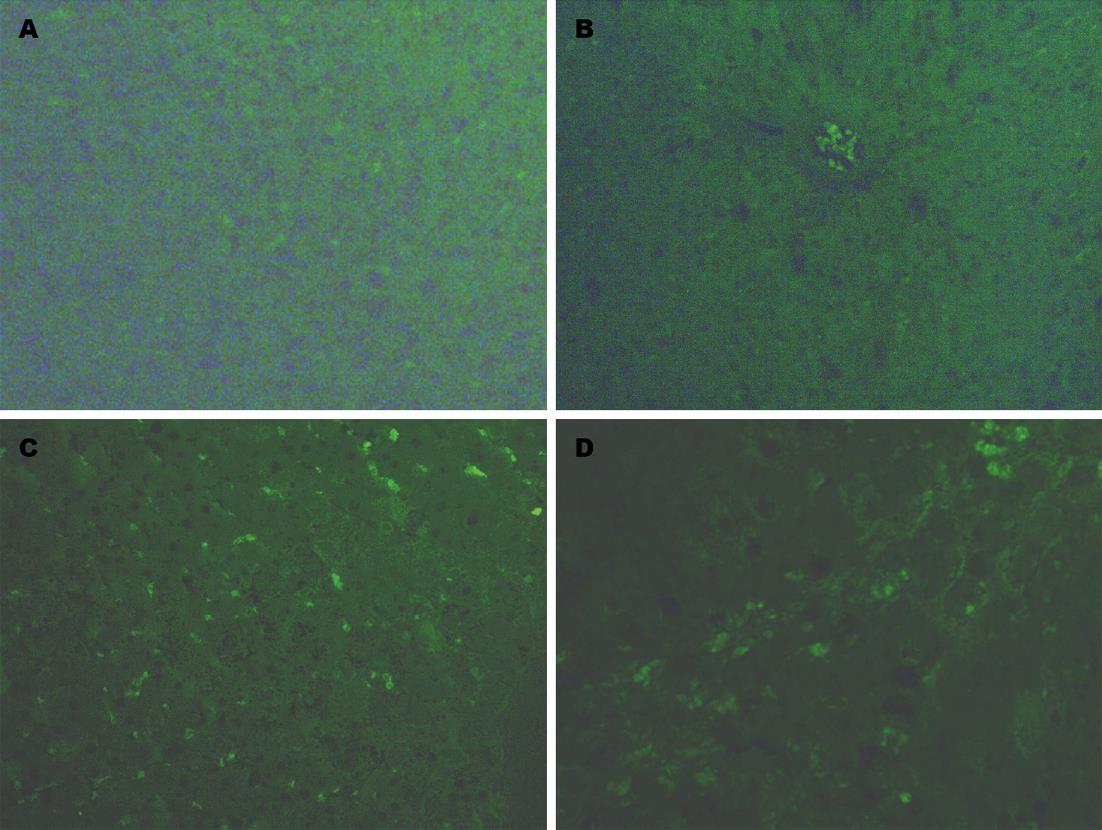
肝纤维化4 wk组大鼠肝细胞凋亡数目与正常4 wk组比较明显增多(9.58±1.79 vs 1.67±0.23), 差异具有显著性(P<0.01); 肝纤维化8 wk组大鼠肝细胞凋亡数目与正常8 wk组比较也显著升高(11.35±3.62 vs 1.92±0.45, P<0.01), 但与肝纤维化4 wk组比较差异不具有显著性(图3).
肝细胞作为肝脏中最丰富的一种细胞, 在各种急慢性肝脏疾病中常常会受到有害因素的影响而发生损伤甚至是死亡. 目前所知的细胞死亡方式主要有3种: 即细胞凋亡、细胞坏死和自噬性死亡[10]. 研究[11,12]发现, 在多数病因所引起的肝损伤中, 除肝细胞坏死外大多有肝细胞凋亡的发生. 而且不论在急性还是慢性肝脏疾病中, 肝细胞凋亡过程中产生的凋亡小体在被吞噬的过程中可激活HSC, 活化的HSC进一步增殖、分化, 并产生大量的细胞外基质, 从而促进肝纤维化的发生、发展. 还有研究[13]发现在小鼠肝损伤模型中, 如果抑制肝细胞凋亡就可以逆转肝脏的炎症反应和肝纤维化. 因此, 肝细胞凋亡可能是肝纤维化发展以及转归过程中的一个重要环节, 而抑制肝细胞凋亡有望成为治疗肝纤维化的新途径.
内质网应激是近年来新发现的一条介导细胞凋亡的信号通路[14,15]. 众所周知, 内质网是细胞内一个膜包绕的细胞器, 其功能主要与蛋白质的折叠、移位, 脂类、类固醇的合成以及胞浆内Ca2+浓度的调节有关[16-18]. 肝细胞的代谢功能非常活跃且拥有数量丰富的内质网, 因此内质网功能的紊乱势必会对肝细胞功能造成影响进而导致疾病的发生[19]. 本研究通过皮下注射CCl4的方法复制肝纤维化动物模型, 在此基础上, 采用RT-PCR、Western blot等方法对肝脏中内质网应激标志蛋白GRP78及GRP94在基因及蛋白水平的表达进行了检测. 结果发现, 肝纤维化4 wk组大鼠肝脏中GRP78、GRP94在基因及蛋白水平的表达已较正常4 wk组大鼠显著增加; 肝纤维化8 wk时, 大鼠肝脏中GRP78及GRP94基因及蛋白的表达仍保持在高水平. 由于GRP78、GRP94可作为ERS发生的标志性蛋白[20-22], 因此说明在CCl4诱导的肝纤维化过程中的确存在肝细胞ERS反应.
ERS的程度及持续时间决定了应激细胞的结局, 适度的ERS有利于细胞的存活, 但当ERS过于严重或持续时间过长时, ERS则诱导细胞凋亡的发生[23-25]. 关于ERS启动细胞凋亡的具体机制, 目前仍未完全阐明, 有研究[26-28]认为是通过激活下游的凋亡信号分子, 如Caspase12、CHOP及JNK等来实现的. Caspase12位于内质网的胞质面, 是ERS介导凋亡的特异性蛋白. 研究表明缺乏Caspase12的小鼠能抵抗ERS诱导的细胞凋亡, 而对死亡受体或线粒体途径诱导的凋亡仍有反应, 说明Caspase12信号通路可能是ERS介导凋亡的特异通路之一[29,30].
正常情况下Caspase12以无活性的酶原形式(Procaspase12)存在, 当后者活化转变为有活性的Caspase12(Cleaved Caspase12)后可介导细胞凋亡过程[31]. 活化的Caspase12可依次激活其下游的Caspase9和Caspase3而诱导细胞凋亡的发生[8]. 本次研究发现, 肝纤维化4 wk组大鼠肝组织中Caspase12 mRNA的表达已开始增加; 到肝纤维化8 wk时, 肝组织中Caspase12 mRNA的表达进一步增高. 对肝组织中Procaspase12及活性Caspase12蛋白水平的检测发现, 肝纤维化4 wk组大鼠肝组织中Procaspase12及活性Caspase12的表达较正常4 wk组大鼠显著增加; 到肝纤维化8 wk时, 大鼠肝组织中Procaspase12及活性Caspase12蛋白的表达与正常8 wk组比较显著增高, 但与肝纤维化4 wk组比较无显著性差异. 上述结果提示肝纤维化发生发展中肝组织内Caspase12基因及蛋白的表达水平均显著增高, 且活化的Caspase12的表达也是明显增高的, 说明在肝纤维化过程中有Caspase12表达及活性的增加. 前期课题组对Caspase12下游促凋亡分子Caspase3的活性表达形式(Cleaved Caspase3)进行检测, 结果发现肝纤维化4及8 wk组大鼠肝组织中活性Caspase3的表达较正常组明显增多[32], 提示Caspase12/Caspase3凋亡信号通路在肝纤维化发生过程中有明显的激活. 进一步以TUNEL法检测细胞凋亡发现, 肝纤维化4及8 wk组大鼠肝细胞凋亡较正常组显著增加, 但肝纤维化4及8 wk组之间肝细胞凋亡率无显著性差异. 这些结果提示在肝纤维化发生发展过程中, 肝组织中ERS介导的细胞凋亡通路是活化的. 因此, 我们推测肝细胞在ERS状态下有可能通过激活特异定位于内质网外膜上的促凋亡分子Caspase12并进一步激活下游的Caspase3, 从而促进肝细胞的凋亡. 但关于肝细胞内质网应激时如何激活Caspase12的机制目前尚不清楚, 有待进一步深入研究.
内质网应激时通过激活未折叠蛋白反应以保护细胞免受有害因素的损伤, 恢复细胞的功能; 但如果损伤过于严重, 或细胞内环境稳定不能及时恢复, 此时内质网应激则诱导细胞凋亡的发生. 因此, 内质网应激可能与很多肝脏疾病的发生、发展密切相关.
金博, 主任医师, 中国人民解放军第309医院(总参谋部总医院)消化内科
关于内质网应激介导肝细胞凋亡的分子机制目前仍不十分清楚, 尤其是内质网应激介导凋亡过程中关键信号分子Caspase12的活化机制尚未完全阐明. 因此, 深入研究Caspase12活性变化及其机制可为进一步阐明肝纤维化的发生机制提供理论基础.
本文研究证实了肝细胞在内质网应激状态下可能通过激活特异定位于内质网外膜上的促凋亡分子Caspase12并进一步激活下游的Caspase3, 从而促进肝细胞凋亡的发生.
内质网应激介导的肝细胞凋亡增加是肝纤维化的重要发病机制之一. 因此, 作为内质网应激介导凋亡过程中的关键信号分子, Caspase12有望成为抗纤维化治疗的新靶点.
本文对肝纤维化大鼠动物模型肝组织中Caspase12的变化及内质网应激的相关分子GRP78、GRP94进行了初步的研究, 并对肝细胞凋亡的情况进行了观察, 有一定的创新性和科学价值.
编辑: 于明茜 电编:闫晋利
| 1. | Guicciardi ME, Gores GJ. Apoptosis as a mechanism for liver disease progression. Semin Liver Dis. 2010;30:402-410. [PubMed] [DOI] |
| 2. | Mehal W, Imaeda A. Cell death and fibrogenesis. Semin Liver Dis. 2010;30:226-231. [PubMed] [DOI] |
| 3. | Canbay A, Friedman S, Gores GJ. Apoptosis: the nexus of liver injury and fibrosis. Hepatology. 2004;39:273-278. [PubMed] [DOI] |
| 4. | Takehara T, Tatsumi T, Suzuki T, Rucker EB, Hennighausen L, Jinushi M, Miyagi T, Kanazawa Y, Hayashi N. Hepatocyte-specific disruption of Bcl-xL leads to continuous hepatocyte apoptosis and liver fibrotic responses. Gastroenterology. 2004;127:1189-1197. [PubMed] [DOI] |
| 5. | Cao Y, Hao Y, Li H, Liu Q, Gao F, Liu W, Duan H. Role of endoplasmic reticulum stress in apoptosis of differentiated mouse podocytes induced by high glucose. Int J Mol Med. 2014;33:809-816. [PubMed] [DOI] |
| 6. | Jiang ZQ, Yao ZH, Deng ZT, Jiang XC, Yan XJ, Chen WP. [Study on antagonistic effect of liangxue huayu recipe on endoplasmic reticulum stress-induced L02 hepatocyte apoptosis and its mechanism]. Zhongguo Zhongyao Zazhi. 2013;38:3544-3548. [PubMed] |
| 7. | Duan XH, Chang JR, Zhang J, Zhang BH, Li YL, Teng X, Zhu Y, Du J, Tang CS, Qi YF. Activating transcription factor 4 is involved in endoplasmic reticulum stress-mediated apoptosis contributing to vascular calcification. Apoptosis. 2013;18:1132-1144. [PubMed] [DOI] |
| 10. | Kroemer G, Galluzzi L, Vandenabeele P, Abrams J, Alnemri ES, Baehrecke EH, Blagosklonny MV, El-Deiry WS, Golstein P, Green DR. Classification of cell death: recommendations of the Nomenclature Committee on Cell Death 2009. Cell Death Differ. 2009;16:3-11. [PubMed] [DOI] |
| 11. | Canbay A, Feldstein AE, Higuchi H, Werneburg N, Grambihler A, Bronk SF, Gores GJ. Kupffer cell engulfment of apoptotic bodies stimulates death ligand and cytokine expression. Hepatology. 2003;38:1188-1198. [PubMed] [DOI] |
| 12. | Canbay A, Taimr P, Torok N, Higuchi H, Friedman S, Gores GJ. Apoptotic body engulfment by a human stellate cell line is profibrogenic. Lab Invest. 2003;83:655-663. [PubMed] [DOI] |
| 13. | Canbay A, Higuchi H, Bronk SF, Taniai M, Sebo TJ, Gores GJ. Fas enhances fibrogenesis in the bile duct ligated mouse: a link between apoptosis and fibrosis. Gastroenterology. 2002;123:1323-1330. [PubMed] [DOI] |
| 14. | Qiu ZL, Zhang JP, Guo XC. [Endoplasmic reticulum stress and vascular endothelial cell apoptosis]. Zhongguo Yixue Kexueyuan Xuebao. 2014;36:102-107. [PubMed] [DOI] |
| 15. | Song L, Wang Y, Wang J, Yang F, Li X, Wu Y. Trinitrotoluene Induces Endoplasmic Reticulum Stress and Apoptosis in HePG2 Cells. Med Sci Monit. 2015;21:3434-3441. [PubMed] [DOI] |
| 17. | Wu H, Ye M, Yang J, Ding J. Endoplasmic reticulum stress-induced apoptosis: A possible role in myocardial ischemia-reperfusion injury. Int J Cardiol. 2016;208:65-66. [PubMed] [DOI] |
| 18. | Guo B, Zhang W, Tume RK, Hudson NJ, Huang F, Yin Y, Zhou G. Disorder of endoplasmic reticulum calcium channel components is associated with the increased apoptotic potential in pale, soft, exudative pork. Meat Sci. 2016;115:34-40. [PubMed] [DOI] |
| 19. | Szegezdi E, Logue SE, Gorman AM, Samali A. Mediators of endoplasmic reticulum stress-induced apoptosis. EMBO Rep. 2006;7:880-885. [PubMed] [DOI] |
| 21. | Zhang Y, Zhang H, Zhao Z, Lv M, Jia J, Zhang L, Tian X, Chen Y, Li B, Liu M. Enhanced expression of glucose-regulated protein 78 correlates with malondialdehyde levels during the formation of liver cirrhosis in rats. Exp Ther Med. 2015;10:2119-2125. [PubMed] |
| 22. | Zhu X, Zhang X, Yu L, Xu Y, Feng X, Wang J. Hepatic Overexpression of GRP94 in a Rabbit Model of Parenteral Nutrition-Associated Liver Disease. Gastroenterol Res Pract. 2015;2015:269831. [PubMed] [DOI] |
| 23. | Ying J, Xu H, Wu D, Wu X. Emodin induces apoptosis of human osteosarcoma cells via mitochondria- and endoplasmic reticulum stress-related pathways. Int J Clin Exp Pathol. 2015;8:12837-12844. [PubMed] |
| 24. | Jiang ZQ, Ma YX, Li MH, Zhan XQ, Zhang X, Wang MY. 5-Hydroxymethylfurfural protects against ER stress-induced apoptosis in GalN/TNF-α-injured L02 hepatocytes through regulating the PERK-eIF2α signaling pathway. Chin J Nat Med. 2015;13:896-905. [PubMed] [DOI] |
| 25. | Lin F, Chen Y, Liao C, Sun Y, Bai Y, Liao Y, Li M, Qi Y. [Hydrogen sulfide attenuates bronchial epithelial cell apoptosis by inhibiting endoplasmic reticulum stress]. Zhonghua Yixue Zazhi. 2015;95:2297-2301. [PubMed] |
| 27. | Guo G, Meng Y, Tan W, Xia Y, Cheng C, Chen X, Gu Z. Induction of Apoptosis Coupled to Endoplasmic Reticulum Stress through Regulation of CHOP and JNK in Bone Marrow Mesenchymal Stem Cells from Patients with Systemic Lupus Erythematosus. J Immunol Res. 2015;2015:183738. [PubMed] [DOI] |
| 28. | Liu M, Wang XR, Wang C, Song DD, Liu XH, Shi DZ. Panax quinquefolium saponin attenuates ventricular remodeling after acute myocardial infarction by inhibiting chop-mediated apoptosis. Shock. 2013;40:339-344. [PubMed] [DOI] |
| 29. | Pal S, Ghosh M, Ghosh S, Bhattacharyya S, Sil PC. Atorvastatin induced hepatic oxidative stress and apoptotic damage via MAPKs, mitochondria, calpain and caspase12 dependent pathways. Food Chem Toxicol. 2015;83:36-47. [PubMed] [DOI] |
| 31. | Lakshmanan AP, Thandavarayan RA, Palaniyandi SS, Sari FR, Meilei H, Giridharan VV, Soetikno V, Suzuki K, Kodama M, Watanabe K. Modulation of AT-1R/CHOP-JNK-Caspase12 pathway by olmesartan treatment attenuates ER stress-induced renal apoptosis in streptozotocin-induced diabetic mice. Eur J Pharm Sci. 2011;44:627-634. [PubMed] [DOI] |