修回日期: 2016-05-06
接受日期: 2016-05-09
在线出版日期: 2016-06-08
目的: 探讨大黄素诱导人胃癌细胞株SGC-7901凋亡及其相关机制.
方法: 采用CCK-8法和Tunel染色法检测不同浓度大黄素处理后, SGC-7901细胞凋亡的变化; 免疫印迹法检测Bcl-2、Bax、cleaved-Caspase3、cleaved-PARP、preCaspase3、PARP的蛋白表达水平; JC-1染色荧光显微观察线粒体膜电位的变化.
结果: CCK-8法和Tunel染色法显示大黄素呈浓度依赖性促进SGC-7901细胞的凋亡(存活率100.73%±8.97% vs 45.27%±3.75%, P<0.05); 免疫印迹法显示给予60 μmol/L大黄素处理后, 与空白对照组相比, 细胞中Bcl-2的蛋白表达显著降低(0.31±0.02 vs 1.01±0.06, P<0.05), 而Bax的表达显著增加(1.98±0.12 vs 1.00±0.08, P<0.05), 导致Bcl-2/Bax比值显著降低(0.14±0.01 vs 1.02±0.13, P<0.05); 再者, JC-1染色显示线粒体膜电位降低; 活性的cleaved-Caspase3(1.73±0.13 vs 0.98±0.06, P<0.05)、cleaved-PARP(2.29±0.17 vs 1.01±0.08, P<0.05)表达增加.
结论: 大黄素呈浓度依赖性促进SGC-7901细胞的凋亡, 其作用机制可能与线粒体途径凋亡有关.
核心提示: 大黄素主要是通过上调促凋亡蛋白Bax的表达, 同时下调抗凋亡蛋白Bcl-2的表达, 改变线粒体膜电位, 激活了内源性线粒体通路, 激活Caspase3, 从而激活一系列凋亡级联因子, 促进细胞的凋亡, 进而促进胃癌细胞的凋亡.
引文著录: 马陈皋. 大黄素对人胃癌细胞株SGC-7901凋亡的影响与初步机制. 世界华人消化杂志 2016; 24(16): 2463-2469
Revised: May 6, 2016
Accepted: May 9, 2016
Published online: June 8, 2016
AIM: To investigate the effect of emodin on cell apoptosis in human stomach cancer cell line SGC-7901 and to explore the related mechanisms.
METHODS: After SGC-7901 cells were treated with different concentrations of Emodin, cell apoptosis was determined by CCK-8 assay and TUNEL assay. The expression of Bcl-2, Bax, cleaved-Caspase3, cleaved-PARP, preCaspase3, and PARP was measured by Western blot. Mitochondrial membrane potential was examined by JC-1 staining and fluorescence microscopy.
RESULTS: The apoptotic rate of SGC-7901 cells was increased by emodin in a dose-dependent manner (survival rate 100.73% ± 8.97% vs 45.27% ± 3.75%, P < 0.05). Compared with the control group, treatment with emodin (60 μmol/L) significantly increased Bax expression (1.98 ± 0.12 vs 1.00 ± 0.08, P < 0.05), Caspase3 (1.73 ± 0.13 vs 0.98 ± 0.06, P < 0.05) and PARP (2.29 ± 0.17 vs 1.01 ± 0.08, P < 0.05) activation, while decreased Bcl-2 expression (0.31 ± 0.02 vs 1.01 ± 0.06, P < 0.05), Bcl-2/Bax ratio (0.14 ± 0.01 vs 1.02 ± 0.13, P < 0.05) and mitochondrial membrane potential.
CONCLUSION: Emodin accelerates the apoptosis of SGC-7901 cells via the mitochondria-dependent pathway. Our results reveal a novel role for emodin in the treatment of gastric cancer.
- Citation: Ma CG. Effect of emodin on apoptosis in human stomach cancer cell line SGC-7901 and possible mechanisms involved. Shijie Huaren Xiaohua Zazhi 2016; 24(16): 2463-2469
- URL: https://www.wjgnet.com/1009-3079/full/v24/i16/2463.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i16.2463
胃癌的发生率在我国高发性消化系肿瘤中占第1位, 且呈逐年上升的趋势. 胃癌的诱因众多, 发病机制非常复杂[1]. 研究[1,2]表明, 机体在正常状态下, 胃黏膜上皮细胞的增殖和凋亡之间保持在一定的动态平衡, 这种动态平常通常是由癌基因和抑癌基因的调控. 胃癌的发病机制主要是由于动态平衡的打破. 诱导肿瘤细胞凋亡是抗癌药物治疗肿瘤的重要机制之一, Bcl-2家族基因是哺乳动物细胞中调节凋亡最重要的调控基因之一, 对肿瘤的发生发展发挥中大的作用[3-5]. 报道[6]指出柠檬酸钠通过调控促凋亡蛋白Bax、抗凋亡蛋白Bcl-2和Bcl-xl的表达, 从而激活内源性线粒体通路, 诱导胃癌细胞的凋亡.
大黄素属于蒽醌类衍生物, 是药用植物大黄的主要药用成分单体, 具有抑菌、抗炎、改善微循环、免疫调节和抗癌等多种药理作用[7-12]. 目前大黄素的应用主要集中于食管癌, 肺癌和胰腺癌等[4-6], 对胃癌的研究机制尚未深入, 本实验主要针对不同浓度大黄素对胃癌细胞株SGC-7901凋亡的影响及其可能的作用机制进行研究.
人胃癌细胞株SGC-7901购自上海细胞所; 大黄素购自山西森弗生物有限公司, 纯度>98.0%; 胎牛血清, RPMI 1640培养基购自Gibco公司; CCK-8试剂盒购自碧云天生物技术有限公司; 线粒体分离试剂盒购自Thermo Fisher Scientific公司; Tunel染色试剂盒购自Roche公司; Bcl-2、Bax、cleaved-Caspase3、cleaved-PARP、preCaspase3、PARP抗体购自Santa Cruz公司, β-actin抗体均购自Cell Signaling Technology公司; 其余试剂均为国产分析纯.
1.2.1 细胞培养与分组: 将SGC-7901细胞株培养于含10%胎牛血清的RPMI 1640培养基中, 于37 ℃、50 mL/L CO2恒温培养箱中孵育, 每天换液1次. 将大黄素溶于DMSO中, 使浓度分别为15、30、60和120 μmol/L. 设空白对照组, 细胞不给药处理; 溶剂对照组, 细胞中加入等体积的DMSO; 不同浓度(15、30、60和120 μmol/L)的大黄素溶液处理组.
1.2.2 CCK-8法检测细胞存活率: 对处于对数期生长的SGC-7901细胞制成细胞悬液, 接种于48孔板中, 加入无血清培养液继续培养24 h. 加药后将各组细胞放于37 ℃、50 mL/L CO2培养箱中孵育48 h后, 加入CCK-8溶液, 继续培养4-5 h, 采用酶联免疫检测仪450 nm处测量吸光度值, 实验重复3次.
1.2.3 Tunel染色法检测细胞凋亡: 将各组细胞调节为5×106个/mL的单细胞悬液, 4%多聚甲醛固定, PBS洗涤, 细胞通透液4 ℃通透2 min, PBS洗涤2次, 加入Tunel反应液(TdT+荧光素标记dUTP), 并于37 ℃湿盒中避光孵育60 min, 洗涤, 加入DAPI, 封片. 荧光显微镜下以484 nm激发波长、535 nm发射波长观察绿色荧光凋亡细胞.
1.2.4 线粒体提取: 采用线粒体分离试剂盒并根据产品说明书提取细胞中的线粒体, 用10 mL冰预冷的PBS轻轻重悬细胞沉淀, 加入冰预冷试剂A, 匀浆10 s, 于4 ℃, 800 r/min离心5 min, 加入冰预冷试剂B, 800 r/min离心3 min, 冰上孵育4 min, 其中每隔1 min涡旋震荡1次, 加入冰预冷试剂C, 4 ℃, 800 r/min离心5 min. 沉淀为线粒体部分. 取上清液, 4 ℃, 10000 r/min离心5 min, 为胞浆部分.
1.2.5 免疫印迹法检测相关蛋白: 细胞给药培养48 h后, 弃去培养液, PBS洗涤2次, 提取少量细胞蛋白定量, 调整蛋白量. 取适量裂解产物, 进行SDS-PAGE电泳分离, 完成电泳后将蛋白转移至PVDF膜上, 脱脂牛奶封闭1 h, 加入一抗孵育过夜, TBST洗涤3次; 加入相应二抗室温孵育1 h, TBST洗涤3次; 进行荧光显色.
1.2.6 线粒体跨膜电位检测: 线粒体跨膜电位检测按照跨膜电位检测试剂盒说明书操作. 采用JC-1荧光染料指示剂检测线粒体膜电位的改变, 于在荧光显微镜下观察绿色荧光强度(激发波长: 485 nm; 发射波长: 535 nm)与红色荧光强度(激发波长: 550 nm; 发射波长: 600 nm)的比值, 实验重复3次.
统计学处理 应用SPSS15.0软件进行数据处理, 各组实验结果均以mean±SD表示, 组间比较采用单因素方差分析进行统计学处理, 以P<0.05为差异有统计学意义.
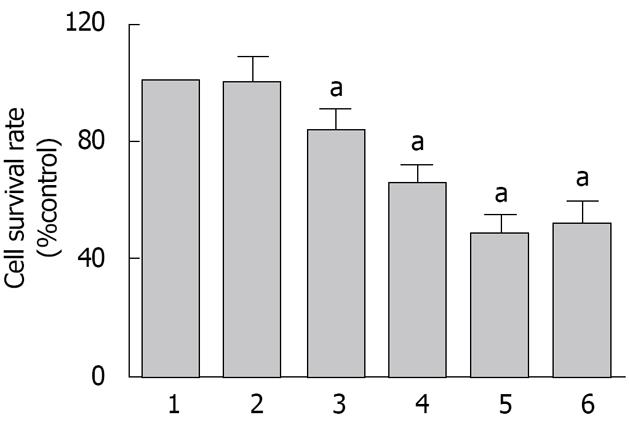
实验结果显示大黄素诱导SGC-7901细胞凋亡, 随着其浓度的增大, 细胞存活率降低, 呈浓度依赖关系. 与空白对照组相比, 差异具有统计学意义(P<0.05), 空白对照组和溶剂对照组间无统计学差异. 60 μmol/L和120 μmol/L的大黄素对细胞存活率的影响作用相近, 两组间无统计学差异(图1).
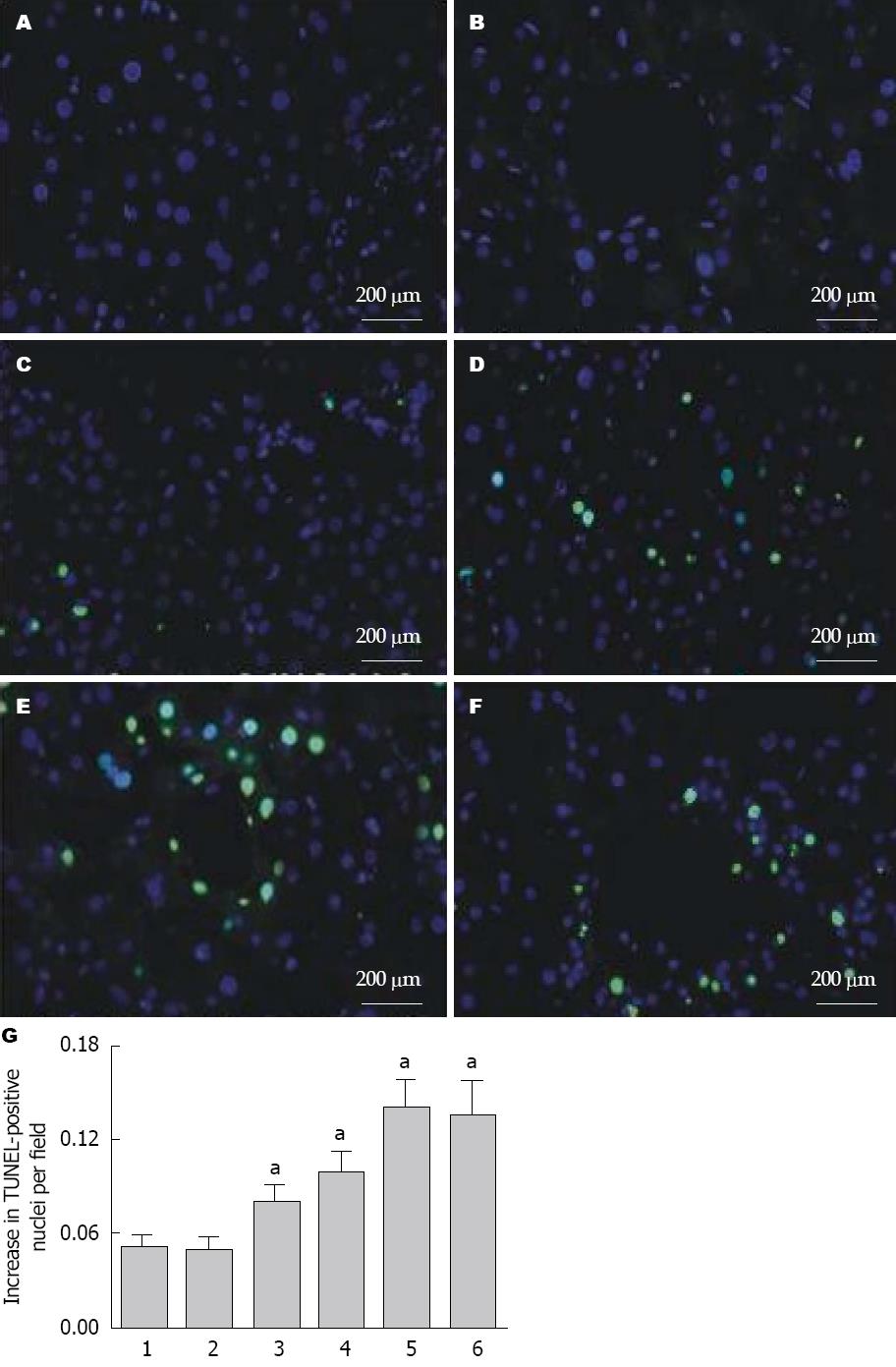
与空白对照组相比, 给予15 μmol/L大黄素培养后的SGC-7901细胞已显示绿色荧光, 且随着浓度的增大而荧光愈发强烈, 提示大黄素呈浓度依赖性诱导SGC-7901细胞凋亡; 空白对照组与溶剂对照组相比无统计学差异(P>0.05). 同样, 60 μmol/L和120 μmol/L的大黄素对细胞凋亡的作用相近, 两组间无统计学差异. 故后续实验采用60 μmol/L的大黄素(图2).
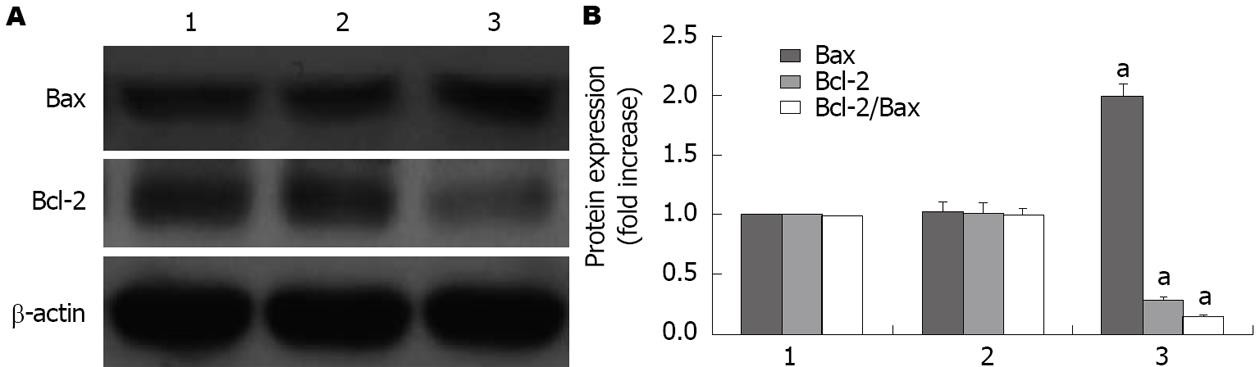
结果显示, 与空白对照组相比, 给予60 μmol/L大黄素培养的SGC-7901细胞中Bax的蛋白表达明显增加, Bcl-2的蛋白表达明显减少, 导致Bcl-2/Bax比值显著减少, 具有统计学意义(P<0.05), 空白对照组与溶剂对照组相比无统计学差异(P>0.05)(图3).
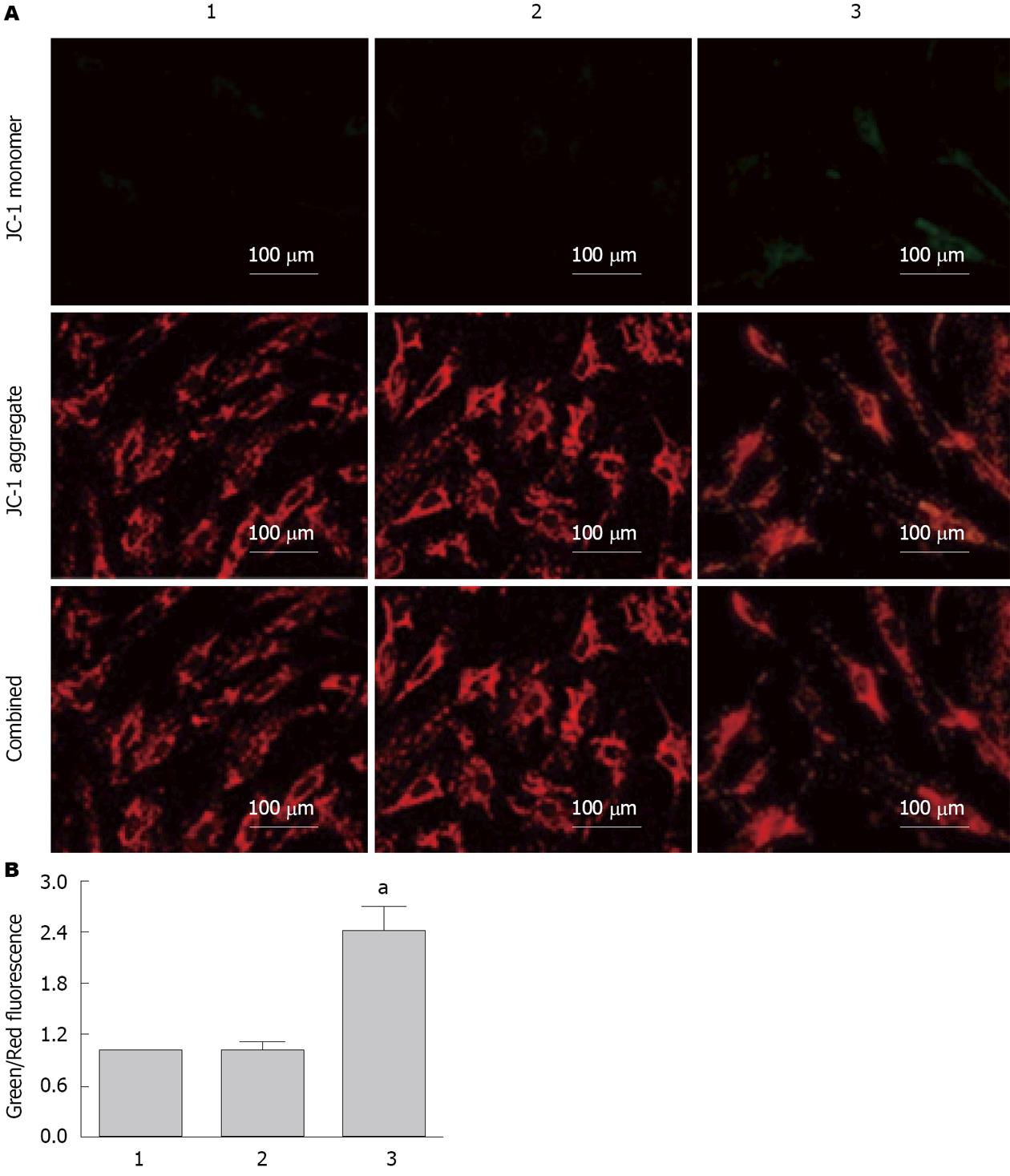
如图4所示, 荧光显微镜下显示空白对照组主要显示红色荧光, 给予60 μmol/L大黄素培养后细胞的绿色荧光增强, 红色荧光减弱, 从而导致绿色荧光与红色荧光比值显著增加, 与空白对照组相比具有统计学差异(P<0.05), 空白对照组与溶剂对照组相比无统计学差异(P>0.05).
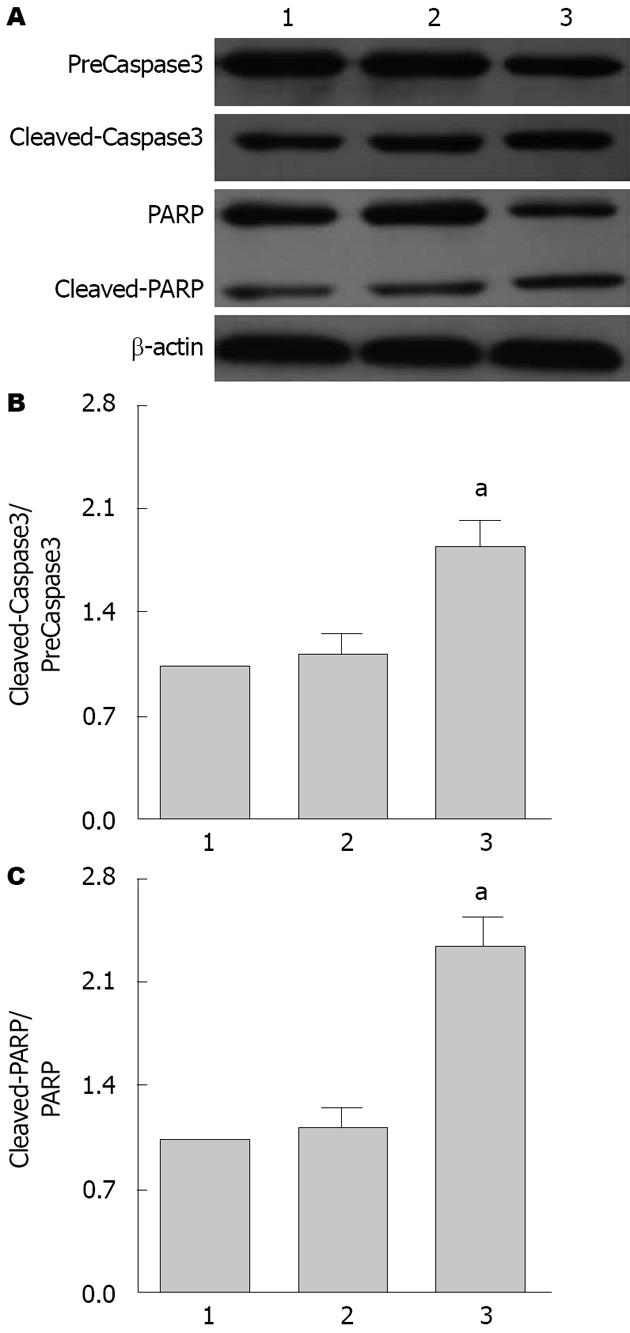
免疫印迹法结果显示, 与空白对照组相比, 给予60 μmol/L大黄素培养后, SGC-7901细胞中活性的cleaved-Caspase3、PARP表达增加, 而preCaspase3、PARP表达减少, 从而增加了cleaved-Caspase3/preCaspase3、cleaved-PARP/PARP比值, 由1.02±0.05上升至2.41±0.17, 与空白对照组相比具有统计学差异(P<0.05), 而空白对照组与溶剂对照组相比无统计学差异(P>0.05)(图5).
细胞凋亡与肿瘤的发生是密切相关的[13-15], 有研究[16-20]表明肿瘤的发生可能是由于细胞凋亡的通路受阻而产生. 已有研究[21]表明大黄素通过诱导细胞凋亡的途径可抑制人卵巢癌细胞增殖, 刘岸等[22]研究发现大黄素同样以诱导细胞凋亡方式抑制人胰腺癌Panc-1细胞的增殖. 本实验发现CCK-8法测定不同浓度大黄素培养24 h后, SGC-7901细胞的存活率随大黄素浓度的增加而降低, 提示大黄素具有诱导SGC-7901细胞凋亡的作用. 此外, Tunel染色结果显示给药后细胞绿色荧光增强, 再次证明了大黄素对SGC-7901细胞的凋亡具有促进作用. 由于60 μmol/L和120 μmol/L的大黄素对细胞的凋亡作用效果没有显著差异, 推测是由于大黄素到达了溶解的最大值, 故后续试验采用60 μmol/L进行下一步研究.
Bcl-2家族由抗凋亡蛋白(Bcl-2、Bcl-XL、Bcl-w)和促凋亡蛋白(Bax、Bak、Bim等)组成, 共同构成一个紧密相互作用的控制细胞凋亡的网络, 是细胞凋亡内源性线粒体途径的重要调节因子[23-27]. Caspase3是Bcl-2的下游调控蛋白, 同时作为引起凋亡的始发因子, 近年研究表明, PARP是Caspase3的底物, Caspase3激活后, 改变构象, 然后与活化子结合而被激活形剪切体cleaved-Caspase3, 同时剪切PARP, 使总PARP减少, cleaved-PARP增加, 导致其失去正常功能, 最终使得核小体间DNA降解, 细胞发生凋亡性死亡[28-30]. 本研究结果发现大黄素处理后细胞Bax呈高表达, Bcl-2呈低表达; 还发现Caspase3剪切体呈高表达的同时PARP剪切体也成呈高表达, 二者具有显著正相关性, 而未被激活的Caspase3、PARP均显著减少, 提示大黄素处理后的胃癌细胞中, Caspase3激活可灭活PARP的活性, 使PARP丧失功能, 导致内源性核酸酶活化, 形成DNA片段化, 加速细胞凋亡, 可抑制癌症的恶化. 总之, 推测大黄素主要是通过上调促凋亡蛋白Bax的表达, 同时下调抗凋亡蛋白Bcl-2的表达, 改变线粒体膜电位, 激活了内源性线粒体通路, 激活Caspase3, 从而激活一系列凋亡级联因子, 促进细胞的凋亡, 进而促进胃癌细胞的凋亡. 本实验为大黄素临床上用于治疗胃癌提供了一定的实验基础.
大黄素(Emodin, EMO)属于蒽醌类衍生物, 是药用植物大黄的主要药用成分单体, 具有抑菌、抗炎、改善微循环、免疫调节和抗癌等多种药理作用.大黄素的应用主要集中于食管癌, 肺癌和胰腺癌等的治疗, 对胃癌的研究机制尚未深入. 本文首次深入探讨大黄素诱导人胃癌细胞株SGC-7901凋亡及其相关机制.
沈克平, 主任医师, 上海中医药大学附属龙华医院
细胞凋亡内源性线粒体途径的重要调节因子主要有Bax、Bcl-2, 及其下游一系列凋亡级联因子Caspase3、Caspase9以及PARP等, 是细胞凋亡的主要热点通路之一.
有报道指出柠檬酸钠通过调控促凋亡蛋白Bax、抗凋亡蛋白Bcl-2和Bcl-xl的表达, 从而激活内源性线粒体通路, 诱导胃癌细胞的凋亡. 但并没有进一步深入研究下游凋亡级联因子的变化.
本文首次研究大黄素通过改变线粒体膜电位, 激活内源性线粒体通路, 促进胃癌细胞的凋亡, 为大黄素临床上用于治疗胃癌提供了一定的实验基础.
为大黄素临床上用于治疗胃癌提供了一定的实验基础, 探讨大黄素促进胃癌细胞凋亡的作用机制, 为后续研究提供了方向.
线粒体凋亡途径: 是细胞凋亡的主要途径之一, 是目前研究凋亡的热点. 各种凋亡刺激信号通过BH3(Bcl-2 homology domain 3)-only蛋白引起Bax(Bcl-2-asslciated protein X)蛋白移位到线粒体 外膜并多聚化, 形成膜通道,刺激线粒体释放细胞色素C(Cyt C)和Smac(second mitochondrial-derived activator of caspase), Cyt C通过Apaf-1因子的多聚化与Caspases9形成凋亡小体, 导致下游胱天蛋白酶的级联反应. 而凋亡蛋白抑制因子和Smac通过抑制和促进胱天蛋白酶的级联反应来调控细胞凋亡.
本文观察不同浓度大黄素对人胃癌细胞株SGC-7901凋亡的作用, 并较深入地研究了其作用机制, 对胃癌的治疗研究具有较重要的意义.
编辑: 郭鹏 电编:闫晋利
| 1. | Sacewicz I, Wiktorska M, Wysocki T, Niewiarowska J. [Mechanisms of cancer angiogenesis]. Postepy Hig Med Dosw (Online). 2009;63:159-168. [PubMed] |
| 3. | 王 卫东, 陈 正堂. Bcl-2/Bax比率与细胞"命运". 中国肿瘤生物治疗杂志. 2007;14:393-396. |
| 4. | 朱 玉山, 卢 铁元, 王 蕊, 黄 理, 马 淇, 赵 丽霞, 高 平, 雷 晓波, 倪 碧云, 林 家凌. Bcl-2家族蛋白调控线粒体膜通透性和细胞色素C释放的新机制. 生命科学. 2011;23:1076-1080. |
| 5. | Zhu Y, Li M, Wang X, Jin H, Liu S, Xu J, Chen Q. Caspase cleavage of cytochrome c1 disrupts mitochondrial function and enhances cytochrome c release. Cell Res. 2012;22:127-141. [PubMed] [DOI] |
| 6. | 冼 书林. 抗能量药物柠檬酸钠对胃癌细胞增殖的影响及其作用机制研究. 南宁: 广西医科大学 2014; . |
| 11. | 周 磊, 云 宝仪, 汪 业菊, 谢 明杰. 大黄素对金黄色葡萄球菌的抑菌作用机制. 中国生物化学与分子生物学报. 2011;27:1156-1160. |
| 13. | Wang QJ, Cai XB, Liu MH, Hu H, Tan XJ, Jing XB. Apoptosis induced by emodin is associated with alterations of intracellular acidification and reactive oxygen species in EC-109 cells. Biochem Cell Biol. 2010;88:767-774. [PubMed] [DOI] |
| 14. | Ko JC, Su YJ, Lin ST, Jhan JY, Ciou SC, Cheng CM, Lin YW. Suppression of ERCC1 and Rad51 expression through ERK1/2 inactivation is essential in emodin-mediated cytotoxicity in human non-small cell lung cancer cells. Biochem Pharmacol. 2010;79:655-664. [PubMed] [DOI] |
| 16. | Litan A, Langhans SA. Cancer as a channelopathy: ion channels and pumps in tumor development and progression. Front Cell Neurosci. 2015;9:86. [PubMed] [DOI] |
| 17. | Suhail MM, Wu W, Cao A, Mondalek FG, Fung KM, Shih PT, Fang YT, Woolley C, Young G, Lin HK. Boswellia sacra essential oil induces tumor cell-specific apoptosis and suppresses tumor aggressiveness in cultured human breast cancer cells. BMC Complement Altern Med. 2011;11:129. [PubMed] [DOI] |
| 18. | Xiao B, Liu C, Liu BT, Zhang X, Liu RR, Zhang XW. TTF1-NPs Induce ERS-Mediated Apoptosis and Inhibit Human Hepatoma Cell Growth In Vitro and In Vivo. Oncol Res. 2016;23:311-320. [PubMed] [DOI] |
| 19. | Shen CJ, Chan TF, Chen CC, Hsu YC, Long CY, Lai CS. Human umbilical cord matrix-derived stem cells expressing interferon-β gene inhibit breast cancer cells via apoptosis. Oncotarget. 2016; Apr 26. [Epub ahead of print]. [PubMed] [DOI] |
| 20. | Liu CT, Xin Y, Tong CY, Li B, Bao HL, Zhang CY, Wang XH. Production of interleukin4 in CD133+ cervical cancer stem cells promotes resistance to apoptosis and initiates tumor growth. Mol Med Rep. 2016;13:5068-5076. [PubMed] [DOI] |
| 21. | Li J, Liu P, Mao H, Wanga A, Zhang X. Emodin sensitizes paclitaxel-resistant human ovarian cancer cells to paclitaxel-induced apoptosis in vitro. Oncol Rep. 2009;21:1605-1610. [PubMed] |
| 25. | Zhu Y, Tchkonia T, Fuhrmann-Stroissnigg H, Dai HM, Ling YY, Stout MB, Pirtskhalava T, Giorgadze N, Johnson KO, Giles CB. Identification of a novel senolytic agent, navitoclax, targeting the Bcl-2 family of anti-apoptotic factors. Aging Cell. 2016;15:428-435. [PubMed] [DOI] |
| 26. | de Brot S, Schade B, Croci M, Dettwiler M, Guscetti F. Sequence and partial functional analysis of canine Bcl-2 family proteins. Res Vet Sci. 2016;104:126-135. [PubMed] [DOI] |
| 27. | Opferman JT. Attacking cancer's Achilles heel: antagonism of anti-apoptotic BCL-2 family members. FEBS J. 2015; Aug 21. [Epub ahead of print]. [PubMed] [DOI] |
| 29. | Baharara J, Ramezani T, Divsalar A, Mousavi M, Seyedarabi A. Induction of Apoptosis by Green Synthesized Gold Nanoparticles Through Activation of Caspase-3 and 9 in Human Cervical Cancer Cells. Avicenna J Med Biotechnol. 2016;8:75-83. [PubMed] |
| 30. | Li WH, Wu HJ, Li YX, Pan HG, Meng T, Wang X. MicroRNA-143 promotes apoptosis of osteosarcoma cells by caspase-3 activation via targeting Bcl-2. Biomed Pharmacother. 2016;80:8-15. [PubMed] [DOI] |