修回日期: 2016-04-11
接受日期: 2016-04-20
在线出版日期: 2016-05-28
目的: 探讨胃癌组织中, 环氧合酶-2(cyclooxygenase-2, COX-2)与金属硫蛋白(metallothionein, MT)的表达情况及和胃癌的关系.
方法: 选取2012-08/2014-08于河南医学高等专科学校附属医院接受治疗的200例胃癌患者, 采集其胃癌组织标本, 设为观察组. 另同步选取患者胃癌切除后的癌旁组织标本, 设为对照组. 对组织标本进行切片, 行免疫组织化学染色, 判断两组样本中COX-2与MT的阳性表达情况.
结果: 观察组样本的MT阳性表达高于对照组(92.0% vs 24.0%), 差异有统计学意义(P<0.05); 观察组样本的COX-2阳性表达率高于对照组(78.0% vs 20.0%), 差异有统计学意义(P<0.05).
结论: 胃癌组织中COX-2与MT呈高表达状态, 影响着胃癌的发展, 并且可能与胃癌细胞的转移、浸润有关, 能够作为诊断胃癌及判断预后效果的重要指标.
核心提示: 环氧合酶-2(cyclooxygenase-2, COX-2)与金属硫蛋白(metallothionein, MT)的表达同肿瘤的发生和发展关系密切, 在胃癌组织中, COX-2与MT呈高表达状态, 影响着胃癌的发生和发展, 并且可能与胃癌细胞的转移、浸润的有关, 能够作为诊断胃癌及判断预后效果的重要指标.
引文著录: 李向阳, 卢文杰. COX-2与MT在胃癌组织中的表达及与胃癌的关系. 世界华人消化杂志 2016; 24(15): 2319-2323
Revised: April 11, 2016
Accepted: April 20, 2016
Published online: May 28, 2016
AIM: To detect the expression of cyclooxygenase-2 (COX-2) and metallothionein (MT) in gastric carcinoma.
METHODS: Two hundred gastric cancer patients treated at our hospital from August 2012 to August 2014 were selected, and gastric cancer tissue specimens and tumor adjacent specimens were collected from these patients. Immunohistochemistry was then used to detect the expression of COX-2 and MT in the above specimens.
RESULTS: The rate of positive expression of MT was significantly higher in gastric cancer tissue specimens than in tumor adjacent specimens (92.0% vs 24.0%, P < 0.05). The rate of positive expression of COX-2 was also significantly higher in gastric cancer tissue specimens than in tumor adjacent specimens (78.0% vs 20.0%, P < 0.05).
CONCLUSION: COX-2 and MT are highly expressed in gastric cancer, which may be involved in the development of gastric cancer, and related to the metastasis and invasion of gastric cancer.
- Citation: Li XY, Lu WJ. Expression of cyclooxygenase-2 and metallothionein in gastric carcinoma. Shijie Huaren Xiaohua Zazhi 2016; 24(15): 2319-2323
- URL: https://www.wjgnet.com/1009-3079/full/v24/i15/2319.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i15.2319
作为目前常见的消化系恶性肿瘤之一, 胃癌在进展期的疗效不佳, 且预后效果差, 术后5年的死亡率较高[1]. 研究[2]结果显示, 引起患者死亡的一个主要原因就是肿瘤转移. 非甾体类抗炎药可以使结肠癌的发病风险降低, 作用机制就是对环氧合酶-2(cyclooxygenase-2, COX-2)加以抑制. 金属硫蛋白(metallothionein, MT)作为一种低分子量蛋白, 对体内金属, 如Cu、Zn的含量有调节作用, 可以消除有毒金属的毒性, 确保烷化剂、放射线等不会损伤细胞[3]. COX-2与MT的表达同肿瘤的发生和发展关系密切[4]. 我们探讨了胃癌组织中, COX-2与MT的表达情况, 现进行如下报道.
选取2012-08/2014-08于河南医学高等专科学校附属医院接受治疗的胃癌患者200例, 均经手术和病理检查确诊, 其中男性122例, 女性78例; 年龄35-78岁, 平均57.4岁±3.2岁; 低分化胃癌125例, 中分化胃癌58例, 高分化胃癌17例; 淋巴结未发生转移者82例, 淋巴结转移者118例; 息肉样型78例, 溃疡型84例, 浸润型48例. 采集其胃癌组织标本, 设为观察组, 排除术前曾接受抗肿瘤治疗者. 另外同步选取胃癌切除后的癌旁组织, 设为对照组. 本次研究中采用的主要试剂为北京中杉金桥生物有限公司提供的DAB显色剂、COX-2单克隆一抗与其原液(随用随配, 粉针剂, 浓度比为1∶200), 鼠抗人MT单克隆抗体, 采用的仪器为Olympus B202型电子显微镜, 石蜡切片机、晶体管自动恒温箱等.
采用40 g/L中性甲醛固定所有标本, 进行石蜡包埋, 连续切片, 每份标本共4张切片, 通过免疫组织化学法染色, 严格根据试剂说明书的要求展开操作. 分别采用已知阳性表达的胃组织标本和PBS当作阳性与阴性对照.
于光镜下观片, 采用双盲法对阳性细胞进行记数, 任意选取5个高倍镜视野, 记数肿瘤细胞300个, 以着色细胞数目为依据, 确定染色结果. MT主要表达于细胞浆中, 如果棕黄色细胞数不低于20%, 则判断MT呈阳性, 棕黄色细胞数在20%以下, 则判断MT呈阴性[5]. 且1%-20%计1分, 26%-50%计2分, 61%-75%计3分, 76%以上4分; 如果有棕黄色颗粒存在于COX-2蛋白胞浆或核膜内, 且阳性染色细胞在10%以上, 则判断COX-2呈阳性, 若阳性染色细胞不高于10%, 则判断COX-2呈阴性. 1%-10%为1分, 11%-25%为2分, 26%-50%为3分, 51%-75%为4分, 76%以上为5分. 以两者乘积为最后得分, ≤5分为(-), 5-7分为(+), 8-10分为(++), ≥11分为(+++). 评分用作病理参数关系.
统计学处理 采用统计学软件SPSS13.0对相关数据进行分析与处理, 计数数据采用百分比的方式表示, 用χ2检验其组间比较. 以P<0.05为差异有统计学意义.
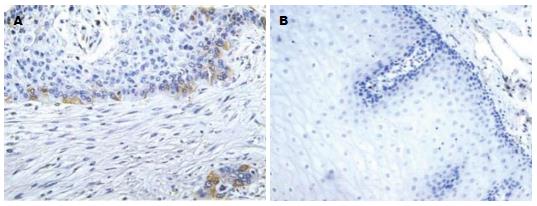
观察组样本的MT阳性表达高于对照组(92.0% vs 24.0%), 差异有统计学意义(P<0.05)(表1); 观察组样本的COX-2阳性表达率高于对照组(78.0% vs 20.0%), 差异有统计学意义(P<0.05)(表1). MT的染色对照如图1.
| 项目 | 对照组 | 观察组 | χ2值 | P值 |
| MT | ||||
| 阳性 | 16(8.0) | 184(92.0) | 13.417 | 0.003 |
| 阴性 | 152(76.0) | 48(24.0) | 9.627 | 0.009 |
| COX-2 | ||||
| 阳性 | 40(20.0) | 160(80.0) | 10.877 | 0.012 |
| 阴性 | 156(78.0) | 44(22.0) | 11.367 | 0.013 |
近几年, 随着人们生活节奏的加快与饮食方式的改变, 胃癌发病率呈逐年增高趋势, 成为了威胁人类健康的主要疾病之一[6]. 流行病学的研究[7]报道显示, 非甾体类药物, 如阿司匹林等, 能够用于肿瘤疾病的治疗, 可以使大肠癌的发病率与患者的死亡率降低, 药物的作用机制是对COX-2进行抑制, 从而引起一系列反应, 起到抗肿瘤的目的. 作为一种诱生型酶, COX-2在正常细胞中呈低表达甚至不表达, 但是当细胞因为肿瘤、炎症等而受到诱导时, 表达的细胞量会大大增加[8-10]. 在胃癌的发生与发展过程中, COX-2会以多种机制或途径参与其中, 比较常见的包括: (1)使肿瘤发生与转移的可能性提高, 使肿瘤细胞具有更强的侵袭力. COX-2在胃癌组织中的过度表达在某种意义上是由淋巴结转移与肿瘤侵袭引起的, 过度表达者通常难以获得理想的预后效果[11-14]. 且COX-2的过度表达和尿激酶型纤溶酶原激活物以及一些蛋白酶的表达型改变和表达都有一定的关联; (2)促进机体生产肿瘤血管. 新生血管是肿瘤生长与发生转移的一个重要条件, 而COX-2的过度表达会促使新生血管形成, 从而加快肿瘤细胞的生长速度, 提高转移发生率; (3)导致细胞凋亡与增殖失衡. COX-2过度表达会加快肿瘤细胞的增殖速度, 使其凋亡受到抑制, 打破细胞凋亡与增殖间的平衡状态, 引发肿瘤恶性行为; (4)参与癌细胞代谢; (5)使机体免疫抑制受到抑制. COX-2的过度表达会增加前列腺素E2的含量, 对于淋巴因子的产生起抑制作用, 导致其无法充分发挥调节免疫作用, 降低机体的免疫监视功能与细胞杀伤能力, 最终肿瘤细胞会处于无免疫监视状态; (6)使细胞周期变化受到影响[15-19].
MT可以结合大量重金属离子, 其巯基含量高、分子量低, 他广泛存在于大部分哺乳动物的内脏器官中, 特别是肾、肝细胞, 并且能参与功能调节[6,7,20-22]. 其异构体的分布区域主要是神经元细胞、星性胶质细胞等中枢神经系统以及消化道、舌、皮肤等器官的复层鳞状上皮细胞和角质细胞中. 作为一种小分子量结合蛋白, MT中的半胱氨酸含量较多, 属于细胞内蛋白, 能够结合铜、锌等多种金属, 其在动物及人体的实质性脏器中分布广泛, 蕴含于分子内的硫基能够结合某些细胞代谢产物. 自由基因与亲电性金属, 在重金属解毒与细胞内微量元素代谢中参与反应, 将自由基清除. 通常情况下MT在体内的含量不多, 应用免疫组化方法是难以检测到的, 然而当机体内存在肿瘤细胞时, MT大量增多, 呈现的检测结果也比较明显. MT能通过多种途径参与肿瘤细胞耐药, 所以在胃癌组织中的阳性表达率高于正常胃组织[15,23-25].
马丹等[26]通过检测正常胃黏膜(40例)与胃癌组织(43例)中COX-2的表达, 分析了其与胃癌临床病理特征的关系, 结果显示, COX-2蛋白在胃癌组织中的阳性表达率为76.74%, 高于其在正常胃黏膜中的表达率(22.50%), 并证实COX-2蛋白在胃癌中的表达和病变的远处转移、淋巴结转移与浸润深度有关. 王俊先等[27]通过免疫组织化学法研究了COX-2与葡萄糖神经酰胺合成酶(glucosylceramide synthase, GCS)在手术切除的非癌性胃组织标本(30例)与胃癌组织标本(63例)中的表达情况. 发现二者在非癌性胃组织中的阳性表达率远低于胃癌组织中, 而且COX-2在淋巴发生结转移的胃癌组织中, 阳性表达率为100%, 高于淋巴结未转移的胃癌组织(69.0%), 且GCS和COX-2在胃癌组织中的表达呈正相关. 而其在后续研究中, 在COX-2表达方面也得到了相同的结果与结论. 上述研究均说明了COX-2蛋白在胃癌组织中呈阳性表达, 且在淋巴结发生阳性转移的组织中表达率更高. 本次研究中, 我们在同样对COX-2蛋白在胃癌组织中的表达进行了研究, 与相关研究的结果一致. 除此之外, 我们分析了MT和胃癌的关系, 发现MT在胃癌组织中的表达率甚至高于COX-2蛋白的阳性表达率, 表明其是检测胃癌的重要标志物.
总之, 在胃癌组织中, COX-2与MT呈高表达状态, 影响着胃癌的发生和发展, 并且可能与胃癌细胞的转移、浸润的有关, 能够作为诊断胃癌及判断预后效果的重要指标.
非甾体类抗炎药可以使结肠癌的发病风险降低, 作用机制就是对环氧合酶-2(cyclooxygenase-2, COX-2)加以抑制. 金属硫蛋白(metallothionein, MT)可以消除有毒金属的毒性, 确保烷化剂、放射线等不会损伤细胞. 因此, COX-2与MT的表达同肿瘤的发生和发展关系密切.
沙杰, 副主任医师, 江苏省靖江市人民医院消化科
本文探讨了胃癌组织COX-2与MT的表达情况, 有一定的研究意义.
编辑: 于明茜 电编:都珍珍
| 2. | 胡 端敏, 冯 一中, 王 少峰. COX-2与MMP-7蛋白在胃癌组织中的表达及临床意义. 苏州大学学报(医学版). 2008;28:82-84, 87, 174. |
| 4. | 魏 学明, 顾 国利, 王 石林, 熊 梅, 李 德昌. 胃癌组织中EGFR、C-erbB-2、VEGF及COX-2的表达及意义. 中国普外基础与临床杂志. 2009;16:900-905. |
| 7. | Almeida PR, Ferreira FV, Santos CC, Rocha-Filho FD, Feitosa RR, Falcão EA, Cavada BK, Lima-Júnior RC, Ribeiro RA. Immunoexpression of cyclooxygenase-2 in primary gastric carcinomas and lymph node metastases. World J Gastroenterol. 2012;18:778-784. [PubMed] [DOI] |
| 8. | 隋 华, 周 利红, 刘 宣, 殷 佩浩, 周 宁, 王 炎, 孙 珏, 范 忠泽, 李 琦. COX-2介导MDR1/P-gp调控人结肠癌细胞多药耐药的研究. 中国癌症杂志. 2011;21:107. |
| 9. | Grzeszkiewicz TM, Lindner V, Chen N, Lam SC, Lau LF. The angiogenic factor cysteine-rich 61 (CYR61, CCN1) supports vascular smooth muscle cell adhesion and stimulates chemotaxis through integrin alpha(6)beta(1) and cell surface heparan sulfate proteoglycans. Endocrinology. 2002;143:1441-1450. [PubMed] |
| 14. | Holloway SE, Beck AW, Girard L, Jaber MR, Barnett CC, Brekken RA, Fleming JB. Increased expression of Cyr61 (CCN1) identified in peritoneal metastases from human pancreatic cancer. J Am Coll Surg. 2005;200:371-377. [PubMed] [DOI] |
| 18. | Liu H, Huang P, Xu X, Liu J, Guo C. Anticancer effect of celecoxib via COX-2 dependent and independent mechanisms in human gastric cancers cells. Dig Dis Sci. 2009;54:1418-1424. [PubMed] [DOI] |
| 20. | 翟 梅娟, 付 琼, 蔡 路兵. CDX-2和COX-2在胃癌中的表达及临床意义. 中国中西医结合外科杂志. 2013;19:133-136. |
| 21. | 孙 海兵, 魏 永长, 涂 宏蕾, 杜 宁, 赵 阳, 胡 丽娟, 任 宏. COX-2、PKC-α和miR-101在胃癌中的表达及相关性. 南方医科大学学报. 2013;33:559-562. |