修回日期: 2016-04-13
接受日期: 2016-04-20
在线出版日期: 2016-05-18
目的: 观察不同次数三硝基苯磺酸(trinitro-benzene-sulfonic acid, TNBS)灌肠刺激对大鼠肠道炎症程度及结肠组织Th17细胞因子白介素(interleukin, IL)-6、IL-17A、IL-21、维甲酸相关孤核受体γt(retinoid-related orphan nuclear receptorγt, RORγt)表达的影响.
方法: 30只清洁级♂SD大鼠, 160 g±10 g, 随机分为正常对照组(NG)、1 wk造模组、2 wk造模组、3 wk造模组、4 wk造模组. 按照Morris等方法制备克罗恩病(Crohn's disease, CD)大鼠模型, TNBS灌肠液由5%TNBS与500 mL/L的乙醇按2∶1比例混合而成, 1次/wk. 采用结肠一般形态和HE病理观察TNBS对结肠黏膜的病理损伤程度, 荧光定量PCR、免疫组织化学等技术观察各组大鼠结肠黏膜中RORγt、IL-17A的表达, ELISA法观察血清中IL-6、IL-21含量的变化.
结果: 大鼠结肠IL-17A mRNA水平在第1次TNBS诱导后表达为下降, 在3 wk时, IL-17A mRNA与蛋白水平明显升高(P<0.05), 第4次诱导后达到最高. 大鼠结肠RORγt蛋白随着刺激次数的增加而表达量逐渐增高(P<0.05), 第4次诱导后达到最高(P<0.05); 血清中IL-6、IL-21含量也均在1 wk时间点即开始显著上升(P<0.01), 在第4周达到最高值. 模型大鼠结肠组织大体形态评分和组织损伤评分显著增加(P<0.01).
结论: TNBS诱导CD模型过程中, Th17细胞因子IL-6、IL-17A、IL-21、RORγt的含量随着刺激次数的增加而逐渐增加, 并伴随结肠炎症程度的加重而逐渐加重.
核心提示: Th17细胞是一群介导炎症反应的重要细胞, 维甲酸相关孤核受体γt(retinoid-related orphan nuclear receptor γt, RORγt)是Thl7细胞特异性转录因子. 在三硝基苯磺酸诱导克罗恩病模型过程中, Th17细胞因子白介素(interleukin, IL)-6、IL-17A、IL-21、RORγt的含量随着刺激次数的增加而逐渐增加.
引文著录: 吴璐一, 翁志军, 吴焕淦, 陆颖, 季光. Th17细胞因子在CD大鼠结肠不同炎性时期的差异表达. 世界华人消化杂志 2016; 24(14): 2161-2169
Revised: April 13, 2016
Accepted: April 20, 2016
Published online: May 18, 2016
AIM: To observe the intestinal inflammatory status and the expression of interleukin (IL)-6, IL-17A, IL-21, and retinoid-related orphan nuclear receptor γt (RORγt) secreted by Th17 cells in colon tissues of rats with trinitro-benzene-sulfonic acid (TNBS) induced Crohn's disease.
METHODS: Thirty male rats were randomly divided into a normal control group and 1-, 2-, 3- and 4-wk model groups. Morphological observation and HE staining were used to assess the degree of damage to the colonic mucosa. Fluorescence quantitative PCR, immunohistochemical method and other techniques were used to observe the expression of RORγt and IL-17A in rat colonic mucosa, and ELISA method was used to detect the contents of IL-6 and IL-21 in serum.
RESULTS: The level of IL-17A mRNA in rat colon decreased at the first induction with TNBS, but the levels of IL-17A mRNA and protein obviously increased (P < 0.05) at 3 wk and reached the highest after the fourth induction. The expression of RORγt protein gradually increased after induction (P < 0.05), and reached the highest at the fourth induction (P < 0.05). The contents of IL-6 and IL-21 in serum obviously increased from the first week (P < 0.01), reaching the highest at the fourth week. The colon general morphological score and tissue damage score of model rats obviously increased (P < 0.01).
CONCLUSION: During the process of Crohn's disease induced with TNBS, the contents of IL-6, IL-17A, IL-21, and RORγt secreted by Th17 cells gradually increased and the degree of colonic inflammation gradually exacerbated.
- Citation: Wu LY, Weng ZJ, Wu HG, Lu Y, Ji G. Differential expression of Th17 cytokines in the colon of rats in different inflammatory periods of Crohn's disease. Shijie Huaren Xiaohua Zazhi 2016; 24(14): 2161-2169
- URL: https://www.wjgnet.com/1009-3079/full/v24/i14/2161.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i14.2161
克罗恩病(Crohn's disease, CD)是一种病因尚未完全明确的累及消化系统的炎症性疾病(inflammatory bowel disease, IBD), CD的发生是由多种因素相互作用引起的, 主要与遗传、免疫、感染、环境等因素有关. 该病典型的病理改变呈节段性, 故又称局限性肠炎. 临床症见腹痛、腹泻、肠梗阻, 伴有发热、营养障碍等肠外表现, 具有慢性和消耗性的特征, 病程多迁延难愈[1-3], 近年发病率逐年升高. 目前认为免疫, 尤其是结肠黏膜局部的免疫紊乱在CD的发病中占有重要地位, 而促炎症性细胞因子增多和抗炎症性细胞因子相对减少是引起结肠黏膜免疫反应异常和慢性炎症的重要原因, 黏膜免疫细胞与非免疫细胞相互作用共同促进组织破坏, 而细胞因子是必需的调节者. T细胞介导的免疫反应在IBD组织破坏的发病机制中发挥中心的作用[4,5], CD4+ T作为效应T细胞的重要成分, 参与了免疫应答的各个阶段. Thl7细胞是一类不同于Th1和Th2细胞的CD4+ T细胞, 分泌的细胞因子除了白介素(interleukin, IL)-17A外, 还包括IL-21、IL-22、IL-6、肿瘤坏死因子-α(tumor necrosis factor α, TNF-α)等, 因此Th17细胞是一群介导炎症反应的重要细胞[6-8]. IL-17启动了其下游核因子-κB(nuclear factor-κB, NF-κB)、p38 MAPK等信号转导途径, 通过协同及负调控等信号转导机制影响众多炎性因子的转录和表达[9]. 其中IL-21作为Th17细胞自分泌调节因子, 在诱导Th17分化、抑制Th1、Treg功能方面发挥关键作用. 在炎症反应和自身免疫性疾病时, IL-6等促炎症细胞因子的过度表达通过影响初始T细胞的分化格局, 能增加Th17细胞分化, 破坏Treg/Th17平衡, 导致一系列炎症反应损伤机体. 同时维甲酸相关孤核受体γt(retinoid-related orphan nuclear receptor γt, RORγt)是Thl7细胞特异性转录因子, 参与自身免疫性疾病、感染和肿瘤等多种病理过程, 在自身免疫性疾病和机体防御反应中具有重要的意义[10]. 本实验旨在观察介导炎症反应的IL-6、IL-21、IL-17A、Thl7细胞特异性转录因子RORγt在不同次数三硝基苯磺酸(trinitro-benzene-sulfonic acid, TNBS)诱导结肠炎症的不同时期中的作用机制.
30只SPF级♂SD大鼠, 体质量为160 g±10 g, 购自上海斯莱克实验动物有限责任公司[生产许可证号: SCXK(沪)2012-0002], 饲养于上海中医药大学附属龙华医院实验动物中心. 适应性饲养后, 大鼠无不良反应、饮食饮水正常者, 大鼠按体质量由小到大编号, 采用完全随机法分组并纳入实验. 所有实验对动物的处理符合中国科学技术部指导建议.
1.2.1 CD大鼠模型制备: 按照Morris等[11]方法制备CD大鼠模型, 5%TNBS与500 mL/L的乙醇按2∶1比例混合而成, 3%戊巴比妥钠麻醉大鼠(按体质量计, 0.1 mL/100 g), 使其身体垂直, 处于倒立位, 每次灌肠剂量: 灌肠液(mL) = 体质量(g)×0.003 mL/g, 5 mL注射器连接灌肠针顺大鼠直结肠生理曲度缓缓从肛门插入约6-9 cm, 注入TNBS灌肠液. 灌肠后将大鼠倒立体位约5 min. 每周第1天灌肠1次, 1次/wk.
1.2.2 分组: (1)正常对照组NG(n = 6): 饲养后不作处理; (2)1 wk造模组(n = 6): 第1周TNBS诱导第1次, 灌肠剂量(mL) = 体质量(g)×0.003 mL/g, 7 d后腹腔麻醉后取材; (3)2 wk造模组(n = 6): TNBS诱导2次. 1次/wk, 第2次诱导7 d后腹腔麻醉后取材; (4)3 wk造模组(n = 6): TNBS诱导3次, 1次/wk, 第3次诱导7 d后腹腔麻醉后取材; (5)4 wk造模组(n = 6): TNBS诱导4次, 1次/wk, 第4次诱导7 d后腹腔麻醉后取材.
1.2.3 标本采集与处理: 标本采集前禁食24 h, 以3%戊巴比妥钠麻醉大鼠(按体质量计, 0.1 mL/100 g), 腹主动脉采血, 离心用于ELISA检测; 沿肠系膜纵行剖开, 用预冷的4 ℃生理盐水冲洗后, 肉眼观察并记录黏膜损伤情况. 截取病变明显处组织, 每只大鼠结肠标本分2份, 1份-80 ℃冰箱保存待测. 另一份用10%的中性缓冲甲醛溶液固定并标记, 行病理学检测.
1.2.4 观察指标与方法: 大鼠结肠组织HE染色: 切片常规脱蜡至水; 苏木素1 min; 盐酸酒精2 s; 伊红10 s; 二甲苯透明; 中性树胶封片, 光学显微镜下观察. 大鼠结肠实时定量PCR检测(real-time quantitative PCR, qRT-PCR)检测: 组织总RNA的抽提, 组织匀浆, 采用TRIzol法提取总RNA, 检测浓度、纯度、完整性. 取相等量的总RNA, 采用SYBRGreen PCR试剂盒(上海捷瑞生物工程公司)逆转录cDNA, 用于qRT-PCR所用引物序列如下: R-IL-17A mRNA, Sense: 5'-CTGATGCTGTTGCTGCTACTGA-3'. Antisense: 5'-GTGAAGTGGAACGGTTGAGGTA-3'; R-β-actin mRNA, Sense: 5'-CTAAGGCCAACCGTGAAAAGAT-3'. Antisense: 5'-ACCAGAGGCATACAGGGACAAC-3'. 数据采用仪器自带软件分析: ABI Prism 7500 SDS Software. 大鼠结肠免疫组织化学检测: 切片0.3%H2O2抑制内源性过氧化物酶20 min; 20%正常羊血清室温孵育30 min; 滴加一抗在37 ℃下孵育2 h, IL-17A、RORγt一抗(Sigma, USA); EnVision试剂(HRP/R)加入后保留30 min; DAB显色1-2 min; 苏木素染色, 树脂封片; 采用Olympus-BX53显微镜进行图像采集(×400), 数据分析采用Image-Pro PLUS软件. 血清ELISA法检测: 血液4 ℃, 5000 r/min离心30 min, 取上清液, 加入100 μL标准品(Standards)、100 μL已适当稀释标本于相应板孔中; 温育20 min后洗板, 每孔加入100 μL兔抗鼠IL-6、IL-21. 轻轻混匀30 s, 20 ℃-25 ℃温育20 min; 洗板后加入100 μL 1x HRP. 轻轻混匀30 s, 20 ℃-25 ℃温育20 min, 洗板后每孔加入100 μL TMB显色液, 轻轻混匀10 s, 每孔加入100 μL终止液(Stop Solution). 轻轻混匀30 s, 15 min内脏450 nm处读OD值. IL-6、IL-21(ng/mL) = 标准曲线上查出的浓度×标本的稀释倍数.
统计学处理 数据分析采用SPSS18.0统计软件进行统计学处理. 对数据作正态分布检验. 数据若符合正态分布, 组间差异采用单因素方差分析(One-way ANOVA), 方差齐时采用最小显著差法(least significant difference, LSD)比较组间差异性, 方差不齐时用Games-Howell比较组间差异性, 数据不符合正态性分布的, 统计采用非参数检验, 组间比较采用ANOVA分析数据秩次, 取检验水准α = 0.05, 以P<0.05为差异有统计学意义.
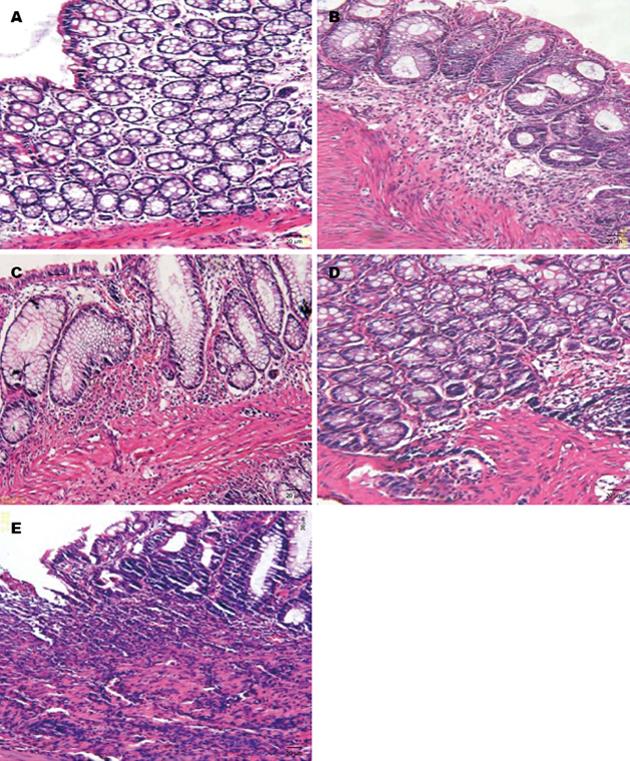
结肠组织一般形态: 正常组: 大鼠结肠肠管均匀; 结肠壁厚薄均匀, 肠黏膜面光滑整齐、完整, 无出血点、糜烂及溃疡. 1 wk组: 肠壁厚薄较一致, 肠管较均匀, 一大片黏膜组织充血、水肿. 2 wk组: 肠壁厚薄不均, 肠管不均匀, 大片黏膜组织充血、红肿, 部分出现溃疡. 3 wk组: 大鼠结肠肠管局部狭窄; 肠壁厚薄不均, 结肠黏膜充血水肿, 广泛分布的糜烂及溃疡. 4 wk组: 大鼠结肠肠管局部狭窄; 肠壁厚薄不均, 局部增厚变硬; 结肠黏膜充血水肿, 广泛分布的糜烂及溃疡. 溃疡多数为小块状甚至连接成片, 多累及黏膜、黏膜下层, 深达肌层.
病理表现(HE染色)如图1所示, 正常组: 结肠黏膜结构完好, 上皮无缺损, 腺体排列整齐, 黏膜及黏膜下层无充血、水肿、炎细胞浸润等异常改变. 1 wk组: 腺体排列较整齐, 水肿、炎症细胞浸润. 2 wk组: 腺体排列结构紊乱, 黏膜下有水肿、充血. 3 wk组: 腺体排列紊乱, 炎症细胞浸润至肌层, 有水肿、充血. 4 wk组: 上皮细胞坏死、脱落, 肠壁全层大量炎症细胞浸润、肉芽肿形成, 大量纤维组织增生.
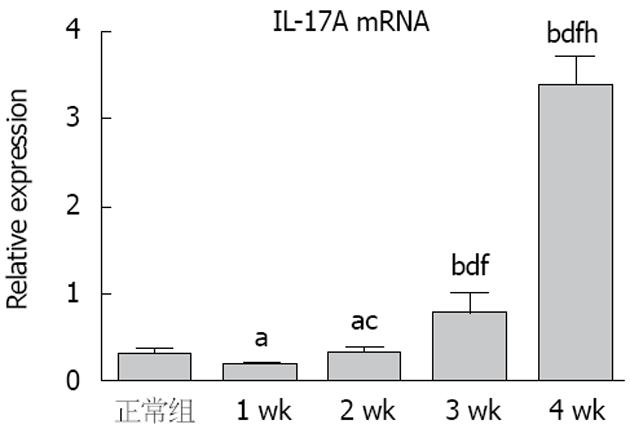
如图2所示, 与正常组相比, CD大鼠结肠组织IL-17A mRNA水平, 在1 wk时IL-17A先下降, 在2 wk时呈上升趋势. 第4周与正常组比较有显著性升高, 差异有统计学意义.
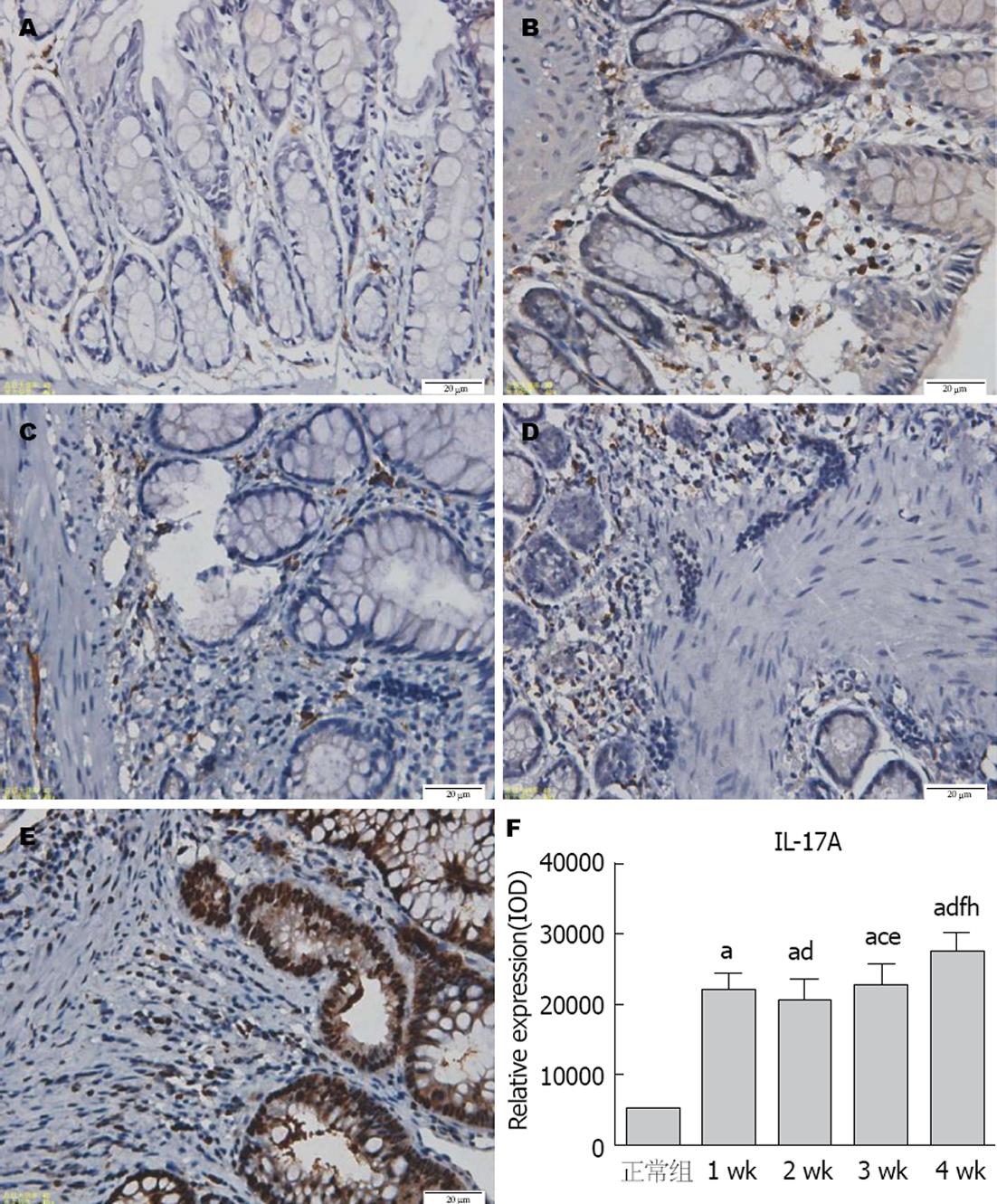
2.3.1 结肠组织IL-17A蛋白表达: 正常组结肠黏膜上皮结构完整、排列整齐, 肠黏膜IL-17A呈弱阳性表达(图3A). 1 wk组: 结肠黏膜上皮结构紊乱, 肠黏膜IL-17A呈弱阳性表达(图3B). 2 wk组: 结肠黏膜上皮结构较紊乱, 炎症细胞明显增生, 肠黏膜IL-17A呈中度-强阳性表达(图3C). 3 wk组: 结肠黏膜上皮结构较紊乱, 炎症细胞大量增生, 肠黏膜IL-17A呈中度-强阳性表达(图3D). 4 wk组: 结肠黏膜上皮有脱落, 结构紊乱, 肠黏膜IL-17A呈强阳性表达(图3E). IL-17A主要表达于大鼠结肠黏膜上皮细胞和结肠黏膜上皮间质非上皮细胞, 在1、2、3、4 wk时间点均呈上升趋势, 在3、4 wk显著升高(P<0.01)(图3F).
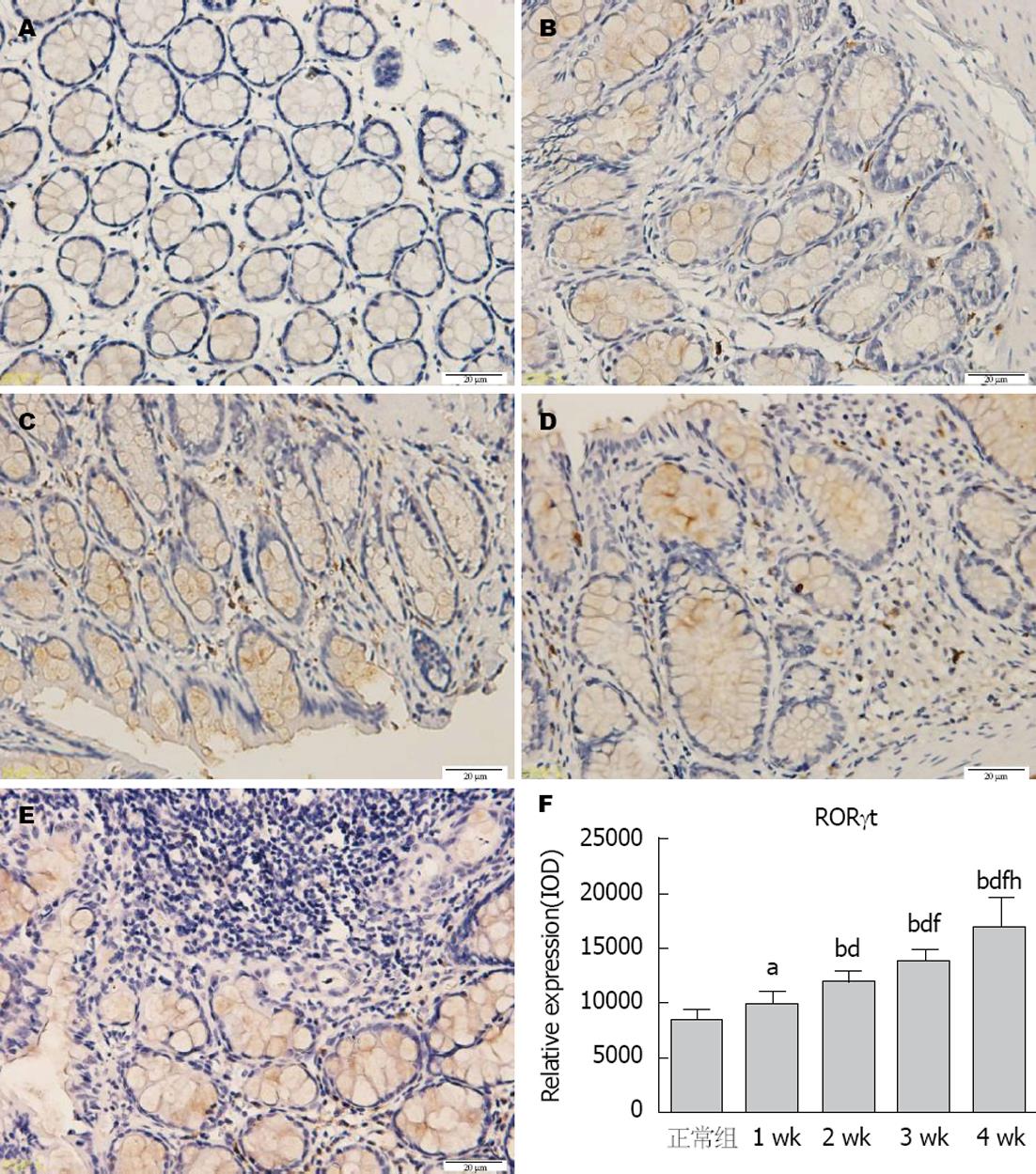
2.3.2 结肠组织RORγt蛋白表达: RORγt主要表达于大鼠结肠黏膜上皮细胞和结肠黏膜上皮间质非上皮细胞. 正常组: 结肠黏膜上皮结构完整, 肠黏膜RORγt呈弱阳性表达(图4A). 1 wk组: 结肠黏膜上皮腺体排列整齐, 肠黏膜RORγt呈中度-阳性表达(图4B). 2 wk组: 结肠黏膜上皮腺体排列较紊乱, 肠黏膜RORγt呈中度-阳性表达(图4C). 3 wk组: 结肠黏膜上皮腺体排列较紊乱, 大量炎症细胞浸润, 肠黏膜RORγt呈中度-强阳性表达(图4D). 4 wk组: 结肠黏膜上皮脱落, 炎症细胞大量增生, 肠黏膜RORγt呈强阳性表达(图4E). RORγt蛋白表达在1、2、3、4 wk时间段均上升趋势, 在3 wk时间点出现显著升高(P<0.01)(图4F).
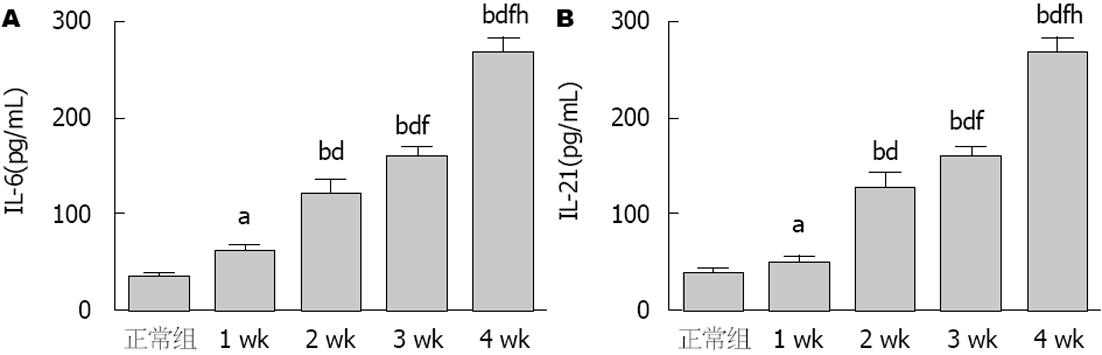
结果显示, 与正常组相比, 血清中IL-6、IL-21含量也均在1 wk时间点即开始显著上升(P<0.01), 在第2、3周时增加较为缓慢, 在第4周达到最高值(P<0.01), 增幅较大(图5).
Th17在自身免疫性疾病的发生和发展中发挥重要作用, 其分泌的相关因子启动和扩大炎症反应在机体中[12,13], Th17细胞与调节性T细胞在功能和分化上相互拮抗, 从而维持机体的稳态, 一旦相关因子因各种刺激造成异常表达或分化功能异常即打破Treg/Th17平衡, 即可引起一系列免疫反应, 最终导致炎症性疾病的发生. 在体内, IL-6、IL-21和IL-23都能够直接或者间接促进Th17细胞分化以及IL-17的表达[14]. Thl7特征性分泌IL-17, IL-17A是IL-17家族原型, 也是Thl7细胞的主要效应因子, 除Thl7细胞外, 多种T细胞亚群均可分泌IL-17A[15], 同时IL-17又可以促进其他促炎因子诱导炎症反应, 临床研究发现IBD患者肠黏膜组织和外周血中IL-17含量明显升高[16]. IL-17活化因子结合IL-17基因, 影响Foxp3与RORγt的平衡, 降低RORγt的表达, 抑制Th17分化[17]. Th17细胞的分化与Treg细胞的诱导存在相互排斥的关系. 当体系内有炎性细胞因子如IL-6存在时, Foxp3+ T细胞的分化受到抑制, 封闭IL-6的作用则加强Foxp3+ T细胞的发育[18,19]. Ivanov等[20]发现, 表达在一些组成性分泌IL-17的肠道固有层淋巴细胞内的, 转录调节因子RORγt是特异性调节Th17分化及功能的转录调节因子[21]. RORγt还表达在CD4+、CD8+ T细胞, 以及淋巴组织诱导(lymphoid tissue inducer, LTi)细胞内, SATA3缺陷T细胞中Th17细胞的分化受到影响, 并且RORγt的表达也受到抑制[22].
在我们的实验观察中, 以TNBS灌肠造模过程中, 大鼠出现了Th17细胞因子的紊乱. 对Th17细胞相关分子进行检测发现, 其信号通路上关键分子IL-17A、RORγt均出现明显变化. 受到抗原刺激的细胞中分化成Th17细胞, 已知RORγt和Foxp3调节的平衡在结肠炎症中起到了关键作用[23,24]. 在结肠黏膜尤其是固有层中, RORγt可被高浓度的TGF-β和IL-6共同作用下诱导, 然后促进Th17细胞的分化. 随着刺激程度的增加, 大鼠结肠RORγt蛋白和血清中IL-6、IL-21含量都出现了不同程度的升高, 可以解释这种分化程度的差异.
在我们的TNBS诱导的结肠炎大鼠结肠中还发现, 在经过不同次数灌肠刺激后, 到第4周时, 炎症反应逐步发展到慢性炎症时期, 这个发展过程中, IL-17A基因和蛋白都出现表达的上调, 以TNBS对大鼠灌肠1 wk后开始观察、取材. 通过观察显示, 大鼠IL-17A mRNA水平在1次造模后表现为下降, 在第2次造模后明显升高, 第4次造模后达到最高. IL-17A在2 wk时明显升高, CD模型大鼠转变为IL-17A介导为主的炎症反应. Th17分化的转录因子RORγt可能滞后于JAK3-Stat5信号通路的启动. 表明在炎症初期, 以Stat5为主的信号转录与转录因子对于IL-17A分化处于抑制状态, IL-17A在结肠黏膜中的mRNA水平在1次造模后表现为下降状态, 随着Th17分化的转录因子RORγt不断分泌, 在2 wk时IL-17A出现逆转, 第4周达到最高(P<0.05). Stat5与RORγt协同作用在IL-17A的分化中发挥重要作用, 可能是改善Th17/Treg平衡的重要靶点[25].
在由TNBS诱导形成的CD模型中, 首先乙醇是溶解肠黏膜表面物质发挥破坏肠黏膜屏障作用; TNBS作为半抗原引发肠道局部的免疫损伤反应, 进而模型大鼠全身免疫调节失衡, 炎症过程逐级放大, 最后造成模型大鼠结肠炎症的病理变化, 体现了急性炎症逐步向慢性炎症的一个动态过程[26], 在我们的实验中所观察的不同炎症时期IL-6、IL-21、IL-17A、RORγt的表达变化情况, 为研究CD急性炎症向慢性转化的病理生理变化、新药的开发和新的疗法等等提供了参考.
在克罗恩病(Crohn's disease, CD)大鼠结肠炎症形成的不同时期, 多种炎症因子介导炎症的发生和发展, 且与肠道的炎症程度的关系密切, 本文旨在观察介导炎症反应的白介素(interleukin, IL)-6、IL-21、IL-17A、Thl7细胞特异性转录因子维甲酸相关孤核受体γt(retinoid-related orphan nuclear receptor γt, RORγt)在不同次数三硝基苯磺酸诱导CD结肠炎症的不同时期中的作用机制.
李卫强, 副教授, 副主任医师, 宁夏医科大学中医学院; 郝微微, 主任医师, 医学博士, 硕士生导师, 上海中医药大学附属岳阳中西医结合医院消化内科; 王学美, 研究员, 北京大学第一医院中西医结合研究室
辅助性T细胞17在自身免疫性疾病的发生和发展中发挥重要作用, 其分泌的相关因子启动和扩大炎症反应. 在机体中, Th7细胞与调节性T细胞在功能和分化上相互拮抗, 从而维持机体的稳态, 在CD炎症的发生发展过程中涉及多种炎症因子的参与, 亟需阐释炎症不同时期的发病机制, 为新药的开发和新的疗法提供科学依据.
T细胞介导的免疫反应在炎症性疾病组织破坏的发病机制中发挥中心的作用, CD4+T作为效应T细胞的重要成分, 参与了免疫应答的各个阶段.
本文旨在揭示介导炎症反应的IL-6、IL-21、IL-17A、Thl7细胞特异性转录因子RORγt在CD结肠炎症的不同时期中的差异表达.
在CD炎症的发生发展过程中涉及多种炎症因子的参与, 亟需阐释炎症不同时期的发病机制, 为新药的开发和新的疗法提供科学依据.
Th17细胞: Th17是由TH0细胞在IL6和IL23的刺激下分化而成的辅助性T细胞, 主要分泌IL17、IL22等促炎症因子, RORγ是其重要的转录因子. Th17细胞在自身免疫中起重要的作用.
本文研究运用TNBS多次诱导形成的CD模型, 体现了急性炎症逐步向慢性炎症的一个动态过程, 为研究CD急性炎症向慢性转化的病理生理变化等提供了参考, 具有一定新颖性.
编辑: 于明茜 电编:闫晋利
| 1. | Cheng L, Huang MF, Mei PF, Bo WH, Deng CS. [The clinical, endoscopic and pathologic features of Crohn's disease in the differentiation from intestinal tuberculosis]. Zhonghua Neike Zazhi. 2013;52:940-944. [PubMed] |
| 2. | Tzivanakis A, Singh JC, Guy RJ, Travis SP, Mortensen NJ, George BD. Influence of risk factors on the safety of ileocolic anastomosis in Crohn's disease surgery. Dis Colon Rectum. 2012;55:558-562. [PubMed] [DOI] |
| 3. | Hovde Ø, Moum BA. Epidemiology and clinical course of Crohn's disease: results from observational studies. World J Gastroenterol. 2012;18:1723-1731. [PubMed] [DOI] |
| 4. | Fina D, Caruso R, Pallone F, Monteleone G. Interleukin-21 (IL-21) controls inflammatory pathways in the gut. Endocr Metab Immune Disord Drug Targets. 2007;7:288-291. [PubMed] [DOI] |
| 5. | Sartor RB, Muehlbauer M. Microbial host interactions in IBD: implications for pathogenesis and therapy. Curr Gastroenterol Rep. 2007;9:497-507. [PubMed] [DOI] |
| 6. | Kolls JK, Lindén A. Interleukin-17 family members and inflammation. Immunity. 2004;21:467-476. [PubMed] [DOI] |
| 7. | Zheng Y, Danilenko DM, Valdez P, Kasman I, Eastham-Anderson J, Wu J, Ouyang W. Interleukin-22, a T(H)17 cytokine, mediates IL-23-induced dermal inflammation and acanthosis. Nature. 2007;445:648-651. [PubMed] [DOI] |
| 8. | Nurieva R, Yang XO, Martinez G, Zhang Y, Panopoulos AD, Ma L, Schluns K, Tian Q, Watowich SS, Jetten AM. Essential autocrine regulation by IL-21 in the generation of inflammatory T cells. Nature. 2007;448:480-483. [PubMed] [DOI] |
| 9. | Globig AM, Hennecke N, Martin B, Seidl M, Ruf G, Hasselblatt P, Thimme R, Bengsch B. Comprehensive intestinal T helper cell profiling reveals specific accumulation of IFN-γ+IL-17+coproducing CD4+ T cells in active inflammatory bowel disease. Inflamm Bowel Dis. 2014;20:2321-2329. [PubMed] [DOI] |
| 10. | Harrington LE, Hatton RD, Mangan PR, Turner H, Murphy TL, Murphy KM, Weaver CT. Interleukin 17-producing CD4+ effector T cells develop via a lineage distinct from the T helper type 1 and 2 lineages. Nat Immunol. 2005;6:1123-1132. [PubMed] [DOI] |
| 11. | Morris GP, Beck PL, Herridge MS, Depew WT, Szewczuk MR, Wallace JL. Hapten-induced model of chronic inflammation and ulceration in the rat colon. Gastroenterology. 1989;96:795-803. [PubMed] |
| 12. | McNamee EN, Masterson JC, Veny M, Collins CB, Jedlicka P, Byrne FR, Ng GY, Rivera-Nieves J. Chemokine receptor CCR7 regulates the intestinal TH1/TH17/Treg balance during Crohn's-like murine ileitis. J Leukoc Biol. 2015;97:1011-1022. [PubMed] [DOI] |
| 13. | Wu W, Chen F, Liu Z, Cong Y. Microbiota-specific Th17 Cells: Yin and Yang in Regulation of Inflammatory Bowel Disease. Inflamm Bowel Dis. 2016; Apr 6. [Epub ahead of print]. [PubMed] |
| 14. | Choi JS, Kim KH, Lau LF. The matricellular protein CCN1 promotes mucosal healing in murine colitis through IL-6. Mucosal Immunol. 2015;8:1285-1296. [PubMed] [DOI] |
| 15. | Cua DJ, Tato CM. Innate IL-17-producing cells: the sentinels of the immune system. Nat Rev Immunol. 2010;10:479-489. [PubMed] [DOI] |
| 16. | Sugihara T, Kobori A, Imaeda H, Tsujikawa T, Amagase K, Takeuchi K, Fujiyama Y, Andoh A. The increased mucosal mRNA expressions of complement C3 and interleukin-17 in inflammatory bowel disease. Clin Exp Immunol. 2010;160:386-393. [PubMed] [DOI] |
| 17. | Yang XP, Ghoreschi K, Steward-Tharp SM, Rodriguez-Canales J, Zhu J, Grainger JR, Hirahara K, Sun HW, Wei L, Vahedi G. Opposing regulation of the locus encoding IL-17 through direct, reciprocal actions of STAT3 and STAT5. Nat Immunol. 2011;12:247-254. [PubMed] [DOI] |
| 18. | Mangan PR, Harrington LE, O'Quinn DB, Helms WS, Bullard DC, Elson CO, Hatton RD, Wahl SM, Schoeb TR, Weaver CT. Transforming growth factor-beta induces development of the T(H)17 lineage. Nature. 2006;441:231-234. [PubMed] [DOI] |
| 19. | Ueno A, Jijon H, Chan R, Ford K, Hirota C, Kaplan GG, Beck PL, Iacucci M, Fort Gasia M, Barkema HW. Increased prevalence of circulating novel IL-17 secreting Foxp3 expressing CD4+ T cells and defective suppressive function of circulating Foxp3+ regulatory cells support plasticity between Th17 and regulatory T cells in inflammatory bowel disease patients. Inflamm Bowel Dis. 2013;19:2522-2534. [PubMed] [DOI] |
| 20. | Ivanov II, McKenzie BS, Zhou L, Tadokoro CE, Lepelley A, Lafaille JJ, Cua DJ, Littman DR. The orphan nuclear receptor RORgammat directs the differentiation program of proinflammatory IL-17+ T helper cells. Cell. 2006;126:1121-1133. [PubMed] [DOI] |
| 21. | Mizuno S, Mikami Y, Kamada N, Handa T, Hayashi A, Sato T, Matsuoka K, Matano M, Ohta Y, Sugita A. Cross-talk between RORγt+ innate lymphoid cells and intestinal macrophages induces mucosal IL-22 production in Crohn's disease. Inflamm Bowel Dis. 2014;20:1426-1434. [PubMed] [DOI] |
| 22. | Sawa S. [Roles of RORγt+ innate lymphoid cells in mucosal tissues of mouse and human]. Nihon Rinsho Meneki Gakkai Kaishi. 2013;36:11-16. [PubMed] [DOI] |
| 23. | Siakavellas SI, Bamias G. Role of the IL-23/IL-17 axis in Crohn's disease. Discov Med. 2012;14:253-262. [PubMed] |
| 24. | Chen QQ, Yan L, Wang CZ, Wang WH, Shi H, Su BB, Zeng QH, Du HT, Wan J. Mesenchymal stem cells alleviate TNBS-induced colitis by modulating inflammatory and autoimmune responses. World J Gastroenterol. 2013;19:4702-4717. [PubMed] [DOI] |
| 25. | Connelly TM, Koltun WA, Berg AS, Hegarty JP, Brinton D, Deiling S, Poritz LS, Stewart DB. A single nucleotide polymorphism in the STAT5 gene favors colonic as opposed to small-bowel inflammation in Crohn's disease. Dis Colon Rectum. 2013;56:1068-1074. [PubMed] [DOI] |
| 26. | Shi XZ, Winston JH, Sarna SK. Differential immune and genetic responses in rat models of Crohn's colitis and ulcerative colitis. Am J Physiol Gastrointest Liver Physiol. 2011;300:G41-G51. [PubMed] [DOI] |