修回日期: 2016-03-25
接受日期: 2016-04-14
在线出版日期: 2016-05-18
目的: 探讨不同途径移植Pkh26标记的大鼠骨髓间充质干细胞(bone mesenchymal stem cell, BMSCs)治疗胰腺炎的最佳移植途径.
方法: 取3周龄健康SD♀小鼠的股骨及胫骨骨髓, 进行分离纯化BMSCs. 取体质量250-300 g ♀ SD大鼠160只, 分模型组及治疗组, 并在不同时间测大鼠的血清淀粉酶及血脂肪酶. 将治疗组分为尾静脉组、胰腺局部注射组、肠系膜上静脉组, 各实验组均移植红色荧光染料Pkh26标记的BMSCs. 细胞移植术后12、24、48、72 h、1 wk测血清淀粉酶、血脂肪酶, 3 wk观察Pkh26标记的BMSCs的定位及HE染色观察胰腺组织病理学变化.
结果: 细胞移植术后12、24、48、72 h、1 wk尾静脉注射组血清淀粉酶和血脂肪酶水平与模型组比较差异有统计学意义(P<0.05), 肠系膜上静脉组、胰腺局部注射组与相应的模型组比较显著下降(P<0.05), 胰腺局部注射组与肠系膜上静脉组比较显著下降(P<0.05), 但是仍高于对照组. 尾静脉组各时间点胰腺内可见极少量Pkh26标记的BMSCs, 肠系膜上静脉组2 wk时胰腺内可见散在亮红色荧光的细胞, 数量少, 3 wk时数量稍多, 胰腺局部注射组2 wk及3 wk胰腺内均可见较多红色荧光的细胞, 对照组各时间点均未见Pkh26标记细胞.
结论: BMSCs经尾静脉、肠系膜上静脉、胰腺局部注射移植于胰腺炎大鼠模型体内, 明显改善了受损胰腺的功能, 对胰腺炎损伤具有修复作用, 胰腺局部注射移植途径优于其他移植途径.
核心提示: 本文通过不同途径移植Pkh26标记的大鼠骨髓间充质干细胞(bone mesenchymal stem cell, BMSCs)治疗胰腺炎, 对不同途径在不用时间内的清淀粉酶、血脂肪酶变化进行检测, 同时对各组进行HE染色及胰腺组织病理学观察, 结果显示, 不同途径移植BMSCs明显改善了受损胰腺的功能, 且胰腺局部注射移植途径优于其他移植途径.
引文著录: 李霞, 庄丽维, 朱承雁, 薄挽澜, 米丽娜. 移植骨髓间充质干细胞治疗胰腺炎的最佳途径. 世界华人消化杂志 2016; 24(14): 2152-2160
Revised: March 25, 2016
Accepted: April 14, 2016
Published online: May 18, 2016
AIM: To find the optimal route of transplantation of mesenchym stem cells for the treatment of acute pancreatitis.
METHODS: Bone marrow mesenchymal stem cells (BMSCs) were derived from the bone marrow of the femur and tibia from healthy 3-week-old SD rats by primary adherent culture. Acute pancreatitis was induced in rats by intraperitoneal injection of L-arginine. The model rats were randomly divided into either a treatment group or a model group. Serum amylase was measured at 12, 24, 48, and 72 h and lipase measured at 24, 48, 72 h, and one week. The treatment group was further divided into a tail vein group, a superior mesenteric vein group, and a pancreatic local injection group, with 40 rats in each group. All experimental groups received Pkh26 labelled BMSCs transplantation. At 12, 24, 48, 72 h, and one week after the transplantation, serum amylase and lipase were measured and compared. After three weeks, Pkh26 labelled BMSCs in animals were observed, and pancreatic tissue pathology was assessed by HE staining.
RESULTS: Two weeks and three weeks after the transplantation, compared with the model group, the levels of serum amylase and lipase were statistically significant different in the tail vein injection group, and they were also significantly decreased in the pancreatic local injection group and superior mesenteric vein group compared with the model group (P < 0.05). The levels of serum amylase and lipase were significantly lower in the pancreatic local injection group than in the superior mesenteric vein group (P < 0.05), but they were still higher in the treatment groups than in the control group. Very few Pkh26 labeled cells were found in the tail vein group at different time points. A few Pkh26 labeled cells were found in the superior mesenteric vein group at week 2, and more were visible at week 3. A lot of Pkh26 labeled cells were found in the pancreatic local injection group at both weeks 2 and 3, but they were not found in the control group or model group at each time point.
CONCLUSION: Transplantation of bone marrow BMSCs via the tail vein, superior mesenteric vein and pancreatic local injection can ameliorate and repair pancreatic function of rats with pancreatic injury. Pancreatic local injection is the best route of transplantation.
- Citation: Li X, Zhuang LW, Zhu CY, Bo WL, Mi LN. Optimal route of transplantation of bone marrow mesenchymal stem cells for therapy of acute pancreatitis. Shijie Huaren Xiaohua Zazhi 2016; 24(14): 2152-2160
- URL: https://www.wjgnet.com/1009-3079/full/v24/i14/2152.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i14.2152
重症急性胰腺炎(severe acute pancreatitis, SAP)在临床上死亡率较高, 是由各种病因引起胰腺内的胰酶被激活, 导致胰腺组织的自身消化、出血、水肿和坏死的炎性反应, 又称出血坏死性胰腺炎[1,2]. SAP常继发感染性腹膜炎、休克、全身炎症反应综合征(systemic inflammatory response syndrome, SIRS)和多器官功能障碍综合征(multiple organ dysfunction syndrome, MODS)等严重并发症, 预后极差, 是一种危害人类健康常见病和多发病[3]. SAP患者促炎细胞因子的产生, 如: 白介素(interleukin, IL)-1β、肿瘤坏死因子-α(tumor necrosis factor α, TNF-α)、IL-6、IL-8和抗炎反应系统的失衡[4], 这些促炎细胞因子和抗炎因子的相互作用, 从而导致了胰腺的坏死, 水肿等严重并发症. 目前, 临床上SAP的治疗, 内科治疗主要是禁食水、营养支持、抑制胰酶分泌、抗生素治疗等, 外科治疗主要是手术治疗, 最常用的是坏死组织清除加引流术, 无论是内科保守治疗还是外科手术治疗, 在临床上, 急性重症胰腺炎的治疗方法多侧重于抑制胰酶分泌、防止多个器官继发损害为主的原则, 而没有太多关注胰腺本身功能的恢复. 随着干细胞的研究进展, 有望使细胞移植在SAP治疗方面取得重大突破.
骨髓间充质干细胞(bone mesenchymal stem cell, BMSCs)是存在于骨髓中的间充质干细胞, 具有定向或多向分化的潜能, 目前的研究[5]已证明, 其有治疗急性胰腺炎的潜能, 主要通过向损伤部位迁移并增殖, 转化为胰腺干细胞, 参与组织再生, 修复血管内皮, 改善血流, 调控炎症相关的细胞因子, 减轻炎症反应以及免疫调节功能来发挥其治疗作用, 为临床上SAP的治疗提供了新的思路.
健康SD♀大鼠200只, 清洁级, 体质量250-300 g, 健康3周龄SD♀小鼠(用于BMSCs的培养), 均来自哈尔滨医科大学动物实验中心. Pkh26购自Santa公司; 干细胞抗体购自Abcom公司; 血清、胰酶、DMEM/F12购自哈尔滨赛拓生物科技有限公司; 血清淀粉酶(amylase, AMY)和脂肪酶(lipase, LPS)试剂购自上海科华生物股份有限公司; 青霉素购自哈药集团制造六厂; 水合氯醛购自青岛宇龙海藻有限公司; 胎牛血清购自美国Hyclone公司. 主要仪器: 切片机、烤箱、显微镜、离心机、37 ℃孵育箱、-80o超低温冰箱、50-1000 μL加样器、雅培ABBOTT型全自动生化分析仪.
1.2.1 胰腺炎大鼠模型的建立: 胰腺炎模型组大鼠160只, 大鼠禁食不禁水12 h, 予以15% L-精氨酸150 mg/100 g腹腔注射, 第1天注射2次, 2次注射时间隔1 h, 以后每天注射1次, 共4-5 d. 1 wk后随机选取10只大鼠, 取胰腺组织做病理学检查, 检验大鼠胰腺炎模型情况.
1.2.2 BMSCs的获取及培养: BMSCs的全骨髓贴壁培养法, 取3周龄SD小鼠, 处死, 750 mL/L乙醇浸润15 min, 在无菌条件下, 取SD小鼠两侧股骨及胫骨, 去除骨面上的肌肉及筋膜等软组织, 然后暴露骨髓腔, 用5 mL注射器吸取PBS液反复冲洗骨髓腔, 将收集的骨髓细胞反复吹打成细胞悬液, 计数后接种到直径为100 mm的一次性塑料培养皿中, 放置到含37 ℃、50 mL/L CO2饱和湿度的培养箱中, 48 h后换液, 然后每隔2 d换液, 8-10 d后当细胞汇合度达到80%左右时, 加入0.25%胰蛋白酶常温下消化2 min, 然后用含10%胎牛血清的DMEM/F12培养基终止消化, 按1∶3传代到新的一次性培养皿中, 以后每3-4 d按上述方法传代1次.
1.2.3 Pkh26标记BMSCs: 取第三代约90%融合的BMSCs, 倒掉培养液, PBS漂洗2次, 加入1 mL胰酶消化, 细胞呈圆形, 加培养液(2 mL双抗、血清40 mL、DMEM/F12 60 mL), 吹打制成单细胞悬液, 离心(1500 r/min、15 min), 去除上清, 按1×109浓度培养液重悬细胞, 加入16 u释液的染料, PBS洗2遍, 放置在37 ℃孵育箱培养5 min, 加入8 mL血清和4 mL培养液, 离心10 min, 1500 r/min, 去掉上清, 加培养液(2 mL双抗、血清40 mL、DMEM/F12 60 mL), PBS洗2遍, 0.9%氯化钠吹打重悬备用.
1.2.4 不同途径移植BMSCs: 将Pkh26标记好的BMSCs分别按3种途径移植到尾静脉组、肠系膜上静脉组和胰腺局部注射组中, 每只大鼠注入BMSCS 0.3 mL数量为1×106个细胞, 胰腺炎模型组不予处理. 肠系膜上静脉组移植途径, 常规10%水合氯醛麻醉, 备皮, 消毒, 铺巾, 打开腹腔, 暴露肠系膜上静脉, 用一次性胰岛素注射器从肠系膜上静脉中下段进针, 注入BMSCs悬液, 迅速退针, 棉签压迫止血5 min, 无出血点, 逐层关闭腹腔, 术后青霉素40×104 U/kg, 肌肉注射3 d, 预防感染. 胰腺局部注射组途径, 常规10%水合氯醛麻醉, 备皮, 消毒, 铺巾, 打开腹腔, 暴露胰腺, 在手术显微镜下, 避开胰腺血管, 用一次性胰岛素注射器在胰腺不同位点注射BMSCs悬液0.3 mL, 棉签压迫止血5 min, 无出血点, 恢复胰腺解剖位置, 关闭腹腔, 术后青霉素40×104 U/kg, 肌肉注射3 d, 预防感染. 尾静脉组移植途径, 常规10%水合氯醛麻醉, 暴露尾静脉, 消毒, 从尾静脉注入BMSCs悬液0.3 mL, 压迫片刻.
1.2.5 血清淀粉酶、血脂肪酶的检测: 将模型大鼠随机分为2组, 模型组和治疗组, 模型组不给予任何处理, 治疗组分为尾静脉组、肠系膜上静脉组、胰腺局部注射组, 治疗组以每只大鼠0.3 mL的剂量经尾静脉、肠系膜上静脉、胰腺局部注射输注BMSCs, 另设正常大鼠对照组, 逐日观察, 并分别于输入BMSCs 12、24、48、72 h, 1 wk, 每组取5只大鼠, 以10%水合氯醛腹腔麻醉, 眼球取血, 离心收集血清, 用全自动生化分析仪检测血清中血淀粉酶与脂肪酶的含量.
1.2.6 荧光显微镜观察BMSCs在胰腺的分布情况: BMSCs回输后3 wk, 处死大鼠, 采集胰腺组织立即进行冰冻切片, 进行HE染色, 荧光显微镜下直接观察, 在20倍镜下每张切片随机观察10个视野, 计算阳性细胞总数, 对照试验, 模型组大鼠未进行任何处理, 取模型组大鼠的胰腺组织, 进行冰冻切片, 荧光显微镜下观察.
1.2.7 石蜡切片及HE染色: 石蜡切片脱蜡, 置于70 ℃ 烤箱中烤片20 min, 二甲苯(5 min), 二甲苯Ⅱ(5 min), 1000 mL/L乙醇(5 min), 950 mL/L乙醇(5 min), 900 mL/L乙醇(5 min), 850 mL/L乙醇(5 min)、800 mL/L乙醇(5 min), 蒸馏水洗2次(每次1 min). 置于苏木紫中8 min后, 自来水冲洗2 min, 浸入1%氨水乙醇5 s, 用自来水冲洗5 min, 而后置于伊红中8 min, 蒸馏水浸洗几下, 再行脱水, 自然晾干封片.
统计学处理 采用析因设计方差分析法用SPSS17.0软件对所有数据进行统计学分析, 所得数据以mean±SD表示, 对数据进行t检验, P<0.05为差异有统计学意义.
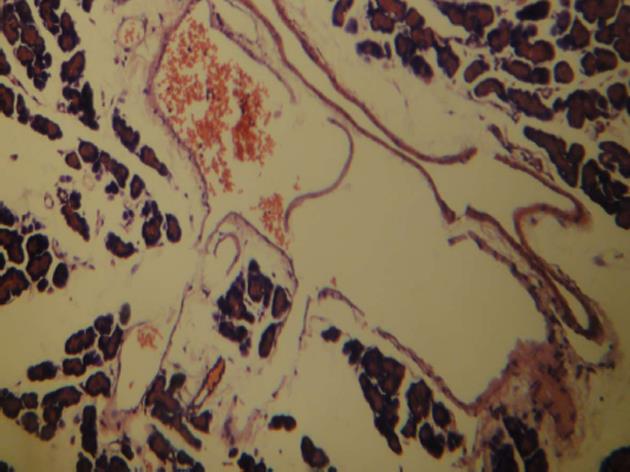
将160只胰腺炎模型组大鼠予以15% L-精氨酸150 mg/100 g腹腔注射4-5 d, 存活大鼠110只, 存活率为68.8%, 体质量下降至200-250 g, 大鼠毛发微黄、凌乱、无光泽, 精神萎靡, 活动少. 取6只正常大鼠和6只胰腺炎模型大鼠进行胰腺大体形态观察和病理学检查, 其余104只胰腺炎模型大鼠随机分为模型组和治疗组, 治疗组随机分为尾静脉组、肠系膜上静脉组、胰腺局部注射组, 每组26只. 正常大鼠胰腺色泽亮白, 表面光滑无结节, 质地柔软. 模型大鼠胰腺组织肿大、充血水肿, 分叶模糊, 质脆, 并有新鲜出血区, 胰腺坏死可表现为红褐色或灰褐色, 有较大范围的脂肪坏死灶. 正常大鼠胰腺切片HE染色, 胰腺结构清晰, 胰腺形态正常. 模型大鼠胰腺切片HE染色见胰腺间质水肿、充血、炎症细胞浸润, 胰腺组织的坏死, 细胞结构消失, 模型组大鼠胰腺呈典型的胰腺炎病理改变, 证明造模成功(图1).
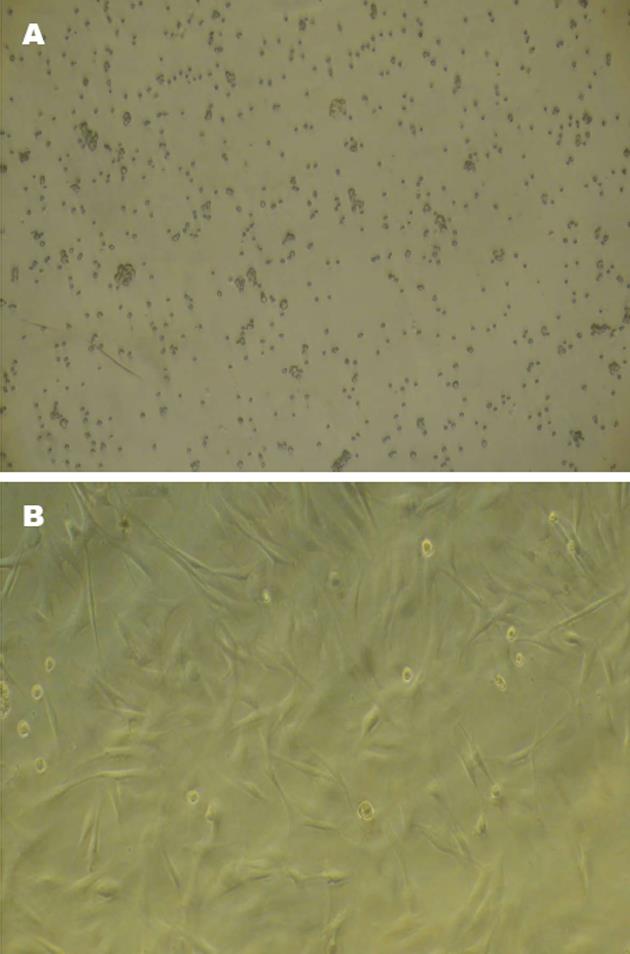
倒置显微镜下观察发现BMSCs呈小圆形, 形态规整, 培养2 d后, BMSCs传代培养的细胞大小均匀, 形态较一致, 多为梭形, 随着培养液的更换, 悬浮细胞、圆形血细胞被逐渐清除, 细胞贴壁后开始分裂增殖, 体积增大, 梭形或纺锤形成纤维样细胞开始出现, 2-3代后, 细胞形态变得较为均匀, 绝大部分为细长梭形细胞, 呈旋涡状排列(图2).
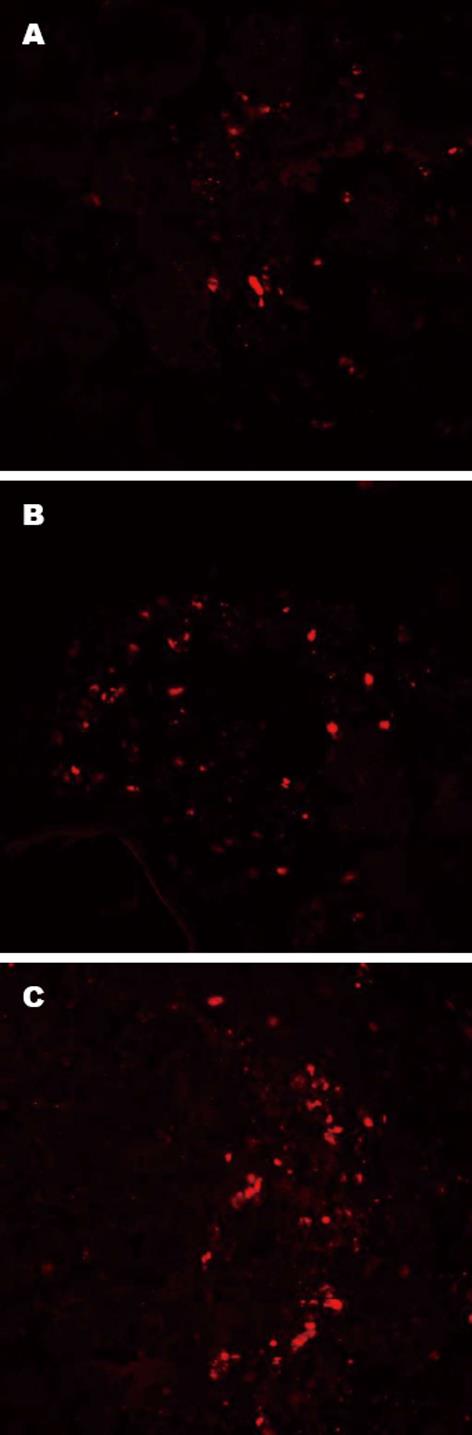
2.3.1 输注BMSCs后显微镜下观察胰腺组织及BMSCs在胰腺组织的分布: 光镜下可见, 模型组大鼠胰腺组织损伤区炎性细胞浸润明显, 胰腺细胞结构模糊, 胰岛结构崩解, 经BMSCs治疗后, 损伤的胰腺组织结构开始恢复, 胰岛再建, 胰腺局部注射组坏死的胰腺组织基本恢复正常. 尾静脉组各时间点胰腺内可见极少量Pkh26标记的BMSCs(图3A), 肠系膜上静脉组2 wk时胰腺内可见散在亮红色荧光的细胞, 数量少, 3 wk时数量稍多(图3B), 胰腺局部注射组2及3 wk胰腺内均可见较多红色荧光的细胞(图3C), 对照组及模型组各时间点均未见Pkh26标记细胞, 尾静脉输注组、肠系膜上静脉输注组、胰腺局部注射组Pkh26染色阳性细胞数分别为80.5个±6.59个、102.0个±9.75个、175.1个±12.57个, 3组间的差异有统计学意义(P<0.05).
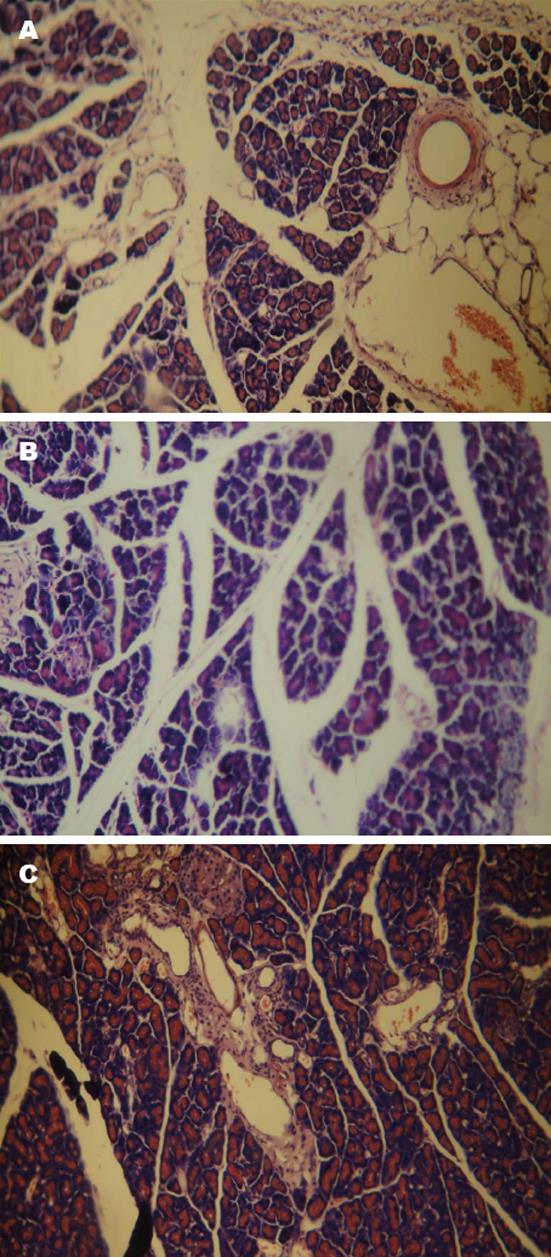
2.3.2 胰腺组织病理学观察: 胰腺组织石蜡切片HE染色显示: 正常大鼠胰腺切片HE染色, 胰腺结构清晰, 胰腺形态正常. 模型大鼠胰腺切片HE染色见胰腺间质水肿、充血、炎症细胞浸润, 胰腺组织的坏死, 细胞结构消失, 模型组大鼠胰腺呈典型的胰腺炎病理改变(图1). 尾静脉注射组各时间点与对照组比较形态学改变有所改善(图4A), 肠系膜上静脉组2 wk时较相应对照组有所改善, 肠系膜上静脉组3 wk时胰腺细胞坏死, 充血, 炎性细胞浸润继续好转(图4B), 胰腺局部注射病理组织学改善情况较肠系膜上静脉组更明显(图4C).
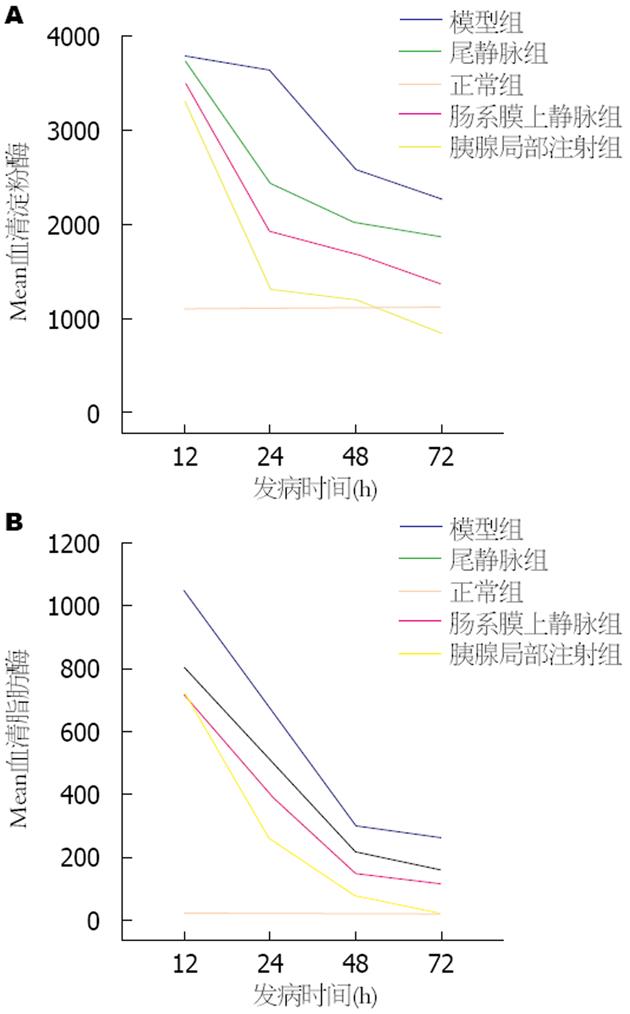
2.3.3 各组大鼠血清中血清淀粉酶及脂肪酶的含量: 治疗组(尾静脉组、肠系膜上静脉组、胰腺局部注射组)在12、24、48、72 h时, 治疗组血清淀粉酶含量均低于模型组(P<0.05)(图5A). 在24、48、72 h和1 wk时, 治疗组(尾静脉组、肠系膜上静脉组、胰腺局部注射组)血清中脂肪酶含量均低于模型组(P<0.0)(图5B). 12、24、48、72 h和1 wk, 尾静脉组、肠系膜上静脉组、胰腺局部注射组血清淀粉酶和脂肪酶含量仍高于正常对照组, 且差异均有统计学意义.
本研究的目的揭示了BMSCs在治疗胰腺炎疾病提供了一种创新、基础实践的干预方法, 急性胰腺炎的特点是发病比较急, 而且病程发展较快, 有较高的死亡率, SAP在治疗上极具有挑战性, 死亡率约20%-40%, SAP常继发感染性腹膜炎、休克、全身炎症反应综合征(systemic inflammatory response syndrome, SIRS)和多器官功能障碍综合征(multiple organ dysfunction syndrome, MODS)等严重并发症[6-8]. 目前几项研究表明胰腺炎的发病机制与复杂的级联反应有关, 一开始是激活胰腺腺泡细胞的胰液素, 胰液素引起胰腺细胞的损伤, 导致局部和全身的炎症反应, 炎症因子[9]如C-反应蛋白、TNF、IL-1、IL-6、IL-8、一氧化氮(nitric oxide, NO)和内皮素被认为与胰腺炎的发病和发展有关, 而且从轻症胰腺炎到重症胰腺炎的这个过程起重要作用. 目前临床上SAP的治疗, 内科[10]、外科[11]都没有更多关注胰腺本身功能的恢复. 随着干细胞的研究进展, 利用BMSCs治疗SAP有着广泛的研究前景和重大的临床意义[12-14].
BMSCs具有多分化潜能和增殖能力的干细胞, 目前研究表明骨髓间充干细胞有强大的免疫调节和多向分化潜能, 另有研究表明BMSCs抑制炎症反应和改善组织修复起到重要作用[15,16]. 胰腺干细胞能分化形成胰腺导管、胰岛及胰腺外分泌腺泡等特定的胰腺组织细胞, 并具有无限分裂和自我更新能力, 胰腺干细胞[17]属未分化细胞, 可表达干细胞的一些分子标志, 但尚未发现其特异性分子标志, 胰腺干细胞参与胰腺的病理生理过程, 为SAP的治疗开辟了新的领域. Seaberg等[18]通过研究小鼠的胰腺干细胞、认为胰腺干细胞为成体干细胞具有高度增殖的多向分化能力, 具备分化为胰腺内分泌细胞、腺泡细胞和导管细胞的潜能, 胰腺干细胞不是起源于中胚层. 近年来有关胰腺干细胞标志的研究取得了较大进展, 其中胰腺十二指肠同源异型盒-1(pancreatic duodenal homeobox 1, PDX-1)、Nestin及神经元素3(neurogenin3, Ngn3)是研究较多的胰腺干细胞标志[19]. PDX-1为胰腺干细胞发育过程中表达最早的分子标记, 有研究[20]表达PDX-1阳性的分化细胞在SAP的细胞增殖与分化过程中的作用, 结果证实PDX-1表达阳性的导管上皮细胞在总导管的分化中所起的作用至关重要. 巢蛋白最初被认定为一个标记的神经干细胞或祖细胞[21], 巢蛋白也被认为是在胰腺的胰岛中细胞表达, 体外研究证明巢蛋白细胞是从胰腺胰岛中分离获得的, 可分化成胰腺内分泌细胞和外分泌细胞. Ishiwata等[22]通过腹腔内注射L-精氨酸诱导大鼠胰腺炎, 使用免疫印迹法发现巢蛋白在上皮细胞及星状细胞周围管状结构中的表达增加, 结果表明巢蛋白可表达于使L-精氨酸诱导的胰腺炎胰腺组织再生的干细胞或祖细胞. Ngn3是胰腺内分泌细胞分化过程中起关键性作用的转录因子[23,24], 其功能的缺失可导致内分泌细胞的缺失. 目前国内、国外有文献报道用 BMSCs治疗AP的移植途径主要是尾静脉. 没有文献报道不同途径移植BMSCs治疗胰腺炎.
到目前为止, 大多数轻型胰腺炎治疗效果较好, 但SAP治愈还很难, 本实验中我们通过不同途径移植BMSCs来改善胰腺炎作为一项治疗策略, 用15%L-精氨酸建立胰腺炎模型, 通过显微镜下观察胰腺组织病理可以发现, 胰腺出现腺叶间隙增宽, 胰腺水肿、出血、炎症细胞浸润, 胰腺细胞坏死, 腺体结构消失, 血栓形成, 脂肪细胞坏死, 空泡化. 实验在无菌条件下通过直接培养法(即全骨髓细胞接种)获取间充质干细胞, 该方法操作简单, 通过换液, 控制胰酶消化时间和传代的方法, 去除杂合细胞, 且细胞活性好, 增殖力强, 通过培养法传代后可逐步纯化. 把培养好的BMSCs用红色染料Pkh26标记, 把标记好的BMSCs通过尾静脉移植途径、肠系膜上静脉移植途径, 胰腺局部注射移植途径输注于大鼠胰腺炎模型体内, 2 wk或3 wk分批处死大鼠, 立即采取大鼠胰腺组织进行冰冻切片, 制作石蜡切片并行HE染色, 在荧光显微镜下观察胰腺组织, 并在不同时间点检测血清淀粉酶及血脂肪酶, 实验结果显示细胞移植术后12、24、48、72 h, 1 wk, 尾静脉注射组血清淀粉酶和血脂肪酶水平与模型组比较差异有统计学意义, 肠系膜上静脉组、胰腺局部注射组与相应的模型组比较显著下降(P<0.05), 胰腺局部注射组与肠系膜上静脉组比较显著下降(P<0.05). 尾静脉组各时间点胰腺内可见极少量Pkh26标记的BMSCs, 肠系膜上静脉组2 wk时胰腺内可见散在亮红色荧光的细胞, 数量少, 3 wk时数量稍多, 胰腺局部注射组2 wk及3 wk胰腺内均可见较多红色荧光的细胞, 对照组各时间点均未见Pkh26标记细胞. 大鼠L-精氨酸诱导急性胰腺炎1 wk后胰腺组织肿大, 质软呈无光泽暗红色, 胰腺有的分叶结构模糊消失, 间质充血水肿并有中性粒细胞及单核细胞浸润, 局限性脂肪坏死. 尾静脉注射组各时间点与对照组比较无明显形态学改变, 肠系膜上静脉组2 wk时较相应对照组有所改善, 肠系膜上静脉组3 wk时胰腺细胞坏死, 充血, 炎性细胞浸润继续好转, 胰腺局部注射病理组织学改善情况较肠系膜上静脉组更明显. 以上结果均说明胰腺局部注射途径优于其他移植途径. 进一步说明为临床上SAP的治疗提供了新的方法.
国外有研究[25-27]表明将表达绿色荧光蛋白的BMSCs移植到大鼠体内, 在大鼠胰岛中可检测到绿色荧光蛋白阳性的细胞, 并且从胰岛中纯化出来的这些表达绿色荧光蛋白的细胞还表达胰腺干细胞特有的转录因子胰腺十二指肠同源异形盒基因-1, 证明骨髓中存在有能够分化为胰腺干细胞. 近年来有关胰腺干细胞标志的研究取得了较大进展. 其中PDX-1、Nestin及神经元素3(neurogenin3, Ngn3)是研究较多的胰腺干细胞标志[28]. 其中有人在体外研究证明[29]巢蛋白细胞是从胰腺胰岛中分离获得, 可分化成胰腺内分泌细胞和外分泌细胞. 近年来, 有研究[30-32]表明, 胰腺损伤部位可能产生迁移因子, 引导干细胞到达该部位参与组织修复. 本实验经胰腺局部注射移植后, 在胰腺迁移因子的作用下BMSCs可能很快进入胰岛, 随血液循环进入身体其他部位的细胞数量很少, 因而在胰腺定植率高.
总之, BMSCs具有较强的增殖能力和多向分化潜能, 免疫原性弱, 易于从骨髓中分离、纯化及体外扩增, 且不存在伦理学问题[33], 因此越来越受到人们的重视.
临床上重症急性胰腺炎(severe acute pancreatitis, SAP)的内科治疗主要是禁食水、营养支持、抑制胰酶分泌等, 外科治疗主要是手术治疗, 最常用的是坏死组织清除加引流术, 无论是内科保守治疗还是外科手术治疗都没有太多关注胰腺本身功能的恢复, 而细胞移植在SAP治疗方面取得重大突破.
孙昀, 副主任医师, 安徽医科大学第二附属医院重症医学科
有研究报道, 骨髓间充质干细胞(bone mesenchymal stem cell, BMSCs)具有治疗急性胰腺炎的潜能, 主要通过向损伤部位迁移并增殖, 转化为胰腺干细胞, 参与组织再生, 修复血管内皮, 改善血流, 调控炎症相关的细胞因子, 减轻炎症反应以及免疫调节功能来发挥其治疗作用, 为临床上SAP的治疗提供了新的思路.
胰腺干细胞能分化形成胰腺导管、胰岛及胰腺外分泌腺泡等特定的胰腺组织细胞, 并具有无限分裂和自我更新能力, 胰腺干细胞属未分化细胞, 可表达干细胞的一些分子标志, 但尚未发现其特异性分子标志, 胰腺干细胞参与胰腺的病理生理过程, 为SAP的治疗开辟了新的领域.
通过本文研究说明胰腺局部注射途径优于其他移植途径, 可为临床上SAP的治疗提供新的方法.
本文为动物实验研究, 较新颖, 实验设计完整, 结果可为临床提供治疗思路.
编辑: 郭鹏 电编:闫晋利
| 1. | Bradley EL, Dexter ND. Management of severe acute pancreatitis: a surgical odyssey. Ann Surg. 2010;251:6-17. [PubMed] [DOI] |
| 2. | Talukdar R, Vege SS. Recent developments in acute pancreatitis. Clin Gastroenterol Hepatol. 2009;7:S3-S9. [PubMed] [DOI] |
| 3. | Bai Y, Liu Y, Jia L, Jiang H, Ji M, Lv N, Huang K, Zou X, Li Y, Tang C. Severe acute pancreatitis in China: etiology and mortality in 1976 patients. Pancreas. 2007;35:232-237. [PubMed] |
| 4. | Granger J, Remick D. Acute pancreatitis: models, markers, and mediators. Shock. 2005;24 Suppl 1:45-51. [PubMed] |
| 6. | Jung KH, Yi T, Son MK, Song SU, Hong SS. Therapeutic effect of human clonal bone marrow-derived mesenchymal stem cells in severe acute pancreatitis. Arch Pharm Res. 2015;38:742-751. [PubMed] [DOI] |
| 7. | Yin G, Hu G, Wan R, Yu G, Cang X, Ni J, Xiong J, Hu Y, Xing M, Fan Y. Role of bone marrow mesenchymal stem cells in L-arg-induced acute pancreatitis: effects and possible mechanisms. Int J Clin Exp Pathol. 2015;8:4457-4468. [PubMed] |
| 8. | Schneider G, Saur D. Mesenchymal stem cells: therapeutic potential for acute pancreatitis. Gastroenterology. 2011;140:779-782. [PubMed] [DOI] |
| 9. | Schneider L, Jabrailova B, Strobel O, Hackert T, Werner J. Inflammatory profiling of early experimental necrotizing pancreatitis. Life Sci. 2015;126:76-80. [PubMed] [DOI] |
| 10. | Kambhampati S, Park W, Habtezion A. Pharmacologic therapy for acute pancreatitis. World J Gastroenterol. 2014;20:16868-16880. [PubMed] [DOI] |
| 11. | Zerem E. Treatment of severe acute pancreatitis and its complications. World J Gastroenterol. 2014;20:13879-13892. [PubMed] [DOI] |
| 12. | Prockop DJ. Further proof of the plasticity of adult stem cells and their role in tissue repair. J Cell Biol. 2003;160:807-809. [PubMed] |
| 13. | Jensen GS, Drapeau C. The use of in situ bone marrow stem cells for the treatment of various degenerative diseases. Med Hypotheses. 2002;59:422-428. [PubMed] |
| 14. | Krause DS, Theise ND, Collector MI, Henegariu O, Hwang S, Gardner R, Neutzel S, Sharkis SJ. Multi-organ, multi-lineage engraftment by a single bone marrow-derived stem cell. Cell. 2001;105:369-377. [PubMed] |
| 15. | Hanson SE, Gutowski KA, Hematti P. Clinical applications of mesenchymal stem cells in soft tissue augmentation. Aesthet Surg J. 2010;30:838-842. [PubMed] [DOI] |
| 16. | Chen K, Zhou Z, Zhou B, Li Y. [Potential therapeutic effect of paracrine factors from bone marrow-derived mesenchyme stem cells in the treatment of severe acute pancreatitis]. Shengwu Yixue Gongchengxue Zazhi. 2015;32:245-248. [PubMed] |
| 17. | Rovira M, Delaspre F, Massumi M, Serra SA, Valverde MA, Lloreta J, Dufresne M, Payré B, Konieczny SF, Savatier P. Murine embryonic stem cell-derived pancreatic acinar cells recapitulate features of early pancreatic differentiation. Gastroenterology. 2008;135:1301-1310, 1310. e1-e5. [PubMed] [DOI] |
| 18. | Seaberg RM, Smukler SR, Kieffer TJ, Enikolopov G, Asghar Z, Wheeler MB, Korbutt G, van der Kooy D. Clonal identification of multipotent precursors from adult mouse pancreas that generate neural and pancreatic lineages. Nat Biotechnol. 2004;22:1115-1124. [PubMed] |
| 19. | Lin HT, Otsu M, Nakauchi H. Stem cell therapy: an exercise in patience and prudence. Philos Trans R Soc Lond B Biol Sci. 2013;368:20110334. [PubMed] [DOI] |
| 20. | Mitnala S, Pondugala PK, Guduru VR, Rabella P, Thiyyari J, Chivukula S, Boddupalli S, Hardikar AA, Reddy DN. Reduced expression of PDX-1 is associated with decreased beta cell function in chronic pancreatitis. Pancreas. 2010;39:856-862. [PubMed] [DOI] |
| 21. | Zulewski H, Abraham EJ, Gerlach MJ, Daniel PB, Moritz W, Müller B, Vallejo M, Thomas MK, Habener JF. Multipotential nestin-positive stem cells isolated from adult pancreatic islets differentiate ex vivo into pancreatic endocrine, exocrine, and hepatic phenotypes. Diabetes. 2001;50:521-533. [PubMed] |
| 22. | Ishiwata T, Kudo M, Onda M, Fujii T, Teduka K, Suzuki T, Korc M, Naito Z. Defined localization of nestin-expressing cells in L-arginine-induced acute pancreatitis. Pancreas. 2006;32:360-368. [PubMed] |
| 23. | Swales N, Martens GA, Bonné S, Heremans Y, Borup R, Van de Casteele M, Ling Z, Pipeleers D, Ravassard P, Nielsen F. Plasticity of adult human pancreatic duct cells by neurogenin3-mediated reprogramming. PLoS One. 2012;7:e37055. [PubMed] [DOI] |
| 24. | Yoshida T, Shiraki N, Baba H, Goto M, Fujiwara S, Kume K, Kume S. Expression patterns of epiplakin1 in pancreas, pancreatic cancer and regenerating pancreas. Genes Cells. 2008;13:667-678. [PubMed] [DOI] |
| 26. | Taguchi M, Yamaguchi T, Otsuki M. Induction of PDX-1-positive cells in the main duct during regeneration after acute necrotizing pancreatitis in rats. J Pathol. 2002;197:638-646. [PubMed] |
| 27. | Gong J, Tian F, Ren J, Luo G. Experimental evidence supporting the lack of primary stem cells in adult pancreatic tissue. Pancreatology. 2010;10:620-630. [PubMed] [DOI] |
| 28. | Li J, Zhu L, Qu X, Li J, Lin R, Liao L, Wang J, Wang S, Xu Q, Zhao RC. Stepwise differentiation of human adipose-derived mesenchymal stem cells toward definitive endoderm and pancreatic progenitor cells by mimicking pancreatic development in vivo. Stem Cells Dev. 2013;22:1576-1587. [PubMed] |
| 29. | Wei P, Li L, Qi H, Zhou HX, Deng CY, Li FR. Reversible immortalization of Nestin-positive precursor cells from pancreas and differentiation into insulin-secreting cells. Biochem Biophys Res Commun. 2012;418:330-335. [PubMed] [DOI] |
| 30. | Tu XH, Song JX, Xue XJ, Guo XW, Ma YX, Chen ZY, Zou ZD, Wang L. Role of bone marrow-derived mesenchymal stem cells in a rat model of severe acute pancreatitis. World J Gastroenterol. 2012;18:2270-2279. [PubMed] [DOI] |
| 31. | Gong J, Meng HB, Hua J, Song ZS, He ZG, Zhou B, Qian MP. The SDF-1/CXCR4 axis regulates migration of transplanted bone marrow mesenchymal stem cells towards the pancreas in rats with acute pancreatitis. Mol Med Rep. 2014;9:1575-1582. [PubMed] [DOI] |
| 32. | Karp JM, Leng Teo GS. Mesenchymal stem cell homing: the devil is in the details. Cell Stem Cell. 2009;4:206-216. [PubMed] |
| 33. | 胡 菱, 韩 明子, 薛 洪璐, 景 德怀. 干细胞移植的安全性分析. 胃肠病学和肝病学杂志. 2011;20:18-20. |