修回日期: 2016-03-31
接受日期: 2016-04-06
在线出版日期: 2016-05-08
早期胃癌的预后显著优于进展期胃癌, 积极开展早期胃癌的筛查可以大大降低胃癌死亡率. 然而传统胃癌生物学标志物癌胚抗原、糖链抗原199等灵敏度和特异性较差, 准确性较高的胃镜或影像学检查不适合大规模的筛查. 正常生理条件下胃液氨基酸含量极少, 需要使用高效液相色谱分析才能分离和检测, 而胃癌早期甚至癌前病变期的胃液多种氨基酸浓度异常升高, 以丙氨酸升高最为显著. 胃液色氨酸荧光检测已经被证实为可靠的早期胃癌诊断方法. 随着色谱和质谱等氨基酸检测技术的进步, 胃液氨基酸谱有可能成为诊断监测胃癌发生发展的新型标志物. 本文就胃癌组织及体液氨基酸变化特点及其可能机制作一综述.
核心提示: 胃癌目前缺乏经济实用的早期筛查指标, 随着代谢组学的兴起, 肿瘤潜在的标志物报道逐渐增多, 血液中氨基酸如芳香族氨基酸已引起临床工作者的重视. 胃液氨基酸谱在胃癌的早期筛查和术后检测具有较高的应用价值.
引文著录: 刘金哲, 周丽雅. 胃液氨基酸谱作为胃癌标志物的潜在价值. 世界华人消化杂志 2016; 24(13): 1984-1992
Revised: March 31, 2016
Accepted: April 6, 2016
Published online: May 8, 2016
Early diagnosis plays a vital role in the improvement of the curative rate of gastric cancer. However, the poor specificity and sensitivity of traditional gastric cancer biomarkers, such as carcino-embryonic antigen and carbohydrate antigen 199, make it difficult to screen early gastric cancer. Gastric juice amino acid profile may be an alternative tumor marker, since abnormal elevation of amino acids in gastric juice has been reported in precancerous patients. Normal concentration of amino acids is extremely low in gastric juice, and special techniques are required to detect amino acids in gastric juice. The change of amino acids in gastric juice is more significant than in blood and tumor tissue. The amino acid profile in gastric juice may work as efficient biomarkers for gastric cancer with the development of amino acid detection technique.
- Citation: Liu JZ, Zhou LY. Elevated amino acids in gastric juice as potential biomarkers for gastric cancer. Shijie Huaren Xiaohua Zazhi 2016; 24(13): 1984-1992
- URL: https://www.wjgnet.com/1009-3079/full/v24/i13/1984.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i13.1984
全球癌症最新统计[1]显示2012年共新发癌症14100000例, 胃癌占951600例, 全球死亡癌症患者8200000例, 胃癌占723100例. 东亚国家(特别是中日韩和蒙古)是胃癌的高发地区, 其中男性发生率35.4/100000, 女性发生率13.8/100000. 国家癌症中心估计2015年中国癌症新发4292000例, 癌症死亡2814000例, 其中胃癌发生和死亡分别是679100例和498000例, 居于全部肿瘤的第2位, 恶性程度仅次于肺癌[2]. 早期胃癌的预后显著优于进展期胃癌, 胃癌的早诊早治将5年生存率由30%提高至95%[3,4]. 然而中国早期胃癌发现率仅为10%-20%, 多数患者就诊时已处于胃癌晚期[5]. 日本很早就积极开展胃癌筛查, 应用PG结合胃镜每年普查发现胃癌3000-6000例, 早期胃癌检出率达50-70%. 目前临床常用的胃癌标志物诊断性能较差, 探究经济简便的早癌胃癌筛查手段是符合我国国情的重要研究课题.
胃癌患者发生全身代谢改变, 癌细胞高表达氨基酸转运蛋白[6](L-type amino acid transporter, lat1)摄取大量的氨基酸, 导致机体氨基酸重新分布: 骨骼肌、肝肾组织释放氨基酸入血, 血浆氨基酸水平下降, 癌组织富集氨基酸, 胃壁丢失蛋白质和氨基酸. 根据已有的研究数据分析, 除谷氨酰胺外肿瘤组织氨基酸含量较正常胃黏膜组织提高43%以上, 血清氨基酸水平略有下降, 除了色氨酸下降超过21%, 其余种类氨基酸下降幅度不超过13%. 因为人体血清氨基酸更新较快, T1/2约15 min, 维持血液氨基酸浓度的因素较多, 所以血清氨基酸谱作为胃癌筛查的特异性较弱. 正常生理条件下胃液氨基酸含量极少, 而发生胃癌后胃液中氨基酸水平显著增高, 多数氨基酸浓度能升高2-4倍. 监测胃液氨基酸可能是胃癌筛查中极有潜力的方法, 也可作为评估术后疗效以及判断复发的指标. 胃液芳香族氨基酸浓度或荧光强度已经被证实为早期胃癌筛查的有效手段, 灵敏度和特异性都在80%以上[7-10].
胃癌起源于胃底腺颈部和胃小凹底部的干细胞, 是在遗传易感性的基础上和环境致癌因素诱导下出现的多基因微效应逐渐累加的结果. 90%的非贲门癌与幽门螺杆菌感染有关[11,12]. 胃癌发病率随年龄递增, 60岁以后发生率最高[2]. 胃癌是一种慢性病和代谢病的观点已经得到普遍的认可. Pinheiro Ddo等[13]综述肿瘤早期就已经在基因组、转录组、蛋白质组和代谢组等各个层面上发生改变, 尤其是在代谢组学的改变最为显著. 遗传改变发生的一系列分子生物学事件导致肿瘤代谢重编程, 进而促进肿瘤进展. 有氧酵解、乳酸堆积、氨基酸富集、谷氨酰胺补充及脂肪酸合成增多等是肿瘤的代谢的一般共同特征[14]. 胃癌发生发展过程中也伴随代谢改变, 根据胃癌细胞代谢特点在遗传改变与代谢效应之间建立联系, 可以理解肿瘤发生发展的过程, 也能发现潜在的早期生物学标志物. 90年前Warburg观察到肿瘤即使在氧充足的条件下糖代谢仍然以糖酵解为主导致大量乳酸产生, 这个现象称为Warburg效应[15]. 基于高效液相色谱分析技术, 这个现象已经在多种肿瘤组织内得到验证[16-19]. 乳酸堆积抑制免疫细胞功能[16], 还能够促进肿瘤发生侵袭转移[20,21]. 癌细胞高表达lat1富集氨基酸酸, 氨基酸补充有氧糖代谢的中间物质. 氨基酸转运蛋白2(cationic amino acid transporter 2, cat2)高表达上调髓系抑制细胞(myeloid-deprived suppressor cell, MDSC)从而抑制T细胞功能[22].
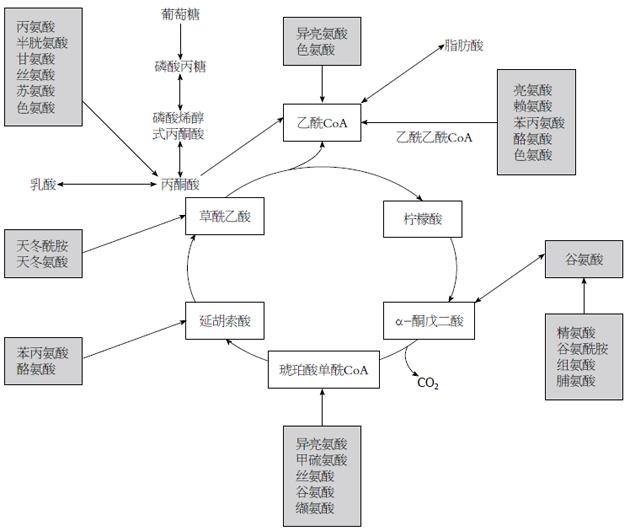
正常细胞三羧酸循环提供90%的能量, 而癌细胞糖代谢以有氧酵解为主, 三羧酸循环受到抑制, 仅能产生所需要ATP的50%[21]. 肿瘤细胞需要三羧酸循环中间产物合成脂肪酸, 肿瘤通过富集氨基酸以适应此需求. 肿瘤代谢以DNA、蛋白质和脂质合成为中心, 氨基酸代谢处于最重要的基础地位: (1)20种L-型氨基酸是蛋白质的基本单位, 是肿瘤发生发展异常基因翻译和表达表达所必需的; (2)核苷酸不是营养必须物质, 食物来源嘌呤和嘧啶不被机体利用, 机体主要利用氨基酸、一碳单位和二氧化碳从头合成核苷酸. 一碳单位主要来自丝氨酸, 甘氨酸、组氨酸和色氨酸代谢也可产生一碳单位. 天冬氨酸、甘氨酸构成碱基的基本骨架. 因此癌细胞DNA复制、基因转录最终都以氨基酸为基本物质; (3)三羧酸中间产物如图1所示循环除了柠檬酸以外都能够由氨基酸来补充. Hirayama等[17]报道胃癌和结肠癌三羧酸循环前期的中间产物柠檬酸、酮戊二酸和乌头酸降低, 而延胡索酸、苹果酸和琥珀酸等后期物质却增多. 谷氨酰胺通过脱氨基作用生成酮戊二酸, 以补充三羧酸循环的后期中间物质, 这个过程被称为谷氨酰胺补充是癌细胞代谢特征之一[5,21]. 补充合成的乙酰辅酶A进而合成脂肪酸.
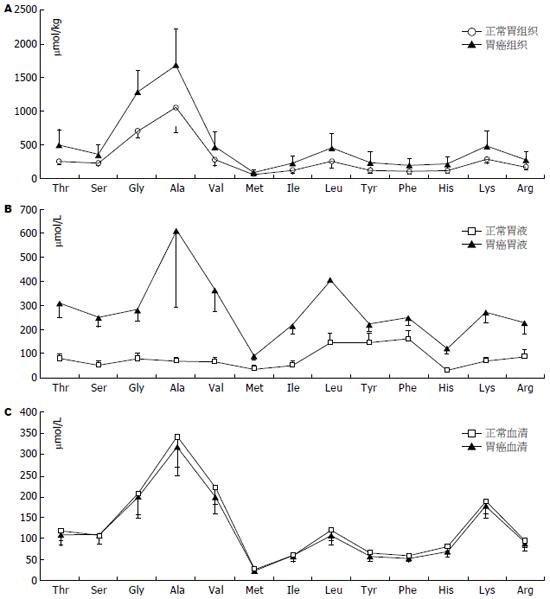
早期肿瘤通过自噬细胞内部蛋白或分解周围组织富集氨基酸, 后期通过血管生成从血液中摄取氨基酸. 人体组织和体液中氨基酸浓度反映机体营养和代谢的状态, 正常生理条件下人体游离氨基酸50%分布于肌肉, 10%分布于肝脏, 4%在肾脏, 1%-6%在血液中. 肌肉和肝脏是维持血液氨基酸稳定的主要器官. 大多数的氨基酸用于合成蛋白质, 多余的氨基酸在人体内不能贮存而用于分解代谢. 胃癌体液氨基酸伴随肿瘤的发生发展而重新分布, 肌肉分解增多, 血液氨基酸略有下降, 肿瘤富集氨基酸. 肿瘤发生发展过程中改变全身代谢的平衡, 通过三种方式富集氨基酸: 早期癌细胞通过泛素化降解癌细胞内部蛋白增加胞内氨基酸, 分泌蛋白酶降解癌旁组织增加组织液氨基酸, 诱导生成管壁缺陷的血管也会导致氨基酸渗出增多. Hirayama等[17]比较了12例胃癌组织和正常胃黏膜组织的22种氨基酸水平(图2): 癌组织半胱氨酸浓度比正常组织高出了4.8倍, 其次是瓜氨酸增多1.7倍, 其余增多0.4-1.2倍不等, 胃癌组织色氨酸富集相对最少, 提示色氨酸被癌细胞代谢消耗. 癌组织中谷氨酰胺比正常胃黏膜下降1.7%, 提示胃癌细胞大量消耗谷氨酰胺. 谷胺胺酰胺分解代谢对于癌细胞的重要性几乎和葡糖糖一样, 谷氨酰胺消耗是肿瘤代谢的重要特征, Medina等[23]和Liu等[24]的工作详细揭示这个过程主要在Myc基因诱导下逐步完成.
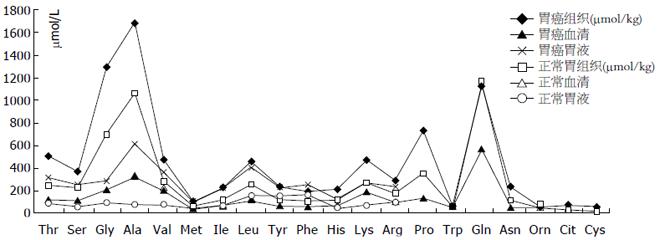
Lai等[25]发现血清氨基酸具有组织特异性和时间特异性. Wiggins等[26]认识到胃食管肿瘤患者血清芳香族氨基酸水平总体下降, 而胃液和尿液芳香族氨基酸含量呈现出上升的趋势. Miyagi等[27]应用液相色谱分析和质谱分析联合的检测血浆氨基酸, 得到肺癌、结直肠癌、前列腺癌、胃癌、乳腺癌五类肿瘤患者的血清氨基酸谱, 其中谷胺酰胺、色氨酸和组氨酸在除了前列腺癌以外的所有肿瘤患者血清中均有所下降, 但没有一种氨基酸是在所有肿瘤患者都表现为一致的变化趋势. 胃癌和结直肠癌患者的大多数种类血清氨基酸水平都是下降的而且越是处于肿瘤的早期血浆氨基酸下降越是显著, 特别是天冬酰胺、组氨酸和色氨酸下降程度最为显著. 血浆氨基酸的浓度反映肝脏、肌肉、及肿瘤等全身蛋白质综合代谢情况[25], 氨基酸在肌肉组织分布最多, 是补充血浆氨基酸的主要来源. Yamandaka等[28]发现胃癌血清氨基酸水平与肿瘤大小成反比, 早期胃癌患者骨骼肌尚能从血液摄取氨基酸, 动静脉血氨基酸浓度有显著的差异, 而晚期癌患者骨骼肌向血液释放氨基酸, 动静脉氨基酸浓度差异消失. 临床上常可见到晚期肿瘤患者肌肉萎缩, 皮下脂肪大量分解, 体内氨基酸重新分布. Miyagi等[27]检测的199例胃癌患血液浓度变化较大的五种氨基酸降低幅度从高到低依次为色氨酸(21.6%)、组氨酸(12.6%)、甲硫氨酸(11.1%)、酪氨酸(10.6%)、缬氨酸(10.5%); 谷氨酸、天冬氨酸和半胱氨酸在血液中的含量不稳定, 未予检测; 谷氨酰胺(2.6%)、甘氨酸(2.6%)和鸟氨酸(1.1%)血清浓度变化不大; 而丝氨酸浓度不降反升高1.5%(图2).
如前所述胃癌血色氨酸下降最多, 而在胃癌细胞富集最少, 提示癌细胞代谢色氨酸增多. Deng等[7,8,10]在探究胃液荧光物质的研究中发现胃液芳香族氨基酸水平异常升高, 胃癌胃液特异性最强的荧光物质是色氨酸[8], 这种荧光检测对诊断早期胃癌灵敏度和特异性能达69.7%和57.1%, 此方法经过北京大学第三医院进一步标准化后诊断胃癌灵敏度、特异性和准确度分别可达到83.2%、80.7%、82.0%[9], 是筛查早期胃食管癌的重要方法. 应用芳香族氨基酸诊断早期胃癌灵敏度和特异度能够达到85.6%和87.9%. 色氨酸可以提供一碳单位合成核苷酸, 也可以补充三羧酸中间物质乙酰CoA. 据报道色氨酸是多种肿瘤转移的标志物如甲状腺腺癌、卵巢癌、乳腺癌和黑色素瘤等[29-32]. 色氨酸是促进T细胞发育成熟的重要物质, 色氨酸经双加氧酶代谢生成的甲酰犬尿氨酸具有免疫抑制功能在肿瘤转移过冲中发挥重要的功能. 色氨酸紫外吸收光谱信号在天然氨基酸中是最强的, 常用于肿瘤的自发荧光检测或拉曼光谱检测[33,34].
很早就有学者意识到胃液氨基酸作为胃食管疾病的标志物的价值[18]. 早在20世纪50年代初就有学者开始研究胃液氨基酸与胃癌的关系, 1958年日本学者Oh-Uti等[35]应用纸上分层色谱法发现消化道溃疡以及胃癌患者胃液15种氨基酸呈强阳性反应, 胃癌术后某些胃液氨基酸则转为阴性, 提示监测胃液氨基酸可能有助于胃癌的诊断和疗效评估. 1965年Abasov等[36]使用纸上层析辐射法结合茚三酮反应半定量检测胃液氨基酸, 发现丙氨酸和亮氨酸在胃癌患者胃液中的浓度比胃炎胃溃疡患者都高出两倍以上. 1981年Komorowska等[37]首次报道使用氨基酸分析仪检测氨基酸浓度, 发现十二指肠溃疡胃液中苯丙氨酸、甘氨酸、亮氨酸、谷氨酸和组氨酸就占总氨基酸的一半, 且胃液氨基酸的浓度与胃酸分泌无关, 由此推断胃液氨基酸由为黏液上皮细胞分泌. 1985年Segawa等[38]通过高效液相色谱技术分析人胃液氨基酸含量, 结果提示胃癌患者胃液氨基酸水平较正常人增高显著, 10种氨基酸较正常水平增多2倍以上, 其中丙氨酸(增多7.6倍)、丝氨酸(增多4.0倍)、谷氨酸(增多3.4倍)和缬氨酸(增多4.5倍)增高最显著(图2). 而胃溃疡患者胃液氨基酸增多以苯丙氨酸、酪氨酸和亮氨酸为主, 十二指肠溃疡患者胃液氨基酸低于正常人和胃溃疡患者.
1984年巴里马歇尔和罗宾沃伦在柳叶刀报道了幽门螺杆菌[39], 从此全世界胃食管疾病研究的焦点转向幽门杆菌, 可能是就是这样的原因导致胃液氨基酸的研究结果没有受到重视. 幽门螺杆菌是胃癌是重要诱因, 有研究[40-42]显示幽门螺杆菌可以改变胃酸分泌. 但日本学者研究提示胃泌素刺激胃酸增多但并不引起胃液氨基酸浓度增高. 最近Deng等[7,8,10]的研究发现胃非瘤病变(包括浅表性胃炎、慢性萎缩性胃炎及消化性溃疡)与胃癌患者的幽门杆菌感染率并无显著差异, 但是胃非瘤病变和胃癌患者的胃液氨基酸确差异显著, 提示胃液氨基酸增高与幽门杆菌感染无直接关系.
据文献报道的数据绘图所示胃液、胃黏膜组织、血液中及肿瘤组织中氨基酸浓度曲线基本相似(图3), 均是丙氨酸浓度最高而甲硫氨酸浓度最低. 胃癌胃液异常的氨基酸可能主要来源于血液、癌组织或癌旁黏膜组织. 胃液由胃黏膜上皮细胞分泌的黏液和胃腺体分泌的混合物组成, 成人日产生量1.5-2.5 L, 基础分泌量10-100 mL/h, 12 h禁食后残余胃液约50 mL. 胃液分泌主要受胃泌素调控, 主要成为包括电解质、胃蛋白酶原、盐酸和脂质. 正常胃液中也能够检测到少量氨基酸, 可能由胃底腺的颈黏液细胞、贲门腺和幽门腺黏液细胞及上皮细胞产生, 这些细胞的分泌均不受到胃泌素的调节. 一般胃液总氨基酸含量约1069 μmol/L[38], 而胃癌患者胃液氨基酸总量高达3619 μmol/L[38](血浆氨基酸含量约2600 μmol/L). 相比癌组织氨基酸浓度(10 mmol/kg)胃癌胃液氨基酸浓度绝对值更接近血清氨基酸浓度, 而且胃液各氨基酸组成比例与血浆氨基酸比例相似: 胃液苏氨酸/丝氨酸浓度比1.2(血液苏氨酸/丝氨酸1.1), 胃液支链氨基酸/芳香族氨基酸(BCAA/AAA)为2.0(血液为3.0-3.5), 因此胃癌患者异常增高胃液氨基酸可能来自癌灶的出血[38].
有学者认为胃液氨基酸来自间质胶原或胃液残留物降解, 根据胶原氨基酸组成: 甘氨酸、脯氨酸和异亮氨酸最多[43]; 胃液有机成分黏蛋白的氨基酸以丙氨酸、甘氨酸、和脯氨酸为主[44]. 这都与胃液中占多数的氨基酸丙氨酸、缬氨酸和亮氨酸不一致. 根据胃液主要氨基酸的组成(如图3B所示)、与血液(图3C)和胃癌组织(图3A)的相应氨基酸浓度比例一致, 我们认为胃液氨基酸来自癌灶的出血或者癌组织脱落分解.
Duraker等[45]报道胃液中癌胚抗原(carcino-embryonic antigen, CEA)等标志物诊断灵敏性及特异性较差, 不适合早期胃癌的筛查. Deng等[7,8,10]报道重度异性增持和肠上皮化生胃液芳香族氨基酸浓度有显著的差异, 分析胃液氨基酸谱可能对筛查早期胃癌有较高的实用性, 甚至能够更好的区分病灶的良恶性, 肿瘤氨基酸谱或许能够做出更精细的病理分型[18]. 但这仍需进一步详细的胃液氨基酸谱的数据支持. 日本学者在20世纪60年代就发现胃癌患者胃液氨基酸含量异常, 可能是受氨基酸检测技术的限制, 没有后续的应用报道. 现代氨基酸检测技术多依靠色谱技术, 利用衍生化反应是待检测氨基酸加入荧光基团, 常用的衍生化试剂为茚三酮、临苯二醛和苯异硫氰酸酯[46,47]再通过荧光光谱确定氨基酸含量. 目前主流的氨基酸分析仪也是基于这个原理, 价格较贵, 有些特殊氨基酸如色氨酸、胱氨酸也不能很好的定量[48-51]. 随着检测技术的进步, 结合胃液采集器技术[52,53], 胃液氨基酸谱适用于筛查早期胃癌.
目前临床常用的胃癌标志物CEA、糖链抗原199(carbohydrate antigen 199, CA199)、CA724诊断性能较差(表1)[45,54-56], 而胃癌患者氨基酸代谢出现失衡, 癌组织大量摄取氨基酸, 血浆氨基酸浓度下降, 尤其是血浆色氨酸下降最显著. 但由于骨骼肌和肝肾的调节作用血浆氨基酸水平降低往往不超过13%. 胃癌患者所有能检测到的胃液氨基酸都异常增多, 而且在异型增生与上皮化生的胃液氨基酸水平差异也十分显著. 无论是绝对值还是相对值胃液中丙氨酸浓度增多最为显著. 应用以丙氨酸为主胃液氨基酸谱作为早期胃癌的筛查手段或者术后监测指标前景广阔.
| 标志物 | 诊断标准 | 灵敏度(%) | 特异性(%) | 准确性(%) |
| CEA | 19.0-56.1 | 26.3-69.0 | ||
| CA199 | 50.0-92.0 | 52.0-95.0 | ||
| CA724 | 31.4-84.2 | 92.0-95.9 | ||
| CA50 | 25.7-70.3 | 92.0-96.0 | ||
| PG | PGⅠ<70 mg/L, PGⅠ/Ⅱ<3 | 63.0-83.0 | 51.0-76.0 | |
| MG7 | 32.1-90.4 | 85.5-96.8 | 73.1 | |
| IL-6 | >1.97 pg/mL | 81.8-87.6 | 58.3-66.7 | |
| 胃液CEA | 35.7-58.7 | 51.3 | 59.6 | |
| 胃液CA199 | 50.0-69.9 | 56.5 | 51.9 | |
| 胃液CA724 | 50.0-62.1 | 52.2 | 50.0 | |
| 胃液色氨酸 | 81.6-81.9 | |||
| 胃液苯丙氨酸 | 75.5-79.4 | 81.4-87.9 | 83.1-85.6 | |
| 胃液酪氨酸 | 79.0-83.8 | |||
| 胃液荧光物质 | P1FI >47.7 | 69.7-83.2 | 57.1-80.7 | 63.2-82.0 |
| 胃液a抗胰蛋白酶 | 96.0 | 92.0 | ||
| 胃液MINT25甲基化 | 92.0 | 90.0 |
富集氨基酸是肿瘤代谢的重要特征, 多种氨基酸在胃癌组织中的浓度是正常胃黏膜组织2倍以上. 血液中和癌组织中氨基酸通过多种方式进入胃液, 使胃液多数氨基酸浓度升高2-4倍, 而且这种改变在胃癌的早期就有体现.
朱永良, 副研究员, 浙江大学医学院附属第二医院门诊楼1104室消化实验室
肿瘤代谢是目前研究的热点, Warburg效应已在多种肿瘤中得到验证, 很多潜在肿瘤标志物得到发现和报道. 肿瘤代谢效应改变发生在遗传改变的下游, 变化显著, 数据庞大, 是肿瘤代谢数据的分析与解释成为目前研究的难点.
从20世纪50年代开始日本学者就开始研究胃癌胃液氨基酸, 在20世纪60-80年代就已经积累的大量的研究数据, 已经明确胃液氨基酸在胃癌患者中是有异常的. 但是当时氨基酸检测技术相对落后, 不适合临床应用.
胃液氨基酸谱在胃癌研究中被忽视30余年, 可能与研究热点都集中在幽门螺杆菌有关系, 本文总结并对比了胃癌氨基酸在组织及体液中分布, 初步探讨了胃液氨基酸可能来源, 期待更进一步的研究.
血液氨基酸受全身代谢影响较大, 早期肿瘤患者血液氨基酸变化不大, 而胃液氨基酸在癌前病变就有异常且差异显著, 以丙氨酸为主的胃液氨基酸谱在胃癌的早期筛查和术后检测具有极高的应用价值.
Warburg效应: 在氧供充足的条件下, 肿瘤细胞糖代谢仍然以无氧酵解为主, 也称为有氧酵解.
本文较全面探讨了胃液氨基酸测定作为胃癌诊断潜在标志物的价值, 对临床研究提供参考依据.
编辑: 郭鹏 电编:都珍珍
| 1. | Torre LA, Bray F, Siegel RL, Ferlay J, Lortet-Tieulent J, Jemal A. Global cancer statistics, 2012. CA Cancer J Clin. 2015;65:87-108. [PubMed] [DOI] |
| 2. | Chen W, Zheng R, Baade PD, Zhang S, Zeng H, Bray F, Jemal A, Yu XQ, He J. Cancer statistics in China, 2015. CA Cancer J Clin. 2016;66:115-132. [PubMed] [DOI] |
| 3. | Muto M, Yao K, Kaise M, Kato M, Uedo N, Yagi K, Tajiri H. Magnifying endoscopy simple diagnostic algorithm for early gastric cancer (MESDA-G). Dig Endosc. 2016; Feb 20. [Epub ahead of print]. [PubMed] [DOI] |
| 4. | Beeharry MK, Liu WT, Yan M, Zhu ZG. New blood markers detection technology: A leap in the diagnosis of gastric cancer. World J Gastroenterol. 2016;22:1202-1212. [PubMed] [DOI] |
| 5. | Zhang Z, Dou M, Yao X, Tang H, Li Z, Zhao X. Potential Biomarkers in Diagnosis of Human Gastric Cancer. Cancer Invest. 2016;34:115-122. [PubMed] [DOI] |
| 6. | Ichinoe M, Yanagisawa N, Mikami T, Hana K, Nakada N, Endou H, Okayasu I, Murakumo Y. L-Type amino acid transporter 1 (LAT1) expression in lymph node metastasis of gastric carcinoma: Its correlation with size of metastatic lesion and Ki-67 labeling. Pathol Res Pract. 2015;211:533-538. [PubMed] [DOI] |
| 7. | Deng K, Lin S, Zhou L, Geng Q, Li Y, Xu M, Na R. Three aromatic amino acids in gastric juice as potential biomarkers for gastric malignancies. Anal Chim Acta. 2011;694:100-107. [PubMed] [DOI] |
| 8. | Deng K, Zhou LY, Lin SR, Li Y, Chen M, Geng QM, Li YW. A novel approach for the detection of early gastric cancer: fluorescence spectroscopy of gastric juice. J Dig Dis. 2013;14:299-304. [PubMed] [DOI] |
| 9. | Zhou LY, Lin SR, Li Y, Geng QM, Ding SG, Meng LM, Sun XN, Wang JT, Xu ZJ, Guo HL. The intrinsic fluorescence spectrum of dilute gastric juice as a novel diagnostic tool for gastric cancer. J Dig Dis. 2011;12:279-285. [PubMed] [DOI] |
| 10. | Deng K, Lin S, Zhou L, Li Y, Chen M, Wang Y, Li Y. High levels of aromatic amino acids in gastric juice during the early stages of gastric cancer progression. PLoS One. 2012;7:e49434. [PubMed] [DOI] |
| 11. | Siegel RL, Miller KD, Jemal A. Cancer statistics, 2015. CA Cancer J Clin. 2015;65:5-29. [PubMed] [DOI] |
| 12. | Plummer M, Franceschi S, Vignat J, Forman D, de Martel C. Global burden of gastric cancer attributable to Helicobacter pylori. Int J Cancer. 2015;136:487-490. [PubMed] [DOI] |
| 13. | Pinheiro Ddo R, Ferreira WA, Barros MB, Araújo MD, Rodrigues-Antunes S, Borges Bdo N. Perspectives on new biomarkers in gastric cancer: diagnostic and prognostic applications. World J Gastroenterol. 2014;20:11574-11585. [PubMed] [DOI] |
| 14. | Pavlova NN, Thompson CB. The emerging hallmarks of cancer metabolism. Cell Metab. 2016;23:27-47. [PubMed] [DOI] |
| 15. | Yuan LW, Yamashita H, Seto Y. Glucose metabolism in gastric cancer: The cutting-edge. World J Gastroenterol. 2016;22:2046-2059. [PubMed] [DOI] |
| 16. | Gottfried E, Kreutz M, Mackensen A. Tumor metabolism as modulator of immune response and tumor progression. Semin Cancer Biol. 2012;22:335-341. [PubMed] [DOI] |
| 17. | Hirayama A, Kami K, Sugimoto M, Sugawara M, Toki N, Onozuka H, Kinoshita T, Saito N, Ochiai A, Tomita M. Quantitative metabolome profiling of colon and stomach cancer microenvironment by capillary electrophoresis time-of-flight mass spectrometry. Cancer Res. 2009;69:4918-4925. [PubMed] [DOI] |
| 18. | Wu W, Chung MC. The gastric fluid proteome as a potential source of gastric cancer biomarkers. J Proteomics. 2013;90:3-13. [PubMed] [DOI] |
| 19. | Zhang X, Xu L, Shen J, Cao B, Cheng T, Zhao T, Liu X, Zhang H. Metabolic signatures of esophageal cancer: NMR-based metabolomics and UHPLC-based focused metabolomics of blood serum. Biochim Biophys Acta. 2013;1832:1207-1216. [PubMed] [DOI] |
| 20. | Porporato PE, Payen VL, Baselet B, Sonveaux P. Metabolic changes associated with tumor metastasis, part 2: Mitochondria, lipid and amino acid metabolism. Cell Mol Life Sci. 2016;73:1349-1363. [PubMed] [DOI] |
| 21. | Vasseur S, Tomasini R, Tournaire R, Iovanna JL. Hypoxia induced tumor metabolic switch contributes to pancreatic cancer aggressiveness. Cancers (Basel). 2010;2:2138-2152. [PubMed] [DOI] |
| 22. | Cimen Bozkus C, Elzey BD, Crist SA, Ellies LG, Ratliff TL. Expression of Cationic Amino Acid Transporter 2 Is Required for Myeloid-Derived Suppressor Cell-Mediated Control of T Cell Immunity. J Immunol. 2015;195:5237-5250. [PubMed] [DOI] |
| 23. | Medina MA, Márquez J, Núñez de Castro I. Interchange of amino acids between tumor and host. Biochem Med Metab Biol. 1992;48:1-7. [PubMed] [DOI] |
| 24. | Liu W, Le A, Hancock C, Lane AN, Dang CV, Fan TW, Phang JM. Reprogramming of proline and glutamine metabolism contributes to the proliferative and metabolic responses regulated by oncogenic transcription factor c-MYC. Proc Natl Acad Sci U S A. 2012;109:8983-8988. [PubMed] [DOI] |
| 25. | Lai HS, Lee JC, Lee PH, Wang ST, Chen WJ. Plasma free amino acid profile in cancer patients. Semin Cancer Biol. 2005;15:267-276. [PubMed] [DOI] |
| 26. | Wiggins T, Kumar S, Markar SR, Antonowicz S, Hanna GB. Tyrosine, phenylalanine, and tryptophan in gastroesophageal malignancy: a systematic review. Cancer Epidemiol Biomarkers Prev. 2015;24:32-38. [PubMed] [DOI] |
| 27. | Miyagi Y, Higashiyama M, Gochi A, Akaike M, Ishikawa T, Miura T, Saruki N, Bando E, Kimura H, Imamura F. Plasma free amino acid profiling of five types of cancer patients and its application for early detection. PLoS One. 2011;6:e24143. [PubMed] [DOI] |
| 28. | Yamanaka H, Kanemaki T, Tsuji M, Kise Y, Hatano T, Hioki K, Yamamoto M. Branched-chain amino acid-supplemented nutritional support after gastrectomy for gastric cancer with special reference to plasma amino acid profiles. Nutrition. 1990;6:241-245. [PubMed] |
| 29. | Chen JY, Li CF, Kuo CC, Tsai KK, Hou MF, Hung WC. Cancer/stroma interplay via cyclooxygenase-2 and indoleamine 2,3-dioxygenase promotes breast cancer progression. Breast Cancer Res. 2014;16:410. [PubMed] [DOI] |
| 30. | Ryu HS, Park YS, Park HJ, Chung YR, Yom CK, Ahn SH, Park YJ, Park SH, Park SY. Expression of indoleamine 2,3-dioxygenase and infiltration of FOXP3+ regulatory T cells are associated with aggressive features of papillary thyroid microcarcinoma. Thyroid. 2014;24:1232-1240. [PubMed] [DOI] |
| 31. | Speeckaert R, Vermaelen K, van Geel N, Autier P, Lambert J, Haspeslagh M, van Gele M, Thielemans K, Neyns B, Roche N. Indoleamine 2,3-dioxygenase, a new prognostic marker in sentinel lymph nodes of melanoma patients. Eur J Cancer. 2012;48:2004-2011. [PubMed] [DOI] |
| 32. | Tanizaki Y, Kobayashi A, Toujima S, Shiro M, Mizoguchi M, Mabuchi Y, Yagi S, Minami S, Takikawa O, Ino K. Indoleamine 2,3-dioxygenase promotes peritoneal metastasis of ovarian cancer by inducing an immunosuppressive environment. Cancer Sci. 2014;105:966-973. [PubMed] [DOI] |
| 33. | Brancaleon L, Durkin AJ, Tu JH, Menaker G, Fallon JD, Kollias N. In vivo fluorescence spectroscopy of nonmelanoma skin cancer. Photochem Photobiol. 2001;73:178-183. [PubMed] [DOI] |
| 34. | Huang Z, McWilliams A, Lui H, McLean DI, Lam S, Zeng H. Near-infrared Raman spectroscopy for optical diagnosis of lung cancer. Int J Cancer. 2003;107:1047-1052. [PubMed] [DOI] |
| 35. | Oh-Uti K, Awataguchi J. Free amino acids in gastric juice of patients with gastric or duodenal ulcer and gastric carcinoma, with special reference to the change after operation. Tohoku J Exp Med. 1958;67:123-130. [PubMed] |
| 36. | Abasov IT. Chromatographic analysis of free amino acids of gastric juice in patients with cancer and other stomach diseases. Neoplasma. 1967;14:429-434. [PubMed] |
| 37. | Komorowska M, Szafran H, Popiela T, Szafran Z. Free amino acids of human gastric juice. Acta Physiol Pol. 1981;32:559-567. [PubMed] |
| 38. | Segawa K, Nakazawa S, Tsukamoto Y, Yamaguchi H, Goto H, Kurita Y. Amino acid patterns in human gastric juice in health and gastric disease. Jpn J Med. 1985;24:244-249. [PubMed] |
| 39. | Marshall BJ, Warren JR. Unidentified curved bacilli in the stomach of patients with gastritis and peptic ulceration. Lancet. 1984;1:1311-1315. [PubMed] |
| 40. | Cao D, Jiang J, You L, Jia Z, Tsukamoto T, Cai H, Wang S, Hou Z, Suo YE, Cao X. The protective effects of 18β-glycyrrhetinic acid on Helicobacter pylori-infected gastric mucosa in Mongolian Gerbils. Biomed Res Int. 2016;2016:4943793. [PubMed] [DOI] |
| 41. | Khalil MA, El-Sheekh MM, El-Adawi HI, El-Deeb NM, Hussein MZ. Efficacy of microencapsulated lactic acid bacteria in Helicobater pylori eradication therapy. J Res Med Sci. 2015;20:950-957. [PubMed] [DOI] |
| 42. | Murakami K, Sakurai Y, Shiino M, Funao N, Nishimura A, Asaka M. Vonoprazan, a novel potassium-competitive acid blocker, as a component of first-line and second-line triple therapy for Helicobacter pylori eradication: a phase III, randomised, double-blind study. Gut. 2016; Mar 2. [Epub ahead of print]. [PubMed] [DOI] |
| 43. | DeMichele SJ, Brown RG, Krasin BW, Sweeny PR. Connective tissue metabolism in muscular dystrophy. Amino acid composition of native types I, III, IV and V collagen isolated from the gastrocnemius muscle of embryonic chickens with genetic muscular dystrophy. Comp Biochem Physiol B. 1985;81:149-157. [PubMed] [DOI] |
| 44. | Dekker J, Aelmans PH, Strous GJ. The oligomeric structure of rat and human gastric mucins. Biochem J. 1991;277:423-427. [PubMed] |
| 45. | Duraker N, Naci Celik A, Gençler N. The prognostic significance of gastric juice CA 19-9 and CEA levels in gastric carcinoma patients. Eur J Surg Oncol. 2002;28:844-849. [PubMed] |
| 46. | Stasyuk NY, Gayda GZ, Fayura LR, Boretskyy YR, Gonchar MV, Sibirny AA. Novel arginine deiminase-based method to assay l-arginine in beverages. Food Chem. 2016;201:320-326. [PubMed] [DOI] |
| 47. | Babu SV, Shareef MM, Shetty AP, Shetty KT. HPLC method for amino acids profile in biological fluids and inborn metabolic disorders of aminoacidopathies. Indian J Clin Biochem. 2002;17:7-26. [PubMed] [DOI] |
| 48. | Zempleni J, Mock DM, Stratton SL, McCormick DB. Lipoic acid analogs and L-tryptophan do not interfere with the assay of biotin by HPLC/avidin-binding assay. Faseb J. 1996;10:4635-4635. |
| 49. | Sugden D, Grady R, Mefford IN. Measurement of tryptophan hydroxylase activity in rat pineal glands and pinealocytes using an HPLC assay with electrochemical detection. J Pineal Res. 1989;6:285-292. [PubMed] [DOI] |
| 50. | Zhang L, Lu B, Lu C, Lin JM. Determination of cysteine, homocysteine, cystine, and homocystine in biological fluids by HPLC using fluorosurfactant-capped gold nanoparticles as postcolumn colorimetric reagents. J Sep Sci. 2014;37:30-36. [PubMed] [DOI] |
| 51. | Varzaru I, Untea AE, Martura T, Olteanu M, Panaite TD, Schitea M, Van I. Development and validation of an RP-HPLC method for methionine, cystine and lysine separation and determination in corn samples. Rev Chim-Bucharest. 2013;64:673-679. |
| 52. | Muretto P, Graziano F, Staccioli MP, Barbanti I, Bartolucci A, Paolini G, Giordano D, Testa E, De Gaetano A. An endogastric capsule for measuring tumor markers in gastric juice: an evaluation of the safety and efficacy of a new diagnostic tool. Ann Oncol. 2003;14:105-109. [PubMed] [DOI] |
| 53. | Muretto P, Ruzzo A, Pizzagalli F, Graziano F, Maltese P, Zingaretti C, Berselli E, Donnarumma N, Magnani M. Endogastric capsule for E-cadherin gene (CDH1) promoter hypermethylation assessment in DNA from gastric juice of diffuse gastric cancer patients. Ann Oncol. 2008;19:516-519. [PubMed] [DOI] |
| 54. | Fang X, Tie J, Xie Y, Li Q, Zhao Q, Fan D. Detection of gastric carcinoma-associated antigen MG7-Ag in human sera using surface plasmon resonance sensor. Cancer Epidemiol. 2010;34:648-651. [PubMed] [DOI] |
| 55. | Ren J, Chen Z, Juan SJ, Yong XY, Pan BR, Fan DM. Detection of circulating gastric carcinoma-associated antigen MG7-Ag in human sera using an established single determinant immuno-polymerase chain reaction technique. Cancer. 2000;88:280-285. [PubMed] |
| 56. | Zhang L, Ren J, Pan K, Ma J, Li J, Shen L, Zhang X, Li J, Fan D, Gail M. Detection of gastric carcinoma-associated MG7-Ag by serum immuno-PCR assay in a high-risk Chinese population, with implication for screening. Int J Cancer. 2010;126:469-473. [PubMed] [DOI] |