修回日期: 2016-03-21
接受日期: 2016-03-28
在线出版日期: 2016-04-28
原发性胆汁性肝硬化(primary biliary cirrhosis, PBC)在疾病的进展过程中, 可累及肺部, 特别是炎症活动的PBC患者更易出现肺间质病变, 其临床表现及影像学改变与普通肺炎相似, 抗生素治疗无效. 回顾性分析贵州医科大学附属医院1例PBC合并肺间质病变患者的临床资料, 并复习相关文献. 研究表明, PBC合并肺间质病变的临床表现缺乏特异性, 易误诊为社区获得性肺炎, 及时免疫抑制剂治疗有效.
核心提示: 肝硬化患者继发感染时肺部感染常见, 故当原发性胆汁性肝硬化合并肺间质病变时在临床中不易被及时诊断, 往往当作普通肺炎而使用抗生素治疗, 延误患者病情, 因此在日常诊疗工作中应仔细鉴别、拓宽思路.
引文著录: 龙历, 吴亚云. 原发性胆汁性肝硬化合并肺间质病变1例. 世界华人消化杂志 2016; 24(12): 1938-1942
Revised: March 21, 2016
Accepted: March 28, 2016
Published online: April 28, 2016
To improve the understanding of primary biliary cirrhosis complicated with interstitial lung disease, we retrospectively analyzed the clinical information of one patient who had primary biliary cirrhosis complicated with interstitial lung disease, and reviewed the related literature. Primary biliary cirrhosis could affect the lung in the disease progression and result in pulmonary interstitial disease, especially in PBC with inflammatory activity. It is similar to common pneumonia in clinical manifestations and imaging appearances, and antibiotic treatment is ineffective. Primary biliary cirrhosis with clinical manifestations of interstitial lung disease lacks specificity and is easily misdiagnosed as community-acquired pneumonia, but timely immunosuppressant therapy is effective.
- Citation: Long L, Wu YY. One case of primary biliary cirrhosis with pulmonary interstitial lesions. Shijie Huaren Xiaohua Zazhi 2016; 24(12): 1938-1942
- URL: https://www.wjgnet.com/1009-3079/full/v24/i12/1938.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i12.1938
自身免疫性肝病(autoimmune liver diseases, ALD)是一组病因不明、免疫介导的肝脏损伤, 包括自身免疫性肝炎(auto-immune hepatitis, AIH)、原发性胆汁性肝硬化(primary biliary cirrhosis, PBC)和原发性硬化性胆管炎(primary sclerosing cholangitis, PSC). 临床上部分患者同时或在病程的不同阶段具有其中两种疾病的临床、生化、免疫及组织学特征时称为重叠综合征, 其中以AIH-PBC重叠综合征最为常见[1]. 除了特异的肝损伤表现外, 自身免疫性肝病的另一重要特点是经常合并其他自身免疫病, 常见的有干燥综合征(Sjogren's syndrome, SS)、系统性红斑狼疮(systemiclupus erythematosus, SLE)、系统性硬化症(systemicsclerosis, SSc)、类风湿关节炎(rheumatoid arthritis, RA)、皮肌炎(dermatomyositis)和/或多发性肌炎(polymyositis, PM)、溃疡性结肠炎(ulcerative colitis, UC)、克罗恩病(Crohn's disease, CD)等. 迄今为止, 国内有关PBC合并肺间质病变(interstitial lung disease, ILD)虽鲜有报道, 但肺间质病变却是最常见并且影响患者预后的重要因素之一[2], 本文报道1例PBC合并肺间质病变患者的误诊经过, 旨在提高临床医生的治疗水平.
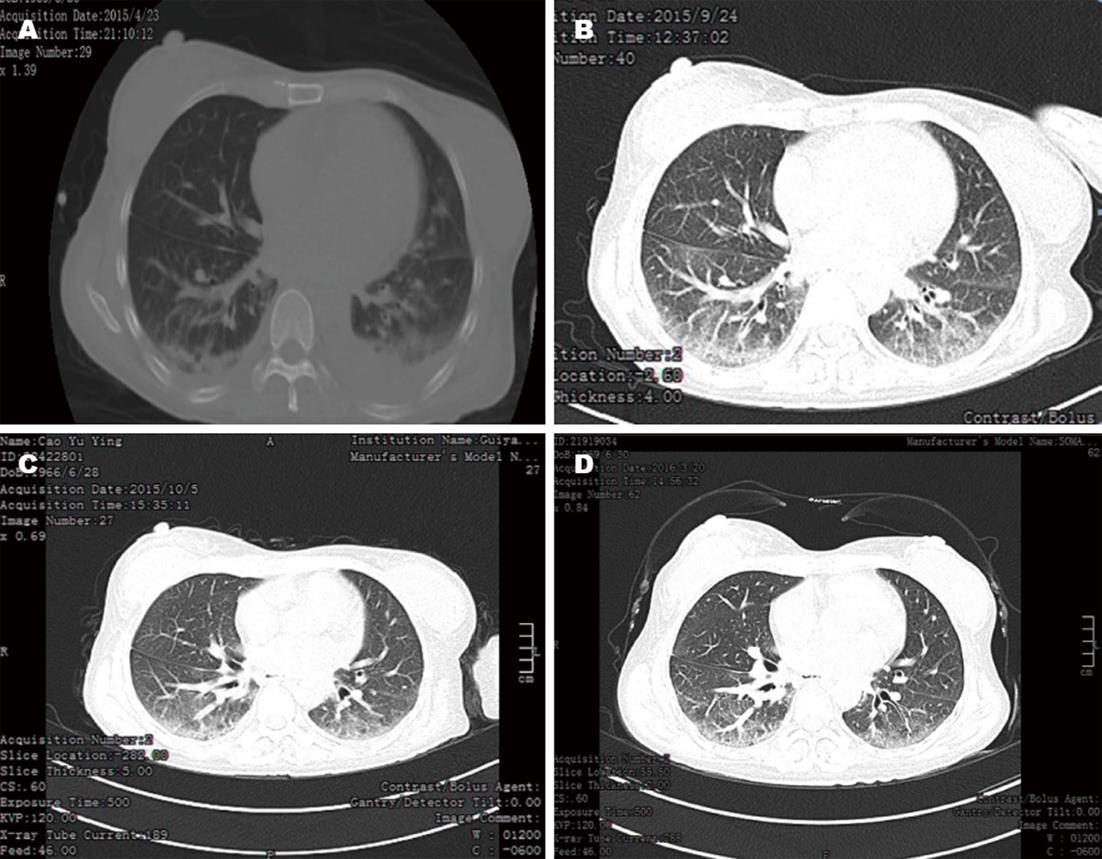
女, 49岁, 因"肝功能异常3年, 目黄2年, 气促5 mo, 加重3 d"于2015-09-25入院. 3年前, 患者行健康体检发现γ-谷氨酰转移酶(gamma-glutamyl transpeptidase, GGT)、碱性磷酸酶(alkaline phosphatase, ALP)增高, 因无自觉症状, 未重视及治疗. 2年前, 出现巩膜黄染, 伴轻微乏力和食欲减退, 行自身抗体、上腹部CT、肝穿刺活检等检查, 诊断为"PBC", 同期胸部CT无异常, 未遵医嘱规律服用"熊去氧胆酸"和未定期复查. 5 mo前, 患者上述症状加重, 并出现活动性气促, 无咳嗽、咳痰、发热等, 胸部CT(图1A)示"双肺感染", 先后予头孢哌酮舒巴坦、莫西沙星等抗炎治疗21 d, 症状无好转, 因经济原因自请出院. 此后仍未复查胸部CT及肝功能. 3 d前, 上述症状再次加重, 并出现咳嗽, 以干咳为主, 常感胸闷憋气、活动耐量下降再次就诊贵州医科大学附属医院, 查肝功能较前明显异常, 以"PBC"收住院. 否认乙型肝炎、结核病史, 否认吸烟史, 无长期大量饮酒、服药、粉尘、坑道作业史. 入院查体: 体温: 36.4 ℃, 脉搏: 76次/min, 呼吸: 17次/min, 血压: 98/60 mmHg. 慢性肝病面容, 全身皮肤、黏膜、巩膜轻度黄染, 胸廓对称无畸形, 双下肺底可闻及明显的细湿啰音, 以吸气末明显. 腹平软, 肝未扪及, 脾脏左肋缘下3横指可扪及, 移浊可疑阳性. 入院后予完善辅助检查: 血常规: 白细胞: 2.97 g/L↓, 中性: 67.5%, 血红蛋白: 118 g/L↓, 血小板: 68 g/L↓. 肝功能: 谷丙转氨酶: 67.99 U/L↑, 谷草转氨酶: 54.64 U/L↑, 总胆红素: 93.17 μmol/L↑, 直接胆红素: 73.68 μmol/L↑, 间接胆红素: 19.49 μmol/L↑, 血清白蛋白: 29.98 g/L↓, A/G: 0.775↓, GGT: 425.32 U/L↑, ALP: 714.14 U/L↑, 总胆汁酸: 226.79 μmol/L↑, 胆碱酯酶: 3865.65 U/L↓. 超敏C-反应蛋白: 11.37 mg/L↑. 抗线粒体抗体: AMA: 阳性, 抗线粒体M2抗体(AMA-M2): 阳性, 着丝点型抗核抗体: 阳性. 免疫球蛋白、单项补体: IgG: 21.90 g/L↑, IgA: 3.620 g/L↑, IgM: 4.01 g/L↑, C3: 0.62 g/L↓. 腹部MRI: 肝左叶囊肿, 脾大; 少量腹水, 双侧胸腔少量积液; 左肾周围炎改变. 胸部CT(图1B)示"双肺感染". 入院诊断: (1)PBC失代偿期; (2)双肺肺炎. 患者入院后予头孢硫咪联合莫西沙星抗感染, 熊去氧胆酸、常规保肝、退黄、利尿及营养对症支持等治疗13 d. 于2015-10-05复查胸部CT(图1C)仍提示肺部感染, 病灶较前无明显吸收. 行肺功能检查示肺弥散功能减退、中度限制性通气障碍. 回顾患者有PBC病史2年, 出现活动性气促症状5 mo余, 查体可闻及双肺底细湿罗音(为Velcro啰音), 以及多次胸部CT提示的毛玻璃样改变和肺功能检查结果, 符合肺间质病变诊断标准[3], 故考虑双肺病变为PBC合并肺间质病变而停用抗生素. 患者及其家属因顾虑糖皮质激素不良反应, 拒绝使用糖皮质激素治疗, 只接受熊去氧胆酸联合硫唑嘌呤治疗. 治疗3 mo后患者感活动性气促稍好转, 咳嗽、胸闷症状稍缓解, 肝功能较前明显好转, 谷丙转氨酶: 56.2 U/L↑, 谷草转氨酶: 62.1 U/L↑, 总胆红素: 44.70 μmol/L↑, 直接胆红素: 35.12 μmol/L↑, 间接胆红素: 9.58 μmol/L↑, 血清白蛋白: 32.73 g/L↓, GGT: 165.27 U/L↑, ALP: 304.92 U/L↑, 胆碱酯酶: 4062.77 U/L. 出院6 mo后再次门诊复诊诉活动后气促明显好转, 咳嗽、胸闷症状消失; 复查肝功能示: 谷丙转氨酶: 43.1 U/L↑, 谷草转氨酶: 58.3 U/L↑, 总胆红素: 42.6 μmol/L↑, 直接胆红素: 33.48 μmol/L↑, 间接胆红素: 9.11 μmol/L↑, 血清白蛋白: 36.02 g/L↓, GGT: 173.31 U/L↑, ALP: 327.96 U/L↑, 胆碱酯酶: 3809.8 U/L. 胸部高分辨CT示: 双肺间质性病变较前稍好转(图1D). 患者从诊断PBC合并肺间质病变后使用熊去氧胆酸联合硫唑嘌呤免疫抑制, 熊去氧胆酸可以保护受损胆管免受胆汁酸的毒性作用, 在进展期胆汁淤积中, 熊去氧胆酸可通过转录后调控机制刺激受损肝细胞的分泌、抑制胆汁酸诱导的肝细胞及胆管细胞凋亡等多方面来发挥有效作用, 其生物化学应答应在治疗1年后评估, 硫唑嘌呤则能抑制DNA合成, 从而抑制淋巴细胞增殖而产生免疫抑制作用[4,5]. 因患者目前已发展致肝硬化失代偿期, 而熊去氧胆酸对晚期PBC患者作用甚微, 晚期患者仅能靠肝移植提高存活率[6]. 因此院外规范服药后, 门诊复查肝功能结果仍有波动符合疾病特点, 但肺部影像学改变明显较前好转, 且咳嗽、胸闷、气促等症状减轻或消失, 说明治疗方案有效, 嘱继续规范使用, 并沟通告知使用糖皮质激素的必要性, 目前仍在随访中.
依据2013年我国胆汁淤积性肝病诊断治疗专家共识及自身免疫性肝病诊疗指南[7,8]. PBC诊断标准: (1)ALP>2×ULN或GGT>2×ULN; (2)抗线粒体抗体(AMA)≥1:100; (3)肝组织活检显示中度或中度以上胆管损伤. 长期熊去氧胆酸13-15 mg/(kg•d)治疗可减轻患者肝脏炎症及肝纤维化程度, 提高患者的生存率. 此患者虽符合PBC诊断标准, 但早期未接受规范的熊去氧胆酸治疗, 故导致2年时间内疾病快速进展, 并出现了肝外器官的损害症状. ILD是以肺泡单位炎症和间质纤维化为基本病变的弥漫性肺疾病, 可累及肺泡上皮细胞和毛细血管内皮细胞间的基底膜, 若肺泡炎症扩展最终使肺泡结构破坏、肺容积缩小、肺泡-毛细血管膜单位功能丧失, 导致低氧血症和呼吸衰竭. 细胞因子介导的细胞和细胞间的相互作用被认为在ILD发病中起着重要的作用[9]. 文献报道[10-12]多种自身免疫性疾病或结缔组织病可引起肺间质病变, 然而, 由PBC引起的肺间质病变国内鲜有报道. 沈敏等[13]对中国人PBC合并肺间质病变进行研究, 发现国人PBC合并肺间质病变发生率为16%, 其发生率低于系统性硬化症、皮肌炎(或肌炎)和类风湿关节炎, 炎症活动的PBC患者可能更易出现肺间质病变. PBC合并肺间质病变临床表现与其他肺间质病变相似, 主要表现为静息或活动后气短、咳嗽伴或不伴咯痰, 查体可见肺底爆裂音、肺动脉瓣区第二心音亢进、杵状指等. PBC合并肺间质病变的病理表现多样, 包括间质纤维化伴血管炎、淋巴性间质性肺炎、非特异性间质性肺炎、结节肉芽肿改变等. 近一半(46%)PBC合并肺间质病变患者可以没有任何呼吸道症状或体征, 仅在行影像学及肺功能检查时才发现. 免疫性疾病合并肺间质病变病理可见肺组织中淋巴细胞浸润和免疫复合物沉积所介导的肺损伤, 提示免疫机制在PBC合并肺间质病变的发生中起重要作用. 因此, 糖皮质激素通常为其治疗的首选药物, 他不仅能抑制中性粒细胞和淋巴细胞向肺内的迁移, 还能降低免疫复合物水平或改变肺泡巨噬细胞功能, 从而抑制炎症反应, 阻止纤维化的进展. 目前普遍认为单独口服糖皮质激素对肺泡炎的长期缓解效果不佳, 环磷酰胺可以弥补这一缺憾[8]. 故其传统的治疗是包括糖皮质激素和免疫抑制剂, 即糖皮质激素联合环磷酰胺. 确诊后尽早糖皮质激素联合免疫抑制剂治疗, 可使约56%患者胸部病变吸收好转[9].
本例患者的临床特点: (1)起病隐匿, 随着PBC病情的进展, 即从代偿期肝硬化至失代偿期的过程中, 逐渐累及肺部, 出现肺间质病变的临床症状如活动后气促; (2)影像学检查示双肺从多发斑片状、大片状密度增高影、边缘模糊的毛玻璃样改变演变为多发条索状、结节状密度增高影, 肺纹理走行紊乱; (3)肺功能检查示肺弥散功能减退、中度限制性通气障碍; (4)抗生素治疗无效, 免疫抑制剂治疗有效. 肝硬化患者, 特别是代偿期患者, 因免疫力低下易合并各种感染. 常见感染部位包括肺部、胸腹腔、胆道、尿道、软组织及皮肤等, 部分患者可出现无明显感染部位的自发性菌血症, 一旦合并感染, 肝损伤可进行性加重, 易诱发上消化道出血、肝性脑病、肝肾综合征等严重并发症, 病死率明显增高, 故早期识别、采取有效抗生素治疗是挽救患者生命的关键[14]. 据文献报道[15,16], 肝硬化患者由于机体免疫防御功能减低、门静脉高压及低蛋白血症等可致肺循环结构和功能异常, 易发生各种病原所致的肺部感染, 居肝硬化并发感染的第二位, 约为15%-20%. 由于肺部间质性改变的影像学表现有时难以与炎性渗出区别, 故当PBC患者影像学检查提示肺部炎症性改变时, 常常易误诊为普通肺炎, 而先予经验性使用抗生素治疗, 直至正规、足疗程抗生素治疗无效时, 才想到肺间质病变为PBC的肝外表现之一. 普通的肺部感染和肺间质病变无论病因、病理、疾病的发生发展过程及预后, 都是两种截然不同的疾病. 通过本例患者的误诊, 提醒我们在以后的临床工作中, 当遇到PBC患者如伴有咳嗽、咳痰、活动性气促或胸闷等呼吸道症状, 在肺部影像学检查示炎症性改变时, 需高度警惕是否为PBC合并的肺间质病变, 行高分辨率胸部CT、肺功能检查、支气管肺泡灌洗液或CT引导下经皮肺穿刺活检病理等检查明确诊断[17], 以便尽早制定恰当的治疗方案, 避免滥用抗生素及延误疾病的治疗.
原发性胆汁性肝硬化(primary biliary cirrhosis, PBC)除了特异的肝损伤表现外, 还经常合并其他肝外表现, 而合并肺间质病变虽鲜有报道, 但肺间质病变却是最常见并且影响患者预后的重要因素之一, 因临床症状缺乏特异性, 易被误诊为普通肺炎.
卢秉久, 教授, 博士生导师, 辽宁中医药大学附属医院感染科
PBC并肺间质病变的早期诊断、治疗, 以及足够数量病例数的疗效、预后观察有待进一步研究.
沈敏等详细地介绍了各种自身免疫性肝病、结缔组织病易合并的疾病, 以及合并肺间质病变的诊断标准、治疗等, 为进一步认识这些疾病及拓展临床思维提供了很好的平台.
本文通过对临床工作中的实际病例诊疗过程的反思, 结合文献资料分析, 旨在提醒临床医生在工作中不能想当然, 遇到按常规方法处理效果不理想时, 应及时分析疾病的特点, 尽早调整临床诊疗思路.
肝硬化失代偿期患者较常并发肺部感染, 及时规范的使用抗生素对疾病的控制无疑至关重要; 若免疫性肝硬化患者伴有咳嗽、气短等呼吸道症状, 胸部影像学示"肺部感染"时, 需认真甄别是单纯的感染所致, 还是肺间质性病变, 及时明确诊断制定正确的治疗方案对患者病情预后有重要意义.
肺间质病变: 是以肺泡单位炎症和间质纤维化为基本病变的弥漫性肺疾病, 可累及肺泡上皮细胞和毛细血管内皮细胞间的基底膜, 若肺泡炎症扩展最终使肺泡结构破坏、肺容积缩小、肺泡-毛细血管膜单位功能丧失, 导致低氧血症和呼吸衰竭.
本文总体构思较好, 层次较清晰, 论述及引文准确.
编辑: 于明茜 电编:闫晋利
| 7. | 胆汁淤积性肝病诊断治疗专家委员会. 胆汁淤积性肝病诊断治疗专家共识2013. 中华肝脏病杂志(电子版). 2013;5:53-62. |
| 9. | 王 丽娟, 杨 旭燕, 汪 慧英. 结缔组织病肺间质病变的诊治进展. 细胞与分子免疫学杂志. 2011;27:115-117. |
| 15. | European Association for the Study of the Liver. EASL clinical practice guidelines on the management of ascites, spontaneous bacterial peritonitis, and hepatorenal syndrome in cirrhosis. J Hepatol. 2010;53:397-417. [PubMed] [DOI] |
| 16. | Tandon P, Garcia-Tsao G. Bacterial infections, sepsis, and multiorgan failure in cirrhosis. Semin Liver Dis. 2008;28:26-42. [PubMed] [DOI] |
| 17. | 林 莉, 张 光峰, 张 晓. 结缔组织病肺间质病变的临床、影像和病理诊断. 中华临床免疫和变态反应杂志. 2009;3:272-277. |