修回日期: 2016-03-15
接受日期: 2016-03-29
在线出版日期: 2016-04-28
目的: 探讨腹腔镜超声在机器人辅助腹部肿瘤微创治疗中的临床应用.
方法: 对41例患者(肝门部胆管癌16例, 肝占位15例, 胰腺占位9例, 腹膜后占位1例)行腹腔镜超声引导机器人辅助腹部肿瘤微创治疗. 肿瘤治疗前经腹腔镜超声全面探查肿瘤精确部位、数量及其与邻近组织关系, 术中实时引导肿瘤治疗路径, 治疗后即刻经腹腔镜超声初步评价疗效. 术后用超声、增强CT/MRI及血生化等进行临床疗效评价.
结果: 41例患者在腹腔镜超声引导下均成功完成机器人辅助腹部肿瘤微创治疗, 手术成功率100%. 其中10例患者在腹腔镜超声扫查下发现术前未预期病情, 改变原手术方式, 手术方式纠正率24.39%(10/41). 围手术期无死亡病例, 术后超声、增强CT/MRI均未见异常改变, 生化指标趋于正常, 术中及术后均未见严重并发症, 患者生活质量改善, 生存状况满意.
结论: 腹腔镜超声在机器人辅助腹部肿瘤微创治疗中不仅可引导手术方式选择, 而且有助于提高术中安全性、减少术后并发症并延长无瘤生存时间, 从而更利于提高机器人微创手术的临床疗效.
核心提示: 腹腔镜超声(laparoscopic ultrasound, LUS)不仅可以引导机器人实现腹部肿瘤治疗微创化, 还可联合肝胆胰切除治疗. LUS助于定位肿瘤边缘及手术切缘, 减少肿瘤在肝内转移风险, 同时助于外科医生选择术式, 提高患者无瘤生存率.
引文著录: 高楠, 牟培源, 白媛媛, 周宁新. 腹腔镜超声在机器人辅助腹部肿瘤微创治疗中的应用. 世界华人消化杂志 2016; 24(12): 1926-1930
Revised: March 15, 2016
Accepted: March 29, 2016
Published online: April 28, 2016
AIM: To assess the clinical application of laparoscopic ultrasound in robot-assisted minimally invasive therapy for abdominal tumors.
METHODS: A total of 41 patients (16 patients with hilar cholangiocarcinoma, 15 patients with hepatic tumors, 9 patients with pancreatic tumors, and 1 patient with retroperitoneal tumor) underwent laparoscopic ultrasound-guided robot-assisted minimally invasive therapy for abdominal tumors. Laparoscopic ultrasound was used preoperatively to detect the number of lesions, and evaluate their location and relationship with surroundings tissue precisely. Also, by means of laparoscopic ultrasound, the surgical pathways were guided operatively, and preliminary clinical effects were evaluated postoperatively. To assess clinical efficacy, all patients were followed by contrast-enhanced CT/MRI, ultrasound, blood tests, etc.
RESULTS: All laparoscopic ultrasound-guided procedures were performed successfully. Laparoscopic ultrasound discovered undetected lesions in 10 patients, which resulted in a change in operative strategy (10/41, 24.39%). No death occurred during the perioperative period. Abnormalities were not found postoperatively by ultrasound and contrast-enhanced CT/MRI in all patients. Laboratory studies demonstrated that blood biochemical indicators decreased to normal range gradually. No severe complications occurred in both intraoperative and postoperative periods. All patients survived, and their life quality was improved significantly.
CONCLUSION: Laparoscopic ultrasound could not only guide operative strategy, but also help to decrease complications and prolong disease-free survival in the postoperative period. This technique provides a safe surgical procedure, and the therapeutic effects could be improved by application of laparoscopic ultrasound in robot-assisted minimally invasive therapy for abdominal tumors.
- Citation: Gao N, Mu PY, Bai YY, Zhou NX. Application of laparoscopic ultrasound in robot-assisted minimally invasive therapy for abdominal tumors. Shijie Huaren Xiaohua Zazhi 2016; 24(12): 1926-1930
- URL: https://www.wjgnet.com/1009-3079/full/v24/i12/1926.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i12.1926
传统的术中超声检查技术在20世纪80年代已广泛应用于多种外科领域中, 对于手术有指导作用[1]. 随着腹腔镜外科的发展, 腹腔镜超声(laparoscopic ultrasound, LUS)不仅可弥补传统超声的不足, 克服超声易受气体及肿瘤特殊部位影响的缺点, 还可拓宽腹腔镜手术的适应证范围, 引导术中精确定位肿瘤并探查肿瘤与邻近脏器的关系, 更有助于手术方式的选择. 2000年美国食品药品管理局(Food and Drug Administration, FDA)批准"达芬奇"机器人应用, 我们于2008年引进该手术设备并在国内最早将LUS与"达芬奇"机器人系统相结合应用于临床, 取得较为满意临床效果, 现将LUS技术在机器人辅助腹部肿瘤微创治疗方面的临床应用情况初步总结如下.
在中国人民解放军火箭军总医院肝胆中心行LUS引导机器人辅助腹部肿瘤治疗患者41例, 男24例, 女17例, 年龄32-76岁, 平均55.4岁±12.1岁. 其中肝门部胆管癌16例, 肝占位15例(肝细胞癌12例, 直肠癌肝转移3例), 胰腺占位9例(胰腺癌8例, 胰岛β细胞瘤1例), 腹膜后占位1例(卵巢癌腹膜后转移). 上述病例均行增强CT、MRI影像学检查及肿瘤标志物检测, 并经手术、病理证实. 术中仪器采用腹腔镜设备AIM型; ALOKA-3500型超声诊断仪, 腹腔镜超声探头型号为UST-MC11-8731, 频率为8.0 MHz, 轴直径10 mm, 长度310 mm; 射频消融术(radiofrequency ablation, RFA)治疗仪RITA-1500X型; Da Vinci S四臂机器人系统.
1.2.1 治疗: 患者全麻后消毒, 铺无菌单. 人工气腹成功建立后, Trocar穿刺置入腹腔镜及操作臂, 探查脏器的基本情况, 再将LUS探头置入腹腔, 全面扫查病灶所在脏器, 探查其与邻近脏器的关系并定位病灶位置, 确定肿瘤治疗路径, 同时确认是否存在术前未知病灶; 术后经LUS初步评估疗效. 通过LUS引导避开邻近的重要脏器及血管、胆管等重要结构, 并根据探查结果进一步决定是否需要改变手术方式.
1.2.2 观察指标: 观察手术有无失败及严重并发症出现, 统计手术成功率, 并观察患者术后生活质量及生存状况. 通过影像学检查(腹部彩超、增强CT/MRI等)观察病灶是否有血供或强化、实验室检查(肿瘤标志物、胆红素等)术后指标是否降低及降低程度, 从而对LUS引导下微创治疗腹部肿瘤的临床疗效进行评估.
41例患者在腹腔镜超声引导下均成功完成机器人辅助腹部肿瘤微创治疗, 围手术期无死亡病例. 其中10例患者在LUS扫查下发现术前未预期病情, 改变原手术方式, 手术方式纠正率24.39%(10/41).
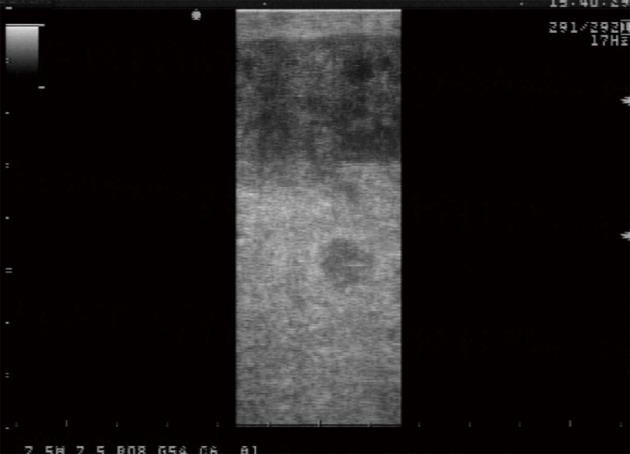
肝占位患者15例, 其中11例仅行RFA; 1例因LUS探查发现术前未检出病灶2个(肝右叶近膈顶部、肝左叶病灶各1个, 直径均<1.2 cm)而改变原手术方式(图1), 由肝左叶切除术改为左叶切除术及右叶RFA; 1例因肿瘤较大并侵犯膈肌, 为便于肿瘤切除, 改行RFA后行肝右后叶肿瘤切除术; 2例分别行肝左叶切除术、肝右叶包块切除术.
16例肝门部胆管癌患者, 12例行根治切除术, 4例因发现肝内微小转移灶而改变术式(直径均<1.5 cm).
9例胰腺占位患者, 2例经LUS探查发现病灶与大血管关系密切, 难以切除, 改行RFA并注入抗肿瘤药物以减轻胆道梗阻程度并部分缓解黄疸病情; 3例行全机器人Whipple手术; 2例行胰体尾切除术; 1例因LUS发现肝内直径1.3 cm转移灶1个, 于胰体尾切除术、胆囊切除术后追加RFA, 效果较为满意; 1例胰岛β细胞瘤患者经LUS探查其与邻近组织关系及确切位置, 行肿瘤切除术, 术前空腹血糖值为2.18 mmol/L, 术后次日空腹血糖值为8.34 mmol/L, 出院前空腹血糖多次监测均恢复至6.0-7.0 mmol/L.
1例卵巢癌腹膜后转移患者, 因LUS示其与大血管关系密切难以切除, 由腹膜后转移癌切除术改为肿瘤RFA以减轻肿瘤负荷, 术后患者状况得到改善.
全部消融区增强CT/MRI均无强化表现、多普勒超声均未见血流信号. 所有患者术后一天转氨酶均呈一过性升高, 随访1 mo后均有不同程度降低或趋于正常, 肿瘤标志物水平趋于正常. 梗阻性黄疸患者直接胆红素均呈明显降低趋势, 减黄效果较显著. 术后患者31例发热, 20例疼痛, 1例发生胆漏, 经保守治疗好转,余均未出现严重并发症. 患者术后体质量、饮食、睡眠等生活质量均有改善, 生存状况满意.
"达芬奇"机器人近年来发展迅速, 拓宽了微创外科的应用领域. 机器人外科手术系统由Insite Vision图像处理系统、操作控制台和机械臂3个部分组成. 这一系统通过处理腔镜提供的图像, 获得放大10-15倍的高分辨率3D图像, 为术者提供高清立体术野图像, 使得镜下视野更近于开腹手术, 有利于医师操作时手眼协调[2,3]. 从传统开腹手术跨越到可视状态下微创治疗, 超声扮演着"透视眼"的角色. 与普通术中超声相比, LUS在机器人手术中具有定位、引导及指导术式选择的功能. 机器人系统因术者存在盲区, 腹腔镜仅可观察脏器表面的情况, 腹腔镜超声在机器人手术中可减少术者触觉丧失的缺点, 在狭小的手术空间, 利于机器人手术系统更好地发挥其独特的微创治疗优势.
本文1例为近膈顶部肝占位小病灶术前未预知及1例肿瘤体积较大侵犯膈肌而难以切除, 在原术式前先行LUS引导下射频消融, 效果较为满意. 特殊部位直肠癌肝转移(colorectal liver metastases, CRLM)患者切除部分肝脏不仅肝功能储备降低, 并且毗邻重要脉管安全性不高[4], 本组3例CRLM患者病灶位置近门脉或肝静脉, 故选择LUS引导下射频消融治疗, 但因随访时间短, 入组病例少, 其远期疗效尚需进一步评估. Babawale等[5]对36例肿瘤直径<4 cm的CRLM患者行LUS引导下射频消融治疗, 1、2、3、4、5年的生存率分别为94%、69%、53%、42%、31%. 本文2例患者在LUS精确引导下成功定位肿瘤后, 分别行机器人辅助肝左叶切除术及右叶包块切除术, LUS助于定位肿瘤边缘及手术切缘, 减少肿瘤在肝内转移风险, 符合无瘤手术原则. 其余8例肝占位患者经LUS探查后发现失去手术切除机会[6,7], 行RFA以降低肿瘤负荷, 同时为肝移植争取了时间. 15例肝占位患者生存质量均满意.
肝门部胆管癌以根治性切除为目标, 对于病变位置特殊难以切除患者, 有效治疗阻塞性黄疸对提高肝门部胆管癌患者生存质量至关重要[8,9]. 本文中16例肝门部胆管癌患者, 12例经LUS探查未见新病灶而行根治切除术, 4例经LUS探查后发现术前未检出病灶, 行肿瘤局部切除及胆肠吻合术. 肝门区域解剖结构复杂, 对于可根治性切除病灶, LUS有助于肝门部胆管癌分期及确定可切除范围, 判断是否有肝内及腹腔淋巴结转移. LUS在胆肠吻合术中也发挥重要作用, LUS引导机器人辅助下行胆肠吻合术, 因其微创性强、精确度高, 在一定程度上减少副损伤(血管及胆管损伤), 同时便于观察吻合口情况, 术后发生胆瘘及腹腔感染的几率较小. 商昌珍等[10]指出对于Bismuth Ⅱ型和Ⅳ型由于断面常遗留较多胆管, 胆肠吻合技术难度大, 可先用腹腔镜联合术中超声进行探查, 明确有无血管侵犯等. LUS引导机器人对16例肝门部胆管癌精确定位、确定肝脏切缘及指导外科医生顺利完成胆汁外引流术、胆肠吻合术, 术后均无严重并发症.
胰腺周边重要脏器较多, 并且毗邻大血管, LUS的应用不仅有助于指导Whipple手术顺利进行, 而且可以帮助外科医生根据具体情况选择合适的术式. 本组8例胰腺占位患者在LUS引导下顺利完成手术. LUS对胰腺内分泌肿瘤定位准确, 安立春等[11]回顾性分析64例腹腔镜胰岛素瘤患者手术结果, 术中超声对肿瘤检出率为96.9%, 对肿瘤个数定位准确率为100%. 另1例胰腺占位为胰岛β细胞瘤患者, 在LUS实时监测下行机器人辅助肿瘤切除术, 术后多次测量血糖均恢复至正常范围.腹腔镜超声结合术前影像学能定位多数胰岛素瘤[12]. LUS可根据术中情况帮助外科医生判断病情、选择合理术式[13-15]. 1例卵巢癌腹膜后转移伴周围淋巴结肿大, 因腹膜后肿瘤位置较深, LUS探查下可以明确病灶病变程度, 因其与大血管关系密切难以切除转为LUS引导下射频消融, 效果较为满意.
总之, LUS不仅可以引导机器人实现腹部肿瘤治疗微创化, 还可联合肝胆胰切除治疗. LUS助于定位肿瘤边缘及手术切缘, 减少肿瘤在肝内转移风险, 符合无瘤手术原则, 降低肿瘤复发率, 提高患者无瘤生存率. 通过实时动态监测, 术中进一步明确诊断, LUS在术前诊断、术式选择、术中引导及术后评估中可发挥不可替代的作用, 在腹部肿瘤治疗中扮演了不可或缺的角色, LUS可为"达芬奇"机器人辅助腹部肿瘤微创治疗的顺利进行保驾护航.
腹腔镜超声可辅助外科医生定位病灶及术式选择, 其与"机器人"系统相结合, 术者不仅可观察组织脏器内部结构, 而且能够减少其触觉反馈减弱的缺点. 随着微创外科发展, 两者相结合会拓宽"机器人"系统临床应用范围.
江艺, 主任医师, 中国人民解放军南京军区福州总医院肝胆外科; 刘金钢, 教授, 博士生导师, 中国医科大学附属第四医院普外科
机器人与腹腔镜超声是智能化腹腔镜与高频超声结合, 随着"智能"时代的到来, 多学科交叉合作增多, 设备结合的推广应用研究是今后的主要问题.
Schneider等研究得出腹腔镜超声引导机器人辅助手术比单纯腹腔镜超声引导手术更具有实用性及可行性.
开放手术与腹腔镜手术中, 术中超声的应用价值已被临床公认, 但多数对机器人手术中腹腔镜超声的应用不熟悉, 腹腔镜超声引导"机器人"系统相关报道仍较少, 临床医生可用于参考借鉴.
腹腔镜超声引导"机器人"系统不仅定位精确、显示脏器深部病灶, 使更多手术得以微创化、减少患者痛苦, 而且助于外科医生选择合适术式, 在未来微创外科领域中拥有良好的前景.
腹腔镜超声: 将腹腔镜和具有高分辨率的高频超声融为一体, 用于术中诊断及定位.
本文针对目前微创技术前沿, 腹腔镜超声的应用价值已被临床公认, 但多数单位对机器人手术中腹腔镜超声的应用不熟悉, 腹腔镜下超声为微创外科医生提供了新的手段, 该文对临床医生有参考借鉴作用.
编辑: 郭鹏 电编:闫晋利
| 3. | Jung M, Hagen ME, Iranmanesh P, Majno P, Buhler LH, Toso C, Cornateanu S, Buchs N, Morel P. [Robotic-assisted hepatic surgery]. Rev Med Suisse. 2015;11:1331-1334. [PubMed] |
| 4. | Labori KJ, Schulz A, Drolsum A, Guren MG, Kløw NE, Bjørnbeth BA. Radiofrequency ablation of unresectable colorectal liver metastases: trends in management and outcome during a decade at a single center. Acta Radiol Open. 2015;4:2058460115580877. [PubMed] [DOI] |
| 5. | Babawale SN, Jensen TM, Frøkjær JB. Long-term survival following radiofrequency ablation of colorectal liver metastases: A retrospective study. World J Gastrointest Surg. 2015;7:33-38. [PubMed] [DOI] |
| 6. | Jiang K. [Laparoscopy-assisted radiofrequency ablation for hepatocellular carcinoma]. Zhonghua Yixue Zazhi. 2015;95:2157-2159. [PubMed] |
| 7. | Montalti R, Patriti A, Troisi RI. Robotic Versus Laparoscopic Hepatectomy: What Is the Best Minimally Invasive Approach? Ann Surg. 2015;262:e70. [PubMed] |
| 8. | Takahashi E, Fukasawa M, Sato T, Takano S, Kadokura M, Shindo H, Yokota Y, Enomoto N. Biliary drainage strategy of unresectable malignant hilar strictures by computed tomography volumetry. World J Gastroenterol. 2015;21:4946-4953. [PubMed] [DOI] |
| 9. | Mansour JC, Aloia TA, Crane CH, Heimbach JK, Nagino M, Vauthey JN. Hilar cholangiocarcinoma: expert consensus statement. HPB (Oxford). 2015;17:691-699. [PubMed] [DOI] |
| 12. | Antonakis PT, Ashrafian H, Martinez-Isla A. Pancreatic insulinomas: Laparoscopic management. World J Gastrointest Endosc. 2015;7:1197-1207. [PubMed] [DOI] |
| 13. | Jiang K, Su M, Zhao X, Chen Y, Zhang W, Wang J, Dong J, Huang Z. "One-off" complete radiofrequency ablation of hepatocellular carcinoma adjacent to the gallbladder by a novel laparoscopic technique without gallbladder isolation. Cell Biochem Biophys. 2014;68:547-554. [PubMed] [DOI] |
| 14. | Schneider CM, Peng PD, Taylor RH, Dachs GW, Hasser CJ, DiMaio SP, Choti MA. Robot-assisted laparoscopic ultrasonography for hepatic surgery. Surgery. 2012;151:756-762. [PubMed] [DOI] |
| 15. | Rodríguez-Sanjuán JC, Gómez-Ruiz M, Trugeda-Carrera S, Manuel-Palazuelos C, López-Useros A, Gómez-Fleitas M. Laparoscopic and robot-assisted laparoscopic digestive surgery: Present and future directions. World J Gastroenterol. 2016;22:1975-2004. [PubMed] [DOI] |