修回日期: 2016-03-24
接受日期: 2016-03-28
在线出版日期: 2016-04-28
目的: 通过实时定量PCR检测(real-time quantitative PCR, qRT-PCR)的方法研究多耐药相关蛋白-3(multidrug resistance-associated protein3, MRP3)、MRP4基因在大鼠幽门结扎性肝损伤中的表达变化.
方法: 采用幽门结扎法建立大鼠肝损伤模型, 测定血清指标、HE染色法在镜下观察病理形态变化、qRT-PCR方法研究MRP3、MRP4在幽门结扎性肝损伤大鼠和正常大鼠肝脏组织中的表达变化.
结果: 模型组与正常组比较血清谷丙转氨酶(alanine transaminase, ALT)、谷草转氨酶(aspartate transaminase, AST)、碱性磷酸酶(alkaline phosphatase, ALP)、BILD2、SBIL3等均明显增高(P<0.01或P<0.05); 肉眼观察模型组大鼠肝脏淤血、腹腔积水; 形态学观察肝细胞有明显的脂肪变、水肿、边膜外肝细胞大量坏死、有部分肝细胞凋亡; 肝细胞膜蛋白MRP3表达上调至正常组的3.5倍、MRP4表达下调至正常组的0.05倍.
结论: 幽门结扎引起肝损伤模型的形成, 与肝细胞膜蛋白MRP3、MRP4的调节有关.
核心提示: 通过研究, 从基因和蛋白水平上解释了幽门结扎性肝损伤对肝脏分泌胆汁功能的影响, 此结果对蒙医学其他病症研究提供了研究思路, 同时对临床类似与该疾病的治疗靶点提供参考.
引文著录: 王欢, 佟山, 红梅, 徐艳华, 巴图德力根, 韩志强, 图拉, 巴根那. 肝细胞膜蛋白MRP3、MRP4在大鼠幽门结扎性肝损伤中的表达变化. 世界华人消化杂志 2016; 24(12): 1853-1859
Revised: March 24, 2016
Accepted: March 28, 2016
Published online: April 28, 2016
AIM: To detect the expression of drug-resistant related protein (MRP) 3 and MRP4 genes in pyloric ligation induced hepatic injury in rats.
METHODS: A rat model of pyloric ligation induced liver injury was first developed. Serum indexes were determined, and HE staining was used to observe pathological changes. Real-time quantitative PCR (qRT-PCR) was used to detect the expression of MRP3 and MRP4 in pyloric ligation induced liver injury.
RESULTS: Serum alanine transaminase (ALT), aspartate transaminase (AST), alkaline phosphatase (ALP), BILD2, and SBIL3 were significantly increased in model rats compared with normal rats (P < 0.01 or P < 0.05). Macroscopically, model rats showed liver congestion and peritoneal effusion. Microscopically, obvious hepatocyte fatty change, edema, liver cell necrosis, and liver cell apoptosis were noted in model rats. The expression of MRP3 was 3.5 times higher in the model group than in the normal group, while the expression of MRP4 was 0.05 times lower in the model group than in the normal group.
CONCLUSION: Pyloric ligation induces liver injury via mechanisms possibly associated with regulating MRP3 and MRP4 expression.
- Citation: Wang H, Tong S, Hong M, Xu YH, Batudeligen, Han ZQ, Tula, Bagenna. Expression of MRP3 and MRP4 in pyloric ligation induced hepatic injury in rats. Shijie Huaren Xiaohua Zazhi 2016; 24(12): 1853-1859
- URL: https://www.wjgnet.com/1009-3079/full/v24/i12/1853.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i12.1853
大鼠幽门结扎性肝损伤是一种新型的肝损伤模型, 是基于蒙医"下结包如"病理论基础上建立的. "下结包如"病是蒙医"包如"病的一种, 在蒙医临床上病因不但复杂, 症状亦多变的重症疾病之一. 主要由于饮食失节, 如过食不易消化或进食不合胃腑之食物, 滞留于胃, 蕴积不化, 致使胃中黏液增多、瘀积, 导致胃内"调火赫依(五种赫依之一)"和"消化希拉(五种希拉之一)"功能衰退, 不能分解精华和糟粕. 侵入肝脏的部分又不能转化成正精, 反而恶血充斥, 影响肝脏功能(蒙医理论上, 肝脏具有造血和分泌胆汁功能[1]), 肝脏肿大, 血不循经而外溢, 又侵入胃腑、小肠和大肠, 则胃肠之消化功能因之减弱, 致使"巴达干"激增. 从而引起"下结包如"病, 也叫"寒性包如病"[1]. "下结包如"病, 病因复杂尤其是与血混合则是主要原因, 所涉及到的脏器是以肝脏、胃和小肠为主. 因此, 蒙医"下结包如"病是由于"肝脏、胃和小肠"代谢功能紊乱而引起的疾病.
肝细胞膜多耐药相关蛋白-3(multidrug resistance-associated protein3, MRP3)、MRP4是多耐超家族成员, 是ATP依赖的有机阴离子转运蛋白. 正常生理状态下, 他作为胆汁酸排泄系统对维持胆汁酸平衡是极为重要的. MRP3表达于人类和啮齿类动物的许多组织中, 如肝脏、肾脏、肠道等. MRP3、MRP4定位于细胞的基底侧膜, 主要介导甘氨酸、硫酸化和牛磺酸结合的胆汁酸、胆红素葡萄糖甘酸以及许多药物的转运[2-4]. 在正常生理状态下, MRP3、MRP4在肝脏中低或不表达, 但在肝损伤性胆汁淤积模型中表达增高[5,6]. 本研究中以大鼠为研究对象, 幽门结扎而引起胃溃疡, 进一步诱导肝损伤, 观察MRP3、MRP4在肝脏中的表达变化, 分析此模型对肝脏胆汁分泌的影响, 为该方法引起肝损伤的病理机制研究提供实验数据.
SD♂大鼠, SDF级, 体质量约200 g, 由辽宁本溪实验动物中心提供, 实验动物合格证号: SCXK(辽)2014-0029. 动物组织总RNA提取试剂盒[天根生化(北京)科技有限公司, 批号: DP121221]; cDNA第一链合成试剂盒[天根生化(北京)科技有限公司, 批号: KR140818]; miRcute miRNA荧光定量试剂盒[天根生化(北京)科技有限公司, 批号: Lot#N3028]; 水合氯醛; 甲醛; MRP3、MRP4等基因特异性引物[由生工生物工程(上海)股份有限公司合成]; 谷草转氨酶(aspartate transaminase, AST)试剂盒(德国罗氏疾病诊断有限公司提供, 批号: 20140618); 谷丙转氨酶(alanine transaminase, ALT)(德国罗氏疾病诊断有限公司提供, 批号: 20130206); BILT3(德国罗氏疾病诊断有限公司提供, 批号: 20140618); BILD2(德国罗氏疾病诊断有限公司提供, 批号: 20130206); 碱性磷酸酶(alkaline phosphatase, ALP)(德国罗氏疾病诊断有限公司提供, 批号: 20130708); 谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-Px)(南京建成生物工程中心提供, 批号: 20140903); 总蛋白测试试剂盒(南京建成生物工程中心提供, 批号: 20141128); 实时定量PCR(real-time quantitative PCR, qRT-PCR)检测仪(型号: AB Applied Biosystems, Stepone); 凝胶成像系统(型号: WD-9413B, 北京市六一仪器厂提供); 超速冷冻离心机(型号: TGL-18R Refrigerated Centrifuge); 二级生物安全净化工作台(型号: BH-C-1300II B2, 江苏安泰空气技术有限公司提供); TGear微型离心机(型号: 0SE-MC8, 天根生化科技有限公司提供); 移液枪1000、100、10 µL(型号: eppendorf Research plus); 罗氏全自动生化分析仪(型号: cobas c 311); 酶标液(型号: SUNRISE); 紫外分光光度计(型号: T6新世纪); 电泳仪(型号: DYY-6D型, 北京市六一仪器厂提供); 微波炉(型号: G80W23YSL-V9, 佛山市顺德区格兰仕微博炉电器有限公司提供); 小型电动匀浆器(天根生化科技有限公司提供); 梯度PCR(型号: Multigene Gradient).
1.2.1 部分试剂液的配制: 10%甲醛: 取10 mL甲醛溶液加36 mL蒸馏水; 10%水合氯醛: 10 g水合氯醛固体加至蒸馏水100 mL; DNase I工作液: 取10 μL DNase I储存液放入新的RNase-Free离心管中, 加入70 μL缓冲液RDD, 轻柔混合.
1.2.2 幽门结扎性肝损伤模型的建立: 取20只♂大鼠, 在实验室环境中适应1 wk, 按体质量随机分成2组, 即正常组和模型组. 实验开始后禁食不禁水24 h, 用10%水合氯醛麻醉(给药剂量3 mg/kg), 指定位置消毒, 在无菌情况下开腹结扎幽门, 缝合腹腔. 术后单笼饲养, 禁食禁水16-18 h, 用10%水合氯醛麻醉, 开腹, 腹主动脉采血, 取肝脏. 分离血清(在37 ℃水浴锅放置30 min, 3000 r/min, 离心10 min, 取上清液)备用. 肝脏用生理盐水清洗后, 称质量, 迅速分装, 液氮冻置, -80 ℃保存备用. 一部分固定在10%甲醛24 h, HE染色, 在镜下观察病理形态变化.
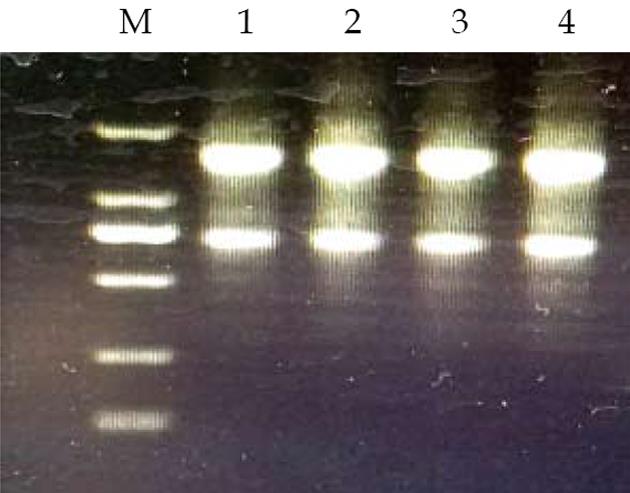
1.2.3 检测指标: (1)测定血清生化指标: ALT、AST、ALP、BILD2、SBIL3、GSH-Px等指标的测定均按照试剂盒说明书要求操作; (2)组织病理检查: 取大鼠相同部位的肝组织, 大小5 mm×5 mm, 置于10%甲醛中, 固定24 h. 样品用梯度乙醇脱水和二甲苯透明后, 同石蜡包埋, 制备5 μm连续切片, 用HE法染色, 并镜下观察形态变化; (3)qRT-PCR: 总RNA的提取、逆转录、荧光定量扩增液的配制均按照试剂盒步骤操作. PCR扩增反应的条件为95 ℃ 15 min、95 ℃ 10 s、60 ℃ 32 s、60 ℃ 1 min、95 ℃ 15 min. 以磷酸甘油醛脱氢酶基因(GAPDH)作为扩增实验的内参对照, 按2-△△Ct法计算目标基因相对水平. 各基因引物序列如表1. 提取总RNA纯度检测时A260/280均为1.8-2.1(图1).
| 基因 | 上游5'-3' | 下游5'-3' |
| GAPDH | GATTGTTGCCATCAACGACC | GTGCAGGATGCATTGCTGAC |
| MRP3 | TTCCGATTCACCACTTTCTACA | GGCAAGGATTTGTGTCAAGATT |
| MRP4 | GAAGGAAAATGAGGAAGCAGAG | GGATGACTGTTGCCAAATC |
统计学处理 血清指标应用SPSS17.0统计软件, 数据以mean±SD表示, P<0.05为差异有统计学意义.
与正常组比较, 模型组AST、ALT、BILD2、SBIL3明显高于正常组, 差异具有统计学意义(P<0.01), 模型组ALP、肝指数明显高于正常组, 差异具有统计学意义(P<0.05). 模型组GSH-Px明显降低(P<0.05)(表2).
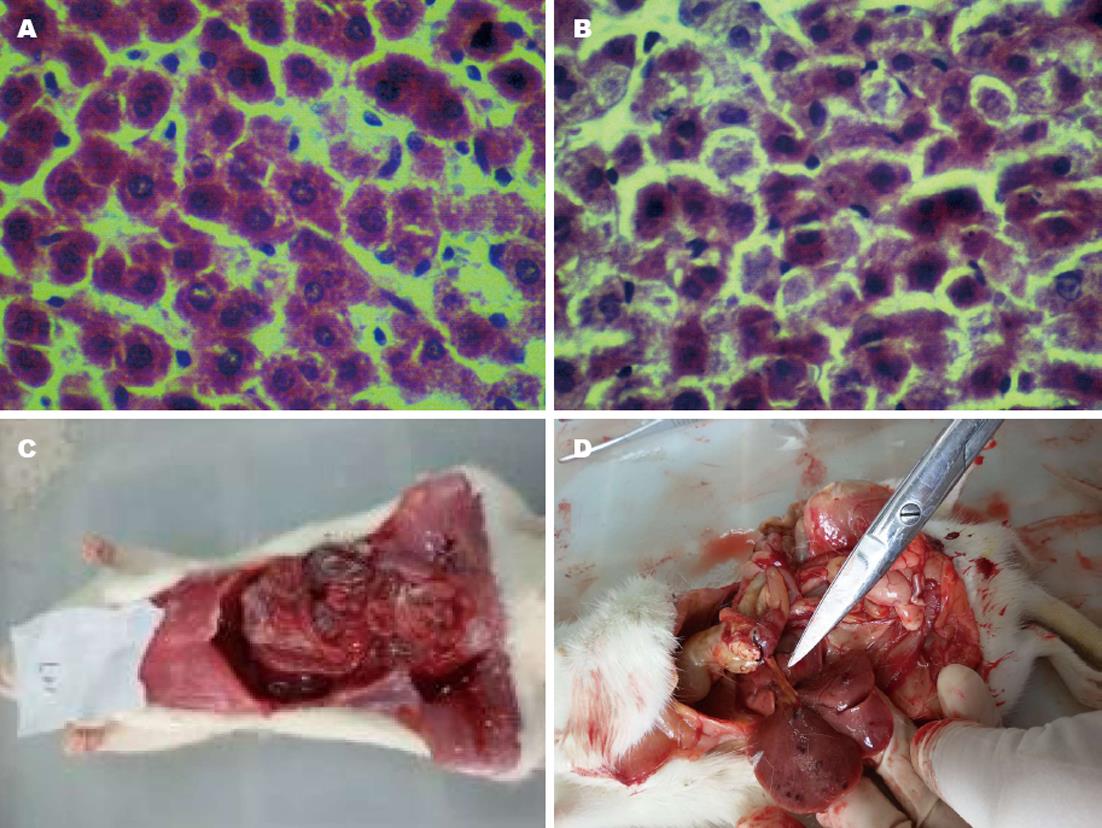
镜下观察结果表明, 模型组大鼠肝脏具有明显的脂肪变、水肿、边膜外肝细胞大量坏死、有部分肝细胞凋亡等形态改变(图2A, B). 大鼠腹腔内变黄疸, 肝脏淤血及腹水(图2C, D).
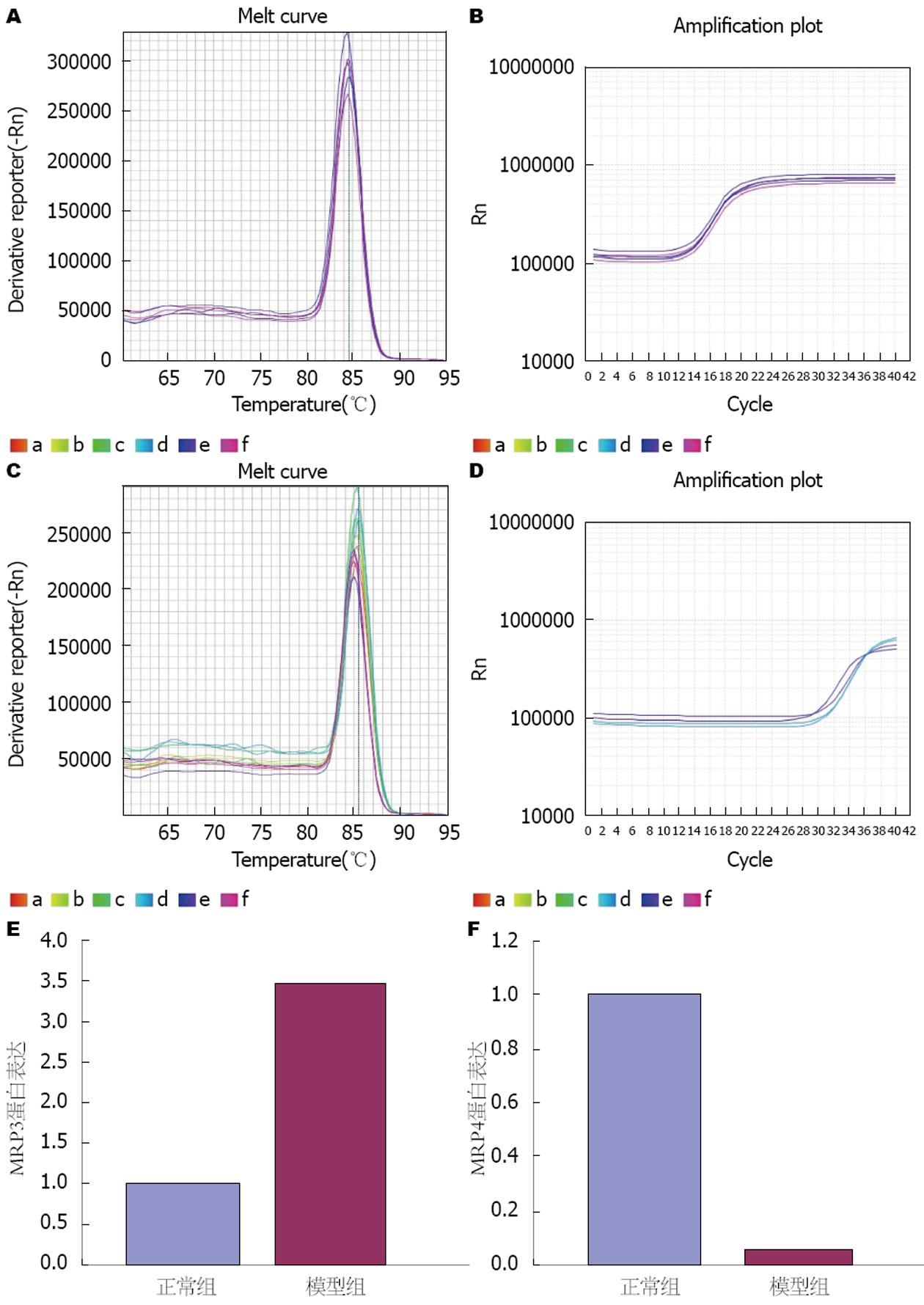
采用qRT-PCR检测幽门结扎引起大鼠肝损伤, 观察肝细胞膜蛋白MRP3、MRP4表达的影响, 与正常组比较模型组对肝细胞膜蛋白MRP3表达与正常组上调至3.5倍, 对肝细胞膜蛋白MRP4的表达与正常组下调至0.05倍(表3, 图3).
| 蛋白 | 正常组 | 模型组 |
| MRP3(△Ct) | -5.8544±1.2353 | -7.6438±4.6084 |
| -△△Ct | - | 1.7894 |
| 2-△△Ct | - | 3.4568 |
| MRP4(△Ct) | 2.5222±1.2515 | 6.7146±3.9845 |
| -△△Ct | - | -4.1924 |
| 2-△△Ct | - | 0.0547 |
蒙医对胃的认识: 胃位于膈下上腹部, 上接食道, 下通小肠, "希拉"之总位, 也是"病变巴达干"窜行之道. 另外"消化三能", 即磨碎巴达干、消化希拉和调火赫依共存于胃内, 在正常情况下"消化三能"处于动态平衡中, 顺利完成代谢功能, 也就是说, 胃内食物经磨碎巴达干(五种巴大干, 即主靠巴达干、腐熟巴达干、司味巴达干、能足巴达干、能合巴达干等[1]之一)所腐熟成甘味泡沫状乳糜; 其次被消化希拉所溶解转化为酸味; 最后被调火赫依分解成苦味的精华和糟粕[1], 经过初步消化分成的精华经脉道被送至肝脏.
蒙医对肝脏的认识: 肝脏位于右侧上腹, 横隔之下, "希拉"之总位, 五元(即木、火、土、铁、水等五元素)中之火元素精华所藏之处, 也是"变色希拉(五种希拉之一)"之所舍, 也是"病变希拉"窜行之道. 肝脏生理功能是通过"分热能"和"变色希拉"之作用, 使水谷之精华生化为血液, 即食物借"司命赫依(五种赫依之一)"之作用被咽进胃内所分成的精华经脉道被送至肝脏的部分在肝脏内通过"变色希拉"之作用变成血液, 同时把肝内生成的血液之糟粕-胆汁液则留于消化系内, 辅助滋养胃之腐熟巴达干[1].
蒙医对肝脏与胃关系的认识: 胃内分成的精华经脉道被送至肝脏. 如果饮食、起居、气候、其他等四种致病条件变化而导致胃内"消化三能"动态平衡被破坏的话就能引起相应的疾病, 从而影响到下一个脏器, 即肝脏. 乌云其木格[7]"胃《宝日》病的治疗体会"; 大格巴雅尔等[8]"胃(包如)溃疡临床治验"; 齐淑芬[9]"胃、十二直肠溃疡治验"; 布仁特古斯[10]"治疗肝《宝日》病(肝硬化)2例"; 陈海洁[11]"胃溃疡治验"; 都格尔扎布[12]"治疗《宝日》症的体会"; 锁链经验天山整理的"胃溃疡的治疗经验"[13]; 胡宝力高[14]"酒精中毒引起肝病的治疗"; 白万福等[15]的"蒙医治疗《肝硬化》23例"等文献均能证明蒙医临床上肝脏和胃疾病的情况及之间相互的联系性. 蒙医理论是以"整体观"为指导下诊断和治疗疾病, 因此外界环境和个体是统一体, 外界环境和个人习惯直接影响到人体的"三根"和"七素", 进而影响到胃内"消化三能"的动态平衡, 进一步影响到肝脏.
实验结果得知, 血清中通常被用做肝损伤最敏感性指标的AST、ALT明显升高; ALP、肝脏指数、BILD2、SBIL3也明显升高; 肝脏组织中GSH-Px明显降低. 参照2000-09中华医学会传染病与寄生虫病分会, 肝病学会西安会议联合修订的《病毒性肝炎(淤胆性)防治方案》制定标准中提示, 血清胆红素升高, 一直接胆红素为主, 碱性磷酸酶也升高. GSH-Px是细胞内抗脂质过氧化作用的酶性保护系统的主要成分, 可催化过氧化脂(lipid peroxide, LPO)分解生成相应的醇, 防止LPO均裂和引发脂质过氧化作用的链式支链反应, 减少LPO的生成以保护机体免受损害. 研究[16-18]发现梗阻性黄疸时肝脏脂质过氧化作用活跃, 自由基清除系统下降.
肝细胞膜蛋白MRP3、MRP4是多耐超家族成员, 是ATP依赖的有机阴离子转运蛋白. 正常生理状态下, 他作为胆汁酸排泄系统对维持胆汁酸平衡是极为重要的. MRP3表达于人类和啮齿类动物的许多组织中, 如肝脏、肾脏、肠道等. 在胆汁淤积状态下, 当肝内和系统内胆汁酸水平增加, 复杂的适应性反映被激活, 进而抵抗胆汁淤积性肝损伤. 其中基底外侧膜MRP3和MRP4是肝细胞预防系统的重要的转运蛋白, 他们主要介导胆汁酸、硫酸盐以及某些抗癌药物的转运[3,4].
总之, 幽门结扎引起胃溃疡, 进一步诱发肝损伤, 结果导致肝脏功能紊乱胆汁酸分泌障碍, 初步证实了蒙医理论的胃和肝脏的相关性, 此造模方法正好吻合蒙医学"整体观"理论. 其他相关研究正在进行中.
蒙医理论是以"整体观"为指导下诊断和治疗疾病. 此观点为依据, 本文建立了幽门结扎肝损伤, 初步探讨蒙医学胃和肝脏的相关性.
麻勇, 副研究员, 哈尔滨医科大学附属第一医院肝脏外科; 王蒙, 副教授, 中国人民解放军第二军医大学附属东方肝胆外科医院肝外综合治疗一科
蒙医药学"整体观"指导思想与现代生物学基因组学和蛋白组学的相关性. 从生物学角度进一步分析胃和肝脏的相关性问题.
以蒙医理论为指导下建立的幽门结扎性肝损伤模型, 且从基因水平上初步探讨了他的发病机制. 该模型与其他肝损伤模型比较操作简单, 重现性好, 成功率高, 经济实惠, 安全可靠.
为蒙医肝脏与胃的相关性提供基因水平的分析搭好基础, 也为临床类似消化系统疾病的诊断和治疗靶点提供实验依据.
三根: 指的是人体赖以进行生命活动的三种能量和基本物质(即赫依、希拉、巴达干);
七素: 指的是构成人体和维持生命活动之七种基本物质(即食物精华、血、肉、脂、骨、骨髓、精液).
本文建立了新型的肝损伤模型, 即大鼠幽门结扎性肝损伤, 此模型操作简单, 重现性好, 成功率高, 经济实惠, 安全可靠, 为蒙医学病症研究提供思路, 也为临床类似消化系统疾病的诊断和治疗靶点提供实验依据.
编辑: 于明茜 电编:闫晋利
| 1. | 百 清云. 中国医药百科全书•蒙医学(第1版). 上海: 上海科技出版社 1992; . |
| 2. | Anakk S, Watanabe M, Ochsner SA, McKenna NJ, Finegold MJ, Moore DD. Combined deletion of Fxr and Shp in mice induces Cyp17a1 and results in juvenile onset cholestasis. J Clin Invest. 2011;121:86-95. [PubMed] [DOI] |
| 3. | Scheffer GL, Kool M, de Haas M, de Vree JM, Pijnenborg AC, Bosman DK, Elferink RP, van der Valk P, Borst P, Scheper RJ. Tissue distribution and induction of human multidrug resistant protein 3. Lab Invest. 2002;82:193-201. [PubMed] [DOI] |
| 4. | Hirohashi T, Suzuki H, Takikawa H, Sugiyama Y. ATP-dependent transport of bile salts by rat multidrug resistance-associated protein 3 (Mrp3). J Biol Chem. 2000;275:2905-2910. [PubMed] [DOI] |
| 5. | Denk GU, Soroka CJ, Takeyama Y, Chen WS, Schuetz JD, Boyer JL. Multidrug resistance-associated protein 4 is up-regulated in liver but down-regulated in kidney in obstructive cholestasis in the rat. J Hepatol. 2004;40:585-591. [PubMed] [DOI] |
| 6. | Donner MG, Keppler D. Up-regulation of basolateral multidrug resistance protein 3 (Mrp3) in cholestatic rat liver. Hepatology. 2001;34:351-359. [PubMed] [DOI] |
| 16. | Ito H, Asahi H, Horiuchi S. [Role of oxygen radicals in the pathogenesis of acute gastric mucosal lesion under obstructive jaundice]. Nihon Geka Gakkai Zasshi. 1993;94:225-233. [PubMed] |
| 17. | Ohshio G, Miyachi Y, Kudo H, Niwa Y, Manabe T, Tobe T. Effects of sera from patients with obstructive jaundice on the generation of oxygen intermediates by normal polymorphonuclear leukocytes. Liver. 1988;8:366-371. [PubMed] [DOI] |
| 18. | Singh S, Shackleton G, Ah-Sing E, Chakraborty J, Bailey ME. Antioxidant defenses in the bile duct-ligated rat. Gastroenterology. 1992;103:1625-1629. [PubMed] |