修回日期: 2016-02-27
接受日期: 2016-03-08
在线出版日期: 2016-04-18
目的: 观察同种异体骨髓间充质干细胞(bone marrow mesenchymal stem cells, BMSCs)移植对大鼠肝脏缺血-再灌注损伤(hepatic ischemia reperfusion injury, HIRI)的修复作用并对其可能的治疗机制进行探讨.
方法: 将健康雌性清洁级SD大鼠的股骨骨髓进行分离、培养、鉴定获得BMSCs; 选取60只SD大鼠建立大鼠HIRI模型. 动物模型建立后, 将90只SD大鼠随机分为BMSCs移植组(n = 30, 予以尾静脉注射BMSC悬液1 mL, 1.0×107/mL), HIRI组(n = 30, 予以尾静脉注射L-DMEM 1 mL), 另设空白对照组(n = 30, 予以尾静脉注射生理盐水1 mL). 分别于移植后的1、2、3 wk于各组随机选取5只大鼠取血检测丙氨酸转氨酶(alanine transanminase, ALT)、天冬氨酸转氨酶(aspartate transaminase, AST)、超氧化物歧化酶(superoxide dismutase, SOD)、丙二醛(malondialdehyde, MDA)、肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、白介素-18(interleukin-18, IL-18)水平; 移植后2 wk对肝组织行HE染色, 观察移植后肝组织的形态学变化; 利用RT-PCR法及Western blot法检测肝细胞生长因子(hepatocyte growth factor, HGF)及α-平滑肌蛋白(alpha-sooth muscle actin, α-SMA)在肝组织中的表达水平.
结果: 移植后1 wk, BMSCs移植组、HIRI组的血清ALT、AST、MDA、TNF-α和IL-18水平明显高于对照组, SOD活性明显低于对照组, 差异均有统计学意义(均P<0.05); 移植后2、3 wk, BMSCs移植组ALT、AST、MDA、TNF-α和IL-18水平与HIRI组比较明显下调, SOD活性明显升高(均P<0.05), 但与对照组相比SOD活性仍偏低(P<0.05). HE染色后发现, BMSCs移植组大鼠肝细胞变性、坏死及纤维化程度较HIRI组均有明显减轻(P<0.05). RT-PCR法检测得知, 与HIRI组比较, BMSCs移植组中HGF基因表达水平明显升高, 而α-SMA的基因表达水平明显下降(均P<0.05). Western blot法检测得知, 与HIRI组比较, BMSCs移植组中HGF蛋白表达水平明显升高, 而α-SMA的蛋白表达水平明显下降(均P<0.05).
结论: 同种异体BMSCs移植能有效减轻大鼠HIRI, 其机制可能是通过降低血清TNF-α、IL-18水平和调节肝脏中HGF及α-SMA的表达水平.
核心提示: 肝脏缺血-再灌注损伤是临床的常见问题, 其发生目前认为与钙超载、氧化应激、代谢性酸中毒、一氧化氮和内皮素平衡失衡等诸多因素有关. 骨髓间充质干细胞目前证实除了具有多向分化能力外, 还具有强大的免疫调控功能. 本研究证实了骨髓间充质干细胞移植可通过降低血清肿瘤坏死因子-α(tumor necrosis factor-α)、白介素-18(interleukin-18)水平和调节肝脏中肝细胞生长因子(hepatocyte growth factor)及α-平滑肌蛋白(alpha-sooth muscle actin)的表达等机制改善大鼠肝脏缺血-再灌注损伤.
引文著录: 郑盛, 杨涓, 张帆, 王玉波. 同种异体骨髓间充质干细胞移植对大鼠肝脏缺血-再灌注损伤的影响. 世界华人消化杂志 2016; 24(11): 1639-1648
Revised: February 27, 2016
Accepted: March 8, 2016
Published online: April 18, 2016
AIM: To assess the therapeutic effects of transplantation of bone marrow mesenchymal stem cells (BMSCs) on hepatic ischemia-reperfusion injury (HIRI) in rats and explore the underlying mechanism.
METHODS: BMSCs were isolated from bone tissues of SD rats, cultured, and identified. SD rats were randomly divided into three groups: a control group, an HIRI group and a BMSCs transplantation group. HIRI was induced by the pringle occlusion method. After hepatic ischemia-reperfusion injury induction, blood samples were taken at 1, 2, and 3 weeks. Serum alanine transaminase (ALT), aspartate transaminase (AST), malondialdehyde (MDA), superoxide dismutase (SOD), interleukin (IL)-18 and tumor necrosis factor-α (TNF-α) were determined. Liver pathological changes were assessed by HE staining after 2 wk. Expression of hepatocyte growth factor (HGF) and alpha-smooth muscle protein (α-SMA) in the liver was detected by RT-PCR and Western blot.
RESULTS: At 1 wk, the levels of serum ALT, AST, IL-18, TNF-α and MDA in the transplantation group and HIRI group were significantly higher than those in the control group (P < 0.05 for all), and the levels of serum SOD were lower than that in the control group (P < 0.05). At 2 wk, the levels of serum ALT, AST, IL-18, TNF-α and MDA in the transplantation group were significantly lower than those in the HIRI group (P < 0.05 for all), but the level of serum MDA was higher and the level of serum SOD was lower in the transplantation group than in the control group (P < 0.05 for both). Hepatic degeneration, necrosis and fibrosis in the transplantation group were reduced significantly compared with the HIRI group (P < 0.05). HGF expression in the liver tissue was significantly higher and α-SMA expression was significantly lower in the transplantation group than in the HIRI group (P < 0.05 for both).
CONCLUSION: Transplantation of BMSCs can alleviate hepatic ischemia-reperfusion injury via mechanism possibly associated with inhibiting inflammatory factors and enhancing anti-oxidation.
- Citation: Zheng S, Yang J, Zhang F, Wang YB. Transplantation of bone marrow mesenchymal stem cells alleviates hepatic ischemia-reperfusion injury in rats. Shijie Huaren Xiaohua Zazhi 2016; 24(11): 1639-1648
- URL: https://www.wjgnet.com/1009-3079/full/v24/i11/1639.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i11.1639
肝脏缺血-再灌注损伤(hepatic ischemia reperfusion injury, HIRI)是临床常见的问题[1], 他是一个多因素参与的过程, 其发生机制尚未完全阐明. 目前认为他的发生与血清钙超载、氧化应激、中性粒细胞和Kuffer细胞释放炎症细胞因子、代谢性酸中毒、一氧化氮和内皮素平衡失衡等诸多因素有关, 其中氧化应激与炎症反应在肝脏HIRI过程中扮演了非常重要的角色[2-4]. 近年来干细胞及其"横向分化"特性的发现为多种消化系统疾病的治疗提供了一种新的思路, 尤其是部分实验证实间充质干细胞(mesenchymal stem cells, MSCs)具备定向分化能力, 也为HIRI的治疗提供了新的希望. 目前已证实骨髓间充质干细胞(bone marrow mesenchymal stem cells, BMSCs)经体外诱导培养后可分化成神经细胞、胰腺细胞、心肌细胞等来自3个胚层的细胞[5,6]. 而目前, 国内外研究[7-9]也表明BMSCs可以分化为肝细胞样细胞, 提示肝损伤后进行BMSCs移植为临床肝病治疗提供可能. 本研究主要通过对大鼠HIRI模型进行同种异体BMSCs移植, 检测其血清丙氨酸转氨酶(alanine aminotransferase, ALT)、天冬氨酸转氨酶(aspartate aminotransferase, AST)、超氧化物歧化酶(superoxide dismutase, SOD)、丙二醛(malondialdehyde, MDA)、肿瘤坏死因子-α(tumor necrosis factor α, TNF-α)、白介素-18(interleukin, IL-18)水平的影响、肝脏病理组织学变化以及肝组织特定蛋白的表达, 探讨了BMSCs移植对HIRI的保护作用及其机制.
健康♀清洁级SD大鼠90只(购自中科院昆明动物研究所), 体质量200-250 g, 饲养于云南省第三人民医院消化实验所, 恒温、恒湿条件下自由摄食摄水. 实验过程中对动物的处置符合中华人民共和国科学技术部2006年颁布的《关于善待实验动物的指导性意见》标准. 胰蛋白酶购自上海化工公司, DNase Ⅰ消化液购自美国Never公司, L-DMEM培养基购自北京百奥莱博科技有限公司, TRIzol购自北京全式金公司, RT试剂盒以及PCR试剂盒购自天根生化科技(北京)有限公司. ALT和AST试剂盒为北京北化康泰临床试剂有限公司产品. SOD、MDA、TNF-α试剂盒为南京建成生物工程研究所产品. IL-18试剂盒为武汉博士德生物工程有限公司产品. HE染色试剂盒购自北京博通生化公司.
1.2.1 大鼠BMSCs的分离、培养和鉴定: 按参考文献[10]的方法对实验大鼠进行BMSCs的分离和培养. BMSCs的鉴定采用流式细胞术, 进行鉴定的细胞选择取第3代BMSCs行流式细胞术鉴定, 使用流式细胞仪检测细胞表面抗原标记CD34-、CD45-且CD29+、CD44+、CD90+以明确为BMSCs, 选择第4代BMSCs作为治疗细胞来源, 将其通过经胰蛋白酶消化、而后PBS冲洗, 最后加入0.9%氯化钠溶液制备成BMSCs细胞悬液, 该细胞悬液的密度为1.0×107/mL, 实验备用用于后续移植实验.
1.2.2 大鼠肝脏HIRI模型建立: 大鼠术前禁食12 h, 禁水4 h. 10%水合氯醛腹腔注射麻醉下切开大鼠后腿内侧皮肤显露隐静脉, 行隐静脉置管给予肝素及补液. 取腹部正中于尖突下0.5 cm处纵向切约3 cm长的切口. 小心剥离暴露肝门, 用无创伤微血管夹按Pringle法夹闭肝十二指肠韧带, 阻断全肝血流. 缺血30 min后取出夹闭肝十二指肠韧带的无创伤血管夹, 恢复肝脏血流. 松动肝门处软组织后用丝线缝合切口, 经2 h血液复流即形成HIRI模型. 术后护理: 术后大鼠置于单笼饲养, 术后严格禁食3 d, 注意保暖, 为预防术后感染, 每日按40万U/kg体质量标准肌注青霉素.
1.2.3 尾静脉移植BMMSCs, 观察其对大鼠肝脏HIRI模型的影响: 将造模成功的肝脏HIRI大鼠随机分为2组: BMSCs移植组(n = 30), 于尾静脉注射制备好的BMSCs悬液1 mL, 细胞数约1×107个; HIRI组(n = 30), 于尾静脉注射L-DMEM 1 mL; 另设空白对照组(n = 30), 于相同时间点尾静脉注射生理盐水0.5 mL.
1.2.4 术后处理及测定指标: 根据文献[11,12]及本实验室预实验结果, 移植后的1、2、3 wk后分别于各组随机抽选5只大鼠采集血液标本, 经下腔静脉取3 mL血, 低温离心(4 ℃, 3500 r/min, 10 min), 分离血清(-80 ℃封存). 分别检测血清ALT、AST、MDA、SOD、IL-18及TNF-α含量. 取血后处死大鼠, 取出肝组织用40 g/L甲醛固定, 常规制作病理标本, HE染色, 以备组织学观察.
1.2.5 RT-PCR法检测HGF及α-平滑肌蛋白的基因表达水平: 移植后的2 wk取BMSCs移植组大鼠肝组织于研钵中反复研磨后置入无酶管中, 据RNA提取试剂盒说明书提取RNA, 然后根据PrimeScript RT reagent Kit Perfect Real Time(Takara公司)反转录体系说明书合成cDNA. 检索基因库中HGF、α-平滑肌蛋白(alpha-sooth muscle actin, α-SMA)正常序列, 利用Primer 5.0软件设计引物, 昆明医科大学基因研究中心负责引物合成, 引物序列设计详如表1. 将反转录后cDNA分别按梯度稀释10、1×102、1×103、1×104和1×105倍后进行qPCR; 反应体系为20 μL: SYBR Primer EX Taq酶™Ⅱ(2×) 10 μL, 上下游引物各0.5 μL, cDNA 1.0 μL, ddH2O 8.0 μL. 反应程序为: 95 ℃(预变性)30 s; 95 ℃ 5 s; 60 ℃ 30 s, 40个循环; 添加熔解曲线95 ℃ 15 s; 60 ℃ 30 s; 95 ℃ 15 s, 选取线性较好的3-4点绘制标准曲线; 反应液配置需要在冰上进行, 以GAPDH为内参, ddH2O代替样本cDNA为阴性对照实验, 实验重复3次.
| 基因名称 | 序列(5'-3') | 扩增长度(bp) |
| HGF | Forward primers: TTCCCAGCTGGTCTATGGTC | 236 |
| Reverse primers: TGGTGCTGACTGCATTTCTC | ||
| α-SMA | Forward primers: CTGACAGAGGCAACCACTGAA | 143 |
| Reverse primers: CATCTCCAGAGTCCAGCACA | ||
| GAPDH | Forward primers: CAAGTTCAACGGCACAGTCA | 258 |
| Reverse primers: CCACCACATACTCAGCACCAG |
1.2.6 Western blot法检测HGF及α-SMA的蛋白表达水平: 移植后的2 wk取BMSCs移植组大鼠肝组织放置于研钵中磨碎, 加入蛋白裂解液, 通过超声破碎仪充分裂解, 以上过程于冰上进行低温操作, 离心机设置4 ℃, 12000 r/min, 10 min, 取上清后BCA法测定HGF及α-SMA蛋白浓度, 按30 μg蛋白量作为标准上样量. SDS-PAGE浓缩胶80 V, 30 min; 分离胶120 V, 120 min, 然后转膜100 V, 100 min; 加入5%脱脂奶粉室温封闭1 h, 一抗4 ℃封闭过夜, 之后将HRP标记二抗室温孵育1 h, ECL法曝光、显影、照相, 过程以β-actin为内参基因.
统计学处理 采用SPSS18.0统计软件进行统计分析, 计量资料应用mean±SD表示, 两样本均数比较采用t检验或Mann-Whitney U检验, 显著性检验采用单因素方差分析, 组间比较方差齐时采用LSD方法, 方差不齐时采用Tamhane's T2方法. P<0.05为差异有统计学意义.
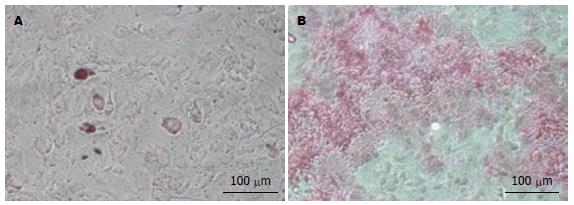
原代BMSC培养3 d后, 镜下可见单个细胞呈单个或少量或少许细胞聚集后贴壁生长, 细胞外形多呈短梭形; 培养7-10 d后, 细胞不断扩大聚集并融合成单层, 其外形转为多呈长梭形或多角形; 传代至第3、4代, 镜下可见细胞的形态和胞质的透光性均良好, 外形类似成纤维细胞, 呈漩涡状生长. 流式细胞术鉴定提示第3代细胞中细胞表面抗原标记CD34-、CD45-且CD29+、CD44+、CD90+表达的细胞占总细胞的比例>95%, 证实第3代细胞为BMSCs. 第4代BMSCs加入成脂诱导剂14 d后成功分化为脂肪细胞, 经成骨诱导培养液培养21 d后成功分化为成骨细胞(图1), 可知贴壁培养法分离获得的BMSCs具有多向分化能力, 细胞活性较好.
移植后1 wk, BMSCs移植组、HIRI组的血清ALT、AST水平明显高于对照组, 差异有统计学意义(均P<0.05); 移植后2、3 wk, BMSCs移植组血清ALT、AST水平与HIRI组比较明显下调, 差异有统计学意义(均P<0.05), 与对照组比较差异无统计学意义(均P>0.05)(表2).
| 分组 | 1 wk | 2 wk | 3 wk | |||
| ALT | AST | ALT | AST | ALT | AST | |
| 对照组 | 46.0±3.2 | 48.6±3.5 | 45.8±4.6 | 49.2±6.3 | 48.8±3.7 | 47.7±5.1 |
| HIRI组 | 423.6±32.7a | 482.3±61.5a | 533.4±62.0a | 592.5±64.1a | 539.0±69.8a | 524.3±48.8a |
| BMSC移植组 | 390.0±54.8a | 444.8±47.6a | 62.6±8.7c | 78.5±6.6c | 53.5±11.6c | 72.8±5.7c |
| F值 | 16.172 | 19.795 | 10.961 | 11.198 | 19.652 | 17.767 |
| P值 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 |
移植后1 wk, BMSCs移植组、HIRI组的血清TNF-α、IL-18水平明显高于对照组, 差异有统计学意义(均P<0.05); 移植后2、3 wk, BMSCs移植组血清TNF-α、IL-18水平与HIRI组比较明显下调, 差异有统计学意义(均P<0.05), 与对照组比较差异无统计学意义(均P>0.05)(表3).
| 分组 | 1 wk | 2 wk | 3 wk | |||
| TNF-α(ng/L) | IL-18(pg/mL) | TNF-α(ng/L) | IL-18(pg/mL) | TNF-α(ng/L) | IL-18(pg/mL) | |
| 对照组 | 68.1±6.2 | 46.2±5.5 | 65.8±7.6 | 49.2±5.9 | 69.2±8.4 | 48.6±4.3 |
| HIRI组 | 232.8±26.1a | 196.2±33.4a | 213.9±42.0a | 188.5±36.7a | 169.0±39.0a | 154.6±26.6a |
| BMSC移植组 | 211.5±34.0a | 174.3±27.9a | 94.4±12.5c | 88.1±10.6c | 83.5±11.2c | 62.7±12.2c |
| F值 | 30.671 | 32.126 | 11.354 | 17.662 | 18.763 | 10.842 |
| P值 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 |
移植后1 wk, BMSCs移植组、HIRI组的血清MDA水平明显高于对照组, SOD活性明显低于对照组, 差异均有统计学意义(均P<0.05); 移植后2、3 wk, BMSCs移植组MDA与HIRI组比较明显下调, SOD活性明显升高(均P<0.05), 但与对照组比较SOD活性仍偏低(P<0.05)(表4).
| 分组 | 1 wk | 2 wk | 3 wk | |||
| MDA(mmol/L) | SOD(U/mL) | MDA(mmol/L) | SOD (U/mL) | MDA(mmol/L) | SOD(U/mL) | |
| 对照组 | 5.4±1.2 | 240.6±35.1 | 5.6±0.6 | 242.9±45.6 | 5.5±0.8 | 239.2±34.8 |
| HIRI组 | 23.8±6.2a | 86.5±13.3a | 20.4±5.5a | 88.7±16.8a | 18.6±4.0a | 104.2±18.6a |
| BMSC移植组 | 21.5±3.3a | 94.1±14.9a | 8.0±2.5c | 148.6±21.4c | 7.4±1.6c | 176.4±22.7ac |
| F值 | 32.188 | 28.821 | 21.314 | 15.547 | 14.547 | 13.386 |
| P值 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 |
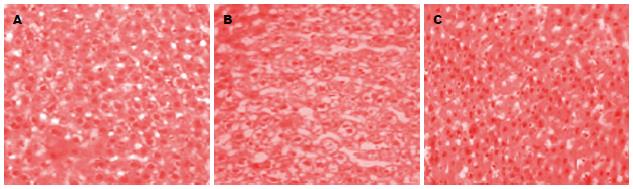
移植后2 wk, HE染色后显微镜下观察可见对照组肝组织结构清楚, 细胞索排列有序, 细胞形态基本正常. HIRI组肝组织有明显的细胞坏死灶及大量炎性细胞浸润, 肝小叶结构破坏较为严重, 肝脏有较严重的纤维化. BMSCs移植组病变明显轻于HIRI组, 肝细胞坏死较少, 亦可见假小叶形成, 但数量较HIRI组减少, 肝脏纤维化、脂肪变性程度明显减轻(图2).
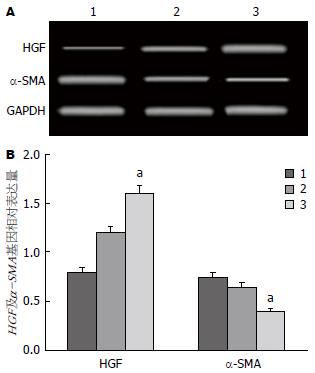
移植后2 wk, RT-PCR法检测得知, 与HIRI组比较, BMSCs移植组中HGF基因表达水平明显升高, 而α-SMA基因表达水平明显下降, 差异有统计学意义(均P<0.05)(图3).
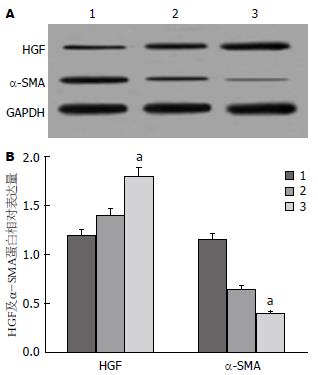
移植后2 wk, Western blot法检测得知, 与HIRI组比较, BMSCs移植组中HGF蛋白表达水平明显升高, 而α-SMA的蛋白表达水平明显下降, 差异有统计学意义(均P<0.05)(图4).
HIRI是临床常见的一种病症, 他是一个多因素参与的过程, 其发生机制尚未完全阐明. 目前认为缺血期钙超载、氧自由基大量产生、生物膜破裂、各种酶漏出和炎性介质大量释放等均与之有关. HIRI分为早期和晚期两个阶段. 其中肝细胞的损伤都与TNF-α等细胞因子网络密切相关, 而TNF-α在此细胞网络发挥核心作用[13]. IL-18是近年发现的一种新的致炎因子, 研究发现IL-18具有多种生物学活性, 可诱导T细胞、NK细胞、中性粒细胞等多种细胞产生IFN-γ、TNF-α、IL-1、IL-18等细胞因子[14,15]. IL-18过度表达会加重局部组织继发性损伤. 有研究表明, IL-18在缺血性组织中表达水平明显上升. 其在病毒性肝炎患者血清的表达与ALT水平呈正相关, 肝脏炎症越重IL-18水平越高. 本文HIRI组ALT和AST水明显高于对照组. 前者镜下可见明显的肝细胞坏死灶, 并伴大量炎性细胞浸润, 同时ALT、AST水平与IL-18的表达同向上升, 两者具有明显的正相关关系. 根据文献和本文实验结果, 我们推测IL-18的过度产生可能是肝功能损害及其病理性改变的直接原因之一. 各种原因造成组织器官血液灌流减少时由于缺血缺氧而发生氧化应激损伤. HIRI时一方面由于细胞缺血缺氧产生大量的无氧代谢产物, 另一方面ATP分解增加和内源性抗氧化物酶失活或消耗, 使氧自由基在短时间内爆发性增多, 引起生物膜脂质过氧化[16-18]. 由于脂质过氧化导致血小板、粒细胞在微血管黏附、聚集改变膜的流动性和通透性, 抑制线粒体的氧化磷酸化, 造成微循环障碍使肝细胞肿胀、变性, 最终导致细胞坏死. SOD是内源性抗氧化酶, 其活性高低反映组织清除氧自由基的能力[19]. MDA是氧自由基攻击生物膜引发脂质过氧化反应的产物, 其在组织中含量可反映脂质过氧化的程度[20]. 本文HIRI组血清MDA含量高于对照组, SOD活性低于对照组. 这表明HIRI引起抗氧化物质减少和氧自由基大量产生是HIRI的重要原因, 后者过度产生会加重组织继发性损伤.
近年来干细胞及其"横向分化"特性的发现为多种消化系统疾病的治疗提供了一种新的思路, 尤其是部分实验证MSCs可定向分化为肝样细胞, 也为肝脏HIRI的治疗提供了新的希望. 越来越多的研究表明BMSC可在一定的微环境中通过细胞替代和旁分泌作用等促进肝损伤后的内源性肝细胞重建, 并减轻氧化应激反应[21-24]. Zou等[25]发现BMSCs可产生部分"保护性"的细胞因子, 他们可以减少和延缓肝细胞坏死及凋亡, 提高急性肝衰竭的生存率. 目前另一些研究[26]发现BMSCs具有抑制肝细凋亡、促进肝细胞增殖、分化的作用. BMSCs的这种作用考虑主要是一种旁分泌的作用机制[27,28]. BMSCs可以产生、分泌和释放多种与肝细胞增殖相关的细胞因子和促生长因子, 促进肝细胞分化、再生和增殖, 同时也可以抑制肝脏组织的炎症反应及肝细胞的凋亡. 目前研究显示在肝脏严重受损、肝细胞增殖受抑制时, BMSCs具有持续增殖、分化成为肝细胞和胆管细胞的能力. 肝脏组织损伤后, 其具有较强的自我修复能力, 在此过程中, 如果采取了移植BMSCs, 则移植的BMSCs可参与分化、增殖形成新的肝细胞, 从而补充了坏死、凋亡的肝细胞, 参与被损伤破坏肝组织结构的修复和重构. 国内外多个研究[29,30]表明, 将BMSCs移植入受损的肝脏组织中, 通过免疫荧光标记的方法以及体内成像追踪等方式均提示了移植的BMSCs可在肝脏有效的定植, 此外部分研究还对比了BMSCs移植入肝损伤组和空白对照组的肝脏, 结果显示BMSCs在肝损伤组的肝脏中定植的数量、分布范围明显高于空白对照组.
本研究结果显示: 移植后1 wk, BMSCs移植组、HIRI组的血清ALT、AST、MDA水平明显高于对照组, SOD活性明显低于对照组, 差异均有统计学意义(均P<0.05); 移植后2、3 wk, BMSCs移植组ALT、AST、MDA水平与HIRI组比较明显下调, SOD活性明显升高(均P<0.05), 但与对照组SOD活性仍偏低(P<0.05). 结果说明了, 移植组大鼠肝功能在BMSCs移植后明显改善, 脂质过氧化反应程度减轻, 进一步论证了BMSCs移植可促进修复HIRI. 此外, 本研究也显示移植后2、3 wk, BMSCs移植组TNF-α和IL-18水平与HIRI组比较明显下调, 肝脏组织病理性改变明显减轻, 提示BMSCs移植对HIRI具有明显保护作用. 研究[31,32]表明, HIRI后肝脏中的Kupffer细胞激活, 分泌大量的TNF-α、IL-18等炎性因子. TNF-α可诱导产生氧自由基及脂质过氧化, 是触发HIRI时炎症瀑布效应的关键因子. 我们的研究结果提示BMSCs移植可通过减弱HIRI对Kupffer细胞的刺激, 下调TNF-α和IL-18水平, 对HIRI的发生起到预防保护作用.
肝脏损害基础是发生肝纤维化, 肝星状细胞(hepatic stellate cell, HSC)激活是肝纤维化发生的中心环节, HSC活化后细胞表型改变, 特征性表达α-SMA, 导致肝纤维化, 其表达量的高低与HSC活化、肝细胞纤维化程度均呈正相关, 所以, α-SMA表达量的检测, 可较好反应肝脏损伤程度[33]. 本实验中对照组大鼠HIRI动物模型在恢复肝脏血供后肝功恢复较为缓慢, 出现了肝纤维化的表现, 提示HIRI同样也是肝纤维化的发病机制之一. 本实验结果显示BMSCs移植组大鼠肝组织α-SMA表达水平显著低于HIRI组, 说明BMSCs可抑制损伤肝组织中HSC的活化, 抑制肝细胞发展为纤维母细胞, 肝损害程度减轻. HGF是发现的刺激原代培养肝细胞生长的细胞因子, 具有多种生物学功能, 作为强效的促有丝分裂剂, 在促进成熟肝细胞分裂、血管新生与侧支微循环的建立方面发挥重要作用[34]. 研究发现[35,36], HGF在肝细胞发生变性、坏死等病理改变后表达增高, 表明HGF可促使肝组织再生与修复. 本研究通过利用RT-PCR与Western blot技术检测后发现BMSCs移植组HGF表达量显著高于HIRI组, 表明BMSCs移植后HGF的表达量增加, 促使肝细胞的增殖与再生, 抑制细胞凋亡, 进一步改善肝细胞纤维化, 从而修复HIRI.
总之, HIRI大鼠经尾静脉注射BMSCs后肝功能明显改善, 病理损伤程度明显减轻, 说明BMSCs移植可以减轻HIRI引起的肝损伤, 其机制可能是通过抑制氧自由基和TNF-α、IL-18等细胞因子的过度产生, 降低抗氧化物质的消耗, 稳定细胞膜及内环境以及通过诱导调节肝细胞纤维化因子α-SMA及促进肝细胞有丝分裂因子HGF的表达等途径减轻肝损伤, 更多的作用机制有待于进一步研究.
近年来干细胞及其"横向分化"特性的发现为多种消化系统疾病的治疗提供了一种新的思路. 多项实验表明骨髓间充质干细胞可以分化为肝细胞样细胞, 并具有较强的免疫调控能力. 这为肝脏缺血-再灌注损伤的治疗提供了一个新的研究方向.
徐泱, 副主任医师, 上海复旦大学附属中山医院
临床上多种疾病的发生、发展与缺血-再灌注密切相关, 目前针对缺血-再灌注的治疗仍然主要集中在药物治疗上, 如多种钙离子阻滞剂(如异搏定)、氧自由基清除剂(如超氧化物歧化酶、辅酶Q10等)以及中药(如丹参、茜草等)等, 对于细胞移植治疗的报道鲜见.
已有报道骨髓间充质干细胞移植可部分改善肝纤维化大鼠动物模型的肝脏组织病理损伤, 此外也有报道证实人脐带间充质干细胞移植对于急性肝衰竭具有一定程度的缓解作用.
目前干细胞的研究多集中其多向分化潜能上, 对于其免疫调控的研究不多, 事实上干细胞的免疫调控对于许多临床疾病的治疗同样具有重大的临床意义.
本文通过一系列的实验证实了骨髓间充质干细胞移植可通过降低血清肿瘤坏死因子-α、白介素-18水平和调节肝脏中肝细胞生长因子及α-平滑肌蛋白的表达等机制改善大鼠肝脏缺血-再灌注损伤, 对于下一步的临床应用奠定了良好的实验基础.
缺血-再灌注损伤: 指遭受一定时间缺血的组织细胞恢复血流(再灌注)后, 组织损伤程度迅速增剧的情况, 是广泛组织细胞损伤的主要发病机制.
本文研究骨髓间充质细胞移植对大鼠肝脏缺血-再灌注损伤的保护作用及机制, 研究角度有一定的创新.
编辑: 郭鹏 电编:都珍珍
| 1. | Zheng W, Men H, Li J, Xing Y, Wu B, Wang Z, Li J, Teng D, Shi Y, Li J. Global microRNA expression profiling of mouse livers following ischemia-reperfusion injury at different stages. PLoS One. 2016;11:e0148677. [PubMed] [DOI] |
| 2. | Bal A, Gonul Y, Hazman O, Kocak A, Bozkurt MF, Yilmaz S, Kokulu S, Oruc O, Demir K. Interleukin 18-binding protein ameliorates liver ischemia-reperfusion injury. J Surg Res. 2016;201:13-21. [PubMed] [DOI] |
| 3. | Tong Y, Ding XB, Chen ZX, Jin SQ, Zhao X, Wang X, Mei SY, Jiang X, Wang L, Li Q. WISP1 mediates hepatic warm ischemia reperfusion injury via TLR4 signaling in mice. Sci Rep. 2016;6:20141. [PubMed] [DOI] |
| 4. | Taghizadieh M, Hajipour B, Asl NA, Khodadadi A, Somi MH, Banei M. Combination effect of melatonin and dexamethasone on liver ischemia/reperfusion injury. Bratisl Lek Listy. 2016;117:47-53. [PubMed] |
| 5. | de Kroon LM, Narcisi R, Blaney Davidson EN, Cleary MA, van Beuningen HM, Koevoet WJ, van Osch GJ, van der Kraan PM. Activin receptor-like kinase receptors ALK5 and ALK1 are both required for TGFβ-induced chondrogenic differentiation of human bone marrow-derived mesenchymal stem cells. PLoS One. 2015;10:e0146124. [PubMed] [DOI] |
| 6. | Bi L, Wang G, Yang D, Li S, Liang B, Han Z. Effects of autologous bone marrow-derived stem cell mobilization on acute tubular necrosis and cell apoptosis in rats. Exp Ther Med. 2015;10:851-856. [PubMed] |
| 8. | Yuan S, Jiang T, Zheng R, Sun L, Cao G, Zhang Y. Effect of bone marrow mesenchymal stem cell transplantation on acute hepatic failure in rats. Exp Ther Med. 2014;8:1150-1158. [PubMed] |
| 9. | Qingqing M, Xin Z, Meizhong S. Bone marrow mesenchymal stem cells altered the immunoregulatory activities of hepatic natural killer cells. Clin Res Hepatol Gastroenterol. 2014;38:689-698. [PubMed] [DOI] |
| 10. | Dalakas E, Newsome PN, Boyle S, Brown R, Pryde A, McCall S, Hayes PC, Bickmore WA, Harrison DJ, Plevris JN. Bone marrow stem cells contribute to alcohol liver fibrosis in humans. Stem Cells Dev. 2010;19:1417-1425. [PubMed] [DOI] |
| 11. | Whiting L, Stewart KW, Hay DL, Harris PW, Choong YS, Phillips AR, Brimble MA, Cooper GJ. Glicentin-related pancreatic polypeptide inhibits glucose-stimulated insulin secretion from the isolated pancreas of adult male rats. Physiol Rep. 2015;3:pii: e12638. [PubMed] [DOI] |
| 12. | Shadrin KV, Morgulis II, Pahomova VG, Rupenko AP, Khlebopros RG. Characteristics of oxygen transport through the surface of the isolated perfused rat liver. Dokl Biochem Biophys. 2015;464:298-300. [PubMed] [DOI] |
| 13. | Sarikus Z, Bedirli N, Yilmaz G, Bagriacik U, Bozkirli F. The effects of epidural bupivacaine on ischemia/reperfusion-induced liver injury. Bratisl Lek Listy. 2016;117:41-46. [PubMed] |
| 14. | Xie Y, Hou W, Song X, Yu Y, Huang J, Sun X, Kang R, Tang D. Ferroptosis: process and function. Cell Death Differ. 2016;23:369-379. [PubMed] [DOI] |
| 15. | Guan L, Liu H, Fu P, Li Z, Li P, Xie L, Xin M, Wang Z, Li W. The protective effects of trypsin inhibitor on hepatic ischemia-reperfusion injury and liver graft survival. Oxid Med Cell Longev. 2016;2016:1429835. [PubMed] [DOI] |
| 16. | Go KL, Lee S, Zendejas I, Behrns KE, Kim JS. Mitochondrial dysfunction and autophagy in hepatic ischemia/reperfusion injury. Biomed Res Int. 2015;2015:183469. [PubMed] [DOI] |
| 17. | Pantazi E, Bejaoui M, Folch-Puy E, Adam R, Roselló-Catafau J. Advances in treatment strategies for ischemia reperfusion injury. Expert Opin Pharmacother. 2016;17:169-179. [PubMed] [DOI] |
| 18. | Strifler G, Tuboly E, Szél E, Kaszonyi E, Cao C, Kaszaki J, Mészáros A, Boros M, Hartmann P. Inhaled methane limits the mitochondrial electron transport chain dysfunction during experimental liver ischemia-reperfusion injury. PLoS One. 2016;11:e0146363. [PubMed] [DOI] |
| 19. | Wang Y, Liu ZS, Zhang SL, Diao QX, Ge YJ. Effect and Mechanism of Portal Blood Stasis Removal on Intestinal Endotoxemia and Hepatic Ischemia Reperfusion Injury. Transplant Proc. 2015;47:2752-2756. [PubMed] [DOI] |
| 20. | Yang HJ, Tang LM, Zhou XJ, Qian J, Zhu J, Lu L, Wang XH. Ankaflavin ameliorates steatotic liver ischemia-reperfusion injury in mice. Hepatobiliary Pancreat Dis Int. 2015;14:619-625. [PubMed] |
| 21. | Jia S, Liu X, Li W, Xie J, Yang L, Li L. Peroxisome proliferator-activated receptor gamma negatively regulates the differentiation of bone marrow-derived mesenchymal stem cells toward myofibroblasts in liver fibrogenesis. Cell Physiol Biochem. 2015;37:2085-2100. [PubMed] [DOI] |
| 22. | Lin J, Meng L, Yao Z, Chen S, Yang J, Tang Z, Lin N, Xu R. Use an alginate scaffold-bone marrow stromal cell (BMSC) complex for the treatment of acute liver failure in rats. Int J Clin Exp Med. 2015;8:12593-12600. [PubMed] |
| 23. | Lukashyk SP, Tsyrkunov VM, Isaykina YI, Romanova ON, Shymanskiy AT, Aleynikova OV, Kravchuk RI. Mesenchymal bone marrow-derived stem cells transplantation in patients with HCV related liver cirrhosis. J Clin Transl Hepatol. 2014;2:217-221. [PubMed] [DOI] |
| 24. | Guo CH, Han LX, Wan MR, Deng GJ, Gan JH. Immunomodulatory effect of bone marrow mesenchymal stem cells on T lymphocytes in patients with decompensated liver cirrhosis. Genet Mol Res. 2015;14:7039-7046. [PubMed] [DOI] |
| 25. | Zou Z, Cai Y, Chen Y, Chen S, Liu L, Shen Z, Zhang S, Xu L, Chen Y. Bone marrow-derived mesenchymal stem cells attenuate acute liver injury and regulate the expression of fibrinogen-like-protein 1 and signal transducer and activator of transcription 3. Mol Med Rep. 2015;12:2089-2097. [PubMed] [DOI] |
| 26. | Song YM, Lian CH, Wu CS, Ji AF, Xiang JJ, Wang XY. Effects of bone marrow-derived mesenchymal stem cells transplanted via the portal vein or tail vein on liver injury in rats with liver cirrhosis. Exp Ther Med. 2015;9:1292-1298. [PubMed] |
| 27. | 郑 盛, 肖 琼怡, 殷 芳. 骨髓间充质干细胞移植对急性肝功能衰竭大鼠肝组织miRNA-155和TNF-α表达的影响. 中华细胞与干细胞杂志(电子版). 2014;4:79-83. |
| 29. | Shiratsuki S, Terai S, Murata Y, Takami T, Yamamoto N, Fujisawa K, Burganova G, Quintanilha LF, Sakaida I. Enhanced survival of mice infused with bone marrow-derived as compared with adipose-derived mesenchymal stem cells. Hepatol Res. 2015;45:1353-1359. [PubMed] [DOI] |
| 30. | Wang X, Zhao W, Wang J, Shi K, Qin X, Kong Q, Wang G, Mu L, Li H, Sun B. Bone marrow stromal cells inhibit the activation of liver cirrhotic fat-storing cells via adrenomedullin secretion. Dig Dis Sci. 2015;60:1325-1334. [PubMed] [DOI] |
| 31. | Lim C, Broqueres-You D, Brouland JP, Merkulova-Rainon T, Faussat AM, Hilal R, Rouquie D, Eveno C, Audollent R, Levy BI. Hepatic ischemia-reperfusion increases circulating bone marrow-derived progenitor cells and tumor growth in a mouse model of colorectal liver metastases. J Surg Res. 2013;184:888-897. [PubMed] [DOI] |
| 32. | Jin G, Qiu G, Wu D, Hu Y, Qiao P, Fan C, Gao F. Allogeneic bone marrow-derived mesenchymal stem cells attenuate hepatic ischemia-reperfusion injury by suppressing oxidative stress and inhibiting apoptosis in rats. Int J Mol Med. 2013;31:1395-1401. [PubMed] [DOI] |
| 33. | Iswandana R, Pham BT, van Haaften WT, Luangmonkong T, Oosterhuis D, Mutsaers HA, Olinga P. Organ- and species-specific biological activity of rosmarinic acid. Toxicol In Vitro. 2016;32:261-268. [PubMed] [DOI] |
| 34. | Ma H, Shi X, Yuan X, Ding Y. IL-1β siRNA adenovirus benefits liver regeneration by improving mesenchymal stem cells survival after acute liver failure. Ann Hepatol. 2016;15:260-270. [PubMed] [DOI] |
| 35. | Wu JP, Ho TJ, Tsai CC, Yeh YL, Lin CC, Lin KH, Hsieh DJ, Chen LM, Pan LF, Huang CY. Hepatoprotective effects of traditional Chinese medicine on liver fibrosis from ethanol administration following partial hepatectomy. Chin J Physiol. 2015;58:393-403. [PubMed] [DOI] |