修回日期: 2016-02-26
接受日期: 2016-03-08
在线出版日期: 2016-04-08
目的: 为高效便捷地去除细胞培养过程中支原体污染, 采用多种抗生素和检测方法对污染细胞进行处理和检测.
方法: 分别采用Plasmocin、BM-Cyclin、MRA3种药物对污染细胞进行处理, 以CLARK的一步法试剂、Biotool的快速检测试剂和自行研制的聚合酶链式反应(polymerase chain reaction, PCR)等3种方法进行检测.
结果: 一步法试剂检测显示Plasmocin处理14 d后支原体消除, 快速检测试剂检测显示BM-Cyclin处理21 d彻底消灭支原体, 而MRA经PCR检测发现彻底消除支原体需要14 d; 另外, 3种药物交替使用清除支原体的效果更加显著.
结论: 通过使用3种抗生素和3种支原体检测方法, 使细胞培养过程中的支原体污染得到有效控制, 为更好地开展细胞研究奠定基础.
核心提示: 在细胞培养过程中易出现支原体污染且不易消除, 对后续科研产生严重影响. 本实验用3种抗生素清除支原体及3种方法进行检测, 最终清除支原体, 并且发现3种抗生素交替使用效果更佳, 在用聚合酶链式反应检测支原体时, 对条件加以优化, 并且测序确定支原体类型, 使支原体的检测更加简便、准确.
引文著录: 邢龙彬, 刘长政, 焦晓磊, 刘彤, 杜智, 高英堂. 细胞培养过程中支原体污染的防治与检测方法. 世界华人消化杂志 2016; 24(10): 1557-1564
Revised: February 26, 2016
Accepted: March 8, 2016
Published online: April 8, 2016
AIM: To eliminate and detect the contamination of mycoplasma during cell culture effectively.
METHODS: Three drugs (plasmocin, BM-Cyclin, and MRA) were used to treat the contaminated cells. CLRAK One Step Test Kit, Biotool Detection Kit and polymerase chain reaction (PCR) were used to detect the degree of contamination.
RESULTS: Plasmocin, BM-Cyclin, and MRA could eliminate the contamination effectively. Assay with the CLARK Kit showed that mycoplasma disappeared completely on 14th day after treatment with plasmocin, the Biotool Detection Kit showed that the contamination disappeared completely on the 21st day after treatment with BM-Cyclin, and PCR showed that mycoplasma disappeared completely on the 14th day after treatment with MRA. The combination of the three drugs was more effective in the eradication of mycoplasma contamination.
CONCLUSION: The combination of three antibiotics and three mycoplasma detection methods can effectively control mycoplasma contamination during cell culture.
- Citation: Xing LB, Liu CZ, Jiao XL, Liu T, Du Z, Gao YT. Treatment and detection of mycoplasma contamination during cell culture. Shijie Huaren Xiaohua Zazhi 2016; 24(10): 1557-1564
- URL: https://www.wjgnet.com/1009-3079/full/v24/i10/1557.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i10.1557
支原体污染在细胞长期培养过程中经常出现且不易消除, 据调查及研究显示, 实验室30%-60%细胞都被支原体污染过[1], 其中95%以上是由口腔支原体(M.orale)等5种造成[2]. 支原体污染初期, 高倍镜下观察细胞无明显变化但有细小黑色颗粒; 随培养时间延长, 尽管培养液不浑浊, 但pH值变化明显、颜色变黄, 在污染后期引起细胞变形, 对后续科研产生严重影响[3], 因此在细胞培养过程中进行支原体检测与防治十分必要.
细胞被支原体污染后清除工作特别困难, 常见的去除支原体方法包括裸鼠过继法[4]、克隆法[5,6]、加热去除法[5]以及药物处理方法[7]等. 裸鼠过继法操作比较繁琐, 易造成裸鼠细胞污染; 克隆法只适用污染较轻的细胞; 由于支原体对热耐受性较差, 将细胞置于41 ℃加热5-10 h(依据细胞本身的耐热性确定作用时间)以杀灭支原体. 由于上述方法的局限性, 目前实验室大多采用抗生素进行处理并取得较好的效果, 最有效抑制支原体活性的抗生素主要为四环素类、大环内酯类等[8].
常见的支原体检测方法有直接培养法[9]和间接法, 其中间接法包括DNA荧光染色法[10]、DNA杂交法[11]、酶联免疫吸附试验法(enzyme-linked immunosorbent assay, ELISA)、免疫荧光试验、电镜观察[8]和聚合酶链式反应(polymerase chain reaction, PCR)方法[12]等. 由于这些方法各自的局限性, 在此基础上相关公司开发了多种快速检测试剂, 如CLARK的一步法支原体检测试剂主要利用恒温扩增与显色技术, 操作简单、结果可靠; Biotool的快速支原体检测试剂利用与支原体分泌的特定代谢物反应而显色, 整个操作过程比较简捷.
基于以上对支原体防治及检测方法的了解, 本研究先后采用3种抗生素(Plasmocin、BM-Cyclin、MRA)进行支原体进行清除, Plasmocin含有大环内酯类和喹诺酮类2种有效成分, BM-Cyclin中包含泰妙菌素和二甲胺四环素, MRA属于喹啉家族的衍生物. 同时利用2种试剂盒以及优化的PCR方法对实验室发生的支原体污染进行检测和控制.
实验中所用细胞均来自天津市第三中心医院所培养的30例患者的原代肿瘤细胞及传代细胞(对其进行相应的命名, 数字代表患者编号, T代表细胞来源于肝癌组织, N代表细胞来源于癌旁组织). 以及实验室购买的HepG2细胞, 每例标本含1-3瓶细胞, 共计80瓶. 所有标本取材均通过天津市第三中心医院伦理委员会审核, 家属知情同意并签字. 细胞培养所用的培养液D-MEM/F-12由美国Invitrogen公司生产, 血清均由以色列Biological Industries公司生产, Liver Digest Medium(肝裂解液)采购于美国Life公司; CLARK支原体一步快速检测试剂盒(One step Mycoplasma test Kit)购自美国CLARK Bioscience公司, 快速支原体检测试剂盒(Mycoplasma Detection Kit-Quick Test)购自美国Biotool公司; Lysis Buffer for Microorganism to Direct PCR购自中国TaKaRa公司; MRA(Mycoplasma Removal Agent)采购于美国Mpbio公司, PlasmocinTMtreatment采购法国InvivoGen公司, BM-Cyclin由瑞士Roche公司生产.
1.2.1 细胞培养: 将肿瘤组织放置培养皿中, 经生理盐水清洗, 将肝裂解液用注射器点状注射消化组织, 用手术剪剪碎, 充分吹打, 将细胞悬液过40 μm滤网, 1000 r/min离心去上清; 加入5 mL的溶血素37 ℃静置10 min去红细胞, 1000 r/min离心弃上清获得细胞. 将细胞接种于25 cm2培养瓶中, 加入D-MEM/F-12培养液: 含5%胎牛血清、100 U/mL青霉素、100 U/mL链霉素, 置于37 ℃、50 mL/L CO2培养箱中培养. 通过反复差速消化、差速贴壁的方式不断纯化癌细胞.
1.2.2 3种抗生素的使用: (1)Plasmocin: 将其按照1:1000比例加入细胞培养液中, 培养3-4 d后更换新的含有Plasmocin的培养液, 共处理14 d; (2)BM-Cyclin: 将BM-Cyclin1与BM-Cyclin2中加入10 mL PBS进行溶解, 分装储存在-20 ℃. 按照1:250比例加入细胞培养液中, BM-Cyclin1工作液处理3 d后更换BM-Cyclin2工作液再处理4 d, 处理周期为2-3个循环(14-21 d); (3)MRA: 按1:1000的比例进行使用, 持续培养可达7 d, 根据需要更换新的含有MRA的培养液至14 d. 加药前留取细胞培养液, 检测结果即为0 d污染情况.
1.2.3 一步支原体检测试剂盒使用: 取25 μL一步法检测试剂加入检测管中, 取1 μL待检测细胞的培养液加入检测管中混匀, 65 ℃水浴30-60 min, 与阳性对照管进行颜色比较, 显示蓝色时判定支原体阳性.
1.2.4 快速支原体检测试剂盒使用: 首先在每孔中加入40 μL反应液A, 依此加入10 μL阴性对照、阳性对照以及待检测样本, 轻轻混匀, 室温孵育5 min; 所有孔中均加入40 μL反应液B, 轻轻混匀, 室温孵育4 min后立即观察样品颜色的变化, 支原体阳性为蓝绿色, 阴性为浅黄色.
1.2.5 支原体PCR检测: (1)引物设计: 基于常见支原体16S-23S间隔区保守序列设计引物(表1); (2)模板制备: 包括煮沸法与裂解法(Lysis Buffer for Microorganism to Direct PCR). 煮沸法: 取50 μL细胞培养液, 100 ℃煮沸10 min, 12000 r/min离心10 min; 留取上清作为模板; 裂解法: 取50 μL微生物PCR裂解缓冲液, 加入10 μL细胞培养液充分混匀. 80 ℃水浴15 min, 8000 r/min离心10 min, 取2 μL上清作为模板; (3)PCR反应: 反应体系包括Tap酶1 μL、上/下游引物各0.5 μL、PCR预混液20 μL、模板2 μL, 总计24 μL; 反应条件: 94 ℃ 5 min, 94 ℃ 45 s, 54 ℃ 30 s, 72 ℃ 45 s, 35个循环, 72 ℃ 5 min. 取10 μL PCR产物进行2.5%琼脂糖凝胶电泳分析并拍照.
| 名称 | 引物序列 | 引物序列(5'-3') | 片段大小(bp) |
| 引物对1 | MP-1381 | F: A(A/C)ACCATGGGAG(C/T)TGGTAAT | 360-500 |
| MP-2096 | R: TTCATCGACTTTCAGACCCAAGGCAT | ||
| 引物对2 | MP-1058 | F: GTG(C/G)GG(A/CTGGA(T/A)(C/T)ACCTCCT | 236-365 |
| MP-2074 | R: GGCATTCCACCA(A/C)A(A/T)AC(C/T)CTT |
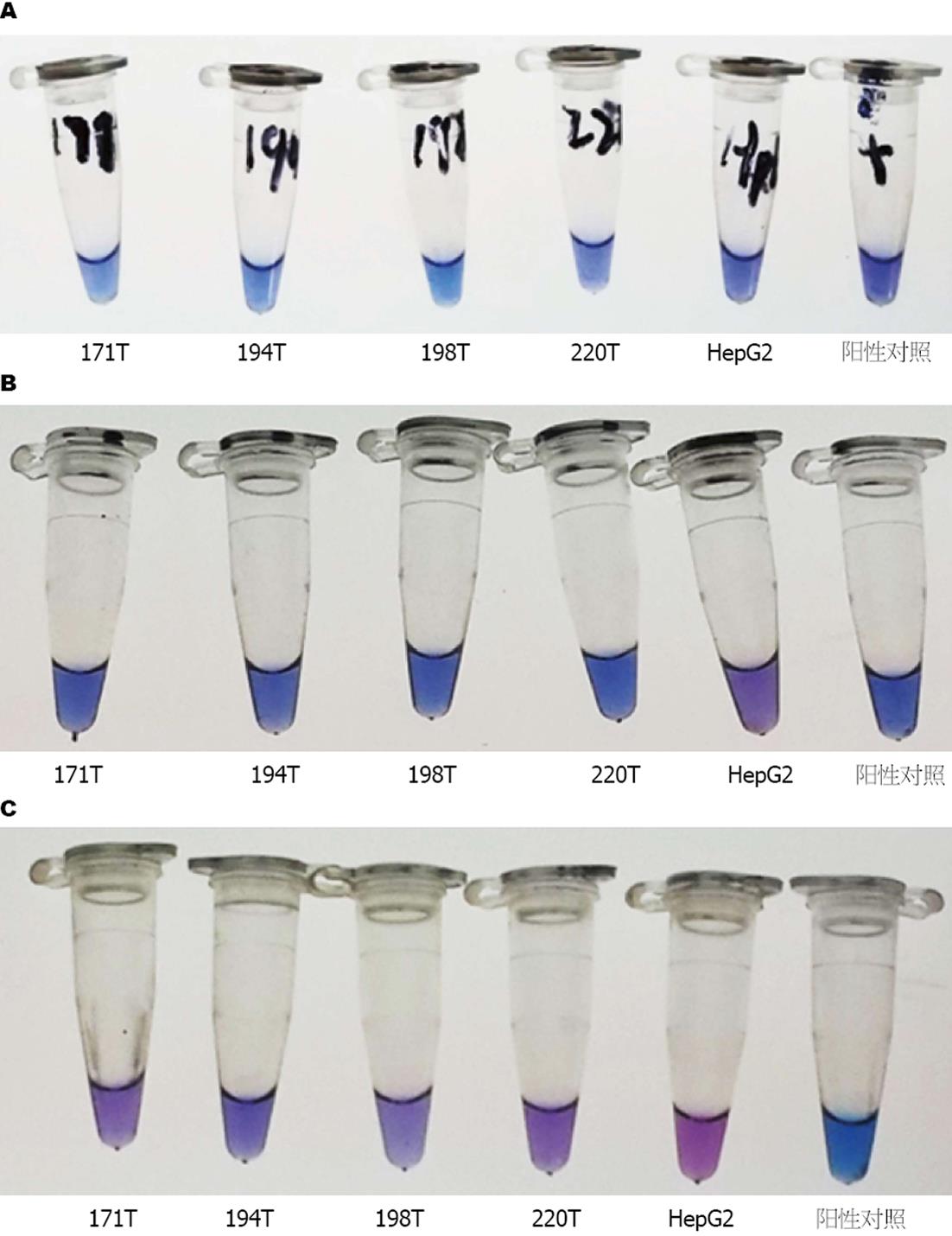
将Plasmocin按1:1000比例加入细胞培养液中, 并在处理前以及处理后7、14 d分别用一步支原体检测试剂盒检测细胞上清液; 检测结果显示药物处理7 d后80瓶细胞只有HepG2等14瓶细胞转为阴性, 其他细胞污染情况减轻不明显, 处理14 d后72瓶细胞支原体被清除, 8瓶细胞仍疑似污染. 处理过程中随机选取5瓶支原体污染阳性的细胞进行拍照, 结果显示处理14 d后194T仍疑似污染, 其他4瓶细胞支原体均被清除(图1).
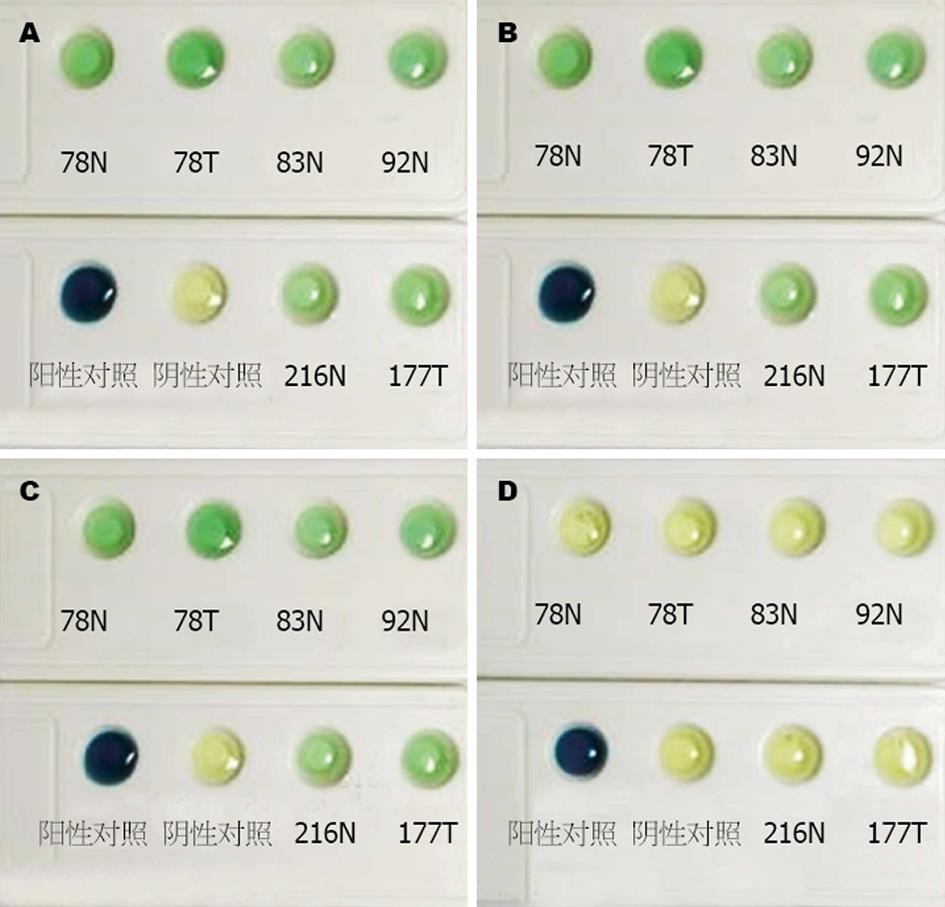
分别留取BM-Cyclin处理前以及处理后7、14、21 d的细胞培养液, 80瓶细胞用快速支原体检测试剂盒进行检测, 通过与阴性/阳性对照对比得知, BM-Cyclin处理7 d与14 d后检测结果颜色逐渐变浅, 但未完全与阴性对照一致, 处理21 d后的细胞上清液经检测与阴性对照结果一致, 支原体污染转为阴性, 随机选取6瓶支原体污染阳性的细胞进行拍照(图2).
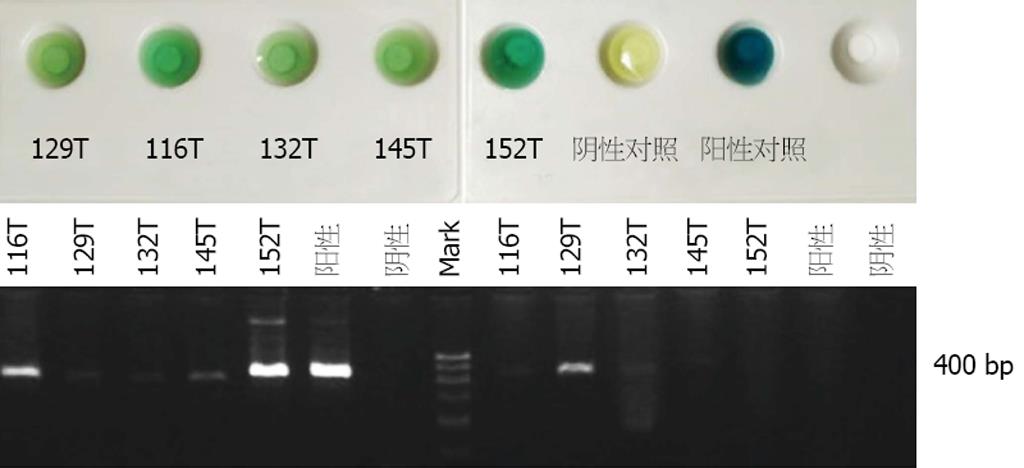
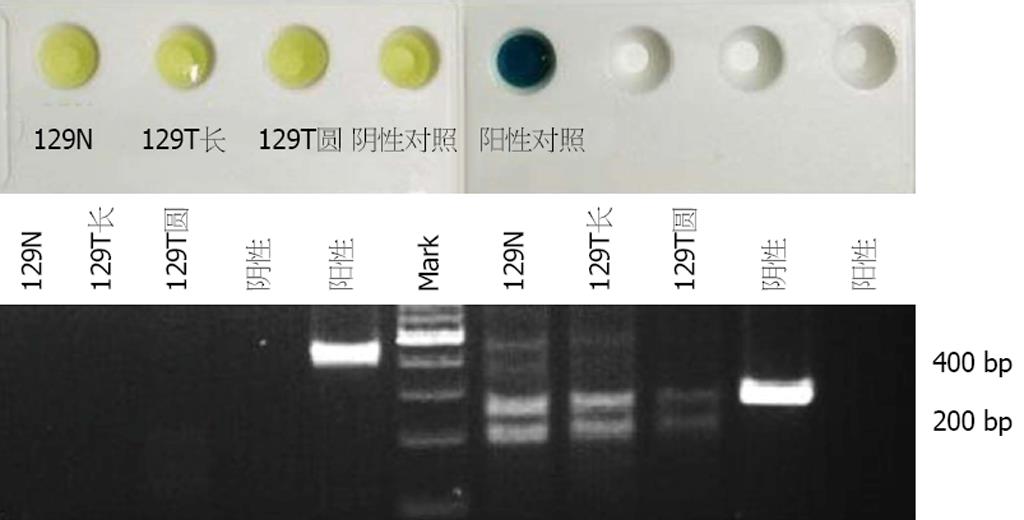
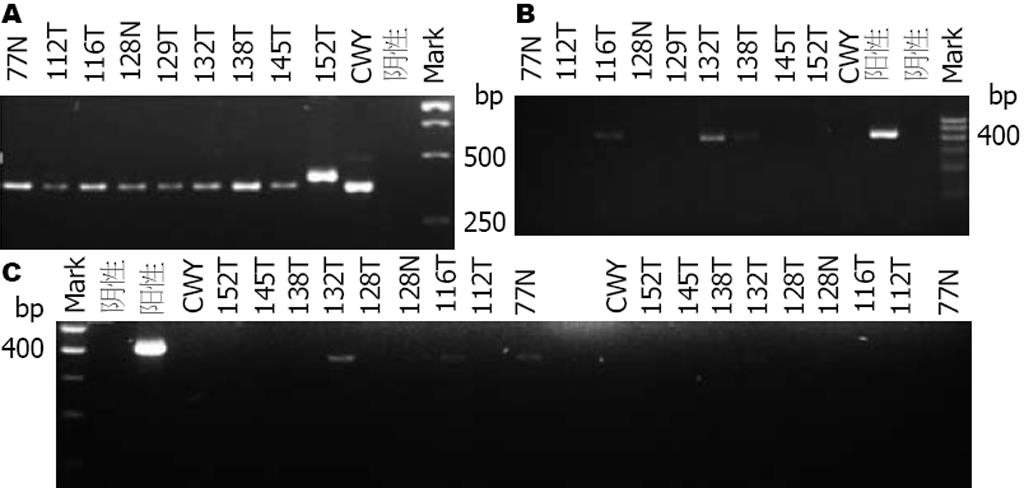
2.3.1 PCR方法的优化: (1)模板的两种不同制备方法的比较: 快速支原体检测试剂盒检测支原体阳性的5例细胞培养液分别采用煮沸法与裂解法处理, 用引物对1进行PCR扩增. 结果显示煮沸法扩增的116T、152T显示强阳性, 129T、132T、145T显示阳性, 与试剂盒检测结一致. 裂解法显示116T、129T、132T弱阳性, 145T、152T阴性, 阳性对照变为阴性, 因此煮沸法灵敏度更高(图3); (2)2种不同引物对扩增结果的可信度比较: 快速支原体检测试剂盒检测支原体污染阴性的3例细胞培养液采用煮沸法制备PCR模板, 分别用2种不同引物对进行扩增, 引物对1扩增结果与一步支原体检测试剂盒检测结果一致, 而引物对2扩增结果均为2条带, 推测为假阳性(图4). 将试剂盒方法与PCR方法(引物对1为引物)检测共阳性的4例扩增产物测序验证, BLAST分析表明其与Mycoplasma yeatsii序列一致, 证明PCR方法的可靠性, 并能确定实验室污染的支原体类型.
2.3.2 PCR方法检测支原体去除试剂MRA的处理效果: 在细胞培养液中加入去支原体试剂MRA, 且在处理前以及处理后7、10、14 d后分别细胞培养液进行留样, 采用煮沸法制备模板、引物对1进行扩增, 电泳结果显示MRA试剂处理后效果显著. 如图5所示随机挑取的10瓶支原体污染阳性细胞拍照, 处理前检测结果显示10瓶细胞细胞均被支原体污染, 检测结果显示阳性; 处理7 d后样本中116T、132T、138T显示阳性; 处理10 d后样本, 77N、116T、132T显示弱阳性, 处理14 d后全部均转变为阴性(图5).
由于在Plasmocin处理过程中有8瓶细胞疑似处理不彻底, 改用抗生素BM-Cyclin进行连续处理, BM-Cyclin处理7 d后8瓶细胞支原体污染彻底清除. 另外, 在近4 mo使用抗生素清除支原体的过程中, 我们发现同一种抗生素使用次数过多或时间超过6 wk时, 一些细胞会出现耐药性, 此时更换另一抗生素能够更有效地彻底清除支原体, 表明不同抗生素交替使用效果显著.
支原体是一种介于细菌和病毒之间的能独立生存的最小微生物之一, 直径0.1-0.3 μm, 无细胞壁, 具有可塑性, 可通过滤菌器(0.22 μm); 并且由于其对多种抗生素耐药使其更加难以清除, 这也是细胞培养过程中易于污染的一个重要因素[13]. 虽然支原体污染初期的细胞培养液不发生浑浊, 细胞无明显变化, 外观上给人以正常感觉, 实则细胞受到多方面潜在影响, 比如, 支原体吸附在细胞表面, 破坏细胞膜的完整性, 影响细胞信号传递; 消耗细胞的核苷库, 引起细胞染色体异常等. 因此, 支原体污染会给细胞研究工作带来巨大危害[14], 这就要求研究人员必须对支原体污染提高警惕.
本实验中采用的3种抗生素所含有效成分各不相同, 其作用原理也有所区别. MRA属于抗生素喹啉家族的衍生物, 主要通过抑制DNA促旋酶清除支原体污染, 该酶是支原体DNA复制过程中必不可少的酶类; MRA活性在细胞培养液中可以维持长达7 d, 由于其只含有一种有效成分, 可能存在某种类型支原体对其不敏感现象[15]; BM-Cyclin含有泰妙菌素(BM-Cyclin1)和二甲胺四环素(BM-Cyclin2)两种有效成分, 能够有效抑制支原体生长, 其中泰妙菌素与支原体核糖体的肽基转移酶中心结合, 导致多肽链起始复合物不能正确地装配, 从而导致支原体无法合成自身蛋白质; 而二甲胺四环素抑菌原理是与原核生物核糖体30S亚基的A位置结合, 阻止肽链的延长, 从而抑制支原体的蛋白质合成. 但是这2种成分各自分开使用, 作用功能相似, 操作比较复杂[12]. Plasmocin包括大环内酯类和喹诺酮类这两种新的杀菌成份, 前者作用于原核细胞的蛋白系统, 后者能干扰DNA的复制, 二者结合能更高效地去除支原体感染[16]. 为了使3种抗生素发挥最大功效, 必须采用现用现配方式. 在实验中我们发现77N加药处理7 d后支原体清除, 但10 d后支原体污染又显示阳性, 这提醒我们即使检测结果显示支原体污染由阳性转为阴性, 并不能立即停药, 需再继续加药处理以防支原体死灰复燃. 另外, 值得我们注意的是如果长时间使用同种抗生素对支原体进行处理, 会使支原体产生耐药性, 因此为了防止支原体产生抗药性, 需采取不同药物轮流对细胞进行处理[17], 在实验中比较发现不同抗生素交替使用的处理效果更加显著.
目前有多种方法检测支原体, 本研究采用两种进口试剂和自制的PCR方法进行检测. 一步法支原体检测试剂整个过程只需一步, 检测结果颜色变化显著, 极易观察. 快速支原体检测试剂依据支原体特有的代谢产物进行显色反应, 阳性会产生蓝绿色, 代谢产物浓度越高, 颜色越深. 这两种进口试剂虽然比较简捷, 但不能区分支原体的具体种类, 长期使用成本较高. PCR作为一种简便快速、特异、灵敏的支原体检测方法已经在国内外广泛用于支原体污染的检测, 并且可以通过扩增产物的测序推断出支原体的种类; 但是PCR的高灵敏度以及残留污染等也会带来假阳性结果, 因此采用这种方法时要严格控制污染以提高稳定性和可靠性. 实验中我们优化了PCR检测方法, 并通过测序验证其检测结果的可靠性, 比较发现以PCR方法动态检测细胞培养过程中的支原体污染不失为一种高效的检测手段.
本文不足之处是尽管采用3种抗生素和3种检测方法使支原体污染得到有效控制, 但是对评价3种抗生素清除效果未做严格的实验设计, 其原因在于我们首次发现细胞遭受支原体污染时, 便立即采用Plasmocin进行处理, 处理14 d后发现仍有少数细胞疑似阳性, 甚至有的细胞出现复发感染, 于是结合文献再次购买两种含有不同有效成分的抗生素BM-Cylin与MRA进行处理, 同时为了提高检测结果的准确性, 又引入两种不同的检测方法.总结前面经验, 在支原体清除后并未立即停止用药, 而是选择继续使用2种抗生素交替对细胞进行处理一段时间, 最终支原体被清除且在很长时间内未复发.
为了吸取经验, 将支原体扼杀在源头, 我们在细胞培养过程中同时对细胞培养所用的血清、生理盐水、培养液等试剂和吸管、离心管等耗材进行支原体检测, 结果显示均为阴性, 由此推测支原体污染源可能来自实验室的培养环境, 因此, 我们采用BioMycoX®Mycoplasma Prevention Spray(预防喷雾)和CLARK LabCleaner预防支原体喷雾2种试剂定期处理细胞培养所需的整个实验室环境. 此外, 3种抗生素低浓度下也可作为支原体细胞预防液使用, 定期使用支原体预防液也是有效预防支原体污染的重要手段.
总之, 通过使用3种抗生素和3种支原体检测方法, 使细胞培养过程中的支原体污染得到有效控制. 我们从中总结经验方法, 希望能为更多实验室存在的潜在支原体污染提供有效的技术手段, 能够及早发现支原体污染并能够快速高效的进行清除, 为更好地开展各项细胞研究奠定基础.
感谢高英堂、刘长政、焦晓磊、刘彤及杜智在本实验过程中的帮助.
有报道实验室30%-60%细胞都被支原体污染过, 常见的去除支原体方法包括克隆法、加热去除法以及药物处理方法等, 常见的支原体检测方法有酶联免疫吸附试验法、电镜观察和聚合酶链式反应(polymerase chain reaction, PCR)方法等. 为了彻底清除细胞中的支原体污染, 本实验选取了3种支原体去除和3种检测方法, 最终清除支原体.
秦阳华, 主治医师, 上海长海医院实验诊断科
目前, 支原体的发现和清除仍然困扰着许多研究者, 各种试剂和方法各有利弊, 并且支原体被清除后, 仍会反复. 寻找一种快速简便的方法来清除和检测支原体仍然是很迫切的一个问题, 本文对此问题给出了较好的经验总结.
本文中实验采用含有3种不同成分的抗生素进行处理, 可以有效清除各种支原体, 并且不同抗生素交替使用效果更加, 解决了单一药物长期使用引起的支原体抗药性, 且支原体清除后不易复发. 3种检测方法均能快速准确检测支原体, 其中对PCR方法加以优化, 使检测更加快捷准确.
支原体: 又称霉形体, 为目前发现的最小的最简单的原核生物. 支原体细胞中唯一可见的细胞器是核糖体.
本文针对研究工作中常见的细胞支原体污染, 采用不同的清除试剂和检测方法, 探讨可行、便捷的支原体清除方法, 选题有意义.
编辑: 于明茜 电编:闫晋利
| 1. | Molla Kazemiha V, Bonakdar S, Amanzadeh A, Azari S, Memarnejadian A, Shahbazi S, Shokrgozar MA, Mahdian R. Real-time PCR assay is superior to other methods for the detection of mycoplasma contamination in the cell lines of the National Cell Bank of Iran. Cytotechnology. 2015; Mar 6. [Epub ahead of print]. [PubMed] [DOI] |
| 2. | Sung H, Kang SH, Bae YJ, Hong JT, Chung YB, Lee CK, Song S. PCR-based detection of Mycoplasma species. J Microbiol. 2006;44:42-49. [PubMed] |
| 3. | DesRochers TM, Kuo IY, Kimmerling EP, Ehrlich BE, Kaplan DL. The effects of mycoplasma contamination upon the ability to form bioengineered 3D kidney cysts. PLoS One. 2015;10:e0120097. [PubMed] [DOI] |
| 4. | Kreipe H, Radzun HJ, Keulers A, Parwaresch MR. An improved method for elimination of mycoplasmas from cell cultures. J Immunol Methods. 1987;103:185-188. [PubMed] [DOI] |
| 5. | 陈 琳. 细胞培养中支原体污染的检测和去除. 国外医学(微生物学分册). 1999;18:28-31. |
| 7. | Boslett B, Nag S, Resnick A. Detection and antibiotic treatment of Mycoplasma arginini contamination in a mouse epithelial cell line restore normal cell physiology. Biomed Res Int. 2014;2014:532105. [PubMed] [DOI] |
| 8. | Uphoff CC, Drexler HG. Elimination of mycoplasmas from infected cell lines using antibiotics. Methods Mol Biol. 2011;731:105-114. [PubMed] [DOI] |
| 9. | Amores J, Corrales JC, Martín AG, Sánchez A, Contreras A, de la Fe C. Comparison of culture and PCR to detect Mycoplasma agalactiae and Mycoplasma mycoides subsp. capri in ear swabs taken from goats. Vet Microbiol. 2010;140:105-108. [PubMed] [DOI] |
| 10. | Masover GK, Becker FA. Detection of mycoplasmas in cell cultures by fluorescence methods. Methods Mol Biol. 1998;104:217-226. [PubMed] [DOI] |
| 11. | Uphoff CC, Drexler HG. Detection of Mycoplasma contamination in cell cultures. Curr Protoc Mol Biol. 2014;106:28.4.1-28.4.14. [PubMed] [DOI] |
| 12. | Gopalkrishna V, Verma H, Kumbhar NS, Tomar RS, Patil PR. Detection of Mycoplasma species in cell culture by PCR and RFLP based method: effect of BM-cyclin to cure infections. Indian J Med Microbiol. 2007;25:364-368. [PubMed] |
| 13. | Drexler HG, Uphoff CC. Mycoplasma contamination of cell cultures: Incidence, sources, effects, detection, elimination, prevention. Cytotechnology. 2002;39:75-90. [PubMed] [DOI] |
| 14. | Lincoln CK, Gabridge MG. Cell culture contamination: sources, consequences, prevention, and elimination. Methods Cell Biol. 1998;57:49-65. [PubMed] [DOI] |
| 15. | Gignac SM, Uphoff CC, MacLeod RA, Steube K, Voges M, Drexler HG. Treatment of mycoplasma-contaminated continuous cell lines with mycoplasma removal agent (MRA). Leuk Res. 1992;16:815-822. [PubMed] [DOI] |
| 16. | Uphoff CC, Denkmann SA, Drexler HG. Treatment of mycoplasma contamination in cell cultures with Plasmocin. J Biomed Biotechnol. 2012;2012:267678. [PubMed] [DOI] |