修回日期: 2016-02-18
接受日期: 2016-02-29
在线出版日期: 2016-04-08
目的: 探讨溴结构域蛋白4(bromodomain-containing protein 4, BRD4)抑制剂JQ1对两种不同肝癌细胞系增殖、凋亡的影响.
方法: 用BRD4抑制剂JQ1处理HepG2, Bel-7402细胞株, 磺酰罗丹明B(sulforhodamine B, SRB)染色检测细胞活力; EdU(5-ethynyl-2'-deoxyuridine)嵌入和Hoechst 33342染色法检测细胞增殖; 以流式细胞术和Annexin V-FITC/PI双染法分别分析细胞周期、细胞凋亡; 最后用Western blot法观察JQ1介导抗增殖作用主要下调蛋白C-myc在蛋白水平上的变化, 进一步验证JQ1抑制肝癌细胞增殖的作用. 同时探讨JQ1与目前肝癌细胞治疗药物甲苯磺酸索拉非尼片对肝癌细胞的比较和联合作用.
结果: BRD4抑制剂JQ1可以以剂量依赖的方式显著抑制HCC细胞系: HepG2细胞和 Bel-7402细胞的活力, 具体表现为: 抑制其细胞增殖; Annexin V-FITC/PI双染法分析发现能促进其凋亡; 同时C-myc蛋白表达的也被显著抑制. 与JQ1、索拉非尼片单药应用相比, 小剂量的JQ1与索拉非尼片联合应用, HCC细胞的生长抑制率增加, 凋亡率也增加, 提示BRD4抑制剂JQ1联合索拉非尼片对细胞生长的抑制作用要强于JQ1或索拉非尼片单独用药.
结论: BRD4抑制剂JQ1可能是一种潜在的可治疗肝细胞癌的新型药物.
核心提示: 溴结构域蛋白4(bromodomain-containing protein 4)抑制剂JQ1可显著抑制肝癌细胞活性, 此外与甲苯磺酸索拉非尼片(索拉非尼片)还具有联合作用, 我们首次发现JQ1可能是一种潜在的可治疗肝细胞癌的新型药物.
引文著录: 张婷, 乔雪, 杨纯. 溴结构域蛋白4抑制剂JQ1对肝癌细胞活性的影响. 世界华人消化杂志 2016; 24(10): 1501-1510
Revised: February 18, 2016
Accepted: February 29, 2016
Published online: April 8, 2016
AIM: To explore the effect of bromodomain-containing protein 4 (BRD4) inhibitor (JQ1) on the proliferation and apoptosis of two hepatocellular carcinoma cell lines.
METHODS: We used JQ1 to treat HepG2 and Bel-7402 cell lines. Cell viability was investigated by sulforhodamine B (SRB) staining. EdU incorporation assay and Hoechst 33342 staining were used to detect cell proliferation. Alteration of cell cycle and cell apoptosis were measured by flow cytometry. Early apoptosis was detected by Annexin V-FITC/propidium iodide double staining assay. Western blot was used to observe the level change of C-myc protein, because JQ1 mediates antiproliferative effect mainly by lowering its expression.
RESULTS: JQ1 significantly inhibited the viability of HCC cell lines HepG2 and Bel-7402. The inhibition was dose-dependent within a certain range. JQ1 inhibited cell proliferation as revealed by EdU incorporation assay. Annexin V-FITC/PI double staining analysis revealed that JQ1 can promote the cell apoptosis. JQ1 treatment significantly suppressed C-myc protein expression. Compared with JQ1 or sorafenib alone, sorafenib in combination with small dose of JQ1 more significantly inhibited HCC cell growth and increased apoptosis, suggesting that JQ1 and sorafenib have a synergistic effect.
CONCLUSION: BRD4 inhibitor JQ1 may be a potential new drug to treat hepatocellular carcinoma.
- Citation: Zhang T, Qiao X, Yang C. BRD4 inhibitor JQ1 inhibits viability of hepatocellular carcinoma cells. Shijie Huaren Xiaohua Zazhi 2016; 24(10): 1501-1510
- URL: https://www.wjgnet.com/1009-3079/full/v24/i10/1501.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i10.1501
肝细胞肝癌是原发性肝癌中最常见的类型, 平均生存期在6-20 mo[1,2]. 虽然人们投入了大量人力物力对其发生、发展及转移机制进行研究, 但在世界范围内, 目前肝细胞肝癌的发生率居第6位, 而死亡率则居所有肿瘤的第3位[3,4].
溴结构域蛋白4(bromodomain-containing protein 4, BRD4)属于溴化结构和BET家族蛋白, 与染色质乙酰化有关, 组蛋白乙酰化必须募集含有一个/多个乙酰基-赖氨酸结合模板/溴化结构域的蛋白, 即BET蛋白[5,6]. BRD4通过结合组蛋白诱导细胞的靶基因活化或抑制, 还可以结合乙酰化的非组蛋白, 来调控DNA复制、细胞周期及基因转录等其他细胞活动[7]. 因此, BRD4在肿瘤发生、发展中起着重要作用.
JQ1是一种小分子化合物, 是BET家族蛋白抑制剂, 可以竞争性结合于BRD4溴化结构, 阻止BRD4与乙酰化的赖氨酸结合. 已有研究[8-12]证明JQ1可抑制多发性骨髓瘤、卵巢癌、脑胶质瘤、胶质母细胞瘤、乳腺癌、中线癌等多种肿瘤生长. C-myc基因与肿瘤的发生、发展密切相关、他通过易位、扩增和突变、参与许多肿瘤癌变过程. 如多发性骨髓瘤、结肠癌、神经细胞瘤等[13,14]. 在淋巴瘤和白血病中, JQ1介导抗增殖作用的主要机制就是下调C-myc及其靶基因的表达[15,16]. 有研究[17]表明, 在急性髓样白血病, 用RNA干扰BRD4表达, 会导致C-myc表达下降. 因此, 我们想探究在肝癌细胞中JQ1的抗肿瘤效应是否与C-myc相关.
虽然目前临床上甲苯磺酸索拉非尼片对肝癌虽有一定的治疗效果, 但尚未达到令人满意的程度. 而截至目前, 尚未出现BRD4抑制剂JQ1对肝癌发病进程影响的研究, 因此本研究拟从JQ1对肝癌细胞的影响入手, 检测其对肝癌细胞活力的影响, 并观察了下游基因C-myc表达水平的改变, 同时探讨比较其跟索拉非尼片的联合和单独使用效果.
人肝癌细胞株HepG2、Bel-7402购自中科院上海细胞所; 索拉非尼片、JQ1购自美国Cayman公司; 小牛、胎牛血清购自南京凯基生物科技有限公司; DMEM液体培养基购自Hyclone公司; DMSO购自南京凯基生物科技有限公司; L-谷氨酰胺、磺酰罗丹明B蛋白染色法(SRB)、Hoechst 33342、TEMED购自Sigma公司; 胰蛋白酶购自GIBCO公司; 兔来源抗人C-myc多克隆抗体购自ABcam公司; 鼠来源抗人Actin抗体、细胞总蛋白抽提试剂盒、细胞周期与细胞凋亡检测试剂盒购自上海碧云天生物技术有限公司; BCA蛋白浓度测定试剂盒购自Pierce; PVDF膜购自Bio-Rad; Annexin V-FITC/PI凋亡检测试剂盒购自美国Roche公司; EdU(5-ethynyl-2'-deoxyuridine)增殖检测试剂购自广州锐博.
1.2.1 Western blot检测细胞C-myc蛋白: 按蛋白抽提试剂盒说明书提取贴壁培养细胞总蛋白. 用每个样本取1.0×106个细胞提取蛋白, 得到细胞总蛋白, 然后按照BCA蛋白浓度测定试剂盒中的操作步骤进行蛋白浓度测定. 配置10%SDS-PAGE, 上样, 电压积层胶90 V、分离胶110 V, 电泳. 电泳结束后采用湿转法将样品转移至PVDF膜, 电压30 V, 4 ℃, 12 h. 转膜结束后, 将PVDF膜放入含有5%脱脂奶粉的TBS中室温下封闭2 h. 加入含有5%脱脂奶粉的TBS配置的加兔抗人C-MYC(1:1000), 4 ℃过夜. TBS-T漂洗15 min×3次, TBS漂洗15 min×1次. 加入用含有5%脱脂奶粉TBS配置的HRP标记羊抗兔 IgG(1:1000)的二抗, 室温2 h. TBS-T漂洗15 min×3次, TBS漂洗15 min×1次, 将膜置于ECL显色液中(临用前A、B液等体积混匀), 室温1 min. 压片、曝光、显影.
1.2.2 磺酰罗丹明B蛋白染色法(SRB): 将处于对数生长期的细胞接种到96孔板中. 细胞于细胞培养箱内稳定培养24 h后, 按下述方案加入药物孵育: 一组实验加入不同浓度(0、0.05、0.1、0.2、0.5、1.0和2.0 μmol/L)JQ1处理细胞; 另一组实验用索拉非尼片(10 μmol/L)、JQ1(1 μmol/L)、JQ1+索拉非尼片处理细胞; 同时设空白对照组. 所有处理均设三复孔. 细胞在培养箱培养72 h后弃去培养液, 每孔加入10%冷TCA 200 μL固定细胞, 在4 ℃放置1 h, 蒸馏水洗涤3次, 于空气中自然干燥. 在每孔中加入由l%冰醋酸配制的SRB溶液100 μL, 室温染色30 min, 弃去上清, 随后用蒸馏水洗涤3次, 放置在空气中自然干燥. 加入10 mmol/L Tris水溶液150 μL/孔, 在酶标仪 = 515 nm波长下测A值. 计算平均值和标准差, 此实验重复3次以上. 细胞生长抑制率 = (对照组A值-给药组A值)/对照组A值×100%.
1.2.3 细胞增殖: 将HepG2细胞种入96孔板(2.0×104个/孔), 于培养箱中培养过夜. 实验组用BRD4抑制剂JQ1(2 μmol/L)处理细胞24 h, 对照组细胞仅加入0.1% DMSO培养24 h. 药物孵育结束后, 加入50 μmol/L的EdU在37 ℃继续孵育2 h. 40 g/L多聚甲醛在室温固定15 min, 使用0.5%曲拉通打孔15 min, Hoechst 33342染色10 min. 荧光显微镜观察, 随机计数5个高倍镜视野中细胞总数及EdU阳性细胞数, EdU(红), DNA合成; Hoechst33342(蓝), 核染色. 取平均值, 计算标记指数(增殖率 = EdU阳性细胞数/Hoechst33342染色细胞总数×100%).
1.2.4 流式细胞仪检测细胞周期: 将Bel-7402细胞分为实验组和对照组, 实验组加入2 μmol/L JQ1分别处理24、48 h, 对照组只加0.1% DMSO培养48 h, 而HepG2细胞实验组(加入2 μmol/L JQ1)和对照组(0.1% DMSO)均培养24 h. 倒去培养液, 胰酶适度消化细胞, 加入冰冷的PBS缓冲液将细胞轻轻吹打成单个细胞. 离心, PBS洗2遍, 用PBS重悬细胞, 一边振荡一边加入预冷的700 mL/L乙醇, 4 ℃固定过夜. 染色前细胞用PBS洗2遍, 沉淀重悬于PI染液中(50 μg/mL PI+200 μg/mL RNase A), 37 ℃避光染色30 min. 细胞经300目尼龙网过滤后, 上机检测; 样品分析测定及打印.
1.2.5 Annexin V和PI双染检测细胞凋亡: 取指数生长期细胞消化计数后按4×105个/孔接种于6孔细胞培养板中. 24 h后加入索拉非尼片(20 μmol/L)、JQ1(2 μmol/L)、索拉非尼片+JQ1分别处理HepG2细胞, 并设置对照组(0.1% DMSO). 72 h后用0.25%胰酶: 0.02%EDTA(1:1)消化, 加入冰冷的PBS缓冲液将细胞轻轻吹打成单个细胞, 与漂浮细胞混合, 离心待用. 用去离子水以4:1稀释结合缓冲液, 以结合缓冲液重悬细胞, 调整细胞浓度为1×106/mL. 用前瞬时离心Annexin V-FITC. 取100 μL细胞悬液于流式管中, 加入5 μL Annexin V-FITC和10 μL 20 μg/mL PI, 混匀. 混匀后于室温避光抚育15 min. 在反应管中加400 μL PBS, 用流式细胞仪检测, Annexin V+/PI-是早期凋亡细胞.
统计学处理 数据主要以mean±SD表示, 使用Graphpad InStat3.0和Graphpad Prism5.01软件进行统计分析和绘图, 用方差齐性检验进行样本均数间的比较, 方差相等时则采用t检验或One-way ANOVA分析. P<0.05表示差异具有统计学意义.
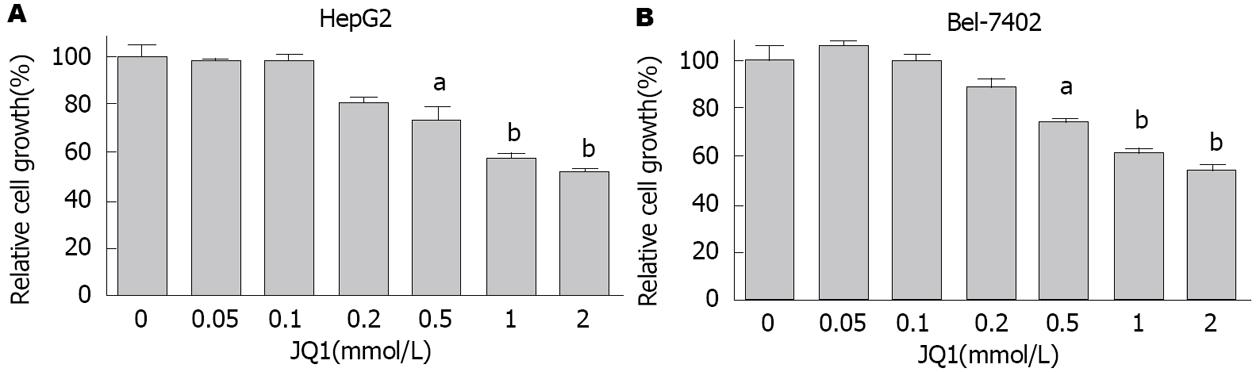
使用不同浓度的JQ1(0.05、0.1、0.2、0.5、1.0和2.0 μmol/L)处理HCC细胞72 h后检测细胞活力, 发现JQ1可以抑制HepG2细胞生长, 当JQ1剂量达到2 μmol/L时, HepG2细胞的生长抑制率为48.91%±1.17%, 统计分析显示, 在一定范围内JQ1对HepG2细胞的抑制作用具有剂量依赖性(P<0.0001)(图1A); 此外, JQ1对HCC细胞生长抑制作用也发生在Bel-7402细胞(图1B), JQ1剂量达到2 μmol/L时, Bel-7402细胞的生长抑制率为47.77%±2.80%, JQ1对Bel-7402细胞的抑制作用也具有剂量依赖性(P<0.0001).
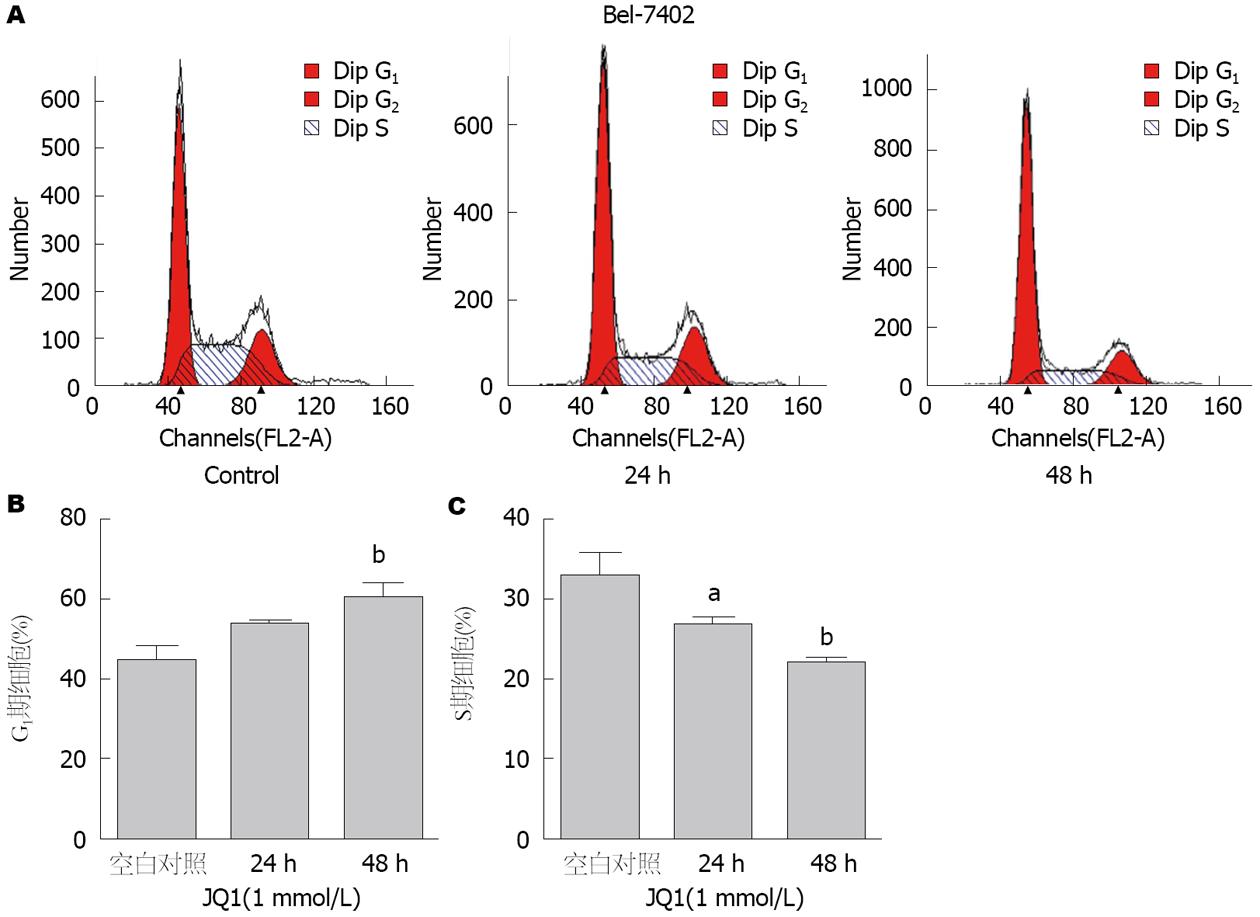
流式细胞仪分析BRD4抑制剂JQ1对Bel-7402细胞周期分布的影响如图2A. 对照组G1期细胞占44.01%±4.04%, JQ1处理24 h后, G1期细胞占53.33%±1.07%, 而JQ1处理48 h后则占60.51%±3.18%, JQ1使细胞阻滞在G1期(P<0.05). 单因素方差分析显示, JQ1对G1期的阻滞作用具有时间依赖性(P = 0.0017, P<0.01)(图2B). 对照组S期细胞占32.71%±2.80%, JQ1处理24、48 h后, 分别为26.54%±0.94%, 21.69%±0.68%, JQ1抑制细胞进入S期(P<0.05), 且具有时间依赖性(P = 0.0008, P<0.01)(图2C).
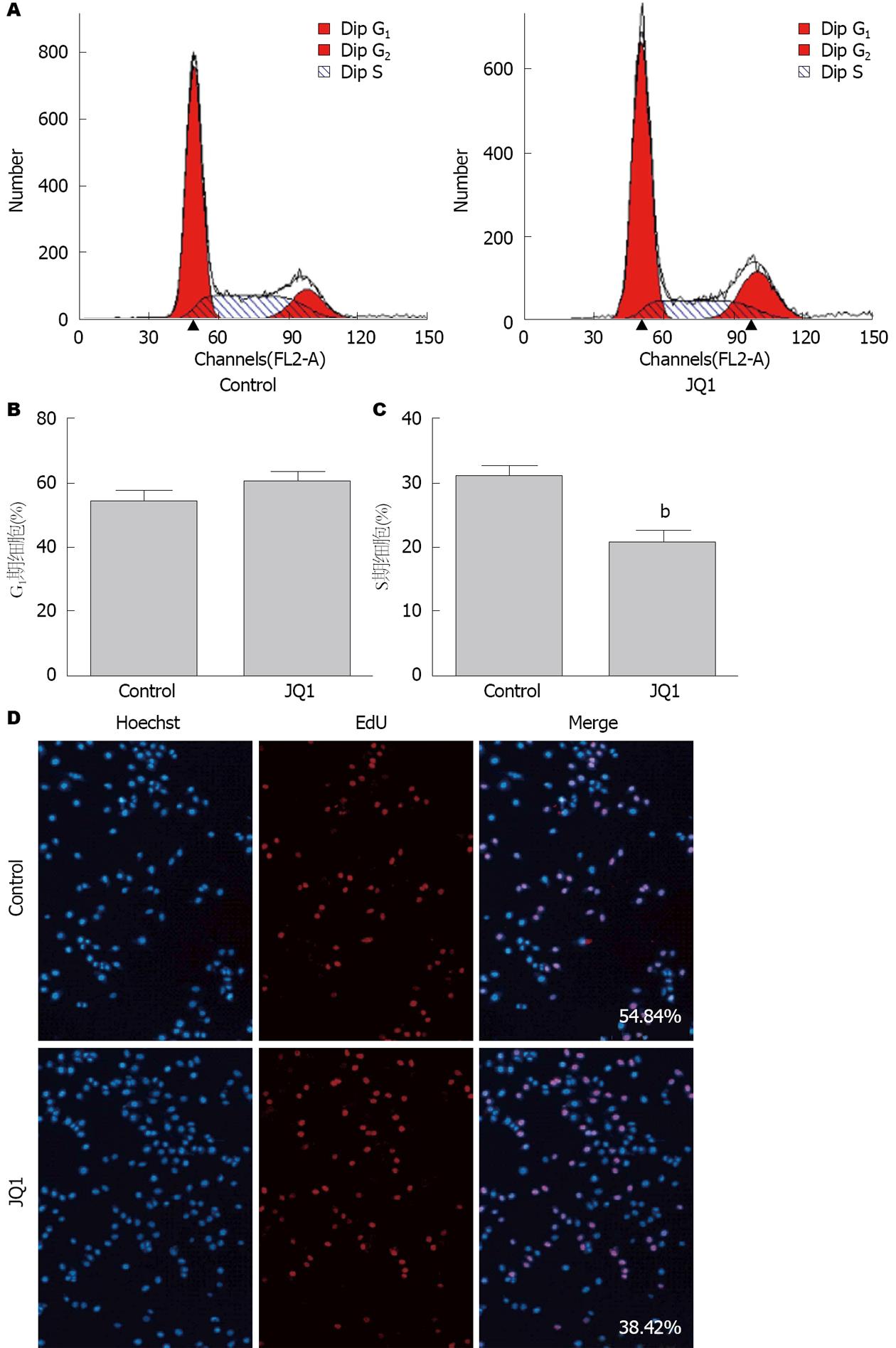
流式细胞仪分析BRD4抑制剂JQ1对HepG2细胞周期分布的影响如图3A. 经JQ1处理24 h后, G1期细胞占60.20%±2.98%, S期细胞占20.75%±1.94%, 而对照组G1%占53.90%±3.59%, S%占31.0%±1.65%, JQ1能抑制细胞进入S期(t = 6.970, P<0.01)(图3B, C). EdU能在细胞增殖时期代替胸腺嘧啶(T)渗入正在复制的DNA分子中, 通过检测EdU标记便能准确地反映细胞的增殖情况. 与阴性组(增殖率54.84%)相比, 实验组增殖率为38.42%, JQ1处理组可以抑制细胞增殖(图3D).
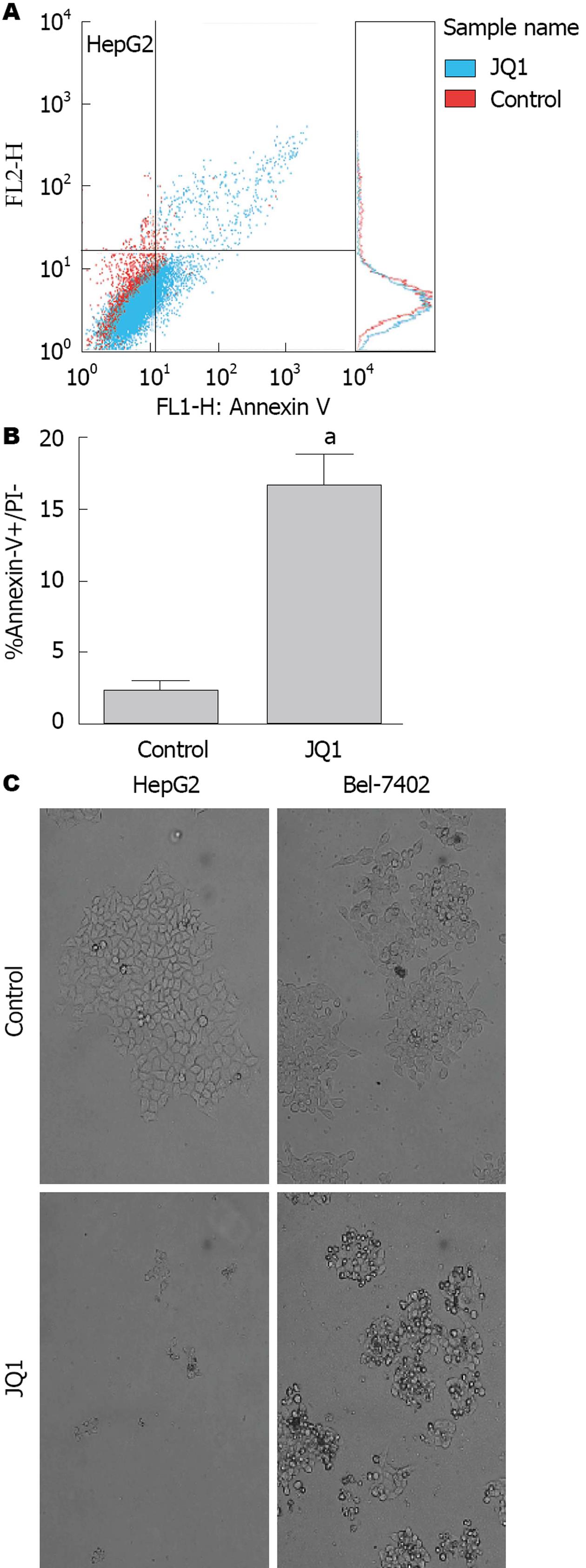
BRD4抑制剂JQ1对HCC细胞凋亡的影响如图4. 在JQ1(2 μmol/L)作用于HepG2细胞72 h后, 通过Annexin V-FITC/PI双染法测定细胞的凋亡率. 与对照组相比, 凋亡率有明显的增高, 两两比较差异有显著性意义(P<0.05), 说明JQ1诱导HepG2细胞凋亡(图4A, B). 选取HepG2和Bel-7402两种细胞, 用JQ1处理14 d, 显微镜下观察发现, 未加入JQ1的对照组细胞克隆性增殖形成细胞球, 而实验组HepG2细胞未形成细胞球, Bel-7402细胞虽形成细胞球, 但是体积较小, 且细胞出现变圆、甚至不贴壁而悬浮等凋亡样形态学改变(图4C).
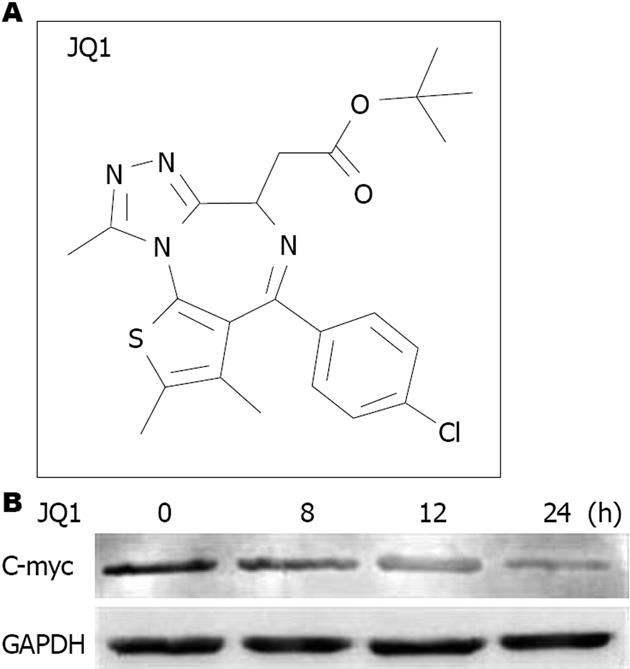
BRD4抑制剂对HepG2细胞C-myc蛋白表达水平的影响如图5. BRD4抑制剂JQ1化学结构如图5A所示, 使用2 μmol/L JQ1处理HepG2细胞不同时间(0、8、12、24 h), 发现JQ1处理8、12和24 h, 均可以抑制HepG2细胞C-myc蛋白表达; 并且这种抑制作用表现出时间依赖性, JQ1处理24 h后HepG2细胞仅表达极低水平的C-myc(图5B).
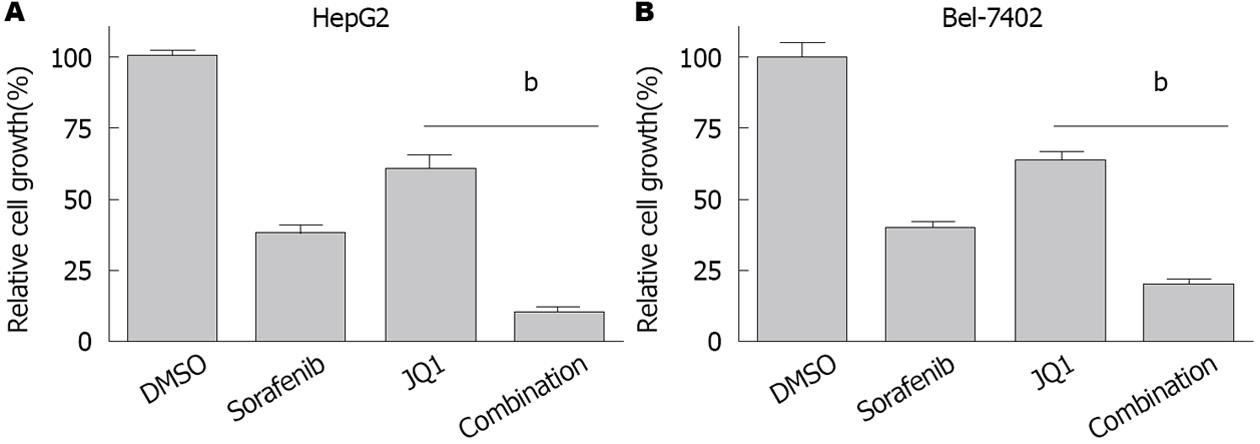
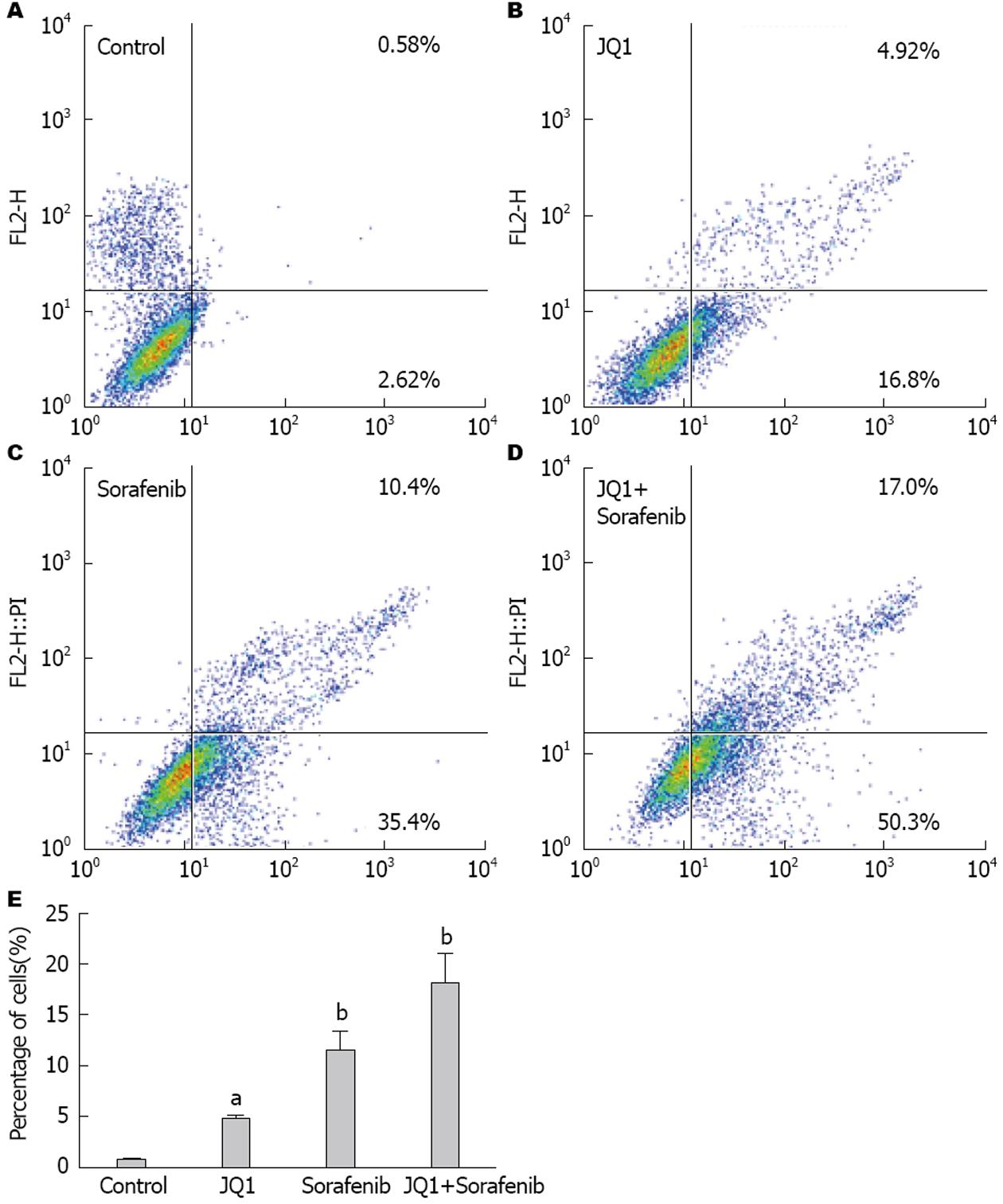
分别使用索拉非尼片(10 μmol/L)、JQ1(1 μmol/L)、JQ1+索拉非尼片处理HCC细胞72 h后检测细胞活力, 发现HepG2细胞对应的生长抑制率分别为60.45%±1.95%, 37.87%±2.81%, 79.49%±1.95%(P<0.05), 而Bel-7402细胞对应的生长抑制率分别为61.42%±2.44%, 35.53%±3.54%, 81.83%±2.28%(P<0.001)(图6), 提示JQ1增强索拉非尼片对HCC细胞的生长抑制作用; Annexin V-FITC/PI双染流式分析显示, JQ1(2 μmol/L)和索拉非尼片(20 μmol/L)单独用药72 h, HepG2细胞凋亡率(AnnexinV+/PI-)分别为16.8%, 35.4%, 联合用药凋亡率则为50.3%(图7), 提示JQ1增强索拉非尼片对HepG2细胞的凋亡作用. JQ1联合索拉非尼片可以更显著的抑制HCC细胞生长, 促进其凋亡.
肝细胞肝癌是我国常见的恶性肿瘤之一. 手术、化疗和放疗是目前治疗肝癌的三大常规方法. 由于肝癌起病隐匿, 早期缺乏特异性症状, 且病情发展快, 恶性程度高, 确诊时大多数患者已是局部晚期或已出现了远处转移[18-20], 不适合手术切除, 因此, 肝癌的药物治疗仍然不可或缺. 索拉非尼片是一种口服的多靶点、多激酶抑制剂, 已被临床证实具有明确疗效[18,21,22], 但总体疗效还不令人满意, 因此新的更有效的靶向药物仍有待进一步开发.
BRD4蛋白属于溴化结构和BET家族, 其结构包含两个溴化结构域, 可识别组蛋白氨基端(N端)的乙酰化赖氨酸残基, 调控一系列生物学行为: DNA复制、DNA修复、染色质重塑和转录调控[23-26]. 最近的研究[26-28]表明BRD4的表达水平失调或功能紊乱与急性髓系白血病、黑色素瘤、结肠癌、乳腺癌等肿瘤的发生有关, BET抑制剂或BRD4 shRNA可以诱导上述肿瘤发生细胞周期阻滞及凋亡等细胞生物学行为改变, 显示出强大的抗肿瘤活性. 因此BET蛋白有望成为上述肿瘤或其他肿瘤的治疗靶点, 那么, BET蛋白能否成为肝细胞肝癌的治疗新靶点值得研究.
JQ1是BRD4溴化结构的小分子抑制剂, 是一种硫二氮杂草类似物, 可竞争性结合于BRD4溴化结构域, 使BED4蛋白从乙酰化的赖氨酸结合位点分离, 抑制染色质活化, 从而抑制相应基因转录[29]. 有研究[8,10]称, JQ1对血液系统恶性肿瘤细胞活性有明显的抑制作用, 如多发性骨髓瘤、急性髓样白血病、Burkitt淋巴瘤和混合性白血病等. 而JQ1对肝癌的细胞的影响尚未明确. 在本实验中我们发现并初步证实了JQ1可抑制肝癌细胞增殖, 促进细胞凋亡.
C-myc基因通过易位、扩增和突变参与许多肿瘤癌变过程, 如多发性骨髓瘤、结肠癌、神经细胞瘤等[13,14]. 在淋巴瘤和白血病中, JQ1介导抗增殖作用的主要机制就是下调C-myc及其靶基因的表达[15,16]. 因此, 我们检测了经JQ1处理后肝癌细胞C-myc蛋白水平的表达. 本研究发现, 在肝癌细胞中, JQ1也可以下调C-myc蛋白及其DNA表达, 我们推测这可能是其抑制肝癌细胞生长的作用机制之一, 但更多具体机制还有待进一步研究.
同时在我们的体外实验可见, 索拉非尼片亦能显著抑制HepG2和Bel-7402细胞增殖, 促使其凋亡, 而JQ1联合索拉非尼片能增强这一抑制效应. 这一研究结果提示我们JQ1和索拉非尼片可能存在协同作用, 在肝癌治疗中也许能获得更好疗效果. 但是本研究只要是在细胞水平的初步探讨, 在实体瘤中是否有效, 还有待进一步验证. 另外还需要大量的动物和临床试验进一步证明.
肝细胞肝癌的死亡率居所有肿瘤的第3位. 溴结构域蛋白4(bromodomain-containing protein 4, BRD4)在肿瘤发生、发展中起着重要作用. BET家族蛋白抑制剂JQ1已有研究证明其可抑制多种肿瘤生长, 目前尚未出现BRD4抑制剂JQ1对肝癌发病进程影响的研究.
李晓武, 教授, 主任医师, 中国人民解放军第三军医大学西南医院肝胆外科研究所; 江建新, 教授, 主任医师, 湖北省肿瘤医院肝胆胰腺外科
虽然目前临床上甲苯磺酸索拉非尼片(索拉非尼片)对肝癌有一定的治疗效果, 但尚未达到令人满意的程度. 因此新的更有效的治疗药物仍然具有很大的研究和探索价值.
JQ1可抑制多发性骨髓瘤、卵巢癌、脑胶质瘤、胶质母细胞瘤、乳腺癌、中线癌等多种肿瘤生长. C-myc基因与肿瘤的发生、发展密切相关. 在淋巴瘤和白血病中, JQ1介导抗增殖作用的主要机制是下调C-myc及其靶基因的表达.
本文发现并初步证实了JQ1可抑制肝癌细胞增殖, 促进细胞凋亡. JQ1和索拉非尼片可能存在协同作用, 在肝癌治疗中也许能获得更好治疗效果. BRD4抑制剂JQ1可能是一种潜在的可治疗肝细胞癌的新型药物.
本文研究了JQ1对肝癌细胞的生长、凋亡, 细胞周期的影响, 并初步探究了JQ1作用的可能机制, 并结合了临床索拉非尼片的研究, 文章实验较为严谨, 图片证据丰富, 论据支持基本有力, 具有一定的科研意义.
编辑: 于明茜 电编:闫晋利
| 1. | Byam J, Renz J, Millis JM. Liver transplantation for hepatocellular carcinoma. Hepatobiliary Surg Nutr. 2013;2:22-30. [PubMed] |
| 2. | Franceschet I, Cazzagon N, Del Ross T, D'Incà R, Buja A, Floreani A. Primary sclerosing cholangitis associated with inflammatory bowel disease: an observational study in a Southern Europe population focusing on new therapeutic options. Eur J Gastroenterol Hepatol. 2016; Feb 11. [Epub ahead of print]. [PubMed] [DOI] |
| 3. | Bravi F, Bosetti C, Tavani A, Gallus S, La Vecchia C. Coffee reduces risk for hepatocellular carcinoma: an updated meta-analysis. Clin Gastroenterol Hepatol. 2013;11:1413-1421.e1. [PubMed] [DOI] |
| 4. | Qiao W, Yu F, Wu L, Li B, Zhou Y. Surgical outcomes of hepatocellular carcinoma with biliary tumor thrombus: a systematic review. BMC Gastroenterol. 2016;16:11. [PubMed] [DOI] |
| 5. | Rahman S, Sowa ME, Ottinger M, Smith JA, Shi Y, Harper JW, Howley PM. The Brd4 extraterminal domain confers transcription activation independent of pTEFb by recruiting multiple proteins, including NSD3. Mol Cell Biol. 2011;31:2641-2652. [PubMed] [DOI] |
| 6. | Jeng MY, Ali I, Ott M. Manipulation of the host protein acetylation network by human immunodeficiency virus type 1. Crit Rev Biochem Mol Biol. 2015;50:314-325. [PubMed] |
| 8. | Delmore JE, Issa GC, Lemieux ME, Rahl PB, Shi J, Jacobs HM, Kastritis E, Gilpatrick T, Paranal RM, Qi J. BET bromodomain inhibition as a therapeutic strategy to target c-Myc. Cell. 2011;146:904-917. [PubMed] [DOI] |
| 9. | Cheng Z, Gong Y, Ma Y, Lu K, Lu X, Pierce LA, Thompson RC, Muller S, Knapp S, Wang J. Inhibition of BET bromodomain targets genetically diverse glioblastoma. Clin Cancer Res. 2013;19:1748-1759. [PubMed] [DOI] |
| 10. | Mertz JA, Conery AR, Bryant BM, Sandy P, Balasubramanian S, Mele DA, Bergeron L, Sims RJ. Targeting MYC dependence in cancer by inhibiting BET bromodomains. Proc Natl Acad Sci USA. 2011;108:16669-16674. [PubMed] [DOI] |
| 11. | Li Z, Guo J, Wu Y, Zhou Q. The BET bromodomain inhibitor JQ1 activates HIV latency through antagonizing Brd4 inhibition of Tat-transactivation. Nucleic Acids Res. 2013;41:277-287. [PubMed] [DOI] |
| 12. | Baratta MG, Schinzel AC, Zwang Y, Bandopadhayay P, Bowman-Colin C, Kutt J, Curtis J, Piao H, Wong LC, Kung AL. An in-tumor genetic screen reveals that the BET bromodomain protein, BRD4, is a potential therapeutic target in ovarian carcinoma. Proc Natl Acad Sci USA. 2015;112:232-237. [PubMed] [DOI] |
| 13. | Yao W, Yue P, Khuri FR, Sun SY. The BET bromodomain inhibitor, JQ1, facilitates c-FLIP degradation and enhances TRAIL-induced apoptosis independent of BRD4 and c-Myc inhibition. Oncotarget. 2015;6:34669-34679. [PubMed] |
| 14. | Fowler T, Ghatak P, Price DH, Conaway R, Conaway J, Chiang CM, Bradner JE, Shilatifard A, Roy AL. Regulation of MYC expression and differential JQ1 sensitivity in cancer cells. PLoS One. 2014;9:e87003. [PubMed] [DOI] |
| 15. | Belkina AC, Denis GV. BET domain co-regulators in obesity, inflammation and cancer. Nat Rev Cancer. 2012;12:465-477. [PubMed] [DOI] |
| 16. | Coudé MM, Braun T, Berrou J, Dupont M, Bertrand S, Masse A, Raffoux E, Itzykson R, Delord M, Riveiro ME. BET inhibitor OTX015 targets BRD2 and BRD4 and decreases c-MYC in acute leukemia cells. Oncotarget. 2015;6:17698-17712. [PubMed] [DOI] |
| 17. | Zuber J, Shi J, Wang E, Rappaport AR, Herrmann H, Sison EA, Magoon D, Qi J, Blatt K, Wunderlich M. RNAi screen identifies Brd4 as a therapeutic target in acute myeloid leukaemia. Nature. 2011;478:524-528. [PubMed] [DOI] |
| 18. | Brade AM, Ng S, Brierley J, Kim J, Dinniwell R, Ringash J, Wong RR, Cho C, Knox J, Dawson LA. Phase 1 Trial of Sorafenib and Stereotactic Body Radiation Therapy for Hepatocellular Carcinoma. Int J Radiat Oncol Biol Phys. 2016;94:580-587. [PubMed] |
| 19. | Hato T, Zhu AX, Duda DG. Rationally combining anti-VEGF therapy with checkpoint inhibitors in hepatocellular carcinoma. Immunotherapy. 2016;8:299-313. [PubMed] |
| 20. | Ferlay J, Soerjomataram I, Dikshit R, Eser S, Mathers C, Rebelo M, Parkin DM, Forman D, Bray F. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012. Int J Cancer. 2015;136:E359-E386. [PubMed] [DOI] |
| 21. | El-Serag HB. Hepatocellular carcinoma. N Engl J Med. 2011;365:1118-1127. [PubMed] [DOI] |
| 22. | Wang G, Liu Y, Zhou SF, Qiu P, Xu L, Wen P, Wen J, Xiao X. Sorafenib combined with transarterial chemoembolization in patients with hepatocellular carcinoma: a meta-analysis and systematic review. Hepatol Int. 2016; Feb 8. [Epub ahead of print]. [PubMed] [DOI] |
| 23. | Muller S, Filippakopoulos P, Knapp S. Bromodomains as therapeutic targets. Expert Rev Mol Med. 2011;13:e29. [PubMed] [DOI] |
| 24. | Dawson MA, Kouzarides T, Huntly BJ. Targeting epigenetic readers in cancer. N Engl J Med. 2012;367:647-657. [PubMed] [DOI] |
| 25. | Crowe BL, Larue RC, Yuan C, Hess S, Kvaratskhelia M, Foster MP. Structure of the Brd4 ET domain bound to a C-terminal motif from γ-retroviral integrases reveals a conserved mechanism of interaction. Proc Natl Acad Sci USA. 2016;113:2086-2091. [PubMed] [DOI] |
| 26. | Nakagawa A, Adams CE, Huang Y, Hamarneh SR, Liu W, Von Alt KN, Mino-Kenudson M, Hodin RA, Lillemoe KD, Fernández-Del Castillo C. Selective and reversible suppression of intestinal stem cell differentiation by pharmacological inhibition of BET bromodomains. Sci Rep. 2016;6:20390. [PubMed] [DOI] |
| 28. | Ferri E, Petosa C, McKenna CE. Bromodomains: Structure, function and pharmacology of inhibition. Biochem Pharmacol. 2015; Dec 18. [Epub ahead of print]. [PubMed] [DOI] |