修回日期: 2015-11-29
接受日期: 2015-12-08
在线出版日期: 2016-01-08
目的: 探讨大肠癌患者人巨细胞病毒(human cytomegalovirus, HCMV)感染情况及其临床相关性.
方法: 采用化学发光(CLIA)法对大肠癌组(n = 60)、大肠息肉组(n = 60)及健康对照组(n = 60)的外周血清进行HCMV免疫球蛋白G(immunoglobulin G, IgG)、IgM抗体检测; 巢式PCR技术结合原位杂交方法检测32例大肠癌组织及癌旁正常肠黏膜组织中HCMV-UL138基因表达; 用Fisher确切概率法比较两组间阳性率, 均数比较采用t检验或单因素方差分析. P<0.05为差异有统计学意义.
结果: 大肠癌组、大肠息肉组、健康对照组血清HCMV-IgG阳性率为分别为95.0%(57/60)、98.3%(59/60)、96.7%(58/60); 血清HCMV-IgM阳性率分别为5.0%(3/60)、1.7%(1/60)、1.7%(1/60), 3组血清HCMV-IgG、IgM差异无统计学意义(P>0.05). 32例大肠癌组织巢式PCR检测HCMV-UL138阳性率为65.6%(19/32), 相应癌旁正常肠黏膜组织中为12.5%(4/32), 原位杂交法检测癌组织HCMV-UL138阳性率为62.5%(20/32), 癌旁正常肠黏膜组织中为9.4%(3/32), 大肠癌组织HCMV阳性检出率较癌旁正常组织显著升高(P<0.01). 未发现HCMV感染与大肠癌患者的年龄、性别、肿块位置、肿块大小、组织病理分化类型、转移及Dukes分期有显著性关联.
结论: 大肠癌组织中存在HCMV感染, 且HCMV相较于癌旁正常组织更倾向感染癌灶, 提示HCMV感染可能参与大肠癌的发生发展过程.
核心提示: 目前人类巨细胞病毒(human cytomegalovirus, HCMV)与大肠癌的关系的研究尚有争议. 以UL138为检测靶基因研究HCMV在大肠癌组织的表达情况尚未报道, 本研究使用新鲜标本采用巢式PCR结合原位杂交方法进一步验证 HCMV感染与大肠癌的关系.
引文著录: 叶梦思, 何云, 杨守醒, 林豪, 薛战雄, 蔡振寨. 人巨细胞病毒感染与大肠癌临床相关性. 世界华人消化杂志 2016; 24(1): 44-50
Revised: November 29, 2015
Accepted: December 8, 2015
Published online: January 8, 2016
AIM: To investigate the clinical relevance between human cytomegalovirus (HCMV) infection and colorectal cancer.
METHODS: The specific immunoglobulin G (IgG) and IgM antibodies against HCMV in sera of colorectal cancer patients (n = 60), patients with colorectal polyps (n = 60) and health controls (n = 60) were detected by chemiluminescence immunoassay. HCMV infection in colorectal cancer tissues and corresponding adjacent normal samples were determined through the detection of UL138 gene by nested PCR and in situ hybridization. The relationships between HCMV infection and clinical features of colorectal cancer were analyzed.
RESULTS: The positive rates of HCMV-IgG in the colorectal cancer group, colorectal polyps group and healthy control group were 95.0% (57/60), 98.3% (59/60), and 96.7% (58/60), respectively; the positive rates of HCMV-IgM were 5.0% (3/60), 1.7% (1/60) and 1.7% (1/60), respectively. There were no statistically significant differences in the positive rates of HCMV-IgG and HCMV-IgM among the three groups. However, there was a significant difference between colorectal cancer tissues and corresponding normal tissues in HCMV-UL138 detection. The positive rates of HCMV-UL138 were 65.6% (19/32) and 62.5% (20/32) in colorectal cancer tissues samples, and 12.5% (4/32) and 9.4% (3/32) in corresponding normal tissues as revealed by nested PCR detection and in situ hybridization, respectively. HCMV infection had no significant association with age, gender, location of mass, tumor size, histological differentiation, metastasis or Dukes stage.
CONCLUSION: HCMV infection is associated with colorectal cancer. Compared with corresponding normal epithelium, the neoplastic epithelium may be preferentially infected by the HCMV. This research suggests that HCMV infection may play a role in the occurrence and development of colorectal cancer.
- Citation: Ye MS, He Y, Yang SX, Lin H, Xue ZX, Cai ZZ. Clinical relevance between human cytomegalovirus infection and colorectal cancer. Shijie Huaren Xiaohua Zazhi 2016; 24(1): 44-50
- URL: https://www.wjgnet.com/1009-3079/full/v24/i1/44.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i1.44
随着人乳头瘤病毒疫苗预防宫颈癌的成功, 感染作为肿瘤的诱因引起了研究者的极大关注, 并成为目前肿瘤病因和发生机制研究的热点. 目前有报道, 链球菌、幽门螺旋杆菌、人乳头状瘤病毒、EB病毒及人类巨细胞病毒(human cytomegalovirus, HCMV)等病原体感染可能与癌相关[1]. 但目前HCMV与大肠癌关系的研究尚有争议. 本研究采用巢式PCR结合原位杂交的方法进一步验证HCMV与大肠癌的相关性.
60例经肠镜及组织病理学检查确诊的大肠癌患者(大肠癌组)血清采自2013-12/2015-02温州医科大学附属第二医院住院患者, 其中男36例, 女24例, 年龄34-79岁, 平均61.16岁±9.42岁; 60例经肠镜及组织病理学检查确诊的大肠息肉(大肠息肉组)患者血清采自同期, 其中男40例, 女20例, 年龄38-76岁, 平均63.22岁±8.63岁; 并在同时期温州医科大学附属第二医院健康体检中心收集60例(男33例, 女27例, 年龄30-78岁, 平均60.12岁±9.22岁)年龄性别相匹配的健康人群(健康对照组)血清. 所有血清标本于-20 ℃保存备用. 组织标本来自于同期在温州医科大学附属第二医院行手术治疗的大肠癌患者32例, 男20例, 女12例, 年龄34-78岁, 平均59.8岁±9.53岁. 每例标本留取肿瘤以及相应的癌旁正常肠黏膜组织(距肿瘤组织5 cm以上), 标本于离体后30 min内保存在液氮中备用. 所有患者术前均未行放、化疗等治疗.
1.2.1 血清HCMV免疫球蛋白G、免疫球蛋白M抗体检测: 采用德国罗氏公司Cobas 8000分析系统及配套试剂盒用化学发光法进行血清HCMV免疫球蛋白G(immunoglobulin G, IgG)、IgM抗体检测, 操作步骤严格参照试剂盒说明书, 空白对照、阴性对照及阳性对照均来自试剂盒.
1.2.2 大肠癌组织DNA提取: 标本DNA提取步骤参照组织基因组DNA提取试剂盒说明书(天根生化科技有限公司). 所有提取的组织DNA经分光光度计测浓度后保存于-20 ℃备用.
1.2.3 巢式PCR检测的大肠癌组织HCMV表达: 根据我们实验室先前报道[2]的引物, 由上海生工生物工程有限公司合成, 将提取的组织DNA进行巢式PCR鉴定. 第一轮PCR反应体系为: DNA模板1.0 μL, Kod-plus酶0.5 μL(日本Toyobo公司), 10×buffer 2.5 μL, 2.5 mmol/L dNTPs 2.5 μL, 25 mmol/L MgSO4 1.0 μL, 20 μmol/L外引物各1.0 μL, ddH2O 15.5 μL. 反应条件为: 94 ℃预变性5 min; 94 ℃变性15 s, 57 ℃退火30 s, 68 ℃延伸15 s, 共35个循环; 最后68 ℃延伸5 min. 第二轮PCR反应体系为: 第一轮PCR产物1.0 μL, Kod-plus 0.5 μL, 10×buffer 2.5 μL, 2.5 mmol/L dNTP 2.5 μL, 25 mmol/L MgSO4 1.0 μL, 20 μmol/L内引物各1.0 μL, ddH2O 15.5 μL, 反应条件同第一轮PCR条件.
1.2.4 原位杂交法检测大肠癌组织HCMV表达: 标本经脱蜡和脱水后, 采用新鲜配制的0.5%H2O2在室温下处理30 min(灭活内源性过氧化物酶); 3%柠檬酸新鲜配制蛋白酶(0.01 g/L)于37 ℃孵育10 min(消化标本DNA结合蛋白); 滴加20 μL不含探针的预杂交液于42 ℃预杂交4 h; 加入含探针(1 ng/L)的杂交液于42 ℃湿盒内杂交12 h; 0.1×标准柠檬酸盐(SSC)42 ℃漂洗, 加SA-Bio-AP于37 ℃孵育10 min(试剂盒购自武汉博士德生物工程有限公司); 后加NBT/BCIP[天根生化科技(北京)有限公司], 避光显色2-4 h. 以不含探针的标本作阴性对照. 基因探针序列为: 5'-ATCGTGGCCATTCTCTGCTATCTG-3', 由华大基因公司经过5'端地高辛(DIG)修饰合成.
统计学处理 采用SPSS22.0统计学软件进行统计学处理. 2组之间阳性率比较采用Fisher确切概率法, 均数比较采用t检验或方差分析. P<0.05为差异有统计学意义.
大肠癌组与大肠息肉组及健康对照组血清HCMV-IgG、IgM特异性抗体阳性率比较差异无统计学意义(P>0.05)(表1).
| 分组 | 血清IgG | P值 | 血清IgM | P值 |
| 大肠癌组 | 57 | 3 | ||
| 大肠息肉组 | 59 | 0.61 | 1 | 0.61 |
| 健康对照组 | 58 | 1.00 | 1 | 0.61 |
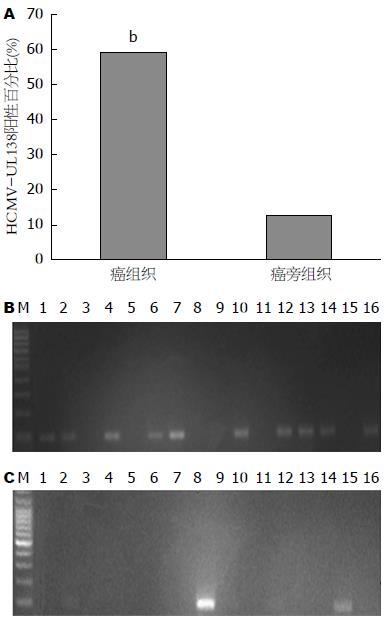
本实验通过巢式PCR检测32例大肠癌组织及配对癌旁正常组织HCMV感染结果如图1. 在大肠癌组织中HCMV-UL138阳性率为59.4%(19/32), 而在相应癌旁正常黏膜组织中HCMV-UL138阳性率为12.5%(4/32), 2组比较差异有统计学意义(χ2 = 13.3, P<0.01).
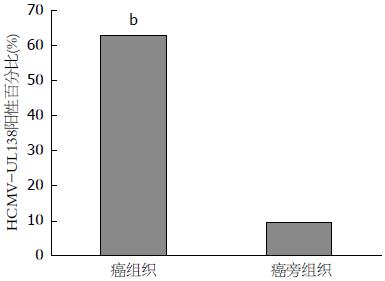
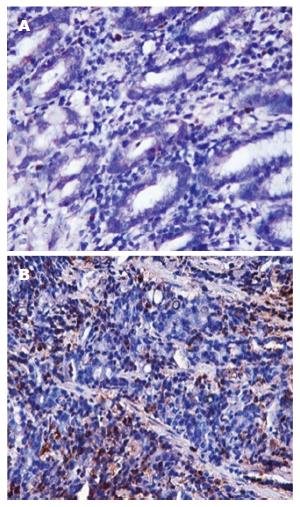
检测32例大肠癌组织及配对癌旁正常组织HCMV感染情况结果如图2, 3. 在大肠癌组织中HCMV-UL138阳性率为62.5%(20/32), 在相应癌旁正常肠黏膜组织中为9.4%(3/32), 大肠癌组织HCMV-UL138阳性检出率较癌旁正常组织显著升高(χ2 = 17.4, P<0.01).
进一步分析大肠癌组织UL138巢式PCR表达结果与临床病理特征的关系发现, 大肠癌组织HCMV感染与年龄、性别、肿块位置、肿块大小、组织病理分化类型、转移及Dukes分期等大肠癌患者的临床病理特征无明显相关性(P>0.05)(表2).
| 病理特征 | UL138 | P值 | |
| 阳性 | 阴性 | ||
| 年龄(岁) | 0.85 | ||
| ≥60 | 12 | 6 | |
| <60 | 8 | 6 | |
| 性别 | 1.00 | ||
| 男 | 13 | 7 | |
| 女 | 7 | 5 | |
| 肿瘤位置 | 0.93 | ||
| 结肠 | 10 | 7 | |
| 直肠 | 10 | 5 | |
| 肿块大小(cm) | 0.64 | ||
| ≥5 | 13 | 6 | |
| <5 | 7 | 6 | |
| 病理分化类型 | 0.45 | ||
| 高分化 | 6 | 6 | |
| 中低分化 | 14 | 6 | |
| 是否转移 | 0.85 | ||
| 是 | 12 | 6 | |
| 否 | 8 | 6 | |
| Dukes分期 | 0.85 | ||
| A-B | 8 | 6 | |
| C-D | 12 | 6 | |
大肠癌是全球发病率最高的恶性肿瘤之一, 全球每年609000例患者死于大肠癌[2], 其中约22%病例在我国, 是严重威胁我国国民生命健康的重要疾病[3,4]. 近年来, 肿瘤病因和发病机制方面的研究不断深入, 但是结直肠癌发生发展的病因及机制迄今仍未完全阐明. 近年来研究显示, HCMV感染与多种恶性肿瘤发生发展有关[5,6], 如神经胶质细胞瘤[7], 急性淋巴细胞白血病[8,9], 乳腺癌[10,11], 泌尿系统肿瘤[12]等. Scheurer等[7]对不同组织类型的神经胶质瘤进行了HCMV检测, 发现恶性胶质瘤相对于间变性胶质瘤、低级别胶质瘤有着更高的感染率. 国内学者施浩强等[12]研究发现HCMV活动性感染与尿路上皮细胞癌的病理分化类型有关. 1978年Lancet杂志首先报道结肠癌组织中HCMV DNA阳性率明显高于癌旁正常组织, 因而提出HCMV感染与结肠癌相关[13], 随后许多学者从分子和病毒学角度再度证实在结肠癌组织中存在HCMV抗原及核酸成分[14-19]. 但数十年来, HCMV感染与结肠癌是否相关一直存在争议, 有些研究[20-26]发现结肠癌组织HCMV DNA阳性率很低或检测不出. Turnage等[26]将56例石蜡固定的结肠癌标本分为4组, 分别为腺瘤组、高分化腺癌组、中分化腺癌组、低分化腺癌组, 对标本进行巢式PCR定量检测组织HCMV-UL55基因. 结果表明仅11%(6/56)为阳性, 其中5%(1/20)为腺瘤组, 21%(5/24)为中分化腺癌组, 而低分化腺癌和高分化腺癌组无阳性表达, 因此提出HCMV感染与结肠癌无关. 而Tafvizi等[27]收集了50例结肠癌和相应的癌旁组织进行巢式PCR检测, 结果表明癌组织HCMV-DNA阳性率为30%(15/50), 癌旁组织阳性率为10%(5/50). 肿瘤组与非肿瘤组HCMV表达差异有统计学意义, 以上结果说明HCMV感染在结肠癌的发生和进展中可能起重要的作用. 国内学者侯治富等[28]对新鲜的80例大肠癌标本进行了HCMV-DNA检测, 阳性率高达50%, 但HCMV阳性在不同分化阶段的癌组织中并无差异.
HCMV感染与大肠癌关系存在争议的原因可能与以下因素有关: HCMV基因的保守性不同, 不同地域不同种族间可能感染不同的HCMV病毒株, HCMV潜伏感染与增殖感染所表达的基因存在差异, 若选择增殖感染相关的基因作为靶基因检测, 就可能会得出HCMV-DNA阳性率低的情况, 另外未采用新鲜标本以及检测方法对结果影响也很大[27,29-31]. 本研究采用新鲜标本、选择HCMV基因组中相对保守的、与潜伏感染相关的、在病毒的生长、增殖过程发挥重要作用的UL138基因作为检测基因. 并采用灵敏度及特异性均较高的巢式PCR技术结合原位杂交方法, 进一步明确HCMV感染与大肠癌的关系.
本研究检测大肠癌组、大肠息肉组及健康对照组各60例血清中的HCMV-IgG、IgM抗体, 未发现大肠癌组与大肠息肉组及健康对照组间差异有统计学意义. 故血清学检测HCMV-IgG、IgM抗体尚不能说明大肠癌与HCMV之间的关联. 国内学者汤智勇等[32]比较了107例结肠癌患者与94例对照的血清HCMV-IgG及IgM水平, 发现两组IgG无明显差异, 与本文结论相符.
尽管HCMV抗体血清学检测未能提示HCMV与结肠癌之间存在相关关系, 但巢式PCR检测32例大肠癌组织结果提示HCMV-UL138阳性率在癌组织为65.6%(19/32), 在相应癌旁正常肠黏膜组织中为12.5%(4/32); 原位杂交方法检测32例大肠癌患者HCMV-UL138阳性率为62.5%(20/32), 相应癌旁正常肠黏膜组织中为9.4%(3/32), 两种检测方法均证实大肠癌组织HCMV阳性检出率较癌旁正常组织显著升高(P<0.01). 说明大肠癌上皮细胞中存在HCMV感染, 且相对于正常肠黏膜, HCMV更倾向感染癌组织, 提示大肠癌可能与HCMV感染相关.
此外, 我们还对HCMV-UL138基因表达情况与患者的临床病理特征进行分析比较. 虽在HCMV-UL138与大肠癌发生发展的相关性分析中未发现HCMV感染与大肠癌的年龄、性别、肿块位置、肿块大小、组织病理分化类型、转移及Dukes分期有显著性关联, 但仍可发现HCMV在分化低、肿瘤体积较大的病灶中有更高感染率的倾向, 需在后续实验中扩大样本量、进行多中心的实验研究.
大肠癌是全球发病率最高的恶性肿瘤之一, 目前有报道, 链球菌、幽门螺旋杆菌、人乳头状瘤病毒、EB病毒及人类巨细胞病毒(human cytomegalovirus, HCMV)等病原体感染可能与结肠癌相关. 但目前HCMV与结肠癌关系的研究尚有争议. 采用可靠的方法验证HCMV与结肠癌的关系对于进一步明确大肠癌发生机制具有重要意义.
胡国清, 教授, 博士生导师, 华中科技大学附属同济医院肿瘤科
病原体感染作为肿瘤的诱因或参与肿瘤的进展是目前研究的重点之一. HCMV在恶性肿瘤发生及进展中的作用是目前研究的热点. 但HCMV与结肠癌关系的研究尚有些矛盾的结果, 亟需采用可靠而灵敏的方法验证两者之间的关系.
以UL138为检测靶基因研究HCMV在大肠癌组织的表达情况尚未报道, 本研究使用新鲜标本采用巢式PCR结合原位杂交方法进一步验证HCMV在大肠癌及癌旁正常组织的表达情况.
研究HCMV与大肠癌的关系, 为将来进一步研究HCMV在大肠癌发生及发展中的作用提供证据, 可为大肠癌的综合防治提供新的思路和策略.
巢式PCR: 是一种变异的聚合酶链反应, 使用两对PCR引物扩增完整的片段. 巢式PCR的好处在于, 如果第一次扩增产生了错误片段, 则第二次能在错误片段上进行引物配对并扩增的概率极低. 因此, 巢式PCR的扩增非常特异.
本研究设计合理, 实验方法选择合理, 统计方法选择正确, 图表制作规范, 实验结果可以支持本论文结论.
编辑: 郭鹏 电编: 都珍珍
| 1. | Collins D, Hogan AM, Winter DC. Microbial and viral pathogens in colorectal cancer. Lancet Oncol. 2011;12:504-512. [PubMed] [DOI] |
| 2. | Jin J, Hu C, Wang P, Chen J, Wu T, Chen W, Ye L, Zhu G, Zhang L, Xue X. Latent infection of human cytomegalovirus is associated with the development of gastric cancer. Oncol Lett. 2014;8:898-904. [PubMed] [DOI] |
| 3. | Jemal A, Center MM, DeSantis C, Ward EM. Global patterns of cancer incidence and mortality rates and trends. Cancer Epidemiol Biomarkers Prev. 2010;19:1893-1907. [PubMed] [DOI] |
| 4. | Chen W, Zheng R, Zhang S, Zhao P, Li G, Wu L, He J. Report of incidence and mortality in China cancer registries, 2009. Chin J Cancer Res. 2013;25:10-21. [PubMed] [DOI] |
| 5. | Samanta M, Harkins L, Klemm K, Britt WJ, Cobbs CS. High prevalence of human cytomegalovirus in prostatic intraepithelial neoplasia and prostatic carcinoma. J Urol. 2003;170:998-1002. [PubMed] [DOI] |
| 6. | Soroceanu L, Matlaf L, Khan S, Akhavan A, Singer E, Bezrookove V, Decker S, Ghanny S, Hadaczek P, Bengtsson H. Cytomegalovirus Immediate-Early Proteins Promote Stemness Properties in Glioblastoma. Cancer Res. 2015;75:3065-3076. [PubMed] [DOI] |
| 7. | Scheurer ME, Bondy ML, Aldape KD, Albrecht T, El-Zein R. Detection of human cytomegalovirus in different histological types of gliomas. Acta Neuropathol. 2008;116:79-86. [PubMed] [DOI] |
| 8. | Libard S, Popova SN, Amini RM, Kärjä V, Pietiläinen T, Hämäläinen KM, Sundström C, Hesselager G, Bergqvist M, Ekman S. Human cytomegalovirus tegument protein pp65 is detected in all intra- and extra-axial brain tumours independent of the tumour type or grade. PLoS One. 2014;9:e108861. [PubMed] [DOI] |
| 9. | Morales-Sánchez A, Pompa-Mera EN, Fajardo-Gutiérrez A, Alvarez-Rodríguez FJ, Bekker-Méndez VC, Flores-Chapa Jde D, Flores-Lujano J, Jiménez-Hernández E, Peñaloza-González JG, Rodríguez-Zepeda MC. EBV, HCMV, HHV6, and HHV7 screening in bone marrow samples from children with acute lymphoblastic leukemia. Biomed Res Int. 2014;2014:548097. [PubMed] [DOI] |
| 10. | Valle Oseguera CA, Spencer JV. cmvIL-10 stimulates the invasive potential of MDA-MB-231 breast cancer cells. PLoS One. 2014;9:e88708. [PubMed] [DOI] |
| 11. | Mohamed MM, El-Ghonaimy EA, Nouh MA, Schneider RJ, Sloane BF, El-Shinawi M. Cytokines secreted by macrophages isolated from tumor microenvironment of inflammatory breast cancer patients possess chemotactic properties. Int J Biochem Cell Biol. 2014;46:138-147. [PubMed] [DOI] |
| 13. | Huang ES, Roche JK. Cytomegalovirus D.N.A. and adenocarcinoma of the colon: Evidence for latent viral infection. Lancet. 1978;1:957-960. [PubMed] [DOI] |
| 14. | Hashiro GM, Horikami S, Loh PC. Cytomegalovirus isolations from cell cultures of human adenocarcinomas of the colon. Intervirology. 1979;12:84-88. [PubMed] [DOI] |
| 15. | Grail A, Norval M. Elution of cytomegalovirus antibodies from adenocarcinoma of the colon. Gut. 1985;26:1053-1058. [PubMed] [DOI] |
| 16. | Roche JK, Cheung KS, Boldogh I, Huang ES, Lang DJ. Cytomegalovirus: detection in human colonic and circulating mononuclear cells in association with gastrointestinal disease. Int J Cancer. 1981;27:659-667. [PubMed] [DOI] |
| 17. | Vinokur VA. [80th anniversary of the invention of the acoustic method of measuring arterial blood pressure by N.S. Korotkov]. Sov Zdravookhr. 1985;75-77. [PubMed] [DOI] |
| 18. | Bennet M, Orlov RS. [In vivo synaptic transmission in the smooth muscle cells of the guinea-pig vas deferens]. Fiziol Zh SSSR Im I M Sechenova. 1968;54:1434-1439. [PubMed] [DOI] |
| 19. | Jennings PE, Barnett AH. New approaches to the pathogenesis and treatment of diabetic microangiopathy. Diabet Med. 1988;5:111-117. [PubMed] [DOI] |
| 20. | Boguszaková L, Hirsch I, Brichácek B, Faltýn J, Fric P, Dvoráková H, Vonka V. Absence of cytomegalovirus, Epstein-Barr virus, and papillomavirus DNA from adenoma and adenocarcinoma of the colon. Acta Virol. 1988;32:303-308. [PubMed] |
| 21. | Brichácek B, Hirsch I, Závadová H, Procházka M, Faltýn J, Vonka V. Absence of cytomegalovirus DNA from adenocarcinoma of the colon. Intervirology. 1980;14:223-227. [PubMed] [DOI] |
| 22. | Hart H, Neill WA, Norval M. Lack of association of cytomegalovirus with adenocarcinoma of the colon. Gut. 1982;23:21-30. [PubMed] [DOI] |
| 23. | Rüger R, Fleckenstein B. Cytomegalovirus DNA in colorectal carcinoma tissues. Klin Wochenschr. 1985;63:405-408. [PubMed] [DOI] |
| 24. | Knösel T, Schewe C, Petersen N, Dietel M, Petersen I. Prevalence of infectious pathogens in Crohn's disease. Pathol Res Pract. 2009;205:223-230. [PubMed] [DOI] |
| 25. | Akintola-Ogunremi O, Luo Q, He TC, Wang HL. Is cytomegalovirus associated with human colorectal tumorigenesis? Am J Clin Pathol. 2005;123:244-249. [PubMed] [DOI] |
| 26. | Turnage CS. Meconium aspiration syndrome. J Perinat Neonatal Nurs. 1989;3:69-80. [PubMed] [DOI] |
| 27. | Tafvizi F, Fard ZT. Detection of human cytomegalovirus in patients with colorectal cancer by nested-PCR. Asian Pac J Cancer Prev. 2014;15:1453-1457. [PubMed] [DOI] |
| 28. | 侯 治富, 杨 绍娟, 王 维忠, 张 文岚, 吴 晓冬. 人巨细胞病毒与大肠癌相关关系的研究. 中华实验和临床病毒学杂志. 2000;3:100. |
| 29. | Harkins L, Volk AL, Samanta M, Mikolaenko I, Britt WJ, Bland KI, Cobbs CS. Specific localisation of human cytomegalovirus nucleic acids and proteins in human colorectal cancer. Lancet. 2002;360:1557-1563. [PubMed] [DOI] |
| 30. | Dimberg J, Hong TT, Skarstedt M, Löfgren S, Zar N, Matussek A. Detection of cytomegalovirus DNA in colorectal tissue from Swedish and Vietnamese patients with colorectal cancer. Anticancer Res. 2013;33:4947-4950. [PubMed] |
| 31. | Chen HP, Jiang JK, Chen CY, Chou TY, Chen YC, Chang YT, Lin SF, Chan CH, Yang CY, Lin CH. Human cytomegalovirus preferentially infects the neoplastic epithelium of colorectal cancer: a quantitative and histological analysis. J Clin Virol. 2012;54:240-244. [PubMed] [DOI] |