修回日期: 2015-02-01
接受日期: 2015-02-06
在线出版日期: 2015-03-28
黏液纤维肉瘤(myxofibrosarcoma, MFS)是少见的软组织恶性肿瘤, 有其独特的临床病理特征; 发生于结肠并呈息肉状生长者罕见. 本例患者女性, 55岁, 因腹痛伴便血1 wk就诊, 电子肠镜检查见升结肠息肉样肿块入院, 外科行部分结肠切除术. 术后病理诊断: 结肠息肉状黏液纤维肉瘤(1级). 本例报告丰富完善了MFS的理论体系, 对该肿瘤的临床诊治会产生积极的影响.
核心提示: 结肠息肉状黏液纤维肉瘤(colon polypoid myxofibrosarcoma)是罕见的软组织恶性肿瘤, 本文报告1例并结合相关文献进行综合分析, 丰富了黏液纤维肉瘤(myxofibrosarcoma, MFS)的理论体系, 对MFS的诊治将产生积极的影响.
引文著录: 何珏, 陈检娣. 结肠息肉状黏液纤维肉瘤1例并文献复习. 世界华人消化杂志 2015; 23(9): 1535-1538
Revised: February 1, 2015
Accepted: February 6, 2015
Published online: March 28, 2015
Myxofibrosarcoma is a rare malignant soft-tissue tumor with unique clinical and pathological characteristics. Myxofibrosarcoma occurring in the colon with polypoid growth is even rarer. A 55-year-old female patient presented with abdominal pain and hematochezia for a week. She underwent an electronic colonoscopic examination, which revealed a polypoid lump in the ascending colon. She then underwent partial colectomy, and postoperative pathological diagnosis suggested polypoid myxofibrosarcoma of the colon (grade 1).
- Citation: He J, Chen JD. Polypoid myxofibrosarcoma of the colon: A case report and literature review. Shijie Huaren Xiaohua Zazhi 2015; 23(9): 1535-1538
- URL: https://www.wjgnet.com/1009-3079/full/v23/i9/1535.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i9.1535
黏液纤维肉瘤(myxofibrosarcoma, MFS)是一种少见的软组织恶性肿瘤, 以黏液样基质和梭形细胞增殖为特征[1], 好发于老年人四肢及躯干, 发生于腹腔脏器者罕见. 赣南医学院第一附属医院胃肠外科2013-12成功诊治1例发生于升结肠呈息肉状外观的MFS, 现对其临床病理特征及免疫组织化学标记予以总结, 并复习相关文献进行报告, 以提高对该肿瘤的诊治水平.
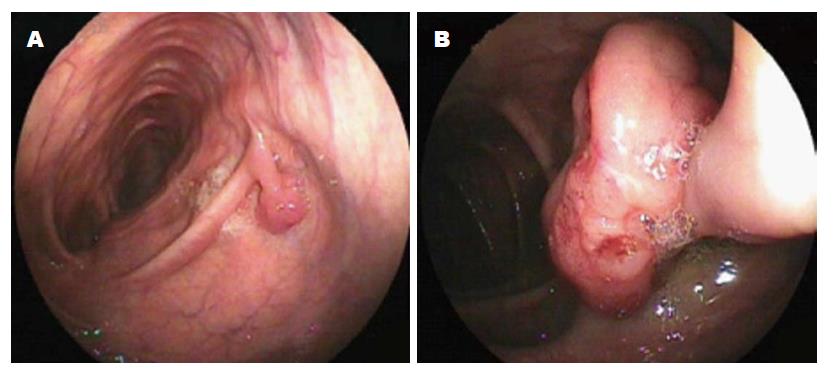
患者女性, 55岁, 因下腹痛伴便血1 wk就诊, 电子肠镜检查提示: 升结肠黏膜充血, 近肝曲见大小约3.0 cm×2.5 cm息肉样带蒂肿物、外观略不规整(图1); 内镜诊断: (1)结肠息肉; (2)结肠癌? 病理活检考虑间叶源性肿瘤. 因肠镜活检组织未能明确诊断, 疑为恶性肿瘤, 无内镜下行圈套灼切指征, 未在肠镜下圈套灼除, 遂入院住胃肠外科求治; 经术前常规检查于2013-12-20上午8: 30在硬膜外麻醉下行部分结肠及肿瘤切除术. 本病例的选取符合伦理道德规范, 并经患者知情同意.
患者术中见结肠肠管1段, 在升结肠距回盲部2.5 cm处见息肉样肿物1个, 大小3.0 cm×2.5 cm×1.5 cm, 蒂长1.2 cm、直径0.8 cm, 表面被覆结肠黏膜灰红色伴糜烂; 肿瘤切面呈结节状、半透明胶冻样, 与周围组织分界不清; 肠壁见直径0.2-0.3 cm淋巴结4枚. 术后标本经40 g/L中性甲醛固定、梯度乙醇脱水、二甲苯透明、石蜡包埋、4 µm切片、HE染色, 光学显微镜观察; 并采用Polink-2HRP染色系统(PV9000二步法)进行免疫组织化学标记, 不同的抗体定位于细胞的不同部位, 阳性判断参照国际通行标准, 通过染色范围和强度评价肿瘤组织标记效果[2]; 病理诊断依据第4版世界卫生组织(World Health Organization, WHO)软组织肿瘤分类规范[3], TNM分期依据JACC第7版标准[4]; 经2名以上高年资病理医生共同阅片、专家会诊.
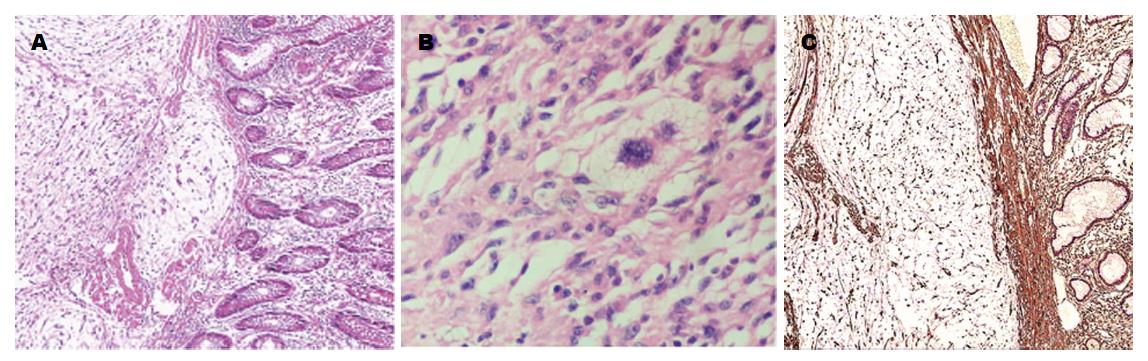
镜下形态: 肿瘤边界不清, 呈多结节状浸润性生长, 破坏结肠黏膜层(图2A); 大多区域肿瘤细胞稀少, 呈梭形或星芒状、异型性不明显, 核分裂少见; 少数致密区域肿瘤细胞呈圆形、卵圆形, 单核或多核, 染色质深染, 有异型, 可见脂母样细胞(图2B); 肿瘤间质疏松水肿、富含黏液及薄壁分枝状小血管, 散在多量炎细胞, 瘤组织内未见出血坏死. 免疫组织化学标记: Vimentin(+)(图2C)、SMA局灶(+)、CD34部分(+), CK、DOG-1、CD117、S100、Desmin均(-), Ki-67(+)约4%. 病理诊断: 结肠息肉状黏液纤维肉瘤(colon polypoid myxofibrosarcoma, CPMFS), FNCLCC分级: 1级, TNM分期: T1aN0M0期; 肠壁淋巴结(×4)反应性增生. 患者术后未进行放化疗及免疫治疗, 随访13 mo, 健康状况良好, 肠管未见肿瘤复发, 肠外未见转移. 此病例罕见, 截止2015年PubMed数据库和中国期刊全文数据库(Chinese Journal Full-text Database, CJFD)未见报道.
MFS, ICD-O编码: 8840/3; 最早出现于1970年, 用来描述表浅软组织的低级别恶性肿瘤; 目前用于描述黏液样纤维/肌纤维母细胞恶性肿瘤, 包括低级别-高级别的一组病变, 同义词: 纤维肉瘤黏液亚型、黏液性恶性纤维组织细胞瘤(mucinous malignant fibrous histiocytoma, MMFH)[3]. MFS多发生于老年人群, 男性略多于女性; 本例为55岁女性患者, 发病年龄与文献基本一致.
MFS多发生于躯干和四肢, 以下肢多见; 可以罕见的发生于内脏器官, 比如心脏、肺、膀胱、胆囊、附睾[5]等器官. 检索2015年以前PubMed和CJFD数据库, MFS发生于结肠者单独或文内均未见报道.
MFS的诊断与鉴别诊断需病理形态结合免疫组织化学表型加以分析, 形态学指标包括: (1)丰富的黏液背景; (2)肿瘤细胞以梭形、星形细胞为主, 显示纤维/肌纤维母细胞的免疫组织化学特征, Vimentin(+)、灶性SMA(+)、部分病例CD34(+); (3)肿瘤细胞的异型性; (4)浸润性边界. 诊断结肠MFS时, 首先需排除其他部位肿瘤转移, 本例患者躯干、四肢等部位均未见MFS发生; 其次需与含有黏液的其他软组织梭形细胞肿瘤鉴别, 如低度恶性纤维黏液肉瘤、黏液性平滑肌瘤、黏液性神经鞘瘤、黏液性脂肪肉瘤、胃肠道间质瘤等.
MFS发生原因与许多恶性肿瘤一样, 目前尚不清楚; 其分子遗传学特征较为复杂, 高通量的基因检测可帮助诊断[6]; 经长期的临床验证, 影像学PET/CT等检查对MFS的早期发现有一定的价值[7]; MFS呈浸润性生长, 容易复发, 首选治疗方法为手术切除; 有资料显示, 术前明确诊断, 术中完整并扩大切除, 对治疗具有非常重要的意义[8]. 有研究认为免疫组织化学CD34阳性表达对预后有提示作用[9], 相关影响因素尚需更多的资料积累.
本例肿瘤外观息肉状, 切面呈多结节状浸润. 镜下富含黏液样基质, 瘤细胞疏密不均, 多呈梭形或星状, 少数呈圆形、卵圆形, 可见脂母样细胞, 轻度异型性, 核分裂少见. 间质疏松水肿、见多量薄壁分枝状小血管, 部分区域小血管呈特征性的曲线形; 肿瘤细胞免疫组织化学标记Vimentin(+)、灶性SMA(+)、灶性CD34(+), DOG-1、CD117、S100、Desmin均(-), 显示纤维/肌纤维母细胞的免疫组织化学特征, 可以排除间质瘤、神经源性和脂肪源性肿瘤; 肿瘤细胞轻度异型、Ki-67(+)约4%呈低表达, 未见出血、坏死, 显示肿瘤为低级别.
本例肿瘤位于结肠黏膜下层和固有层的深部, 其表面被覆黏膜大多良好, 部分区域糜烂; 由于肠镜活检时取材表浅, 取到的肿瘤组织较少, 黏膜下仅见少许疏松水肿的黏液样基质、薄壁小血管及纤维组织, 容易误诊为息肉、肉芽组织或炎性纤维组织增生等. 本例肠镜活检未能明确诊断, 疑恶性肿瘤, 无肠镜下行圈套灼切指征, 后在硬膜外麻醉下行肿瘤区域部分结肠切除手术, 术后病理诊断: CPMFS, 侵及黏膜, FNCLCC分级: 1级, TNM分期T1aN0M0.
总之, MFS是一种少见的软组织恶性肿瘤, 发生于结肠并呈息肉状生长者罕见, 本例CPMFS为低级别恶性肿瘤, 既要避免诊断为炎性息肉、炎性假瘤等非肿瘤性病变, 又要避免过度诊断为恶性间质瘤、纤维肉瘤、未分化肉瘤等高级别恶性肿瘤; 本病例的报告丰富完善了MFS的理论体系, 掌握其临床病理特征、深化认识, 对临床减少误诊, 选择妥当的治疗方法将会产生积极的影响.
本病例承蒙病理专家江苏省人民医院范钦和教授会诊, 特表谢意.
黏液纤维肉瘤(myxofibrosarcoma, MFS), 最早出现于1970年, 目前用于描述黏液样纤维母/肌纤维母细胞的一类恶性肿瘤, 包括低-高级别的一组病变, 多发生于躯干和四肢的表浅软组织, 空腔脏器罕见.
顾国利, 副主任医师, 空军总医院普通外科
MFS首选手术治疗, 低级别MFS完整扩大切除, 高级别MFS在完整扩大切除的基础上辅以放化疗及生物免疫治疗; 以准确的病理诊断指导临床治疗是目前MFS领域的研究重点, 涉及的手段涵盖影像学、病理学、分子遗传学等专业学科.
Erdogan等人研究证实影像学PET/CT等检查对MFS的早期发现有一定的价值, Look等资料显示, 术前明确诊断, 术中完整并扩大切除, 对治疗具有非常重要的意义.
CPMSF为罕见病例, 检索2015年以前PubMed数据库和中国期刊全文数据库(Chinese Journal Full-text Database, CJFD)未见报道.
本病例的报告丰富完善了MFS的理论体系, 掌握其临床病理特征、深化认识, 对临床减少误诊、选择妥当的治疗方法有重要的指导意义.
本文内容较充分, 对临床诊治具有一定的指导意义.
编辑: 郭鹏 电编:都珍珍
| 1. | Kikuta K, Kubota D, Yoshida A, Suzuki Y, Morioka H, Toyama Y, Kobayashi E, Nakatani F, Chuuman H, Kawai A. An analysis of factors related to recurrence of myxofibrosarcoma. Jpn J Clin Oncol. 2013;43:1093-1104. [PubMed] [DOI] |
| 2. | David J D. Diagnostic Immunohistochemistry: Theranostic and Genomic Applications. Philadelphia: Elsevier saunders 2014; 3-18. |
| 3. | Fletcher C D M, Bridge J A, Hogendoorn P C W, Mertens F. WHO Classification of Tumours of soft tissue and bone. Lyon: IARC 2013; 93-94. |
| 4. | Edge SB, Byrd DR, Compton CC, Fritz A G, Greene F L. AJCC cancer staging manual. New York: Springer Verlag 2010; 291-298. |
| 5. | Baspinar S, Kapucuoglu N, Akdeniz R, Oksay T, Guzel A, Kocer M. Paratesticular myxofibrosarcoma. Indian J Pathol Microbiol. 2014;57:503-504. [PubMed] [DOI] |
| 6. | Goldblum J R, Folpe A L, Weiss Sharon W. Enzinger and Weiss's soft tissue tumors. Philadelphia: Elsevier saunders 2014; 318-324. |
| 7. | Erdoğan EB, Asa S, Aksoy SY, Ozhan M, Halac M. Appearance of recurrent cardiac myxofibrosarcoma on FDG PET/CT. Clin Nucl Med. 2014;39:559-560. [PubMed] [DOI] |
| 8. | Look Hong NJ, Hornicek FJ, Raskin KA, Yoon SS, Szymonifka J, Yeap B, Chen YL, DeLaney TF, Nielsen GP, Mullen JT. Prognostic factors and outcomes of patients with myxofibrosarcoma. Ann Surg Oncol. 2013;20:80-86. [PubMed] [DOI] |
| 9. | Smith SC, Poznanski AA, Fullen DR, Ma L, McHugh JB, Lucas DR, Patel RM. CD34-positive superficial myxofibrosarcoma: a potential diagnostic pitfall. J Cutan Pathol. 2013;40:639-645. [PubMed] [DOI] |