修回日期: 2015-01-25
接受日期: 2015-01-29
在线出版日期: 2015-03-28
目的: 探讨Bmi-1(B-cell-specific moloney murine leukemia virus insertion site 1)和Mina53(myc-induced nuclear antigen with a molecular mass of 53 kDa)在大肠癌(colorectal carcinoma, CRC)组织中的表达及临床病理意义.
方法: 采用免疫组织化学法分别检测56例CRC及相应癌旁正常大肠黏膜组织中Bmi-1和Mina53蛋白的表达, 并分析两者的表达水平相关性及与临床病理因素的关系.
结果: CRC及相应癌旁正常大肠黏膜组织中Bmi-1蛋白的阳性表达率分别为80.4%和35.7%, Mina53蛋白的阳性表达率分别为73.2%和19.6%, 组间相比差异均有统计学意义(χ2 = 22.913、32.308, 均P<0.05). CRC组织中Bmi-1和Mina53蛋白的表达与患者的性别、年龄无关(均P>0.05), 而与肿瘤的分化程度、淋巴转移及浸润深度有关(均P<0.05). CRC组织中Bmi-1和Mina53蛋白的表达呈正关联(r = 0.296, P<0.05).
结论: Bmi-1和Mina53的高表达可能与CRC的发生、发展及预后有关, 联合检测两者对CRC的诊断及预后判断可能具有重要意义.
核心提示: Bmi-1(B-cell-specific moloney murine leukemia virus insertion site 1)可通过调控下游基因INK4a-ARF和人端粒酶逆转录酶(human telomerase reverse transcriptase)调控细胞周期, 也能与c-myc协同作用引起细胞转化和肿瘤形成, Mina53(myc-induced nuclear antigen with a molecular mass of 53 kDa)是c-myc下游直接靶基因, 通过多种机制参与肿瘤形成. Bmi-1和Mina53的高表达在大肠癌(colorectal carcinoma, CRC)的发生发展中起重要作用, 联合检测两者可能有助于CRC的诊断及恶性程度判断, 并指导CRC的靶向治疗和预后判断.
引文著录: 王满, 张创杰, 徐峰, 赵立群. Bmi-1和Mina53在大肠癌组织中的表达及意义. 世界华人消化杂志 2015; 23(9): 1420-1425
Revised: January 25, 2015
Accepted: January 29, 2015
Published online: March 28, 2015
AIM: To investigate the clinicopathological significance of expression of B-cell-specific moloney murine leukemia virus insertion site 1 (Bmi-1) and myc-induced nuclear antigen with a molecular mass of 53 kDa (Mina53) in colorectal carcinoma.
METHODS: The expression of Bmi-1 and Mina53 proteins was detected by immunohistochemistry in 56 colorectal cancer samples and matched tumor-adjacent normal tissue samples. The correlation between the expression of these proteins and the clinicopathologic features of colorectal carcinoma was analyzed.
RESULTS: The positive rates of Bmi-1 expression and Mina53 in colorectal cancer were significantly higher than those in matched tumor-adjacent normal tissue (80.4% vs 35.7%, 73.2% vs 19.6%, χ2 = 22.913, 32.308, P < 0.05 for both). Expression of Bmi-1 and Mina53 was significantly associated with tumor differentiation, lymph node metastasis and tumor infiltration depth in colorectal carcinoma (P < 0.05 for all), but not with age or gender (P > 0.05 for both). A positive correlation was noted between the expression of Bmi-1 and that of Mina53 in colorectal carcinoma (r = 0.296, P < 0.05).
CONCLUSION: High expression of Bmi-1 and Mina53 proteins may participate in the occurrence, progression and prognosis of colorectal carcinoma. Combined detection of the expression of these proteins is helpful to the diagnosis and evaluation of the prognosis of colorectal carcinoma.
- Citation: Wang M, Zhang CJ, Xu F, Zhao LQ. Clinical significance of expression of Bmi-1 and Mina53 in colorectal carcinoma. Shijie Huaren Xiaohua Zazhi 2015; 23(9): 1420-1425
- URL: https://www.wjgnet.com/1009-3079/full/v23/i9/1420.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i9.1420
大肠癌(colorectal carcinoma, CRC)包括结肠癌与直肠癌, 是消化系常见的恶性肿瘤之一. 据报道, CRC在西方国家发病率位居恶性肿瘤的第2位[1], 近年来, 我国CRC发病率呈上升趋势, 排在恶性肿瘤的第4位[2], 但其发病机制尚不完全清楚, 多数专家认为该病是一个多步骤、多阶段及多基因共同参与的过程[3-5].
Bmi-1(B-cell-specific moloney murine leukemia virus insertion site 1)基因属于多梳基因(polycomb group genes, PcG)家族成员[6], 已经证实与胰腺癌[7]、乳腺癌[8]、胃癌[9]、鼻咽癌[10]等多种肿瘤的发生发展相关. Mina53(myc-induced nuclear antigen with a molecular mass of 53 kDa)为一种近年新发现的原癌基因c-myc的下游靶基因[11]. Bmi-1和Mina53在多种肿瘤中表达异常, 但其在CRC中的发病机制尚不明确, 并且国内外对联合检测两者在CRC中的表达及相关性研究均未见相关报道. 本实验采用免疫组织化学法检测56例CRC及相应癌旁正常大肠黏膜组织中Bmi-1和Mina53蛋白的表达, 以探讨两者与CRC发生、发展的关系及其临床病理意义.
收集郑州大学第一附属医院2012-08/2013-12手术切除的CRC标本56例及56例相应的癌旁正常组织(距肿瘤边缘≥5 cm), 病历资料均齐全. 所有患者术前均未行放化疗及生物免疫治疗. 其中男30例, 女26例; 年龄33-77岁, 中位年龄55岁; 有淋巴结转移24例, 无淋巴结转移32例; 按组织学分级: 高中分化29例, 低分化及黏液腺癌27例; 有浆膜浸润25例, 无浆膜浸润31例. 所有组织均用40 g/L中性甲醛固定, 常规石蜡包埋, 4 µm厚度连续切片. 所有切除标本均经病理学证实为大肠腺癌. 兔抗人多克隆抗体Bmi-1及免疫组织化学试剂盒购自北京博奥森生物有限公司, 兔抗人多克隆抗体Mina53购自武汉三鹰生物技术有限公司.
1.2.1 免疫组织化学法: 采用链酶卵白素-生物素过氧化物酶法(streptavidin peroxidase, SP)染色, Bmi-1抗体稀释浓度为1:100, Mina53抗体稀释度为1:50, DAB显色, 苏木素复染, 操作步骤严格按照说明书进行, 用已知的阳性组织作阳性对照, PBS液代替一抗作阴性对照.
1.2.2 评分: 参考张磊等[12]与Hong等[13]计分方法并做适当修改: Bmi-1以胞核和/或胞浆出现黄色颗粒为阳性, Mina53以胞核出现黄色颗粒为阳性, 随机选取5个高倍视野计数, 以阳性细胞数和着色强度综合判断. 阳性细胞数计分: 0%-5%为0分, 6%-25%为1分, 26%-50%为2分, 51%-75%为3分,>75%为4分; 着色强度计分: 无色0分, 淡黄色1分, 棕黄色2分, 黄褐色3分, 以上两项之积, 0-4分为阴性,≥5分为阳性.
统计学处理 采用SPSS17.0统计软件进行数据分析, 统计方法采用χ2检验及Spearman等级相关分析, P<0.05为差异有统计学意义.
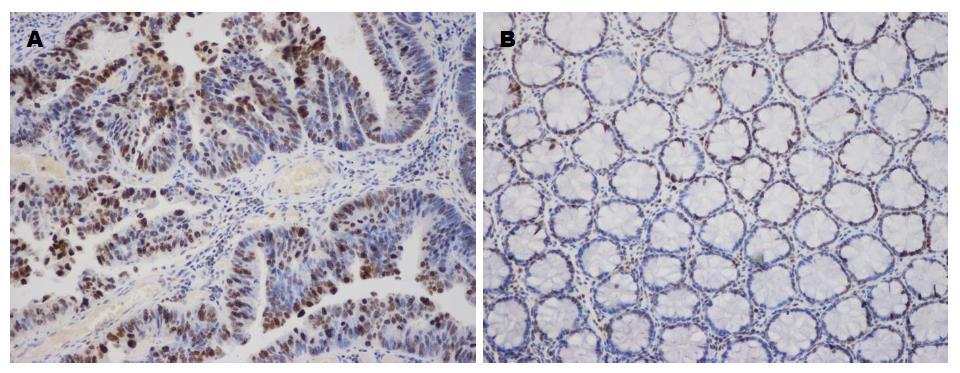
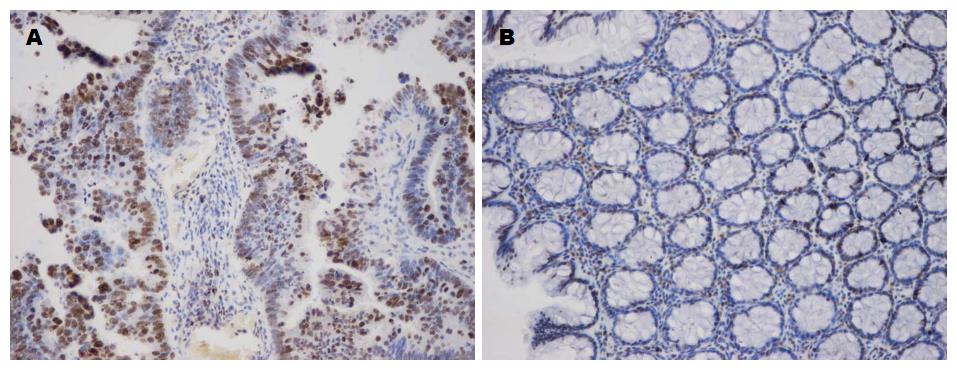
Bmi-1和Mina53阳性染色呈黄色颗粒, Bmi-1阳性主要在定位于胞核, 少数定位于胞浆(图1), Mina53阳性定位于胞核, 部分定位于核仁区(图2). Bmi-1在CRC组织和癌旁正常组织中阳性表达率分别为80.4%和35.7%; Mina53在CRC组织和癌旁正常组织中阳性表达率分别为73.2%和19.6%. 两种蛋白在CRC组织中的表达阳性率均高于癌旁正常组织, 两者的差异具有统计学意义(P<0.05)(表1).
| 组织类别 | Bmi-1 | χ2值 | P值 | Mina53 | χ2值 | P值 | ||
| 阳性 | 阴性 | 阳性 | 阴性 | |||||
| 大肠癌 | 45(80.4) | 11(19.6) | 22.913 | 0.000 | 41(73.2) | 15(24.8) | 32.308 | 0.000 |
| 正常组织 | 20(35.7) | 36(64.2) | 11(19.6) | 45(80.4) | ||||
Bmi-1和Mina53在CRC组织中的表达与患者的性别、年龄无关(P>0.05), 而与肿瘤的浸润深度、淋巴转移及分化程度有关(P<0.05)(表2).
| 因素 | n | Bmi-1 | χ2值 | P值 | Mina53 | χ2值 | P值 | ||
| 阳性 | 阴性 | 阳性 | 阴性 | ||||||
| 性别 | 0.050 | 0.942 | 0.000 | 0.983 | |||||
| 男 | 30 | 24(80.0) | 6(20.0) | 22(73.3) | 8(26.7) | ||||
| 女 | 26 | 21(80.8) | 5(19.2) | 19(73.1) | 7(26.9) | ||||
| 年龄(岁) | 0.113 | 0.737 | 2.276 | 0.131 | |||||
| <60 | 28 | 23(82.1) | 5(17.9) | 23(82.1) | 5(17.9) | ||||
| ≥60 | 28 | 22(78.6) | 6(21.4) | 18(64.3) | 10(35.7) | ||||
| 淋巴转移 | 4.773 | 0.029 | 5.738 | 0.017 | |||||
| 有 | 24 | 23(95.8) | 1(4.2) | 22(91.7) | 2(8.3) | ||||
| 无 | 32 | 22(68.8) | 10(31.2) | 19(59.4) | 13(40.6) | ||||
| 分化程度 | 4.629 | 0.031 | 6.643 | 0.010 | |||||
| 高+中 | 29 | 27(93.1) | 2(6.9) | 26(89.7) | 3(10.3) | ||||
| 低+黏液腺癌 | 27 | 18(66.7) | 9(33.3) | 15(55.6) | 12(44.4) | ||||
| 浆膜浸润 | 5.325 | 0.021 | 6.489 | 0.011 | |||||
| 有 | 25 | 24(96.0) | 1(4.0) | 23(92.0) | 2(8.0) | ||||
| 无 | 31 | 21(67.7) | 10(32.3) | 18(58.1) | 13(41.9) | ||||
Bmi-1基因在人体位于第10号染色体短臂13区, 含有保守螺旋-折转-螺旋-折转(helex-turn-helix-turn, H-T-H-T)DNA结合模体和位于N端的环指结构域(ring finger domain)[14,15]. H-T-H-T DNA结合模体对端粒酶活性及细胞永生化有决定意义, 而环指结构对细胞转化和肿瘤形成起重要作用[16]. Bmi-1主要通过抑制INK4a-ARF基因位点, 从而参与多种肿瘤的发生和发展[17], INK4a-ARF是一个常见的基因失活位点, 能够编码并负性调节p16INK4a和p14ARF两种抑癌蛋白[18]. 其中, p16INK4a通过抑制CyclinD-CDK-Rb-E2E通路来调控细胞周期并影响细胞增殖, p14ARF通过调节MDM2-P53通路调控细胞周期. 此外, Bmi-1可以与c-Myc协同作用引起细胞转化和肿瘤的形成[19-21]. 另外, 人端粒酶逆转录酶(human telomerase reverse transcriptase, hTERT)作为Bmi-1的下游靶基因的产物, 可以影响端粒酶的活性使得细胞增殖速度增快[22]. 本研究发现Bmi-1基因在CRC组织中高表达, 而在正常组织中低表达, 差异具有统计学意义, 说明其在CRC的发生、发展中起重要作用. 姚尧等[23]采用实时荧光定量PCR法及免疫组织化学法分别检测发现Bmi-1 mRNA及蛋白在CRC中均高表达, 与本实验结果一致. 本研究还发现Bmi-1在CRC组织中的表达与肿瘤的浸润深度、淋巴转移及分化程度有关, 而与患者的性别、年龄无关, 提示Bmi-1蛋白高表达可能是判断患者预后不良的参考指标.
据研究[24], c-myc是一种在细胞增殖分化的调控中起关键作用的原癌基因, 其通过特异性结合靶基因的E-box位点转录激活结构域激活下游靶基因, Mina53就是近年来新发现的受c-Myc直接调控的下游靶基因之一[25]. Mina53位于染色体3q12.1, 主要定位于细胞核, 部分蛋白定位于核仁区[26]. Mina53蛋白第128-271位氨基酸残基可形成一个β折叠结构, 研究发现该结构可能催化多种脱甲基化酶, 在介导组蛋白脱甲基化的过程中起重要作用[27]. 也有学者认为Mina53是通过Wnt/APC/β-catenin通路影响细胞生长发育的[28]. 另外, Mina53能够参与免疫调控抑制白介素(interleukin, IL)-4的表达使得免疫平衡由Th2倾斜向Th1, 从而影响人体免疫力及抗癌能力, 与多种肿瘤的预后相关[29]. Komiya等[30]研究显示Mina53高表达在62%肺癌患者的早期临床试验阶段即出现, Ogasawara等[31]发现Mina53在食管癌患者中有83%高表达, 表明其对细胞增殖有着重要作用. 本研究结果显示Mina53在CRC组织中的表达明显高于正常组织, 表明其在CRC的发生发展中起重要作用. 本研究还发现随着癌组织的浸润深度、淋巴转移、分化程度的增加, Mina53表达的阳性率逐渐升高, 而与患者的性别、年龄无相关性. Teye等[32]也发现Mina53在具有侵袭性和转移性的肿瘤中表达较强, 在分化程度不同的结肠癌中均高表达. 由此证实了Mina53在CRC的发生、发展中可能发挥重要作用, 在判定预后方面有一定的指导意义.
本研究结果显示Bmi-1和Mina53在CRC组织中的表达呈正相关, 推测Bmi-1和Mina53可能通过某种机制协同促进CRC的发生和发展, 其具体的作用机制目前尚不完全清楚, 且本研究应用免疫组织化学方法, 样本量少, 因此还有待进一步研究. 总之, Bmi-1和Mina53的高表达在CRC的发生发展中起重要作用, 联合检测两者可能对CRC的诊断及恶性程度判断有重要意义, 并且为CRC的靶向治疗和预后判断提供指导意义.
大肠癌(colorectal carcinoma, CRC)是常见的消化系恶性肿瘤, 其发病率和死亡率均居高不下, 已成为威胁人类健康和生命的主要疾病. Mina53(myc-induced nuclear antigen with a molecular mass of 53 kDa)是新发现的受原癌基因c-myc直接调控的下游靶基因, 与肺癌、胰腺癌、肝癌等多种肿瘤相关, 因此推测Mina53也可能参与了CRC的发生发展、浸润转移过程.
白雪, 副主任医师, 中国人民解放军北京军区总医院普通外科
Bmi-1(B-cell-specific moloney murine leukemia virus insertion site 1)在CRC中的研究虽可见报道, 但是国内外对Mina53与CRC关系的研究报道很少, 联合检测两者在CRC中的表达及相关性研究尚未见报道. 二者分别在CRC中的具体机制及如何相互作用促进肿瘤形成及浸润转移是需要进一步研究的问题.
Ogasawara等报道了Mina53在食管癌的发生发展中的作用. 该论文报道原癌基因c-myc通过特异性结合E-box位点而激活靶基因Mina53, 继而Mina53介导组蛋白脱甲基化, 导致染色体断裂、易位, 甚至丢失, 肿瘤形成. Renkonen等发现Bmi-1可与c-myc协同作用可以引起细胞转化和肿瘤的形成.
本文首次探讨了Bmi-1和Mina53在CRC中表达的相关关系, 提示Bmi-1的高表达可能上调Mina53的表达, 可能通过某种机制共同促进细胞增殖, 加速肿瘤形成.
本研究发现Bmi-1的表达与CRC的浸润深度、淋巴转移及分化程度有关, Mina53的表达与CRC的浸润深度、淋巴转移和分化程度有关. Bmi-1和Mina53蛋白在CRC中的表达水平呈正相关. 联合检测两者可能对CRC的诊断及恶性程度判断有重要意义, 并且为CRC的靶向治疗和预后判断提供指导意义.
CyclinD-CDK4-Rb-E2F通路: 在正常的细胞周期中, CyclinD能够与细胞周期依赖蛋白激酶4(cyclin-dependent kinase 4, CDK4)结合激活CDK4的蛋白激酶活性, 被激活的CDK4可引起Rb蛋白磷酸化, 磷酸化的Rb蛋白受到上述调节能够释放转录因子E2F, 从而活化许多与DNA复制相关的限速酶, 因此细胞能够有充足的条件从G1期进入S期.
本文具有一定的创新性, 课题设计合理, 数据真实可靠, 研究内容重要, 提供了充足的有意义的信息. 作者对该领域的研究进展也较为熟悉.
编辑: 韦元涛 电编:都珍珍
| 3. | 王 新颖, 姜 泊. 大肠癌发病机制基础研究进展与展望. 胃肠病学和肝病学杂志. 2011;20:197-200. |
| 4. | Mehlen P, Tauszig-Delamasure S. Dependence receptors and colorectal cancer. Gut. 2014;63:1821-1829. [PubMed] [DOI] |
| 5. | Rasool S, Rasool V, Naqvi T, Ganai BA, Shah BA. Genetic unraveling of colorectal cancer. Tumour Biol. 2014;35:5067-5082. [PubMed] [DOI] |
| 6. | Jiang L, Li J, Song L. Bmi-1, stem cells and cancer. Acta Biochim Biophys Sin (Shanghai). 2009;41:527-534. [PubMed] [DOI] |
| 7. | Song W, Tao K, Li H, Jin C, Song Z, Li J, Shi H, Li X, Dang Z, Dou K. Bmi-1 is related to proliferation, survival and poor prognosis in pancreatic cancer. Cancer Sci. 2010;101:1754-1760. [PubMed] [DOI] |
| 8. | Joensuu K, Hagström J, Leidenius M, Haglund C, Andersson LC, Sariola H, Heikkilä P. Bmi-1, c-myc, and Snail expression in primary breast cancers and their metastases--elevated Bmi-1 expression in late breast cancer relapses. Virchows Arch. 2011;459:31-39. [PubMed] [DOI] |
| 9. | Cordisco S, Maurelli R, Bondanza S, Stefanini M, Zambruno G, Guerra L, Dellambra E. Bmi-1 reduction plays a key role in physiological and premature aging of primary human keratinocytes. J Invest Dermatol. 2010;130:1048-1062. [PubMed] [DOI] |
| 10. | Song LB, Zeng MS, Liao WT, Zhang L, Mo HY, Liu WL, Shao JY, Wu QL, Li MZ, Xia YF. Bmi-1 is a novel molecular marker of nasopharyngeal carcinoma progression and immortalizes primary human nasopharyngeal epithelial cells. Cancer Res. 2006;66:6225-6232. [PubMed] [DOI] |
| 11. | Tsuneoka M, Nishimune Y, Ohta K, Teye K, Tanaka H, Soejima M, Iida H, Inokuchi T, Kimura H, Koda Y. Expression of Mina53, a product of a Myc target gene in mouse testis. Int J Androl. 2006;29:323-330. [PubMed] [DOI] |
| 13. | Hong J, Hu K, Yuan Y, Sang Y, Bu Q, Chen G, Yang L, Li B, Huang P, Chen D. CHK1 targets spleen tyrosine kinase (L) for proteolysis in hepatocellular carcinoma. J Clin Invest. 2012;122:2165-2175. [PubMed] [DOI] |
| 14. | Szabo AZ, Fong S, Yue L, Zhang K, Strachan LR, Scalapino K, Mancianti ML, Ghadially R. The CD44+ ALDH+ population of human keratinocytes is enriched for epidermal stem cells with long-term repopulating ability. Stem Cells. 2013;31:786-799. [PubMed] [DOI] |
| 15. | Haupt Y, Alexander WS, Barri G, Klinken SP, Adams JM. Novel zinc finger gene implicated as myc collaborator by retrovirally accelerated lymphomagenesis in E mu-myc transgenic mice. Cell. 1991;65:753-763. [PubMed] [DOI] |
| 16. | Dhawan S, Tschen SI, Bhushan A. Bmi-1 regulates the Ink4a/Arf locus to control pancreatic beta-cell proliferation. Genes Dev. 2009;23:906-911. [PubMed] [DOI] |
| 17. | Jacobs JJ, Scheijen B, Voncken JW, Kieboom K, Berns A, van Lohuizen M. Bmi-1 collaborates with c-Myc in tumorigenesis by inhibiting c-Myc-induced apoptosis via INK4a/ARF. Genes Dev. 1999;13:2678-2690. [PubMed] [DOI] |
| 18. | Parry L, Young M, El Marjou F, Clarke AR. Evidence for a crucial role of paneth cells in mediating the intestinal response to injury. Stem Cells. 2013;31:776-785. [PubMed] [DOI] |
| 19. | Xie X, Ye Z, Yang D, Tao H. Effects of combined c-myc and Bmi-1 siRNAs on the growth and chemosensitivity of MG-63 osteosarcoma cells. Mol Med Rep. 2013;8:168-172. [PubMed] [DOI] |
| 20. | Renkonen S, Häyry V, Heikkilä P, Leivo I, Haglund C, Mäkitie AA, Hagström J. Stem cell-related proteins C-KIT, C-MYC and BMI-1 in juvenile nasopharyngeal angiofibroma--do they have a role? Virchows Arch. 2011;458:189-195. [PubMed] [DOI] |
| 21. | Liu Y, Yang Y, Xu H, Dong X. Implication of USP22 in the regulation of BMI-1, c-Myc, p16INK4a, p14ARF, and cyclin D2 expression in primary colorectal carcinomas. Diagn Mol Pathol. 2010;19:194-200. [PubMed] [DOI] |
| 22. | Tátrai P, Szepesi Á, Matula Z, Szigeti A, Buchan G, Mádi A, Uher F, Német K. Combined introduction of Bmi-1 and hTERT immortalizes human adipose tissue-derived stromal cells with low risk of transformation. Biochem Biophys Res Commun. 2012;422:28-35. [PubMed] [DOI] |
| 24. | Orian A, van Steensel B, Delrow J, Bussemaker HJ, Li L, Sawado T, Williams E, Loo LW, Cowley SM, Yost C. Genomic binding by the Drosophila Myc, Max, Mad/Mnt transcription factor network. Genes Dev. 2003;17:1101-1114. [PubMed] [DOI] |
| 25. | Tsuneoka M, Koda Y, Soejima M, Teye K, Kimura H. A novel myc target gene, mina53, that is involved in cell proliferation. J Biol Chem. 2002;277:35450-35459. [PubMed] [DOI] |
| 26. | Teye K, Arima N, Nakamura Y, Sakamoto K, Sueoka E, Kimura H, Tsuneoka M. Expression of Myc target gene mina53 in subtypes of human lymphoma. Oncol Rep. 2007;18:841-848. [PubMed] |
| 27. | Nomura H, Uzawa K, Ishigami T, Kouzu Y, Koike H, Ogawara K, Siiba M, Bukawa H, Yokoe H, Kubosawa H. Clinical significance of gelsolin-like actin-capping protein expression in oral carcinogenesis: an immunohistochemical study of premalignant and malignant lesions of the oral cavity. BMC Cancer. 2008;8:39. [PubMed] [DOI] |
| 28. | Kikuchi A, Yamamoto H. Tumor formation due to abnormalities in the beta-catenin-independent pathway of Wnt signaling. Cancer Sci. 2008;99:202-208. [PubMed] [DOI] |
| 29. | Okamoto M, Van Stry M, Chung L, Koyanagi M, Sun X, Suzuki Y, Ohara O, Kitamura H, Hijikata A, Kubo M. Mina, an Il4 repressor, controls T helper type 2 bias. Nat Immunol. 2009;10:872-879. [PubMed] [DOI] |
| 30. | Komiya K, Sueoka-Aragane N, Sato A, Hisatomi T, Sakuragi T, Mitsuoka M, Sato T, Hayashi S, Izumi H, Tsuneoka M. Mina53, a novel c-Myc target gene, is frequently expressed in lung cancers and exerts oncogenic property in NIH/3T3 cells. J Cancer Res Clin Oncol. 2010;136:465-473. [PubMed] [DOI] |
| 31. | Ogasawara S, Komuta M, Nakashima O, Akiba J, Tsuneoka M, Yano H. Accelerated expression of a Myc target gene Mina53 in aggressive hepatocellular carcinoma. Hepatol Res. 2010;40:330-336. [PubMed] [DOI] |
| 32. | Teye K, Tsuneoka M, Arima N, Koda Y, Nakamura Y, Ueta Y, Shirouzu K, Kimura H. Increased expression of a Myc target gene Mina53 in human colon cancer. Am J Pathol. 2004;164:205-216. [PubMed] [DOI] |