修回日期: 2015-01-10
接受日期: 2015-01-15
在线出版日期: 2015-03-08
目的: 探究济生肾气汤对移植后的干细胞在肝硬化大鼠肝脏中归巢定植能力的影响.
方法: 将分离培养得到的大鼠骨髓间充质干细胞(bone marrow mesenchymal stem cells, BMSCs)采用DAPI荧光标记, 然后将造模成功的肝硬化大鼠随机分为A、B、C、D 4组, 每组各15只. A组大鼠单纯采用BMSCs移植治疗; B组采用济生肾气汤中药灌胃联合BMSCs移植治疗; C组采用注射粒细胞集落刺激因子(granulocyte colony stimulating factor, G-CSF)联合BMSCs移植治疗; D组单纯采用济生肾气汤中药灌胃作为对照. 4 wk后分别取4组大鼠肝组织做冰冻切片, 并于荧光显微镜下观察肝组织中DAPI标记的细胞计数.
结果: 治疗后, A、B、C、D组大鼠死亡数量分别为2、2、4、0只. A、B、C、D 4组大鼠荧光显微镜(100倍视野)下观察到细胞计数分别为7.31个±1.55个、20.85个±3.21个、15.82个±1.89个、0.00个±0.00个. 组间比较显示: B组、C组大鼠荧光显微镜下观察到的细胞计数明显多于A组(P<0.01); B组大鼠荧光显微镜下观察到的细胞计数明显多于C组(P<0.01).
结论: 济生肾气汤可有效促进移植后的干细胞向肝脏归巢定植且安全性良好.
核心提示: 本研究通过观察联合不同干预条件下骨髓间充质干细胞(bone marrow mesenchymal stem cells)移植后大鼠肝组织内DAPI标记的细胞计数, 证实了济生肾气汤可有效促进移植后的干细胞向肝脏归巢定植且安全性良好.
引文著录: 刘莹, 周晓玲, 谢胜, 李泽鹏, 侯秋科, 陈峭, 李灿, 韦金秀. 济生肾气汤对干细胞移植后肝硬化大鼠干细胞归巢能力的影响. 世界华人消化杂志 2015; 23(7): 1104-1109
Revised: January 10, 2015
Accepted: January 15, 2015
Published online: March 8, 2015
AIM: To assess the effect of Jisheng Shenqi decoction on homing of stem cells to the liver after transplantation of bone marrow mesenchymal stem cells (BMSCs) in cirrhotic rats.
METHODS: BMSCs were labeled with DAPI. Forty cirrhotic rats were randomly divided into four groups (15 cirrhotic rats in each group): A, B, C and D. Group A underwent BMSC transplantation, group B was given Jisheng Shenqi decoction combined with BMSC transplantation, group C received injection of granulocyte colony stimulating factor (G-CSF) combined with BMSC transplantation, and group D was treated with Jisheng Shenqi decoction. After 4 wk of treatment, liver tissues of rats in each group were taken to observe pathological changes, and cells labeled with DAPI were counted under a fluorescence microscope.
RESULTS: After treatment, two rats were dead in each of groups A and B. In group C, 4 rats were dead. Under the fluorescence microscope (×100), the counts of cells labeled with DAPI in the four groups were 7.31 ± 1.55, 20.85 ± 3.21, 15.82 ± 1.89, and 0.00 ± 0.00, respectively. The numbers of cells labeled with DAPI in groups B and C were significantly higher than that in group A (P < 0.01), and the number in group B was significantly higher than that in group C (P < 0.01).
CONCLUSION: Jisheng Shenqi decoction can effectively promote BMSC homing to the liver after BMSC transplantation, and is safe and feasible.
- Citation: Liu Y, Zhou XL, Xie S, Li ZP, Hou QK, Chen Q, Li C, Wei JX. Effect of Jisheng Shenqi decoction on homing of stem cells to the liver after bone marrow mesenchymal stem cell transplantation in cirrhotic rats. Shijie Huaren Xiaohua Zazhi 2015; 23(7): 1104-1109
- URL: https://www.wjgnet.com/1009-3079/full/v23/i7/1104.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i7.1104
肝硬化(liver cirrhosis)是由一种或多种病因引起肝脏慢性、进行性、弥漫性病变. 其主要病理变化是在肝细胞广泛变性坏死的基础上产生肝脏纤维组织大量增生, 并形成再生结节和假小叶, 导致正常肝小叶结构和血管解剖的破坏. 该病早期可无明显临床症状, 逐渐发展则可出现肝功能损害和门静脉高压的相应表现, 晚期可出现上消化道出血、肝性脑病等多种并发症. 肝硬化是一种全球性疾病, 每年全世界有数十万人死于肝硬化. 对于肝硬化的治疗, 除了肝移植之外, 迄今没有令人满意的治疗方法, 而肝移植由于存在供肝短缺、手术损伤、免疫排斥、高额费用等缺点, 其临床应用严重受限.
近些年来多项研究[1-5]均表明, 干细胞移植对于改善终末期肝病患者的症状、肝脏炎症以及纤维化评分、肝功能指标等方面具有良好的临床疗效. 但干细胞移植治疗仍存在一些问题犹待解决, 其中如何促进移植后的干细胞向肝脏归巢定植即是亟待解决的问题之一. 我们进行的前期研究[6]表明, 联合济生肾气汤的干细胞移植较单纯的干细胞移植能够更好的改善肝硬化患者的生化指标及肝脏的病理状态. 因此我们提出假设, 济生肾气汤提高干细胞移植疗效的机制是否与改善移植后的干细胞向肝脏定植归巢能力相关, 并设计此次研究予以验证.
4周龄大鼠10只, 雌雄不限, 质量为70-92 g[提取骨髓间充质干细胞(bone marrow mesenchymal stem cells, BMSCs)用]; 健康成年SD大鼠68只, 雌雄不限, 体质量为192-236 g. 所有动物均由广西中医药大学实验动物中心提供. 动物合格证号: 桂医动字第11004号. 分离干细胞采用的低糖DMEM培养基、胎牛血清及胰蛋白酶均购自美国Gibico公司; 抗大鼠CD29-PE、抗大鼠CD45-PE、抗大鼠CD90.1-PE、CD34-PE均购自美国BioLegend公司; 4',6-二脒基-2-苯基吲哚(DAPI)购自美国Roche公司; 荧光显微镜购自日本Olympus公司; 流式细胞仪购自美国BD公司. 济生肾气汤的制备: 熟地黄80 g、山茱萸40 g、山药40 g、泽泻30 g、茯苓30 g、丹皮30 g、肉桂10 g、附子10 g、车前子20 g、牛膝20 g(以上药物由天津三延公司生产的三延牌中药煎煮机进行煎煮). 以上中药以大火煎开, 文火水煎2次过滤去渣, 合并水煎液后在中药液体包装机中浓缩成后放入4 ℃冰箱保存备用.
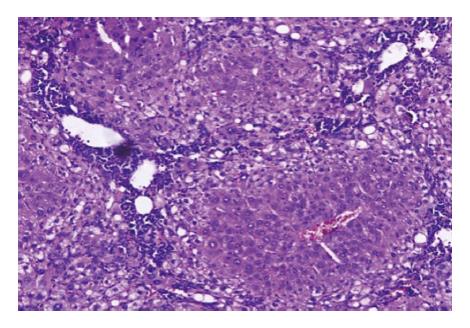
1.2.1 肝硬化大鼠造模: 参照文献[7,8], 对健康成年SD大鼠腹腔注射50%的橄榄油CCl4溶液(橄榄油与CCl4的体积比为1:1), 剂量以1 mL/kg大鼠腹部皮下注射起始, 1次/3 d, 逐渐增加到3 mL/kg, 根据大鼠体质量变化调整剂量, 以体质量不增加或者轻度降低为准, 注射2 mo后取肝组织活检, 通过肝脏组织病理学证实模型成功.
1.2.2 BMSCs分离、培养和鉴定: 将4周龄大鼠, 用异氟烷腹腔注射深度麻醉处死后, 于无菌条件下分离出大鼠的股骨和胫骨, 取其骨髓细胞制成单细胞悬液, 用加10%胎牛血清DMEM/F12细胞培养液, 接种于75 cm2的培养瓶中, 置于37 ℃, 50 mL/L CO2饱和湿度的恒温培养箱中培养, 3 d后首次换液, 以后每2-3 d换液1次, 7-10 d细胞生长融合, 经0.25%胰酶消化, 1:2传代, 其后一般3 d传代1次, 选取生长良好的P3代细胞进行实验. 之后分别加入PE标记的CD29、CD34、CD45和CD90单克隆荧光抗体, 同型对照, 室温避光孵育, 应用流式细胞仪检测BMSCs的表面标志.
1.2.3 BMSCs的标记: 取P3代BMSCs, 待细胞60%-70%融合时, 培养液中加入浓度为1 μg/mL DAPI溶液, 孵育12 h后用PBS洗涤至少6次, 去除未与细胞结合的DAPI, 在荧光显微镜下观察细胞标记情况.
1.2.4 BMSCs移植: 分别将分离、培养、鉴定并标记好的P3代BMSCs悬液1.5 mL, 经大鼠的鼠尾静脉缓慢的注入大鼠体内中. 移植数量为2×106/只.
1.2.5 分组处理及观察: 将造模成功的肝硬化大鼠随机分为A、B、C、D 4组. (1)A组大鼠单纯采用BMSCs移植治疗. 经尾静脉注入1.5 mL约含2×106的BMSCs; (2)B组采用济生肾气汤中药灌胃联合BMSCs移植治疗. 经尾静脉注入1.5 mL约含2×106的BMSCs; 灌胃: 分别于干细胞移植前后各1 wk, 采用浓煎保存的济生肾气汤中药灌胃, 3 mL/次, 1次/d(上午9点), 共灌胃14次; (3)C组采用注射粒细胞集落刺激因子(granulocyte colony stimulating factor, G-CSF)联合BMSCs移植治疗. 经尾静脉注入1.5 mL约含2×106的BMSCs; G-CSF注射方法: 于干细胞移植后1 wk内采用G-CSF皮下注射, 1次/d(上午9点), 共注射7次, 每次注射10 μg/(kg•d); (4)D组采用济生肾气汤中药灌胃治疗, 1次/d. 治疗4 wk后分别取4组大鼠肝组织做冰冻切片, 并于荧光显微镜下观察肝组织中DAPI标记的细胞计数.
统计学处理 采用SPSS19.0统计分析软件进行相关统计分析. 观察到的荧光干细胞计数以mean±SD表示, 组间均数比较采用单因素方差分析, 以P<0.05为差异具有统计学意义.
肝硬化造模过程中共死亡大鼠8只, 存活60只. 造模成功的肝硬化大鼠肝组织病理学可见假小叶的形成(图1), 日常表现为精神差, 食欲差, 喜卧少动. 将造模成功的60只大鼠随机分为A、B、C、D 4组, 每组各15例. 在治疗过程中, A组大鼠死亡2只, 均发生在干细胞移植后第2天; B组大鼠死亡2只, 1只发生在干细胞移植后第2天, 1只发生在干细胞移植后第3天; C组死亡4只, 1只死亡在干细胞移植后第2天, 2只发生在干细胞移植后第3天, 1只发生在干细胞移植后第4天. D组死亡0只.
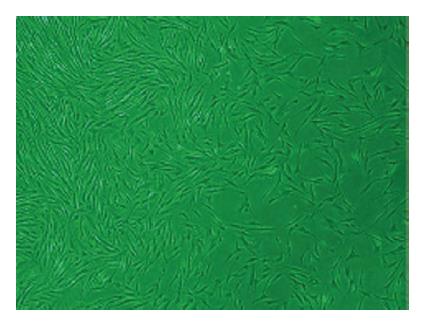
原代培养的BMSCs, 多为不规则形状, 胞核较大, 此后贴壁生长的细胞呈集落样生长, 悬浮的细胞随着换液逐渐被去掉, 生长良好的P3代细胞呈梭状, 且细胞形态更趋于一致(图2). 流式细胞仪检测表面抗原特性, 结果显示CD34、CD45的阳性率分别为0.38%、0.62%, CD29、CD90的阳性率分别为97.30%、98.50%, 说明传代贴壁生长的梭形细胞是骨髓中区别于造血干细胞的另一群处于未分化状态的非定向干细胞-BMSCs.
干细胞移植4 wk后, A、B、C、D 4组大鼠荧光显微镜(100倍视野)下观察到肝组织中DAPI标记的细胞计数分别为7.31个±1.55个、20.85个±3.21个、15.82个±1.89个、0.00个±0.00个. 组间比较显示: B组、C组大鼠荧光显微镜下观察到的细胞计数明显多于A组(P<0.01); 且B组大鼠荧光显微镜下观察到的细胞计数明显多于C组(P<0.01)(表1).
干细胞是指具有无限增殖和自我更新能力, 并能产生至少一种高度分化子代细胞的细胞群体. 目前用于疾病治疗的干细胞主要包括骨髓来源的间充质干细胞(mesenchymal stem cells, MSCs)、造血干细胞(hematopoietic stem cells, HSCs)及未分类的混合细胞. MSCs来源广泛, 可由多种组织(如骨髓、脐血、胎肝、肺及脂肪等) 中分离得到, 并具有分化为多种组织(如骨、脂肪、心肌、肝等)的能力[9-13], 已成为组织修复工程的研究热点. 研究[14]证实: MSCs经静脉注射到体内后, 可迁移定植到很多组织当中, 如肝脏、脾脏、肌肉、骨髓、肾脏以及肺脏. 我国是一个肝炎大国, 而肝硬化是大多数肝病患者疾病进展的终末阶段, 患者疾病进展至肝功能失代偿, 出现腹水、黄疸、消化系出血、感染、肝肾综合征和肝性脑病等严重并发症, 进而危及患者生命. 迄今为止, 肝移植被认为是肝硬化唯一有效的治疗方法, 但存在肝源短缺、费用昂贵和手术风险大等问题, 难以推广应用. 干细胞在一定条件下能够分化为肝样细胞, 替代和补充损伤肝细胞的作用, 为肝硬化患者的细胞治疗提供了新思路. 目前干细胞移植治疗肝硬化已在国内多家医院开展, 并展现出良好的临床疗效[2-5].
移植后的干细胞定植于肝脏, 并分化为肝组织细胞, 从而代替损伤及死亡的肝细胞, 恢复肝脏的功能, 这是我们预期的目标. 但如何促进移植后的干细胞有效的向损伤的肝组织中归巢定植仍是一个需要解决的问题. G-CSF能与粒细胞及单核巨噬细胞系的前体细胞表面特异性受体结合, 促进其增殖分化, 产生中性粒细胞、嗜酸性粒细胞及单核巨噬细胞. 有研究[15,16]显示了G-CSF可以促进骨髓单个核细胞向急性肝损伤小鼠的肝脏迁移. 其机制被认为是: G-CSF可以改变细胞因子的水平, 而肝脏是多种细胞因子的靶器官, 故可能通过细胞因子对肝脏产生直接或间接的影响; 同时, G-CSF可以动员干细胞入血, 故动员的肝系相关的干细胞可能归巢入肝脏, 参与肝再生[17]. 在本研究中, 我们可以看出联合注射G-CSF组的BMSCs移植组较单纯采用BMSCs移植组, 在移植后2 wk观察到的DAPI标记的细胞计数明显增多, 也证实了G-CSF有促进干细胞向肝脏定植归巢的能力.
肝硬化在祖国医学中称为积聚、痞块、水臌、单臌胀等. 通过临床实践, 观察到肝硬化的患者久病以"正虚"为特点, 可表现为肝、脾、肾的亏虚. 济生肾气丸源于宋代严用和的《济生方》, 是在张仲景创制的经方金匮肾气丸基础上加用车前子、牛膝化裁而成, 该方组方严谨, 配伍精当, 方药组成包括: 熟地黄、山茱萸、山药、泽泻、茯苓、丹皮、肉桂、附子、车前子、牛膝. 本方有填精补肾、温阳利水的功效, 对于临床上肝硬化有肝肾不足兼水湿不化者尤其合适. 本方通过填补肾水以滋养肝木, 温通肾阳以助肝气升发, 虽以补为主, 但补中有泻无壅滞之嫌; 虽可利水, 但利中有补无伤阴之弊. 我们多年临床观察发现, 济生肾气汤治疗肝硬化安全有效, 前期研究[6]表明, 联合济生肾气丸能够明显提高干细胞移植的临床治疗效果, 包括肝功能、肝Child-Pugh评分以及肝脏病理的改善. 但作用机制尚不明确, 我们考虑是否与促进干细胞向肝脏定位移植有关. 本研究中, 联合济生肾气汤中药灌胃组的大鼠肝组织中观察到的DAPI标记的细胞计数较单纯采用干细胞移植及联合注射G-CSF组明显增多, 可以证实济生肾气汤可以促进移植后的干细胞向肝脏定植归巢.
在安全性方面, 4组当中C组(联合注射G-CSF组)大鼠死亡最多, 死亡4只; A、B组均为死亡2只, 大鼠死亡均发生在干细胞移植后2-3天内(考虑与干细胞移植相关); D组无大鼠死亡. 由此可以看出联合济生肾气汤灌胃的干细胞移植较联合注射G-CSF的干细胞移植更加安全.
尽管如此, 本研究仍为小样本量的研究, 对于济生肾气汤改善移植后干细胞肝脏归巢定植能力的机制, 也需进一步深化研究. 且出于伦理学考虑, 目前关于干细胞归巢的研究尚停留在动物试验层面, 其在人体内的情况是否相同或类似, 仍有待将来的研究不断的完善和证实.
近些年关于干细胞移植临床治疗肝硬化的研究报道越来越多, 其临床疗效逐渐得到证实, 但仍有一些问题尚未解决, 比如如何促进干细胞向肝脏归巢定植.
黄颖秋, 教授, 本溪钢铁(集团)总医院消化内科
多项临床研究表明: 粒细胞集落刺激因子(granulocyte colony stimulating factor, G-CSF)可以有效的促进骨髓单个核细胞向急性肝损伤小鼠的肝脏迁移. 但其临床有效性及安全性尚未得以验证. 近些年逐渐涌现一些关于中药在干细胞移植过程中协同增效的临床报道, 但机制尚未明确.
临床研究表明, 联合济生肾气汤的干细胞移植较单纯的干细胞移植能够更好的改善肝硬化患者的生化指标及肝脏的病理状态.
本研究通过与疗效得到认可的G-CSF相对比, 证实济生肾气汤改善干细胞归巢的有效性和安全性, 同时验证了济生肾气汤在干细胞移植当中协同增效的机制之一.
本研究通过小样本研究证实了济生肾气汤可以有效改善干细胞的归巢, 而且安全可行, 对于其进一步的临床研究以及联合中药治疗的干细胞移植治疗肝硬化的中西医结合方案的初定提供了一定的依据.
DAPI: 是一种荧光染料, 脂溶性, 能够穿透细胞膜深入细胞核, 染色较牢固, 是观测细胞在体内分布和存在的重要手段, 缺点是不能观测细胞动态;
干细胞的归巢能力: 指移植后的BMSCs向肝脏组织迁移和定植的能力.
本文就济生肾气汤提高干细胞移植疗效的机制展开研究, 创新性较好. 本文发现济生肾气汤可有效促进移植后的干细胞向肝脏归巢定植且安全性良好, 对进一步的临床研究提供了实验依据, 学术价值较好.
编辑: 郭鹏 电编: 都珍珍
| 2. | 乔 飞, 张 馨, 盛 云峰, 耿 家宝, 陈 小军, 钟 晶, 赵 颖, 隋 云华, 何 长伦, 高 蕾. 脐带血干细胞治疗肝硬化失代偿期疗效观察. 中国肝脏病杂志. 2011;3:10-13. |
| 4. | 郭 健, 陈 洪, 王 智. 干细胞移植治疗肝硬化Meta分析. 东南大学学报(医学版). 2013;32:429-436. |
| 7. | 高 琳琳, 关 方霞, 郑 鹏远, 杨 波, 迟 连凯, 梁 硕, 邹 润钦, 刘 志强. 人羊膜脐带源性间充质干细胞对大鼠肝硬化的治疗作用. 世界华人消化杂志. 2012;20:916-922. [DOI] |
| 9. | Battiwalla M, Hematti P. Mesenchymal stem cells in hematopoietic stem cell transplantation. Cytotherapy. 2009;11:503-515. [PubMed] [DOI] |
| 10. | Ni WF, Yin LH, Lu J, Xu HZ, Chi YL, Wu JB, Zhang N. In vitro neural differentiation of bone marrow stromal cells induced by cocultured olfactory ensheathing cells. Neurosci Lett. 2010;475:99-103. [PubMed] [DOI] |
| 11. | Gang EJ, Hong SH, Jeong JA, Hwang SH, Kim SW, Yang IH, Ahn C, Han H, Kim H. In vitro mesengenic potential of human umbilical cord blood-derived mesenchymal stem cells. Biochem Biophys Res Commun. 2004;321:102-108. [PubMed] [DOI] |
| 12. | Goodwin HS, Bicknese AR, Chien SN, Bogucki BD, Quinn CO, Wall DA. Multilineage differentiation activity by cells isolated from umbilical cord blood: expression of bone, fat, and neural markers. Biol Blood Marrow Transplant. 2001;7:581-588. [PubMed] [DOI] |
| 13. | Gang EJ, Jeong JA, Hong SH, Hwang SH, Kim SW, Yang IH, Ahn C, Han H, Kim H. Skeletal myogenic differentiation of mesenchymal stem cells isolated from human umbilical cord blood. Stem Cells. 2004;22:617-624. [PubMed] [DOI] |
| 14. | Rochefort GY, Delorme B, Lopez A, Hérault O, Bonnet P, Charbord P, Eder V, Domenech J. Multipotential mesenchymal stem cells are mobilized into peripheral blood by hypoxia. Stem Cells. 2006;24:2202-2208. [PubMed] [DOI] |
| 15. | 金 世柱, 韩 明子, 王 新红. 分泌型与包涵体型G-CSF促进骨髓单个核细胞向肝脏迁移比较. 胃肠病学与肝脏病学杂志. 2008;17:639-641. |
| 16. | 金 世柱, 韩 明子, 孙 立影, 耿 莹, 洪 钰. 粒细胞集落刺激因子促进自体骨髓单个核细胞向急性肝损伤小鼠肝脏迁移的实验研究. 胃肠病学与肝脏病学杂志. 2008;17:230-233. |