修回日期: 2014-12-28
接受日期: 2015-01-04
在线出版日期: 2015-02-28
目的: 探讨小肝癌(small hepatocellular carcinoma, SHCC)超声造影(contrast-enhanced ultrasonography, CEUS)特征判断肿瘤分化程度及病理组织学类型的价值.
方法: 对90例经手术病理证实的SHCC病灶CEUS表现进行了回顾性分析, 比较并分析不同分化程度和病理类型SHCC病灶的回声增强模式及CEUS定量参数.
结果: 经病理检查结果显示, 90例SHCC病灶中高分化病灶48例, 中分化病灶30例, 低分化病灶12例; 梁索型56例, 腺管型16例, 实体型11例, 纤维硬化型7例. 高分化组的消退时间显著高于中分化组与低分化组(P = 0.000, P = 0.006). 在门脉相、延迟相, 不同分化程度SHCC回声增强模式差异有统计学意义(P = 0.000), 低分化组的低增强比例与呈现"快进快出"增强模式的比例显著高于中分化组和高分化组(均P<0.05). 各病理类型SHCC的回声消退时间存在差异(P = 0.021), 与梁索型(100.12 s±33.00 s)和假腺管型(98.98 s±30.20 s)相比, 实体型SHCC消退时间(66.20 s±10.54 s)显著缩短(均P<0.05). 在门脉相及延迟相, 梁索型、假腺管型、实体型的SHCC病灶中, 分别有77%、75%、100%病灶呈现"快进快出"增强模式, 而纤维硬化型的病灶中, 100%呈"快进慢出"增强表现, 差异有统计学意义(P<0.05).
结论: 初步认为CEUS对判断SHCC分化程度和病理类型具有重要的参考价值, 但仍然需要更多的循证依据.
核心提示: 本研究将不同分化程度、病理类型的小肝癌(small hepatocellular carcinoma, SHCC)患者的超声造影(contrast-enhanced ultrasonography)做以回顾性分析, 研究结果提示SHCC的超声回声特征, 为判断肿瘤的分化程度及病理类型提供了客观依据, 有助于其鉴别, 在影像学方面为早期诊断和临床采取合理的治疗方式及治疗评估提供了依据.
引文著录: 任卫平, 俞明华, 徐萍. 超声造影判断小肝癌的分化程度和病理类型的价值. 世界华人消化杂志 2015; 23(6): 907-913
Revised: December 28, 2014
Accepted: January 4, 2015
Published online: February 28, 2015
AIM: To investigate the value of contrast-enhanced ultrasonography (CEUS) in assessing differentiation degree and pathological type of small hepatocellular carcinoma (SHCC).
METHODS: Ninety SHCC lesions examined by CEUS were retrospectively analyzed. The enhancement time and patterns were compared and analyzed according to the differentiation degree and pathological type of SHCC.
RESULTS: Of the 90 lesions, 48 had high differentiation, 30 had moderate differentiation, and 12 had low differentiation; 56 were trabecular type, 16 glandular type, 11 compact type and 7 cirrhotic type. Compared with patients with moderate or low differentiation lesions, those with high differentiation lesions showed significantly longer washout time (P = 0.000, P = 0.006). In the portal venous and late phases, the enhancement patterns showed statistically significant differences among lesions with different differentiation degrees (P = 0.000): compared with patients with moderate and high differentiation lesions, those with lower differentiation lesions showed a significantly higher rate of hypoechoic nodules and fast wash-in and wash-out enhancement pattern (P < 0.05). The difference of washout time was statistically significant among pathological types of SHCC (P = 0.021). Compared with the trabecular (100.12 s ± 33.00 s) and glandular types (98.98 s ± 30.20 s), the washout time was significantly shorter for the compact type (66.20 s ± 10.54 s). In the portal venous and late phases, the difference of enhancement patterns was statistically significant among pathological types of SHCC (P = 0.000, P = 0.000). In the trabecular, glandular and compact types, 77%, 75%, and 100% of lesions exhibited a fast wash-in and wash-out enhancement pattern, respectively. However, for the cirrhotic type, all lesions exhibited a fast wash-in and slow wash-out enhancement pattern.
CONCLUSION: CEUS may provide valuable information for assessing differentiation degree and histopathologic type of SHCC. More studies are needed to provide more evidence.
- Citation: Ren WP, Yu MH, Xu P. Value of contrast-enhanced ultrasound in assessing differentiation degree and pathological type of small hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2015; 23(6): 907-913
- URL: https://www.wjgnet.com/1009-3079/full/v23/i6/907.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i6.907
近年来, 原发性肝癌发病率、死亡率逐年增高, 已成为严重危害人类健康的恶性肿瘤之一[1]. 小肝癌(small hepatocellular carcinoma, SHCC)一般被定义为单个结节直径≤3 cm, 或相邻癌结节直径总和<3 cm的肝细胞癌[2], 及早明确SHCC的分化程度和病理类型对临床治疗方法的选择及评估预后具有重要意义[3]. 目前SHCC的诊断存在一定的局限, 临床上多采用手术切除或穿刺活检来确定其分化程度及病理类型, 但由于存在操作易导致肿瘤转移, 创伤较大、花费较高等缺陷, 限制了其广泛应用[4,5]. 近年来, 新一代超声造影剂的应用, 使实时动态观察肿瘤血管及微循环的灌注时相变化成为可能, 从而为早期明确SHCC的分化程度和病理类型提供了新途径, 但缺乏足够的循证依据, 其临床价值尚存较大争议[6,7]. 基于以上背景, 本研究将不同分化程度、病理类型的SHCC患者的超声造影(contrast-enhanced ultrasonography, CEUS)做回顾性分析, 进而探讨CEUS对SHCC分化程度和病理类型有无判断价值.
选取2012-05/2013-12在宁波市鄞州三院行CEUS并经手术病理证实为SHCC的85例患者为研究对象, 比较并分析其CEUS表现. 纳入标准: (1)经手术病理证实为原发性SHCC患者; (2)无肝外转移者; (3)无肝癌治疗史者. 85例患者中男64例, 女21例; 平均年龄58.4岁±10.6岁; 肿瘤平均直径19.0 mm±10.8 mm; 肿瘤病灶数为90个. 本实验所采用的仪器情况详如表1.
| 仪器/试剂 | 型号/规格 | 参数 | 供应商 |
| 彩色多普勒超声诊断仪 | Sequoia512型 | 探头4C1,频率1.0-4.0 MHz | 德国西门子公司 |
| 超声造影剂 | SonoVue | 造影微泡为磷脂微囊的六氟化硫,直径为2.5 μm, pH为4.5-7.5 | 意大利博莱科公司 |
| 病理显微镜 | CX31 | MCX51型镜体203 mm×145 mm | 日本奥林巴斯 |
1.2.1 造影: 造影剂冻干粉使用前经5.0 mL 0.9%氯化钠溶液溶解, 随即振荡混匀成悬浊液, 用注射器抽吸2.4 mL, 通过肘部静脉快速注入[8].
1.2.2 超声检查: 造影前以二维及彩色多普勒超声观察病灶的数目、位置、形态、大小、边界、内部回声情况. 在低机械指数状态(机械指数<0.1)的造影模式下, 选择病灶显示最佳切面后切换至CEUS显像模式, 实时观察不同时相状态下病灶及周围正常肝组织回声强度[8], 详如表2. 连续记录5 min造影图像并存盘.
| 时相 | 注射造影剂后时长(s) |
| 动脉相 | 5-30 |
| 门脉相 | 31-120 |
| 延迟相 | 121-360 |
1.2.3 CEUS定量参数分析: 造影完成后回放录像, 启动时间-信号强度曲线(time-signal intensity curve, TIC)分析软件, 将固定大小的取样框置于病灶区, 同时与病灶周围等面积正常组织行对照, 绘制TIC, 每个病灶均需于TIC曲线获取以下定量参数: 开始增强时间、达峰时间、消退时间[8].
1.2.4 SHCC病理分级与分型: 90例病灶均CEUS后10 d内, 进行了手术或穿刺获取组织样本, 获取的样本首先用40 g/L甲醛固定, 之后用石蜡包埋切片, 再进行HE染色, 然后通过镜检观察其病理特征, 确定病理学分型及分级[8,9].
统计学处理 采用SPSS17.0统计软件. 计量资料(CEUS定量参数)以mean±SD表示. 采用KruskalWallis H检验比较不同分化程度的SHCC患者CEUS定量参数之间的差异; 采用R×C表χ2检验比较不同分化程度患者增强模式的差异; 采用CMH χ2检验比较不同病理类型患者增强模式的差异. 以P<0.05为差异有统计学意义.
经病理检查结果显示, SHCC分化程度与病理分型详如表3.
| 病理分型 | 数量(个) | 分化程度 | 数量(个) |
| 梁索型 | 56 | 高分化 | 48 |
| 腺管型 | 16 | 中分化 | 30 |
| 实体型 | 11 | 低分化 | 12 |
| 纤维硬化型 | 7 | - |
SHCC病灶的回声消退时间随着分化程度的降低, 而逐渐缩短, 差异有统计学意义(P = 0.000), 高分化SHCC的消退时间显著低于中分化及高分化SHCC(P = 0.000, P = 0.006)(表4).
| 分化程度 | 病灶(n) | 始增时间(s) | 达峰时间(s) | 消退时间(s) |
| 高分化 | 48 | 14.40±3.60 | 29.10±9.84 | 98.12±33.00 |
| 中分化 | 30 | 13.40±2.45 | 28.30±13.80 | 69.98±30.29 |
| 低分化 | 12 | 12.90±2.35 | 26.60±12.45 | 40.92±9.24 |
| χ2值 | - | 4.015 | 5.600 | 64.980 |
| P值 | - | 0.135 | 0.058 | 0.000 |
在门脉相、延迟相, 不同分化程度SHCC间的回声增强模式有明显差异(P = 0.000), 分化程度较低者, 其门脉相及延迟相的低增强比例较高, 同时呈现"快进快出"增强模式的比例亦较高. 在高分化SHCC病灶中, 67%病灶于90 s内快速退出, 呈"快进快出"增强模式, 33%病灶呈现"快进慢出"增强模式. 在中分化SHCC病灶中, 83%病灶呈现"快进快出"增强模式. 在低分化SHCC病灶中, 全部病灶呈现"快进快出"增强模式(表5).
| 分化程度 | 病灶(n) | 动脉相n(%) | 门脉相n(%) | 延迟相n(%) | |||||
| 高增强 | 等增强 | 高增强 | 等增强 | 低增强 | 高增强 | 等增强 | 低增强 | ||
| 高分化 | 48 | 42(88) | 6(12) | 16(33) | 11(23) | 21(44) | 10(21) | 9(19) | 29(60) |
| 中分化 | 30 | 26(87) | 4(13) | 5(17) | 4(13) | 21(70) | 0(0) | 0(20) | 24(80) |
| 低分化 | 12 | 12(100) | 0(0) | 0(0) | 3(25) | 9(75) | 0(0) | 0(0) | 12(100) |
| χ2值 | - | 0.128 | 8.120 | 14.040 | |||||
| P值 | - | 0.990 | 0.019 | 0.006 | |||||
各病理类型SHCC的回声消退时间存在差异, 且差异有统计学意义(P = 0.021). 其中实体型SHCC消退时间(66.20 s±10.54 s)显著早于梁索型(100.12 s±33.00 s)和假腺管型(98.98 s±30.20 s)
(P = 0.001, P = 0.002)(表6).
| 分化程度 | 病灶(n) | 开始增强时间(s) | 达峰时间(s) | 消退时间(s) |
| 梁索型 | 56 | 14.47±2.77 | 30.45±9.90 | 100.12±33.00 |
| 假腺管型 | 16 | 13.70±2.75 | 29.39±11.03 | 98.98±30.20 |
| 实体型 | 11 | 12.99±2.91 | 27.67±12.75 | 66.20±10.54 |
| 纤维硬化型 | 7 | 12.60±2.86 | 27.90±13.12 | 80.23±18.98 |
| χ2值 | - | 4.001 | 5.405 | 18.390 |
| P值 | - | 0.149 | 0.069 | 0.021 |
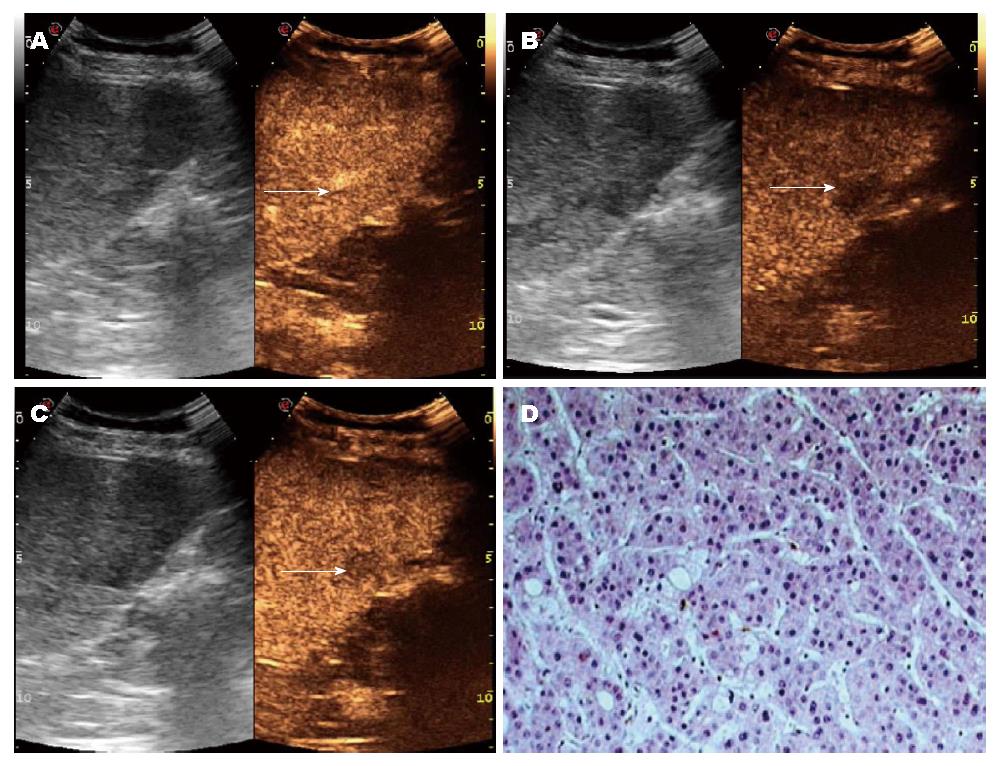
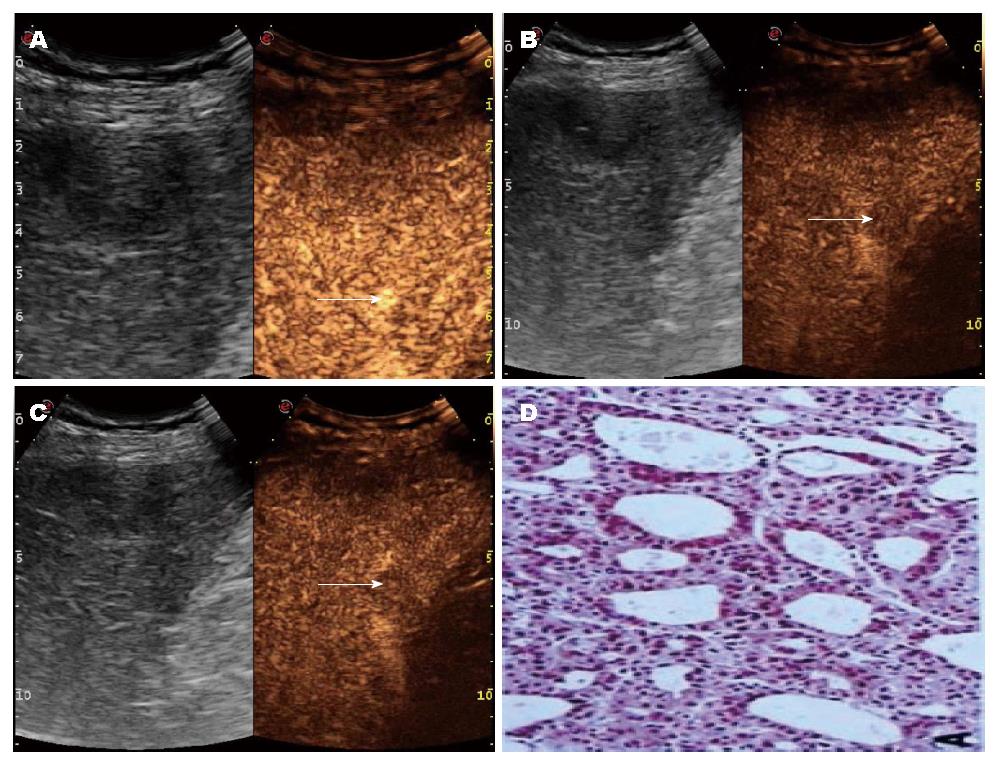
在门静脉相及延迟相, 各不同病理类型SHCC间回声增强模式间的差异有统计学意义(P = 0.000, P = 0.000). 在梁索型、假腺管型、实体型病灶中, 分别有77%、75%、100%病灶造影剂在90 s内快速退出, 呈现"快进快出"增强模式(图1, 图2); 而纤维硬化型病灶中, 100%病灶呈"快进慢出"增强表现.
在门脉相及延迟相, 梁索型与实体型、纤维硬化型、假腺管型与实体型、纤维硬化型、实体型与纤维硬化型间, 增强模式的差异均有统计学意义(均P<0.05)(表7).
| 病理类型 | 病灶(n) | 动脉相n(%) | 门脉相n(%) | 延迟相n(%) | |||||
| 高增强 | 等增强 | 高增强 | 等增强 | 低增强 | 高增强 | 等增强 | 低增强 | ||
| 梁索型 | 56 | 49(87) | 7(13) | 13(23) | 11(20) | 32(57) | 5(9) | 8(14) | 43(77) |
| 假腺管型 | 16 | 12(80) | 4(20) | 4(25) | 4(25) | 8(50) | 0(0) | 4(25) | 12(75) |
| 实体型 | 11 | 11(100) | 0(0) | 0(0) | 0(0) | 11(100) | 0(0) | 0(0) | 11(100) |
| 纤维硬化型 | 7 | 5(71) | 2(29) | 7(100) | 0(0) | 0(0) | 5(71) | 2(29) | 0(0) |
| χ2值 | - | 2.110 | 16.690 | 18.130 | |||||
| P值 | - | 0.550 | 0.000 | 0.000 | |||||
SHCC常常无明显临床症状和体征, 因而又称为亚临床肝癌或早期肝癌, 其早期诊断与治疗一直是临床研究的热点和难题[10]. 临床上常以手术切除活检或穿刺活检来实现对肝癌明确诊断, 但SHCC病灶通常较小, 因而易造成取样误差, 常不能实现对SHCC的早期诊断[11]. 常规彩超常在临床作为肝癌首选筛选检查, 但由于其存在对微血管显示困难、反映血流动力学信息有限等局限, 敏感性较低[11]. 近年来CEUS技术得到发展, 可以通过造影剂微气泡的作用, 动态检测肿瘤组织中血流灌注状态, 因而进一步增强了对肝癌病灶内细微血流信号的显示, 对肝癌的早期诊断具有重大意义[12]. 近年来国内外有学者亦发现肝细胞癌的CEUS特征与其病理类型及分化程度有一定的相关性[13,14], 但其循征依据尚不充分[10]. 基于以上背景, 本研究将不同分化程度、病理类型的SHCC患者的CEUS做回顾性分析, 以探讨CEUS与SHCC分化程度和病理类型有无相关联系, 从而为治疗途径和方法的选择提供早期依据.
在本研究中, SHCC病灶造影剂消退时间随着分化程度的降低而逐渐缩短, 在门脉相、延迟相, 不同分化程度SHCC回声增强模式存在差异, 分化程度越低, 低增强比例越高, 同时呈现"快进快出"增强模式的比例越高. 以上结果提示分化程度低的SHCC造影剂廓清时间越快. 考虑原因为不同分化程度的SHCC, 其病灶血流灌注情况亦不相同, 而CEUS灌注特征与肿瘤的血供关系密切, 多数SHCC病灶的血供来源于肝动脉, 少数SHCC病灶由肝动脉和门静脉双重供应, 而低分化肿瘤大多为肝动脉供血, 血供较丰富, 高分化肿瘤常有双重血供[15,16]. 因而分化程度越低的SHCC病灶肝动脉供血越多, 造影剂可通过灌注量大且流速快的动脉迅速进入SHCC病灶, 其CEUS多表现为动脉期迅速增强, 而其门静脉供血较少, 门脉期造影剂迅速廓清, 即"快进快出"增强模式, 且消退时间较短. 正常肝组织由于主要由静脉供血, 所以增强较晚, 动脉期增强不显著, 因此当肿瘤病灶的造影剂迅速廓清时, 肿瘤内回声强度明显低于周围肝组织[16,17].
另外本研究显示, 各病理类型SHCC的回声消退时间存在差异, 其中实体型SHCC消退时间显著早于梁索型和假腺管型. 同时在门静脉相及延迟相, 各不同病理类型SHCC间回声增强模式间的差异有统计学意义. 在梁索型、假腺管型、实体型SHCC病灶中, 分别有77%、75%、100%病灶造影剂在90 s内快速退出, 呈现"快进快出"增强模式; 而纤维硬化型病灶中, 100%病灶呈"快进慢出"增强表现. 梁索型SHCC病理特征为癌细胞紧密排列的索状结构, 常常以高中分化为主[18,19]. 假腺管型的病理特征为呈腺管状排列的癌组织[18]. 本研究显示, 梁索型和假腺管型SHCC的超声特性与高中分化肿瘤基本类似, 表现出"快进快出""快进慢出"两种增强模式, 与以往研究结果一致[10]. 实体型SHCC常以低分化为主, 病理特点为癌细胞紧密排列成巢状或片状结构[19,20]. 本研究发现, 11例实体性型SHCC全部表现为"高-低-低"的增强模式, 且与梁索型和假腺管型SHCC相比, 其门静脉相及延迟相消退时间显著缩短. 考虑原因为可能是实体型分化程度较低, 血液供应主要来源于肝动脉, 门脉期近乎无血流灌注, 使得造影剂不易滞留而廓清迅速. SHCC病灶通常较小, 其内部无明显变性坏死, 从而表现出上述超声特征[19,20]. 在SHCC中, 纤维硬化型病例较少见, 本研究仅发现7例, 其病理特征为癌组织中弥漫纤维基质[19,20]. 本研究显示, 其主要超声特点为门静脉相呈高增强, 延迟相呈高或等增强, 考虑原因为致密的纤维组织将癌细胞包围, 使造影剂停留在病灶内的时间延长, 因而病灶在门静脉相及延迟相灶持续强化[18,19].
总之, 初步认为SHCC的超声回声特征, 为判断肿瘤的分化程度及病理类型提供了客观依据, 有助于其鉴别, 在影像学方面为早期诊断和临床采取合理的治疗方式及治疗评估提供了依据. 但本研究由于病例数量较少, 尚存在一定的局限性, 因而SHCC超声回声特征与分化程度及病理分型的联系还需更多循证依据和进一步的研究.
近年来, 原发性肝癌发病率、死亡率逐年增高, 已成为严重危害人类健康的恶性肿瘤之一. 其中小肝癌(small hepatocellular carcinoma, SHCC)一般被定义为单个结节直径≤3 cm, 或相邻癌结节直径总和<3 cm的肝细胞癌. 目前SHCC的诊断存在一定的局限, 临床上多采用手术切除或穿刺活检来确定其分化程度及病理类型, 但由于存在操作易导致肿瘤转移, 创伤较大、花费较高等缺陷, 限制了其广泛应用. 常规彩超常在临床作为肝癌首选筛选检查, 但由于其存在对微血管显示困难、反映血流动力学信息有限等局限, 敏感性较低.
程树群, 教授, 中国人民解放军第二军医大学东方肝胆外科医院综合治疗六科
随着新一代超声造影剂及造影相关技术的发展, 克服了常规二维及彩色多普勒超声的局限性, 使实时动态观察肿瘤血管及微循环的灌注时相变化成为可能, 从而为早期诊断SHCC, 并明确其分化程度和病理类型提供了新途径.
既往一些研究提示超声造影(contrast-enhanced ultrasonography, CEUS)对SHCC的诊断及其病理分化程度、病理类型判断具有一定价值. 但同时有研究结果提示, CEUS特征与病灶的病理组织学类型及分化程度并无严格的对应关系.
本研究将不同分化程度、病理类型的SHCC患者的CEUS做以回顾性分析, 进而探讨CEUS对SHCC分化程度和病理类型有无判断价值.
CEUS的回声特征为判断肿瘤的分化程度及病理类型提供了客观依据, 有助于其鉴别, 在影像学方面为早期诊断和临床采取合理的治疗方式及治疗评估提供了依据.
小肝癌(SHCC): 一般被定义为单个结节直径≤3 cm, 或相邻癌结节直径总和<3 cm的肝细胞癌; 动脉相、门脉相、延迟相: CEUS过程分为3个时相, 注射造影剂后5-30 s为动脉相, 31-120 s为门脉相, 121-360 s为延迟相; 开始增强时间: 造影剂开始在病灶内出现的时间; 达峰时间: 病灶时间-信号强度曲线(time-signal intensity curve, TIC)曲线峰顶对应的时间; 始退时间: 病灶TIC达峰后与肝实质TIC交叉时对应的时间.
本研究选题实用, 设计科学, 结果可靠, 有较好的意义.
编辑: 韦元涛 电编: 闫晋利
| 6. | Chami L, Lassau N, Malka D, Ducreux M, Bidault S, Roche A, Elias D. Benefits of contrast-enhanced sonography for the detection of liver lesions: comparison with histologic findings. AJR Am J Roentgenol. 2008;190:683-690. [PubMed] [DOI] |
| 8. | 丁 红, 王 文平, 黄 备建, 李 超伦, 魏 瑞雪, 何 婉媛, 张 晖. 肝脏实质性占位病灶的超声造影检测. 中华医学超声杂志(电子版). 2007;4:28-31. |
| 10. | 廖 继安, 王 爱玉, 张 化诚, 金 夏祥. 不同分化程度、不同病理类型小肝癌患者超声造影表现分析. 中华医学超声杂志(电子版). 2012;9:136-141. |
| 12. | 虞 梅, 梅 琪, 倪 娟, 钦 晨, 徐 祥勇, 傅 庆印, 沙 红芳, 翟 凌云, 王 钢, 张 菁. 肝超声造影监测和早期诊断微小肝癌的应用价值. 中国癌症杂志. 2014;24:203-207. |
| 13. | 范 智慧, 陈 敏华, 戴 莹, 王 艳滨, 严 昆, 吴 薇, 杨 薇, 尹 珊珊, 李 吉友. 原发性肝细胞癌不同分化程度超声造影模式分析. 中华医学超声杂志(电子版). 2006;3:152-154. |
| 14. | Quaia E, Degobbis F, Tona G, Mosconi E, Bertolotto M, Pozzi Mucelli R. [Differential patterns of contrast enhancement in different focal liver lesions after injection of the microbubble US contrast agent SonoVue]. Radiol Med. 2004;107:155-165. [PubMed] |
| 16. | Nicolau C, Catalá V, Vilana R, Gilabert R, Bianchi L, Solé M, Pagés M, Brú C. Evaluation of hepatocellular carcinoma using SonoVue, a second generation ultrasound contrast agent: correlation with cellular differentiation. Eur Radiol. 2004;14:1092-1099. [PubMed] [DOI] |