修回日期: 2014-12-10
接受日期: 2014-12-31
在线出版日期: 2015-02-28
我国肝癌患者就诊时多数处于中晚期. 联合肝脏离断和门静脉结扎的二步肝切除术(associating liver partition and portal vein ligation for staged hepatectomy, ALPPS)是当前的创新手术方式, 国外多用于治疗无肝病基础的巨大或多发的转移性肝癌的治疗. 本例用ALPPS成功地治疗合并较重肝硬化的巨大肝细胞癌. 介绍了术中联合防黏连膜肝周隔绝和肝动脉和门静脉放置治疗泵, 经治疗泵注射含血管内皮抑素化疗栓塞乳剂防治肿瘤复发的方法. 随访3 mo未见复发.
核心提示: 本例用联合肝脏离断和门静脉结扎的二步肝切除术(associating liver partition and portal vein ligation for staged hepatectomy)成功地治疗合并较重肝硬化的巨大肝细胞癌. 介绍了术中联合防黏连膜肝周隔绝和肝动脉和门静脉放置治疗泵, 经治疗泵注射含血管内皮抑素化疗栓塞乳剂防治肿瘤复发的方法. 随访3 mo未见复发.
引文著录: 刘静, 陈永艺, 曾荣耀, 徐政, 姚志华, 陈艺辉, 柯恩明, 谢宝强, 周水添. 联合肝脏离断和门静脉结扎的二步肝切除术治疗合并较重肝硬化肝癌1例. 世界华人消化杂志 2015; 23(6): 1038-1044
Revised: December 10, 2014
Accepted: December 31, 2014
Published online: February 28, 2015
Associating liver partition and portal vein ligation for staged hepatectomy (ALPPS) is a novel method for treating metastatic hepatocellular carcinoma (HCC) with tremendous or multiple tumors without liver cirrhosis. Here we report that ALPPS was used successfully in a man with huge HCC in the left lobe of the liver complicated with severe liver cirrhosis. Absorbable antistick film around remnant liver was inserted and drug delivery systems (DDS) to proper hepatic artery and portal vein were respectively embedded in the second step to reduce HCC relapse by chemoembolization with emulsion including Endostar through the two DDS. Relapse of HCC was not found three months after surgery.
- Citation: Liu J, Chen YY, Zeng RY, Xu Z, Yao ZH, Chen YH, Ke EM, Xie BQ, Zhou ST. Associating liver partition and portal vein ligation for staged hepatectomy in a hepatocellular carcinoma patient with severe liver cirrhosis. Shijie Huaren Xiaohua Zazhi 2015; 23(6): 1038-1044
- URL: https://www.wjgnet.com/1009-3079/full/v23/i6/1038.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i6.1038
肝切除术仍是目前治疗原发性肝癌(hepatocellular carcinoma, HCC)的首选方法, 我国80%的HCC患者合并不同程度的肝硬化, 大范围肝切除术后剩余肝脏体积不足, 肝功能无法代偿从而引起致命的肝衰竭, 致使根治性切除率不足30%. 联合肝脏离断和门静脉结扎的二步肝切除术(associating liver partition and portal vein ligation for staged hepatectomy, ALPPS)是一个非常新的外科手术[1], 被誉为肝胆外科领域革命性突破, 可用于治疗巨大或多发性HCC. 第1步手术后剩余肝脏体积可在第7天左右迅速增大74%-99%, 继而可安全切除肿瘤[1,2]. ALPPS为既往不具有安全手术条件的患者获得短期根治性切除的机会. 解放军第175医院普通外科于2014-07对1例合并较重的乙型病毒性肝炎后较重肝硬化左肝巨大HCC患者成功施行ALPPS取得了良好的疗效, 现报道如下.
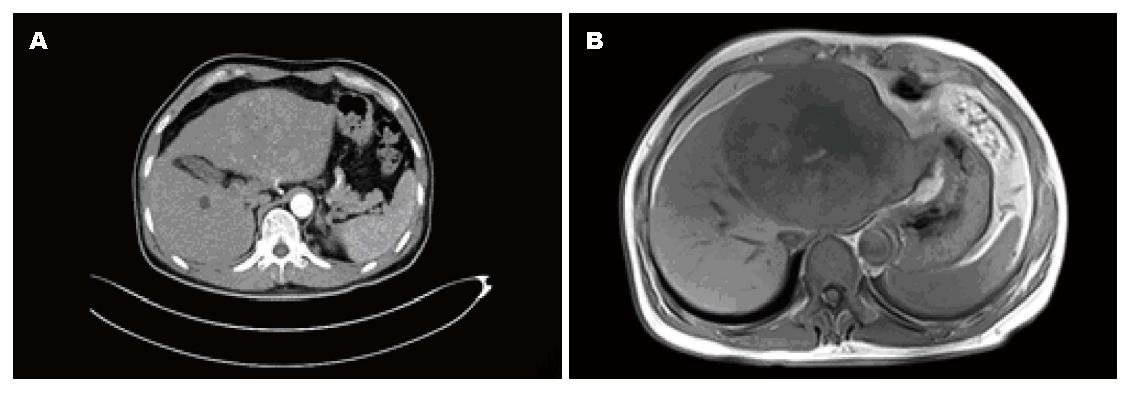
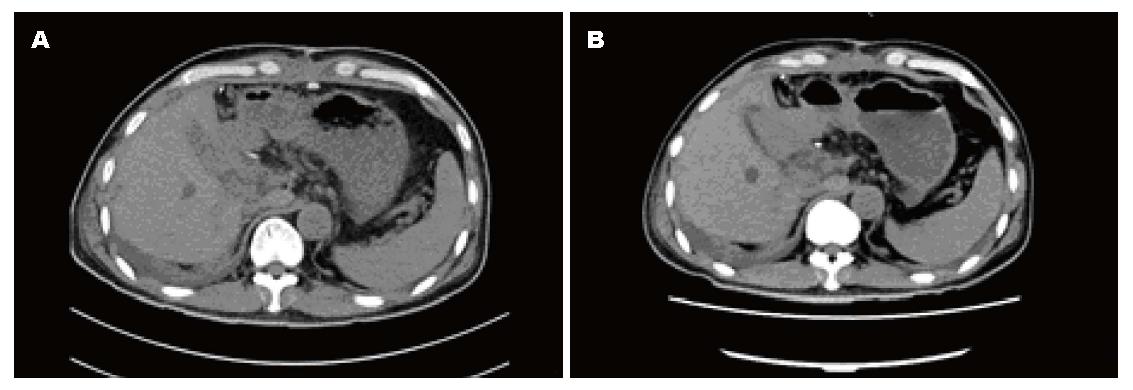
男, 52岁, 因发现HCC 2 d于2014-07-28入院, 无腹痛、腹胀, 恶心等不适, 1995年始发现"乙型病毒性肝炎", 2004年出现前胸蜘蛛痣, 未抗病毒等治疗, 1年前被诊断为高血压. 查体见一般情况好, 身高: 172 cm, 体质量70 kg, 前胸6个胸蜘蛛痣, 上腹部稍隆起, 剑突下5 cm触及质地硬包块, 全腹无压痛, 反跳痛, 无肝掌, 血甲胎蛋白(α-fetoprotein, AFP)3409 ng/mL, 乙型肝炎"小三阳", 抗-丙型肝炎病毒(hepatitis C virus, HCV)阴性, HBV<500拷贝/mL, 凝血五项纤维蛋白原(fibrinogen, FIB)5.85 g/L稍高外, 肝功能仅白蛋白(albumin, ALB)35.2 g/L稍低, 肾功能, 心肺功能正常, 电子计算机断层扫描(computed tomography, CT)、磁共振成像(magnetic resonance imaging, MRI)示肝左叶巨大HCC, 肝中静脉部分显影, 肝左叶及肿瘤体积1166 mL, 右叶体积816 mL, 脾脏增大至9肋单元(图1), 左胸腔积液并左肺不张. 经鼓励患者咳嗽促进肺复张, 莫西沙星输注抗感染, 用恩替卡韦抗病毒性3 d, 标准肝体积为1445.9 mL, 术前CT测量右肝残肝体积为816 mL, 仅占标准肝体积的56%. 于2014-07-31行手术.
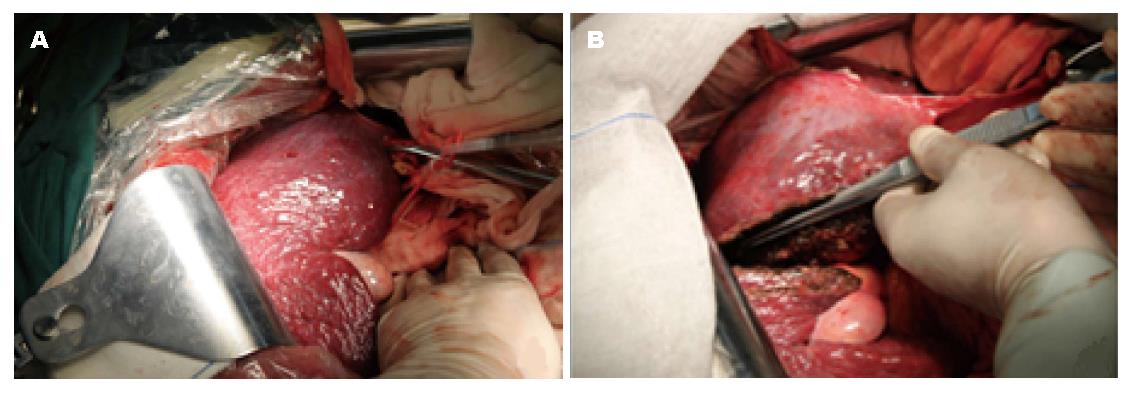
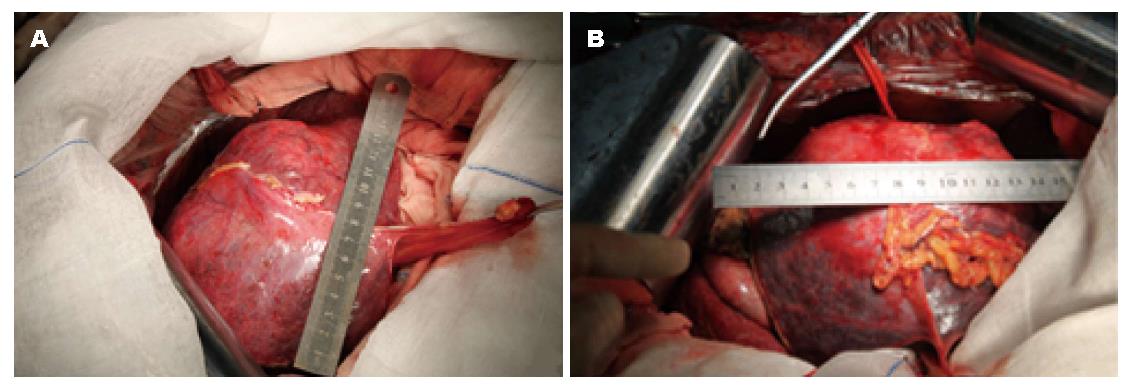
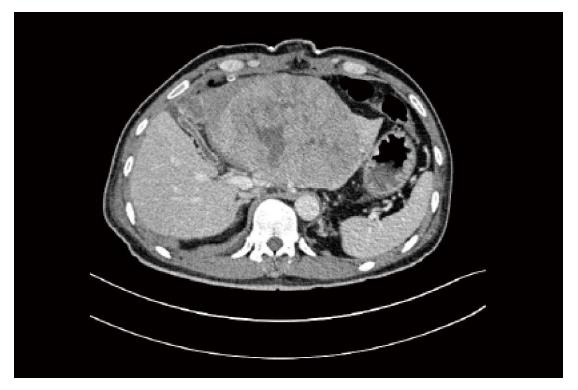
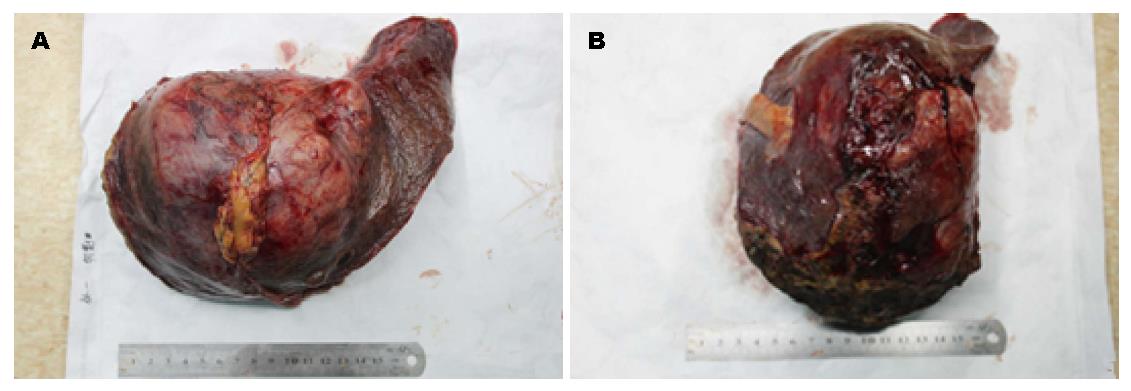
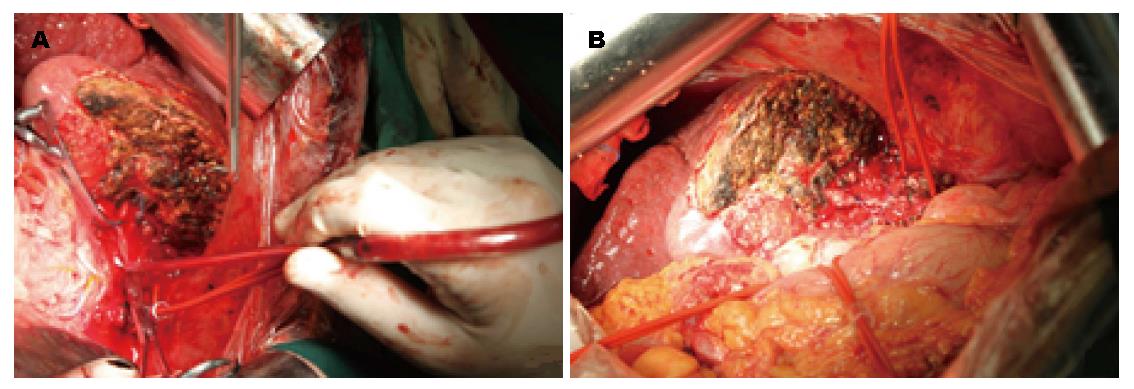
第1步手术: 麻醉成功后, 患者取仰卧, 右侧抬高30度, 右上腹反"L"形切口进腹. 肿瘤主要位于肝左叶, 呈球形, 直径大小约16 cm, 肝脏呈中结节肝硬化表现, 肝左叶仅剩Ⅲ段部分未受侵犯(图2, 图3A). 未见腹水和肿瘤转移, 肿瘤与周围无明显黏连, 切断肝圆韧带、镰状韧带、左、右三角韧带、左、右冠状韧带、肝结肠韧带和肝肾韧带. 经肝组织行肿瘤细针穿刺细胞学检查可见癌细胞, 游离肝门部, 找到门脉左支并结扎; 在距肿物右侧边缘约1 cm处肝表面作一预切线, 沿肝中静脉的左侧壁, 用超声刀和彭氏多功能切割器(Peng's multifunction operative dissector, PMOD)离断肝, 注意保护肝动脉、左肝管及肝中静脉、肝左静脉, 结扎、切断所遇之的小血管及胆管, 直到近腔静脉前方2 cm, 由于肝中静脉近心段紧贴肿瘤包膜, 担心继续分离, 肿瘤巨大, 万一肝中静脉破裂, 不能显露被迫结扎肝中静脉, 从而影响右叶肝功能, 因此未继续分离. 肝断面完全止血后, 用温盐水冲洗肝断面和右膈下, 吸净血块和冲洗液, 电刀喷凝止血肝断面, 检查无出血点和胆汁外漏. 分出门静脉左支并双重结扎. 用医用可吸收防黏连膜将肝断面及肿瘤与周隔绝, 以防止黏连形成新生血管. 文氏孔及膈下各放置一引流管引出. 第1步手术时间为190 min, 术中出血量约为200 mL, 术中未输血. 术后患者一般情况良好, 术后10 d剩余肝脏体积增加至896 mL(图4), 增加了9.8%, 残肝体积占标准肝脏体积占标准肝体积的62%.
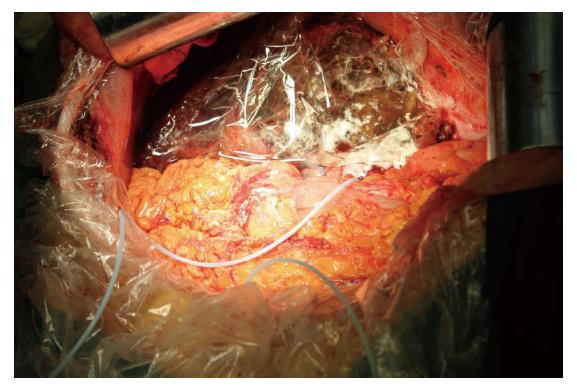
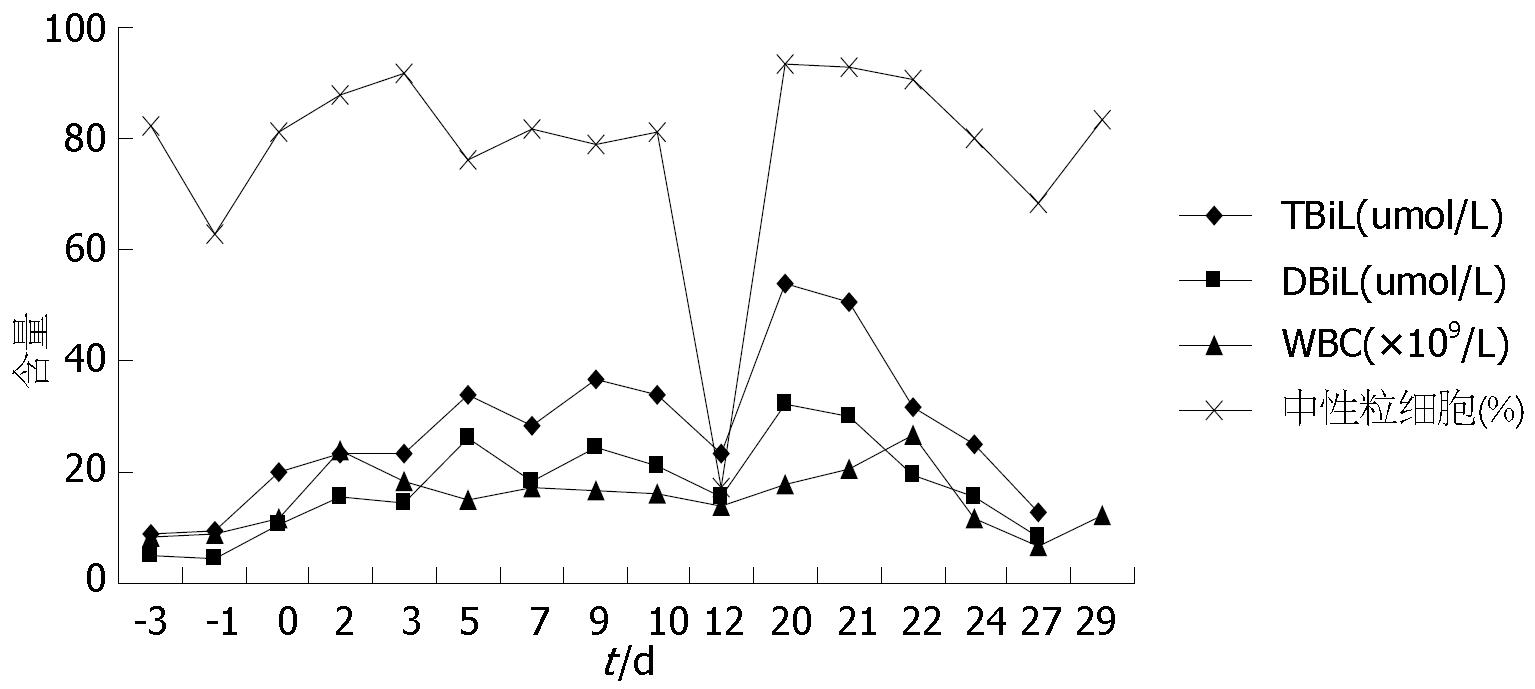
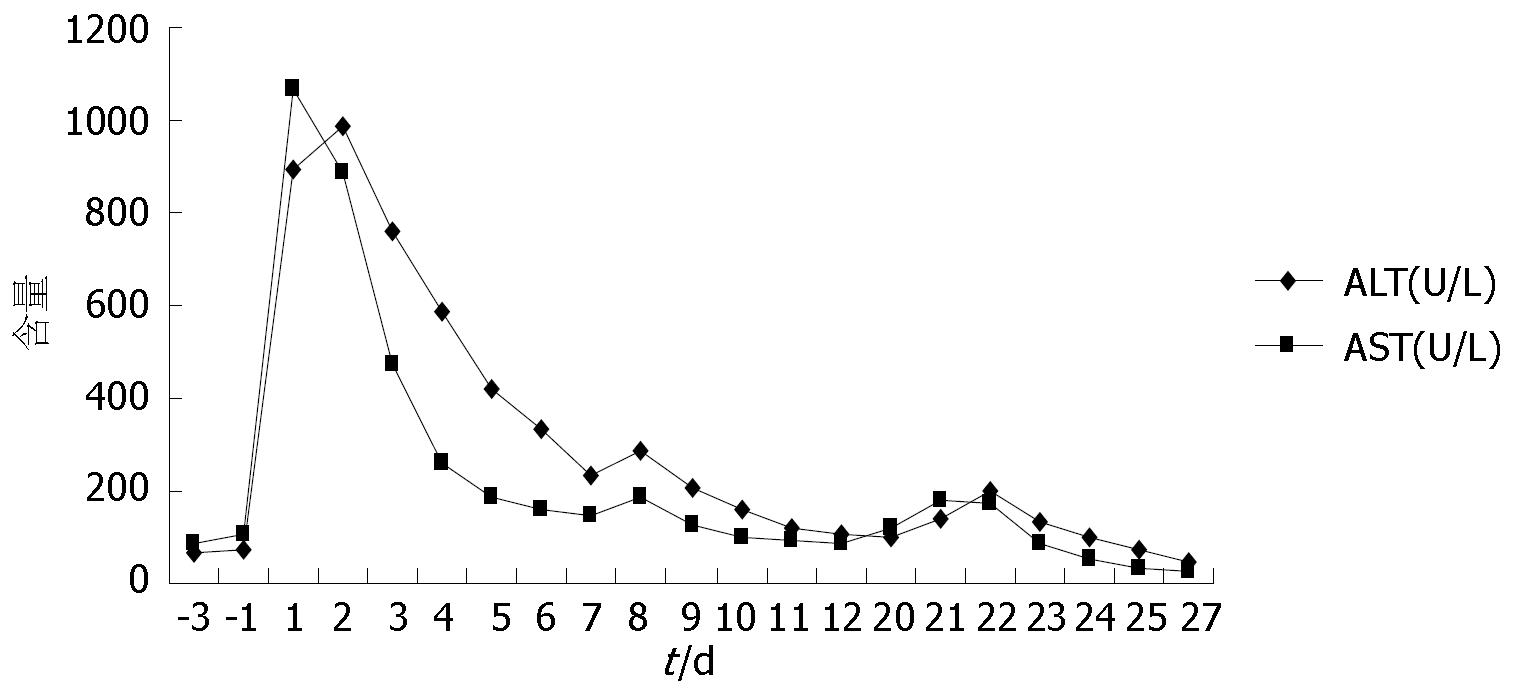
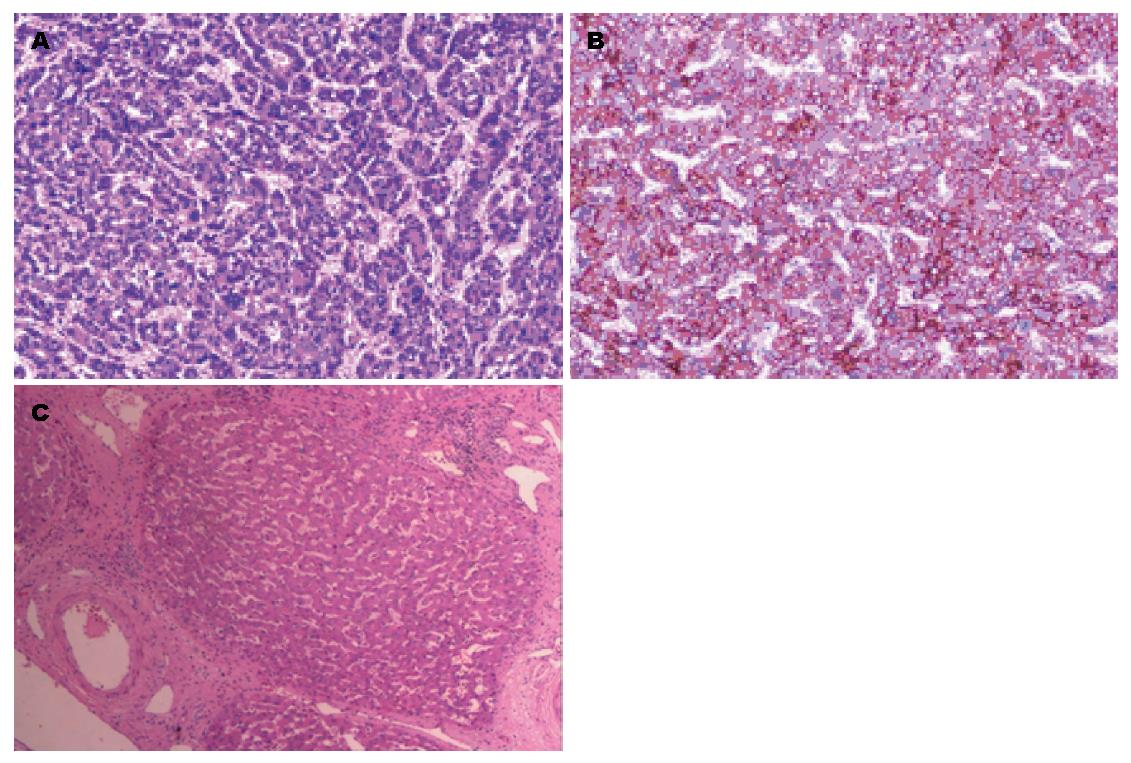
第2步手术: 于2014-08-12, 第1步手术后第12天行第2步手术, 麻醉成功后, 右侧抬高20度, 经原切口进腹见: 腹腔内少量淡黄色清亮渗液, 右叶体积明显增大, 肿瘤直径增大1 cm(图3B). 原放置可吸收膜处肝组织处及肿瘤处与周围无黏连. 分离显露第一肝门、肝下下腔静脉, 肝上下腔静脉, 并在预置阻断带后. 分别结扎, 切断源于胃左动脉粗大变异的肝左动脉, 左胆管支, 门静脉左支后, 分离肝中静脉与肝肿瘤包膜的黏连, 保留肝中静脉, 结扎切断肝左静脉, 左侧的肝短静脉, 完整切除肿瘤(图5). 5/0 Prolen线缝合肝左静脉断端和修补肝中静脉长约4 cm破口(图6). 游离胃十二指肠动脉3 cm, 经其放置动脉治疗泵(drug delivery system, DDS)导管至肝固有动脉, 经泵注射美兰, 见肝脏右叶均匀蓝染, 肝素盐水充盈DDS. 同法经结肠中静脉置入静脉治疗泵至门静脉主干. 热蒸馏水反复冲洗腹腔. 检查未见出血和胆漏后, 用可吸收防黏连膜将残肝包绕, 以防止肝脏与周围组织黏连形成新生血管(图7), 大网膜包埋放置中人氟胺后. 肝断面及文氏空各放置一引流管引出. 第2步手术时间为205 min, 术中出血量为1890 mL, 输血1500 mL, 其中浓缩红细胞4个单位. 患者第1、2步手术后实验室检查结果如图8, 图9. 二步术后第7天、第10天CT检查示剩余肝脏体积继续增大(图10), 术后病理检查结果: 中分化肝细胞HCC(腺瘤型), 癌旁组织呈结节状肝硬化(图11).
随访: 术后腹腔引流管引出液体少, 无胆漏、出血, CT未见腹腔积液后拔去腹腔引流管, 术后稍有肺不张, 经咳嗽后好转, 体温、血常规、肝功能已正常4 d, 精神, 睡眠, 胃口好, 切口无红肿, 第2次手术后第12天出院. 随后二次返院, 经DDS的肝动脉和门静脉预防性注射含血管内皮抑素栓塞化疗乳剂2次, 随访3 mo, 术后间隔1 wk经DDS栓塞化疗2次, 2014-09-16血AFP 23 ng/mL, 2014-10-23血AFP 4 ng/mL, 术后随访3 mo, 至今未见HCC复发.
ALPPS被誉为肝胆外科领域革命性突破, 对中国的意义重大, 因为中国为HCC大国, 全球半数以上的HCC在中国, 且中国的HCC多数合并乙型病毒性肝炎后肝硬化, 尽管手术切除HCC是首选的治疗方法, 肝脏切除的手术无禁区, 但是肝切除后肝功能不全, 甚至肝功能衰竭的可能性普遍存在, 一旦肝功能衰竭, 只有行肝移植才能挽救患者的生命, 然而, 肝脏供体的短缺依然是全球性的问题, 中国肝脏供体短缺的问题更加突出. 因此, 中国的HCC手术切除率不超过30%. ALPPS的出现, 可以使部分原来不能切除的HCC, 得以切除, 提高切除率.
本例患者由于合并较重的肝硬化, 尽管术前的肝功能处于Child A级, 但是其肝硬化的时间已10年, 又没有抗病毒治疗, 术前胸部较多的蜘蛛痣, 脾脏增大明显, 术前白蛋白偏低, 尽管右肝体积仅为标准肝体积的56%, 一次切除左半肝, 势必导致肝功能衰竭, 因此用ALPPS技术成功切除巨大HCC, 在第2步术后, 患者总胆红素一度达到54 µmol/L. 进一步证明右肝体积和功能的不全.
文献报道[2]门静脉一侧分支结扎后, 对侧肝会在1-2 wk增大100%, 本例在门静脉左支结扎后第10天, 右肝体积仅仅增大9.8%, 可能与本例患者肝硬化较重, 增生的纤维组织较多, 影响其增生. 但是本病例支持用此技术使肝硬化肝部分增生, 最终切除肿瘤.
到2013-11为止, 全球56家中心已应用ALPPS 246例[4], 且多用于切除肝右叶巨大肿瘤[2,3], 在我国有零星报道应用此技术, 多数为成人无肝硬化的肝脏切除肝右叶巨大肿瘤, 最近, 也有用ALPPS成功治疗6岁患儿[5], 较少为切除合并肝硬化的肝左叶HCC, 本例用ALPPS成功切除了较重的肝硬化合并左叶巨大HCC, 术后恢复好, 未见复发, 证明ALPPS可为合并肝硬化巨大HCC的手术治疗提供了一种可行的手术选择. 至于第1步手术后, 肝硬化残肝增生情况如何, 第1步手术后多久进行第2步手术及是否能安全地进行第2步手术, 可能与肝硬化的病因, 程度, 肿瘤的位置等因素有关, 还需进行深入研究.
本例在第1步手术时应用可吸收防黏连膜将肝断面及肿瘤与周隔绝, 以防止其与周围组织黏连形成新生血管, 防治肝断面间黏连, 可能有减少肝右叶的血液向左侧通过肝断面向左侧分流, 从而促进残肝的增生, 减轻左叶肿瘤的增长.
本例ALPPS术后用可吸收防黏连膜隔绝残肝, 并在门静脉、肝动脉放置DDS, 术后1 wk行经DDS向肝动脉和门静脉注射含血管内皮抑素化疗栓塞乳剂2次, 目的是为了减少左肝肿瘤切除后残肝肿瘤复发. 且通过用可吸收膜防黏连膜隔绝残肝, 减少因术后预防性肝动脉门静脉的栓塞化疗引起肿瘤缺氧, 从而减少因栓塞缺氧刺激缺氧诱导因子产生引起的残肝与周围血管生成. 用血管内皮抑素进一步抑制肿瘤因栓塞后缺氧引起的血管生成, 进而加强抗肿瘤治疗的效果. 同时第2步手术时放置DDS, 为残肝肿瘤的复发提供经肝动脉和门静脉栓塞化疗的经济有效良好途径.
ALPPS是一个困难的手术[2], 因此应该正确对待, 正确使用此技术, 他有明显优点, 但他仍然有其不足[1], 应该慎重选择, 防治将ALPPS运用到可以一次安全切除的病例上. ALPPS用在在乙型病毒性肝炎, 尤其在慢性肝炎或肝硬化HCC患者后, 其生存时间是否延长, 尚需更多病例多中心对比研究的循证医学证据; 至于ALPPS是否优于"门静脉和肝动脉结扎序贯2步法肝切除术治疗巨大HCC"[6]的技术, 也有待进行严格的临床对比研究.
我国80%的原发性肝癌(hepatocellular carcinoma, HCC)患者合并不同程度的肝硬化, 大范围肝切除术后剩余肝脏体积不足, 肝功能无法代偿从而引起致命的肝衰竭, 致使根治性切除率不足30%.
金山, 主任医师, 内蒙古医学院附属医院普通外科
联合肝脏离断和门静脉结扎的二步肝切除术(associating liver partition and portal vein ligation for staged hepatectomy, ALPPS)是一个非常新的外科手术, 被誉为肝胆外科领域革命性突破, 可用于治疗巨大或多发性HCC第1步手术后剩余肝脏体积可在第7天左右迅速增大74%-99%, 继而可安全切除肿瘤.
目前欧美报道的ALPPS主要用于治疗结直肠转移性肝癌, 肝门部胆管癌, 神经内分泌肿瘤或小肠肿瘤伴肝转移或侵犯, 左侧ALPPS, 右侧ALPPS, 腹腔镜下ALPPS. 上述ALPPS的主要并发症为第1步术后胆漏, 而联合门静脉支结扎肝组织捆绑二步肝切除术避免了肝组织离断后引起的胆漏, 目前我国用于合并乙型肝炎后肝硬化的肝癌切除, 但是未见报道ALPPS应用于合并严重肝硬化的肝癌切除.
本文将ALPPS应用于合并严重肝硬化的肝癌切除, 证明其可行性.并且在第1步手术时于肝断面及肿瘤周放置可吸收防黏连膜减少黏连, 便于第2步手术分离.在第2步手术时用防黏连膜残肝周隔绝, 经肝动脉、门静脉置管连接治疗泵, 经DDS注射栓塞化疗药物减少和治疗癌症的复发. 用血管内皮抑素经肝动脉和门静脉的DDS注射进一步抑制肿瘤因栓塞后缺氧引起的血管生成, 进而加强抗肿瘤治疗的效果.
ALPPS术后尚没有明确的长远肿瘤效果的研究, 并且手术死亡率和并发症发生率仍然较高. 该方法在肝硬化肝癌患者中能否安全施行尚有疑问. 抛开病例选择, 作者们探索该方法值得鼓励.
编辑: 郭鹏 电编: 闫晋利