修回日期: 2014-12-29
接受日期: 2015-01-04
在线出版日期: 2015-02-18
目的: 研究结直肠癌组织中CD151及整合素α6的表达, 探讨他们与结直肠癌临床病理因素及上皮间质转化(epithelial-mesenchymal transition, EMT)的关系.
方法: 132例结直肠癌制成2张组织芯片, 以30例癌旁组织作对照, 采用免疫组织化学检测其中CD151、整合素α6及E-钙黏蛋白(E-cadherin)、波形蛋白(Vimentin)的表达, 分析比较前两种蛋白与结直肠癌临床病理因素之间的关系及其与上皮间质表达标志物之间的关系.
结果: 结直肠癌组织中CD151及整合素α6表达阳性率分别为65.9%和75.7%, 均高于癌旁组织; CD151和整合素α6的表达均与肿瘤浸润深度及淋巴结转移密切相关; CD151在结直肠癌中表达还与E-cadherin的低表达、Vimentin的高表达密切相关.
结论: CD151和整合素α6通过促进EMT促进结直肠癌浸润转移, 为研究结直肠癌EMT发生机制提供新的思路, 同时为CD151作为肠癌的靶向治疗指标提供理论依据.
核心提示: CD151和整合素α6的表达与肿瘤浸润深度及淋巴结转移密切相关; CD151在结直肠癌中表达还与E-钙黏蛋白(E-cadherin)的低表达、波形蛋白(Vimentin)的高表达密切相关. CD151和整合素α6通过促进上皮间质转化(epithelial-mesenchymal transition, EMT)促进结直肠癌浸润转移, 为研究结直肠癌EMT发生机制提供新的思路.
引文著录: 盛霞, 刘红胜, 沈晶莹, 冯雯, 秦建民. CD151及整合素α6在肠癌中的表达及其与上皮间质转化的关系. 世界华人消化杂志 2015; 23(5): 852-856
Revised: December 29, 2014
Accepted: January 4, 2015
Published online: February 18, 2015
AIM: To investigate the relationship between CD151 and Integrin α6 expression and clinicopathological parameters in colorectal cancer, and analyze the role of the two proteins in epithelial-mesenchymal transition (EMT).
METHODS: Immunohistochemistry was performed to detect the expression of CD151, Integrin α6, E-cadherin and Vimentin in 132 colorectal cancer specimens using tissue microarray.
RESULTS: The positive rates of CD151 and Integrin α6 in colorectal cancer tissues were 65.9% and 75.7%, respectively, significantly higher than those in tumor-adjacent normal tissues. CD151 and Integrin α6 expression was closely related with the depth of invasion and lymph lode metastasis, while the expression of CD151 was closely associated with low E-cadherin expression and high Vimentin expression.
CONCLUSION: CD151 may accelerate the invasion and metastasis of colorectal cancer by promoting EMT.
- Citation: Sheng X, Liu HS, Shen JY, Feng W, Qin JM. Relationship between expression of CD151 and Integrin α6 and epithelial-mesenchymal transition in colorectal cancer. Shijie Huaren Xiaohua Zazhi 2015; 23(5): 852-856
- URL: https://www.wjgnet.com/1009-3079/full/v23/i5/852.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i5.852
细胞表面蛋白CD151是四次跨膜家族(transmembrane 4 superfamily, TMSF4)中唯一的癌基因, 我们在前期的研究工作中发现CD151在结直肠癌组织中的表达与肿瘤的分化程度、临床分期及淋巴结转移密切相关, 但其具体作用机制不明[1]. 研究[2,3]表明, CD151蛋白与整合素的多种亚型结合, 将来自细胞外基质的促细胞迁移和血管形成信号向细胞内转导, 同时又担负着将细胞内信号转导到细胞外的双向调节功能, 有利于癌细胞的浸润和远处转移. 有报道CD151在肝细胞肝癌中促进上皮间质转化(epithelial-mesenchymal transition, EMT). 因此, 本研究通过免疫组织化学检测CD151、整合素α6蛋白及E-钙黏蛋白(E-cadherin)、波形蛋白(Vimentin)的表达, 分析他们与结直肠癌临床病理因素的关系; 探讨四者之间的相互关系, 初步了解CD151与结直肠癌EMT的关系.
收集2009-01/2012-12上海中医药大学附属普陀医院原发性结直肠癌手术切除标本132例, 由两名有经验的病理医师复片分级: 其中高分化腺癌12例, 中分化腺癌50例, 低分化腺癌70例; 结直肠癌中有淋巴结转移44例, 无淋巴结转移88例. 132例标本制成组织芯片2张, 每个样片均上样2个有代表性的点, 同时取30例癌旁正常肠黏膜组织作对照. 所有标本经4%甲醛溶液固定, 石蜡包埋, 4 μm厚连续切片, 分别进行HE和免疫组织化学染色.
试剂: 鼠抗人CD151单克隆抗体抗体购自eBioscience公司(Catalog Number: 16-1519, clone: 50-6), 浓度1∶100; 整合素α6单克隆抗体购自Abcam公司, 浓度1∶100; 其余抗体及免疫组织化学试剂盒、显色液均购自福州迈新生物技术公司产品.
1.2.1 免疫组织化学检测: 免疫组织化学采用Envision二步法, 用已知阳性切片组织作阳性对照, 阴性对照用PBS代替一抗.
1.2.2 结果评定: CD151、整合素α6产物为棕黄色颗粒, 分别位于肿瘤细胞膜和/或胞浆内. 综合考虑切片中阳性细胞占所观察同类细胞数的百分比和阳性细胞着色强度, 采用双评分半定量法进行评分: 阳性细胞<25%为1分, 26%-50%为2分, 51%-75%为3分, >75%为4分. 着色强度按切片中细胞着色有无及深浅计分: 细胞无着色0分, 浅黄色1分, 黄色2分, 棕褐色3分. 将两分值相加, <3分判为阴性, ≥3分判为阳性. E-cadherin和Vimentin阳性信号均定位于肿瘤细胞胞质, E-cadherin在部分肿瘤细胞胞膜有表达.
统计学处理 应用SPSS15.0统计软件, CD151、整合素α6的表达与临床病理因素之间的关系采用χ2检验, 各蛋白之间的相关性采用Spearman等级相关分析, 以P<0.05为差异有统计学意义.
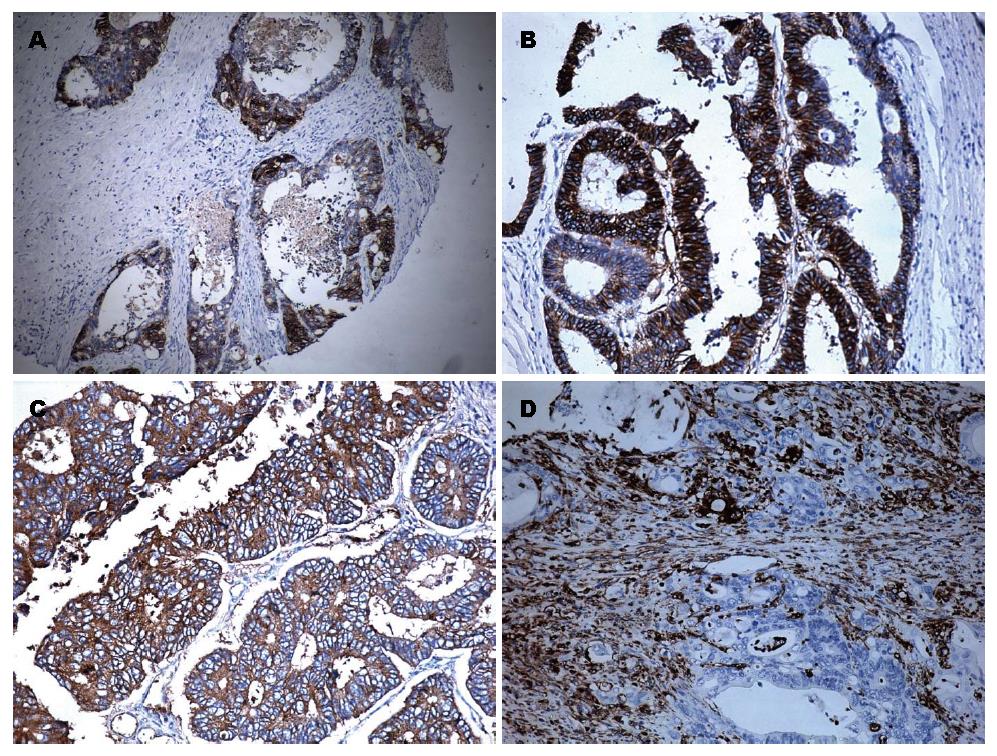
免疫组织化学检测结果显示(图1): CD151蛋白阳性信号位于肿瘤细胞的胞质, 部分胞膜见着色(图1A), 阳性率为65.9%(87/132); 整合素α6蛋白阳性信号位于肿瘤细胞的胞质(图1B), 阳性率75.7%(100/132); 两者在癌旁均阴性或弱阳性. E-cadherin、Vimentin蛋白以肿瘤细胞胞质或部分胞膜出现棕黄色颗粒判定为阳性(图1C, D), 阳性率分别为77.3%(102/132)和18.9%(25/132).
CD151和整合素α6的表达均与肿瘤的浸润深度及淋巴结转移的相关性有统计学意义(P<0.05), CD151阳性的患者具有较低的肿瘤分化程度, 淋巴结转移. 而肿块大小及肿瘤细胞的分化程度与CD151和整合素α6的表达均无相关性(表1).
| 临床病理资料 | CD151 | P值 | 整合素α6 | P值 | ||
| - | + | - | + | |||
| 肿块大小(cm) | 0.414 | 0.074 | ||||
| <5 | 34 | 71 | 29 | 76 | ||
| ≥5 | 11 | 16 | 3 | 24 | ||
| 分化 | 0.074 | 0.106 | ||||
| 高-中 | 26 | 36 | 19 | 43 | ||
| 低 | 19 | 51 | 13 | 57 | ||
| 浸润 | 0.000 | 0.000 | ||||
| 肌层 | 33 | 22 | 30 | 25 | ||
| 浆膜(外) | 12 | 65 | 2 | 75 | ||
| 淋巴结转移 | 0.002 | 0.004 | ||||
| 有 | 7 | 37 | 4 | 40 | ||
| 无 | 38 | 50 | 28 | 60 | ||
统计学分析结果表明, CD151在结直肠癌中表达与E-cadherin的低表达、Vimentin的高表达密切相关(表2); 而整合素α6与E-cadherin、Vimentin表达之间的相关性无统计学意义(表3).
| CD151 | E-cadherin | Vimentin | ||
| - | + | - | + | |
| - | 7 | 38 | 39 | 6 |
| + | 29 | 58 | 51 | 36 |
| r值 | -0.189 | 0.285 | ||
| P值 | 0.030 | 0.001 | ||
| 整合素α6 | E-cadherin | Vimentin | ||
| - | + | - | + | |
| - | 8 | 24 | 23 | 9 |
| + | 28 | 72 | 67 | 33 |
| r值 | 0.029 | 0.645 | ||
| P值 | 0.742 | 0.610 | ||
EMT是在多细胞生物胚胎发育过程和组织重建中存在的现象, 最近的研究[4]发现EMT与上皮性恶性肿瘤的发生、发展及浸润转移密切相关, 他是许多肿瘤进展的特性, 与获得侵袭性形态有关. EMT的发生涉及到多个信号转导通路和复杂的分子机制, 目前其具体机制尚未完全阐明, 可能与钙黏蛋白、生长因子、转录因子及微环境有关. 上皮细胞发生EMT的重要特征为: 上皮性标志物钙黏蛋白E-cadherin表达的降低或缺失; 间质细胞表型的获得-Vimentin等间叶标志物的上调; 细胞形态间质化; 细胞运动能力增强, 肿瘤细胞也就具有了更强的侵袭力[5,6]. 在EMT的过程中, E-cadherin表达的减少或丢失是最重要的变化, 也是评估EMT的主要标志. EMT在结直肠癌的发生发展中起着重要的作用, 是肿瘤细胞侵袭转移的重要机制[7].
CD151在多种肿瘤组织中过表达, 如前列腺癌、肺癌、胃癌、乳腺癌等, 是TMSF4家族中唯一的癌基因, 与肿瘤的预后密切相关. 研究[8]显示CD151在前列腺癌肿瘤细胞的表达明显高于前列腺增生的细胞, 且分化好的前列腺癌肿瘤细胞CD151的表达明显低于分化差的前列腺癌肿瘤细胞. 对非小细胞肺癌的表达与预后的研究[9]表明, CD151表达的患者预后较不表达的差. CD151的过表达已成为胃癌独立的预后因素, 有望成为进展期胃癌患者靶向治疗的靶点[10]. CD151过表达与乳腺癌肿瘤大小、淋巴结转移、临床分期及雌激素孕激素的失表达密切相关, 是乳腺癌潜在的分子靶向治疗的靶点和独立的预后因素[11]. 体外实验发现, CD151通过与整合素α3β1和α6β1形成复合体, 促进HepG2细胞的转移[11]. CD151在消化系肿瘤中均有表达并且与肿瘤的转移侵袭成正相关, 其对消化系肿瘤侵袭转移的影响机制与基质金属蛋白酶(matrix metalloproteinase, MMPs)、整合素(如α5、β1及β6)及其他四跨膜蛋白(如CD9、CD82和CD81)相关; CD151有望成为预测消化系肿瘤预后的肿瘤标志和治疗的分子靶标[11,12].
本研究采用免疫组织化学检测了132例结直肠癌组织中CD151、整合素α6的表达情况, 并分析比较他们与肿瘤细胞分化程度、浸润深度及有无淋巴结转移的表达差异. 结果发现CD151、整合素α6在结直肠癌灶中的表达高于正常组织, CD151、整合素α6在有淋巴结转移组中的阳性率也明显高于无转移组. 这些发现提示CD151与整合素α6可能与结直肠癌的发生有关. 这与我们前期研究[1]结果一致; 同时, CD151-整合素复合体的形成是细胞迁移信号从细胞外向细胞内传递的关键环节. 抗CD151抗体和抗整合素α6抗体作用后的白细胞在纤维黏连蛋白上的连接减少, 表明CD151整合素α6复合体在细胞迁移中起关键作用[13,14]. 越来越多的证据显示在人结直肠癌形成和肿瘤侵袭过程中发生了EMT, 在EMT介导结直肠癌发生发展过程中伴随着众多信号通路的激活, 将胞外信号传导入胞内引起E-cadherin、Vimentin等异常、表型改变、基底膜降解、上皮细胞向间质转变和细胞迁移等一系列变化, 最终导致正常结肠上皮细胞转变为肠癌细胞[15]. 本研究中, 在分析CD151和整合素α6与EMT的标志物E-cadherin、Vimentin之间的关系时我们发现, CD151的高表达伴随着E-cadherin的低表达及Vimentin的高表达, 且CD151的表达与肿瘤细胞的低分化, 浸润至浆膜层及淋巴结转移密切相关; 这说明CD151可能通过下调E-cadherin的表达促进EMT, 促进结直肠癌的浸润转移.
总之, CD151与结直肠癌的浸润转移密切相关. 其主要机制之一可能是通过促进结直肠癌EMT, 除了与文献报道的整合素α6形成复合体, 可能还与其他信号通路有关, 有待进一步研究证实. 借助靶向抑制CD151等的治疗方法为防止肿瘤进展提供了可能, 此外, EMT信号传导通路中的关键分子整合素、转化生长因子等将来也有可能成为阻断EMT的重要靶点.
结直肠癌是我国常见的恶性肿瘤之一, 侵袭和转移是影响患者生命和治疗效果的主要原因, CD151在肿瘤细胞迁移中起重要作用, 是肿瘤转移的重要分子基础. 越来越多的证据显示在结直肠癌形成和肿瘤侵袭过程中发生了上皮间质转化(epithelial-mesenchymal transition, EMT).
刘连新, 教授, 哈尔滨医科大学第一临床医学院; 刘丽江, 教授, 江汉大学医学院病理学
CD151在肝细胞肝癌中促进EMT; CD151在消化系肿瘤中均有表达并且与肿瘤的转移侵袭成正相关, 有望成为预测消化系肿瘤预后的肿瘤标志和治疗的分子靶标.
CD151与多种肿瘤的预后密切相关, 并与整合素形成复合体促进肿瘤的浸润及转移. CD151在肝胆管细胞癌中起到促进EMT的作用.
通过组织学实验结直肠癌组织中CD151、整合素α6β1与结直肠癌分化程度、临床分期、淋巴结转移及预后之间的关系; 分析CD151与上皮性标志物E-钙黏蛋白(E-cadherin)及间质性标志物波形蛋白(Vimentin)之间的关系, 观察结直肠癌中CD151功能状态与结直肠癌EMT的关系, 揭示CD151促进结直肠癌转移的可能途径.
随着对CD151在结直肠癌浸润转移中的作用及机制研究不断深入, 为靶向抑制CD151等的治疗方法防治结直肠癌进展提供了可能.
上皮细胞间质转化(EMT): 指在生理或病理情况下发生上皮细胞与间质细胞之间的转变, 同时伴随细胞形态与相关基因表达的改变, 在此过程中上皮细胞顶-底极性改变、桥粒等紧密连接结构消失、细胞骨架重组, 波形蛋白表达上调、角蛋白表达下调, 从而使细胞离体、获得迁移能力, 并能抵抗细胞凋亡.
本文中重点研究CD151和整合素在结直肠癌中的表达和EMT之间的关系, 文章的设计有一定的科学性和先进性, 并结合临床实际, 有一定的使用性, 通过研究提出了两者与临床病理指标之间的关联性. 同时, 作者紧密结合相关文献, 展开了讨论, 对于临床工作有一定的帮助.
编辑: 韦元涛 电编: 都珍珍
| 1. | 盛 霞, 张 隆, 蔡 瑞霞, 沈 晶莹. 结直肠癌组织中CD151表达及其临床意义. 临床与实验病理学杂志. 2009;25:298-301. |
| 2. | Ke AW, Shi GM, Zhou J, Wu FZ, Ding ZB, Hu MY, Xu Y, Song ZJ, Wang ZJ, Wu JC. Role of overexpression of CD151 and/or c-Met in predicting prognosis of hepatocellular carcinoma. Hepatology. 2009;49:491-503. [PubMed] [DOI] |
| 3. | Ke AW, Shi GM, Zhou J, Huang XY, Shi YH, Ding ZB, Wang XY, Devbhandari RP, Fan J. CD151 amplifies signaling by integrin α6β1 to PI3K and induces the epithelial-mesenchymal transition in HCC cells. Gastroenterology. 2011;140:1629-1641.e15. [PubMed] [DOI] |
| 5. | Lamouille S, Xu J, Derynck R. Molecular mechanisms of epithelial-mesenchymal transition. Nat Rev Mol Cell Biol. 2014;15:178-196. [PubMed] [DOI] |
| 6. | Micalizzi DS, Farabaugh SM, Ford HL. Epithelial-mesenchymal transition in cancer: parallels between normal development and tumor progression. J Mammary Gland Biol Neoplasia. 2010;15:117-134. [PubMed] [DOI] |
| 8. | Palmer TD, Martínez CH, Vasquez C, Hebron KE, Jones-Paris C, Arnold SA, Chan SM, Chalasani V, Gomez-Lemus JA, Williams AK. Integrin-free tetraspanin CD151 can inhibit tumor cell motility upon clustering and is a clinical indicator of prostate cancer progression. Cancer Res. 2014;74:173-187. [PubMed] [DOI] |
| 9. | Kwon MJ, Seo J, Kim YJ, Kwon MJ, Choi JY, Kim TE, Lee DH, Park S, Shin YK, Han J. Prognostic significance of CD151 overexpression in non-small cell lung cancer. Lung Cancer. 2013;81:109-116. [PubMed] [DOI] |
| 10. | Ha SY, Do IG, Lee J, Park SH, Park JO, Kang WK, Choi MG, Lee JH, Bae JM, Kim S. CD151 overexpression is associated with poor prognosis in patients with pT3 gastric cancer. Ann Surg Oncol. 2014;21:1099-1106. [PubMed] [DOI] |
| 11. | Kwon MJ, Park S, Choi JY, Oh E, Kim YJ, Park YH, Cho EY, Kwon MJ, Nam SJ, Im YH. Clinical significance of CD151 overexpression in subtypes of invasive breast cancer. Br J Cancer. 2012;106:923-930. [PubMed] [DOI] |
| 12. | Fei Y, Wang J, Liu W, Zuo H, Qin J, Wang D, Zeng H, Liu Z. CD151 promotes cancer cell metastasis via integrins α3β1 and α6β1 in vitro. Mol Med Rep. 2012;6:1226-1230. [PubMed] [DOI] |
| 14. | Zevian S, Winterwood NE, Stipp CS. Structure-function analysis of tetraspanin CD151 reveals distinct requirements for tumor cell behaviors mediated by α3β1 versus α6β4 integrin. J Biol Chem. 2011;286:7496-7506. [PubMed] [DOI] |